1型鹅星状病毒ORF2蛋白原核表达及其多克隆抗体的制备与鉴定
2022-02-15顾玲玲朱善元王安平
刘 莉,顾玲玲,张 硕,谢 军,朱善元,王安平
(1.江苏农牧科技职业学院,江苏省兽用生物制药高技术研究重点实验室,泰州 225300;2.江苏海洋大学食品科学与工程学院,连云港 222005)
近年来,中国鹅场暴发了一种主要引起4~20日龄雏鹅痛风症状的传染病,其主要特征为跛行或瘫痪,剖检可见内脏和关节有大量尿酸盐沉积,死亡率高达50%,给中国养鹅业造成了重大的经济损失。
星状病毒(Astrovirus,AstV)为单股正链、无囊膜的RNA病毒,于1975年首次发现于患肠胃炎的婴儿粪便中[1]。透射电子显微镜观察可见其表面具有特征性星状结构,因此被命名为星状病毒[2]。首个GAstV FLX株全基因组序列报道于2017年[3],FLX株基因组全长为7 299 nt,其基因组结构与星状病毒属其他成员相似,由3个不同的重叠开放阅读框(ORF1a、ORF1b和ORF2)组成。其中,ORF1a 和ORF1b编码非结构蛋白[4],ORF2编码病毒衣壳蛋白(Cap蛋白),是基因组中的高变区域,与病毒粒子形成及抗体产生相关[5]。此后,陆续报道了多株GAstV全基因组序列,如GD[6]、SDPY[7]、HN1G[8]、SD01[9]、GsFJ02[10]和HN01[11]等。遗传进化分析表明,所有已知序列的GAstVs均属于2个不同的系统进化分支,因此,有学者建议将FLX类毒株命名为GAstV-1,将SD01类毒株命名为GAstV-2,又称之为新型GAstV[10]。
已有多篇文献报道用GAstV-2进行雏鹅回归试验可复制出鹅痛风,证明GAstV-2是鹅痛风的病原[6-8]。江苏省兽用生物制药高技术研究重点实验室课题组前期研究证明,用GAstV-1 TZ03接种健康雏鹅,可引起与临床症状相似的鹅痛风,说明GAstV-1也是鹅痛风的病原之一[12]。张玉杰等[13]报道,GAstV-1与GAstV-2混合感染能致雏鹅发生典型痛风症状,且比单独感染导致的死亡率更高。因此,为了做好鹅痛风的防控,需对GAstV-1与GAstV-2做好诊断和检测工作。
目前尚无用于GAstV检测的商品化试剂盒,张玉霞等[14]建立了GAstV-2 LAMP快速检测方法,Yuan等[15]建立了GAstV-2实时荧光定量PCR方法,吕炫等[16]利用大肠杆菌系统表达了GAstV-2衣壳蛋白,且制备了高效价多克隆抗体。而针对GAstV-1诊断检测方法的研究鲜有报道。本研究在前期分离鉴定的GAstV-1的基础上,利用大肠杆菌表达系统表达GAstV-1衣壳蛋白ORF2,并制备其多克隆抗体,以期为GAstV-1血清学检测方法的建立奠定基础。
1 材料与方法
1.1 病毒、菌种与细胞
GAstV-1 TZ03毒株(全基因组序列GenBank登录号:MW353015)由江苏省兽用生物制药高技术研究重点实验室分离鉴定并保存;pET-30a(+)由江苏省兽用生物制药高技术研究重点实验室保存;大肠杆菌DH5α和BL21(DE3)感受态细胞均购自TaKaRa公司。
1.2 主要试剂
限制性内切酶BamHⅠ、XhoⅠ、T4 DNA连接酶及预染蛋白质分子质量标准均购自Thermo公司;DNA胶回收试剂盒购自TaKaRa公司;质粒抽提试剂盒、His标签蛋白纯化试剂盒、BCA蛋白定量试剂盒、HRP标记的抗His标签鼠单克隆抗体及DAB显色试剂盒均购自康为世纪有限公司;弗氏完全佐剂和弗氏不完全佐剂均购自Sigma公司;HRP标记的羊抗兔IgG、FITC标记的羊抗兔IgG均购自KPL公司。
1.3 ORF2基因密码子优化及合成
在不改变ORF2基因核苷酸序列的前提下,对其核苷酸序列进行优化,将大肠杆菌稀有密码子改变为大肠杆菌偏嗜性密码子,同时在该基因两端引入BamH Ⅰ和XhoⅠ酶切位点。优化后的基因序列由上海英潍捷基生物技术有限公司合成,并克隆于pGEM-T质粒载体中。
1.4 重组质粒pET-ORF2的构建及鉴定
将含有优化基因ORF2的质粒和原核表达载体pET-30a(+)分别用BamH Ⅰ和XhoⅠ双酶切后,分别回收ORF2基因片段和pET-30a(+)载体,两者经T4 DNA连接酶连接,连接产物转化大肠杆菌 DH5α感受态细胞,37 ℃培养14 h。随机挑取单菌落,接种于含卡那青霉素(50 μg/mL)的LB液体培养基扩增培养,提取质粒后用BamH Ⅰ和XhoⅠ双酶切鉴定,鉴定正确的菌株送苏州金唯智生物科技有限公司测序。
1.5 重组菌诱导表达
将测序正确的重组质粒pET-ORF2及载体质粒pET-30a(+)分别转化大肠杆菌BL21(DE3)感受态细胞,挑取单菌落接种于含卡那青霉素(50 μg/mL)的LB液体培养基中,37 ℃、200 r/min振荡培养12 h,次日按1∶100的比例转接至相同培养基中,37 ℃、200 r/min 振荡培养,当菌液D600 nm值达0.6~1.0时,加入 IPTG至终浓度为0.6 mmol/L,37 ℃诱导3~5 h,离心收集菌体,溶于适量PBS中,超声波裂解菌体,取裂解后的菌液12 000 r/min离心10 min,将上清和沉淀分别与5×Loading Buffer混匀,煮沸5 min,进行SDS-PAGE分析。同时转印至PVDF膜上,5% BSA 4 ℃封闭过夜,用HRP标记的抗His标签单克隆抗体(1∶1 000稀释)于37 ℃孵育2 h,DAB显色试剂盒进行显色观察。
1.6 重组蛋白纯化
按上述1.5的方法重新诱导菌液100 mL,4 ℃、8 000 r/min离心10 min收集菌体,溶于适量PBS,超声波裂解菌体,按照His标签蛋白纯化试剂盒说明书进行纯化,以200 mmol/L咪唑缓冲液进行洗脱,将洗脱液进行SDS-PAGE鉴定。利用BCA蛋白定量试剂盒对纯化后的重组蛋白浓度进行定量。
1.7 多克隆抗体制备
参照刘雪婷等[17]制备多克隆抗体血清,将上述纯化的重组蛋白ORF2与弗氏完全佐剂等体积混匀,充分乳化。以背部皮下多点注射免疫新西兰大白兔,每只家兔免疫的蛋白量为400 μg。首免2和4周后,以相同量的重组蛋白与等体积的弗氏不完全佐剂混合乳化,分别进行二免和三免。三免后第14天采血,分离血清,-20 ℃保存备用。
1.8 多克隆抗体鉴定
1.8.1 多克隆抗体效价测定 将纯化后的重组蛋白稀释至浓度为2 μg/mL,100 μL/孔包被96孔酶标板,4 ℃作用过夜。PBST洗涤5次,3 min/次,每孔加入200 μL含有5%脱脂乳的PBST封闭液,37 ℃封闭2 h。PBST洗涤后,每孔加入用封闭液倍比稀释的待检血清200 μL,37 ℃孵育1 h。PBST洗涤后,加入HRP标记的羊抗兔IgG(1∶5 000稀释),37 ℃孵育1 h。PBST洗涤后,TMB避光显色30 min,加入2 mol/L H2SO4终止反应,在酶标仪上读取D450 nm值。同时设立免疫前兔血清作为阴性对照。
1.8.2 间接免疫荧光试验(IFA)检测 参考文献制备鹅胚肾细胞(GEK)[11],将GAstV-1 TZ03毒株以100 TCID50感染GEK细胞,48 h后弃去上清,PBS洗涤2次,用-20 ℃预冷的甲醇固定20 min,PBS洗涤3遍后加入5% BSA室温封闭1 h。以制备的兔源多克隆抗体血清为一抗(1∶200),37 ℃孵育2 h;PBS洗涤5次,以FITC标记的羊抗兔IgG(1∶2 000稀释)为二抗,37 ℃孵育1 h,PBS洗涤3遍后置于荧光倒置显微镜下进行观察。同时以未接种病毒的GEK细胞作为阴性对照。
2 结 果
2.1 重组质粒pET-ORF2鉴定
将酶切回收的目的基因ORF2与载体pET-30a(+)连接,转化大肠杆菌 DH5α感受态细胞,经PCR筛选获得重组子,提取质粒经BamH Ⅰ和XhoⅠ双酶切鉴定,产生大小约为5 400和2 140 bp的2条条带(图1),与预期大小一致,表明ORF2基因已成功克隆入载体pET-30a(+)中。测序结果完全正确。
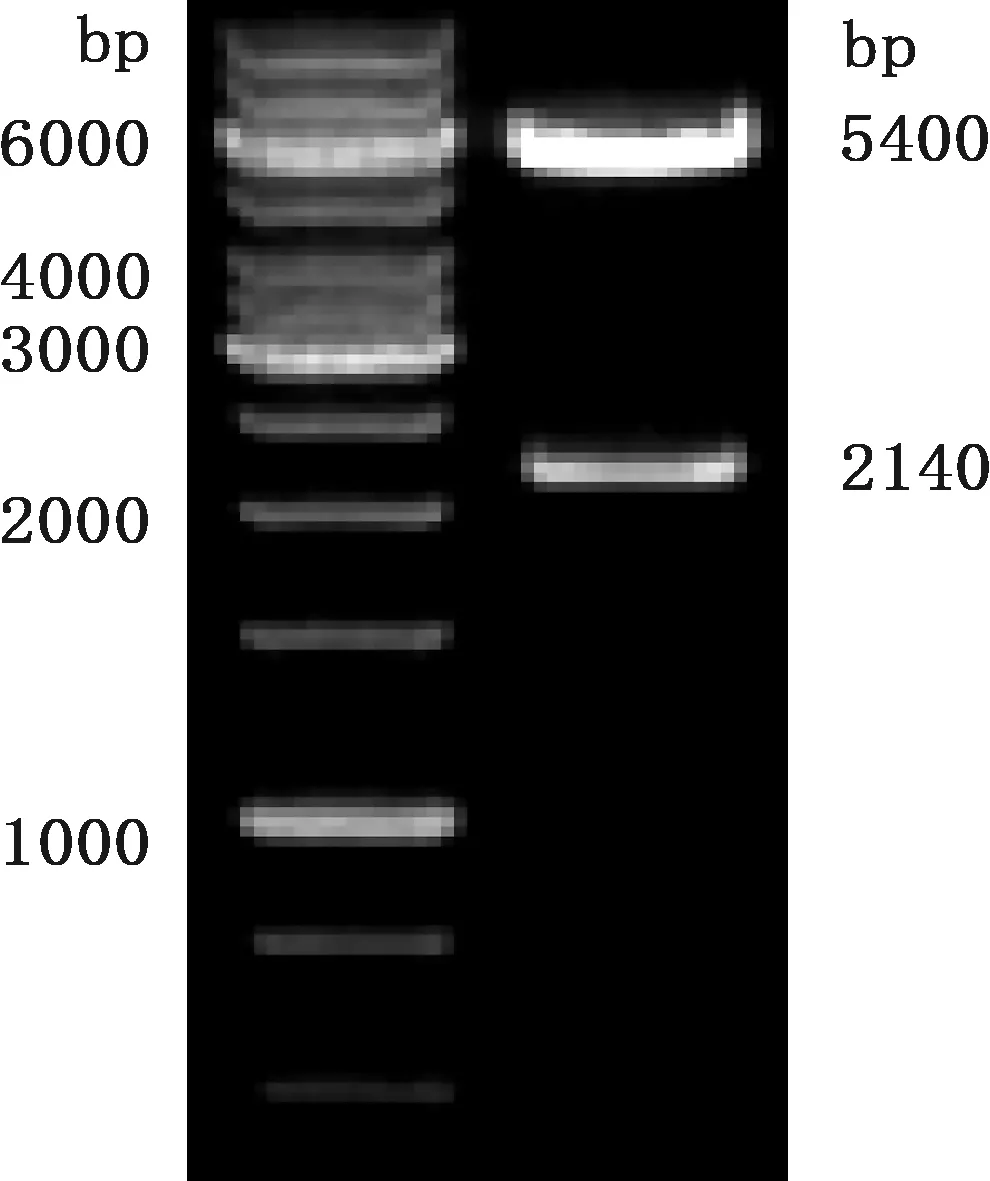
图1 重组质粒pET-ORF2双酶切鉴定Fig.1 Identification of recombinant plasmid pET-ORF2 by double enzyme digestion
2.2 重组蛋白ORF2的诱导表达及SDS-PAGE分析
将测序正确的重组质粒pET-ORF2及载体质粒pET-30a(+)分别转化大肠杆菌BL21(DE3)感受态细胞,经IPTG诱导,重组蛋白获得较高水平表达,SDS-PAGE分析结果显示,在约70 ku处出现一条明显的蛋白条带,与预期的6His-ORF2融合蛋白大小一致,且以包涵体形式存在(图2)。
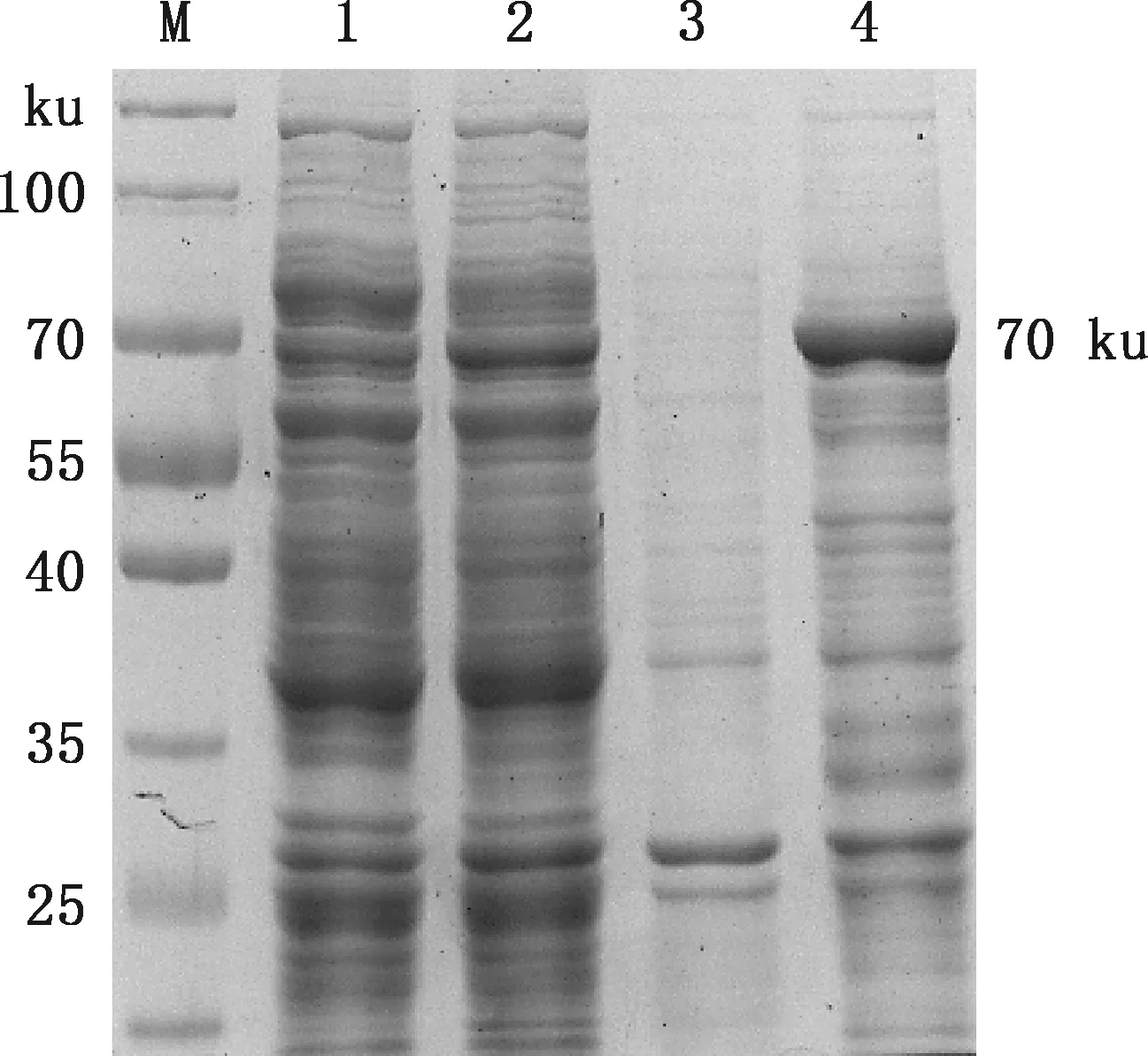
M,蛋白质分子质量标准;1,pET-30a(+)诱导菌裂解上清;2,pET-ORF2诱导菌裂解上清;3,pET-30a(+)诱导菌裂解沉淀;4,pET-ORF2诱导菌裂解沉淀M,Protein Marker;1,Supernatant of lysed pET-30a(+) after inducement;2,Supernatant of lysed pET-ORF2 after inducement;3,Precipitation of lysed pET-30a(+) after inducement;5,Precipitation of lysed pET-ORF2 after inducement图2 重组蛋白ORF2的SDS-PAGE分析Fig.2 SDS-PAGE analysis of recombinant protein ORF2
2.3 重组蛋白ORF2纯化
对纯化后的重组蛋白ORF2进行SDS-PAGE鉴定,结果显示,在约70 ku处出现特异性条带,与重组蛋白的理论值相符,且条带较单一(图3),说明重组蛋白获得成功纯化。利用BCA蛋白定量试剂盒进行定量,蛋白浓度为1.02 mg/mL。

图3 纯化重组蛋白ORF2的SDS-PAGE分析Fig.3 SDS-PAGE analysis of purified recombinant protein ORF2
2.4 重组蛋白ORF2的Western blotting鉴定
用HRP标记的抗His标签鼠单克隆抗体对表达的重组蛋白进行Western blotting鉴定,结果显示,在分子质量约70 ku处出现了特异性条带(图4),与预期条带大小一致,表明表达的重组蛋白具备良好的反应原性。
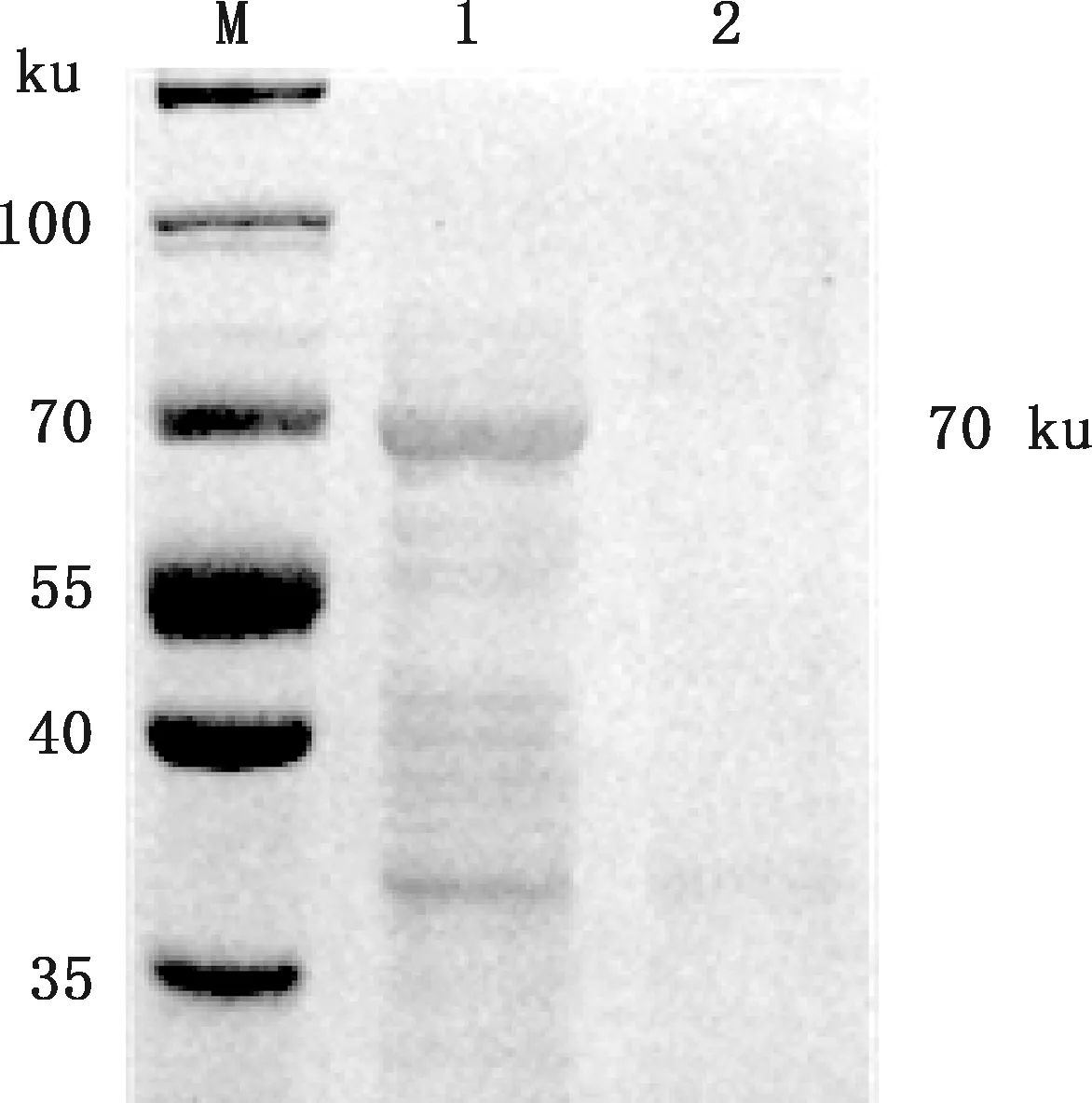
M,蛋白质分子质量标准;1,pET-ORF2诱导菌裂解沉淀;4,pET-30a(+)诱导菌裂解沉淀M,Protein Marker;1,Precipitation of lysed pET-ORF2 after inducement;2,Precipitation of lysed pET-30a(+) after inducement图4 重组蛋白ORF2的Western blotting鉴定Fig.4 Identification of recombinant protein ORF2 by Western blotting
2.5 多克隆抗体效价测定
将纯化的重组蛋白ORF2包被酶标板,利用间接ELISA方法测定多克隆抗体效价。结果显示,制备的ORF2多克隆抗体效价最高达1∶128 000(图5)。
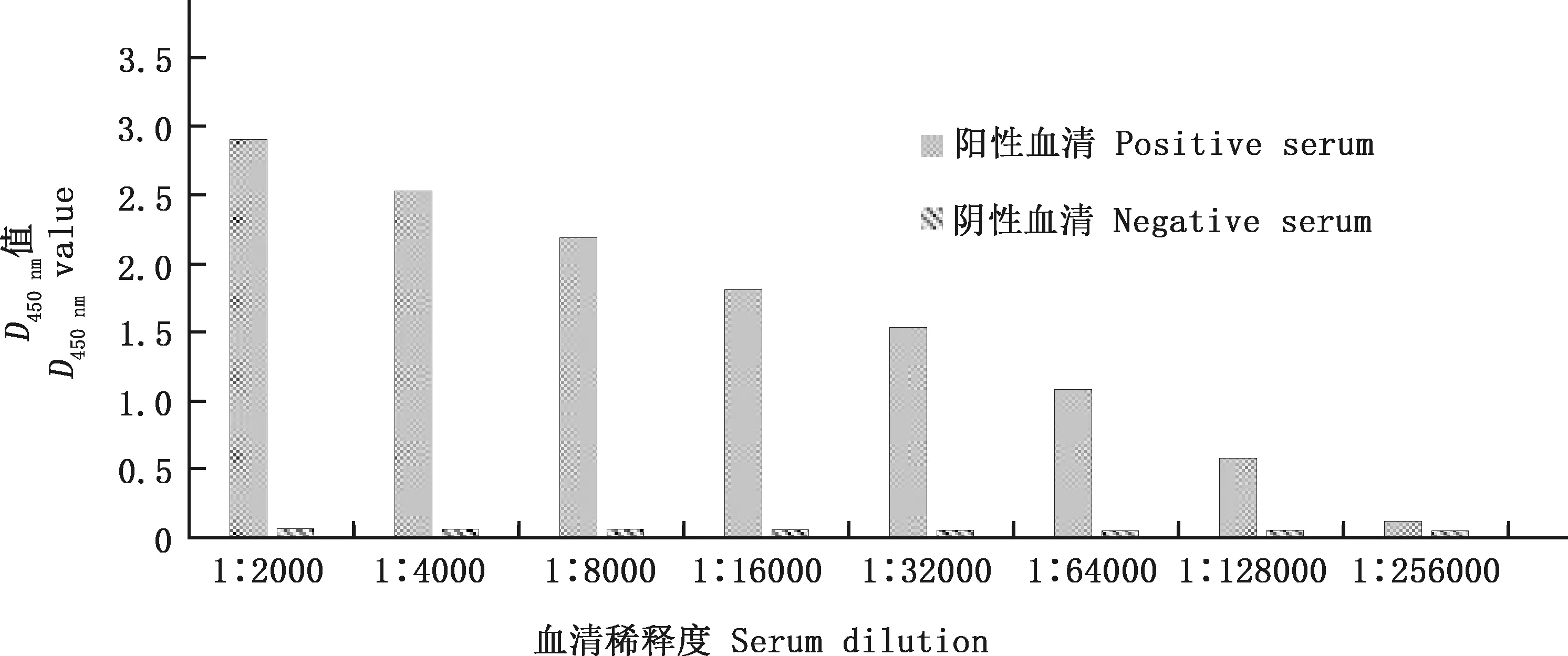
图5 多克隆抗体效价测定Fig.5 Titer determination of polyclonal antibody
2.6 多克隆抗体IFA鉴定
通过IFA对制备的兔源多克隆抗体血清进行鉴定,结果显示,GAstV-1感染的GEK细胞中有大量特异性免疫荧光,而对照组未出现荧光(图6),说明制备的兔源多克隆抗体血清能与GAstV-1发生特异性结合。
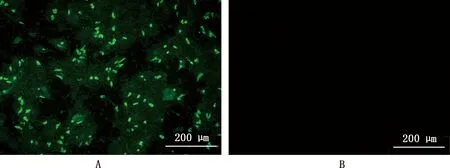
A,感染GAstV-1的GEK细胞;B,未感染的GEK细胞A,GEK cells infected with GAstV-1;B,Uninfected GEK cells图6 ORF2多克隆抗体IFA鉴定(200×)Fig.6 Identification of ORF2 polyclonal antibody by IFA (200×)
3 讨 论
鹅痛风为近年来的新发病,死亡率高达50%,给养鹅业造成了巨大的经济损失。分析其原因主要有:①鹅痛风病原较复杂,有GAstV-1和GAstV-2,2种GAstV不仅基因同源性不到60%,且两者之间没有交叉保护作用[13,18];②目前尚无商品化的GAstV疫苗产品用于该病的防控;③目前为止,还没有成熟的GAstV诊断检测试剂,仅有的几篇文献是关于GAstV-2 PCR检测方法的建立[14-16],而关于GAstV-1检测方法的研究还鲜见报道,因此,有必要积极开发其诊断制剂。
ORF2是星状病毒的结构蛋白,不仅介导病毒与宿主的相互作用,还可刺激机体产生中和抗体[19-21]。本研究选择原核表达载体,以前期分离的GAstV-1 TZ03株为基础,表达GAstV-1结构蛋白ORF2。前期试验中,以GAstV-1基因组为模板,高保真PCR方法扩增出ORF2基因,将其克隆入原核表达载体pET-30a(+),在优化了不同条件之后,重组蛋白均没有表达。重新利用其他原核表达载体如pET-28(+)、pET-32a(+)、pCold TF等,仍不表达。分析其原因,GAstV-1ORF2基因密码子可能不是原核表达系统所偏爱的密码子。因此,对ORF2基因进行了大肠杆菌偏爱性密码子优化合成后,再克隆入原核表达载体pET-30a(+),SDS-PAGE和Western blotting结果表明重组蛋白ORF2获得了正确、高效的表达。蒲路莎等[22]利用原核表达载体pET-32a(+),未经密码子优化,成功表达了GAstV-2 HLJ01株ORF2基因;孙佳卉等[23]利用原核表达载体pET-30a(+),同样未经密码子优化,成功表达了GAstV-2 CH16株ORF2基因。以上研究表明,虽然很多外源基因不需进行偏爱性密码子优化也能在大肠杆菌中获得高效表达,但GAstV-1ORF2基因密码子不适合在原核表达系统中表达,需进行密码子优化后才能在大肠杆菌中获得较高水平表达,同时也说明GAstV-1与GAstV-2ORF2基因在密码子的偏嗜性上差异较大。
4 结 论
本研究利用原核表达系统成功表达了GAstV-1结构蛋白ORF2,制备了高效价的兔抗ORF2蛋白多克隆抗体,且该抗体具有良好的反应性和特异性,能特异性识别GAstV-1,可用于临床样品GAstV-1的检测及相关方法的建立。
