重组动物疱疹病毒活载体疫苗的构建与应用研究进展
2022-02-15杨明珠陈晓春宋佳诚侯亚欣李俊平
杨明珠,陈晓春,宋佳诚,侯亚欣,李俊平
(中国兽医药品监察所,北京 100081)
在集约化养殖模式下,免疫是动物疫病防控的有效手段。疫苗作为免疫防控的最主要物质,安全、有效、质量可控是其应具备的最重要的特性。经济动物使用的疫苗还要考虑其生产工艺、成本、使用的方便性等,最好是多联多价,以减少免疫次数、节约人力成本等。活疫苗具有成本低、免疫效果好的优点,但有的微生物不易致弱,或致弱后易引起毒力返强,存在安全风险,不宜制备活疫苗。灭活疫苗虽无毒力返强的风险,但制备成本较高、免疫效果相对较差,有的微生物制备成灭活疫苗甚至无免疫保护作用。同时大多数传染性病原体是通过黏膜进入宿主体内,因此除了传统诱导系统免疫的注射疫苗外,还应该开发能诱导黏膜免疫的疫苗,从而在黏膜侵入点建立第一道防线,阻止病原体侵入机体[1]。重组活载体疫苗是利用重组DNA技术将外源性目的基因插入到载体基因组中并获得高效表达,同时又不影响原毒株的复制,且能诱导机体的体液免疫与细胞免疫,甚至是黏膜免疫[2],有效规避了传统活疫苗和灭活疫苗的一些缺点,达到一针多防的效果。目前用来构建活载体的动物病毒主要有痘病毒[3-5]、腺病毒[6-7]、疱疹病毒[8]、不分节段的单股RNA病毒[9]等,其中,疱疹病毒因基因组大、宿主范围广泛、含有多个复制非必需区及相关基因操作技术成熟而成为大多数研究者选择的载体病毒。用作病毒载体的动物疱疹病毒主要有火鸡疱疹病毒(Herpesvirus of turkey,HVT)、伪狂犬病病毒(Pseudorabies virus,PRV)、鸭瘟病毒(Duck enteritis virus,DEV)、鸡传染性喉气管炎病毒(Infectious laryngotracheitis virus,ILTV)等。疱疹病毒基因组中的有些基因与病毒的毒力有关而不参与病毒的复制,通过缺失或失活相关毒力基因会在不同程度上降低病毒的毒力,由此可构建出弱毒疫苗对载体相关病毒引起的疾病进行有效防控,同时插入外源基因的重组病毒所表达的蛋白可正常进行翻译、加工与修饰,保证了重组活载体疫苗良好的免疫原性[10]。笔者从重组疱疹病毒的构建方法、外源基因的表达方式及插入位点的筛选、重组疱疹病毒活载体疫苗的研究、重组活载体疫苗的应用及展望等几方面进行综述,以期为相关领域的研究提供理论和实践指导。
1 重组疱疹病毒的构建方法
1.1 传统同源重组法
基于同源重组的原理来构建基因缺失病毒或重组病毒的技术路线分为转移质粒的构建与重组病毒的筛选这2个步骤。通常是先利用PCR技术以病毒基因组为模板扩增用作重组同源臂的2个基因片段,而后将外源基因表达盒插入同源臂之间,构建含有外源基因表达盒及左右同源臂的转移载体,利用转移载体与亲本株在真核易感细胞内同时培养发生同源重组而达到基因的缺失或替换。其中一种重组方法是在亲本病毒株感染真核细胞后再进行转移载体的转染,这种重组效率低,且不易对重组毒株和亲本毒株进行分离,筛选纯化的时间长[11]。目前常采用转移载体与亲本毒基因组共转染的方法,利用转移载体上携带的报告基因进行重组病毒的蚀斑筛选,一般经3~5代筛选即可获得具有感染活性的重组病毒[12]。时庆贺等[13]通过DNA体外重组技术构建出含有猪圆环病毒2型(Porcine circovirus type 2,PCV2)YY株ORF2基因和细胞因子佐剂IL-2基因的转移质粒,将其与rPRV-gE-/TK-/EGFP+的基因组共转染293T细胞,获得重组病毒rPRV-gE-/TK-/ORF2+/IL-2+。Andoh等[14]通过体外克隆技术将含有传染性法氏囊病病毒(Infectious bursal disease virus,IBDV)VP2基因的表达盒插入到含有不同同源臂的重组转移质粒中,并将其与HVT共转染鸡胚成纤维细胞(CEF),基于同源重组将IBDV的VP2基因成功插入到HVT基因组中UL3-4、UL22-23、UL45-46和US10-SORF3这4个位点,成功构建出4株重组病毒。
同源重组技术不仅在早期病毒构建过程中发挥着重要作用,更是与时俱进地与新兴技术相结合形成更高效的重组病毒构建方法,如CRISPR/Cas9介导的同源重组技术[15]、Red/ET重组技术[16]等。
1.2 基于病毒细菌人工染色体(BAC)平台的构建方法
随着对大型基因组序列分析的需求越来越多,对高装载量载体的开发技术逐渐发展,目前已开发出多种类型的人工染色体载体,其中包括基于大肠杆菌性因子F质粒构建的BAC系列,其装载量为50~300 kb,目前已被广泛用于大基因组病毒的克隆。人工构建的BAC载体质粒拷贝数低,但稳定性好,同时在真核细胞中基于BAC表达的基因能接近生理性表达[17]。
构建病毒BAC是对病毒基因组进行修饰、获得重组病毒的前提。在含有病毒BAC的大肠杆菌中对病毒基因组进行快速缺失、突变及插入特定序列等基因修饰非常方便,可利用Red/ET重组技术来改造大肠杆菌中的BAC[16]。一般可分为两步进行,第一步是构建带有标记基因及两端含有同源臂序列的表达盒,将其电转化含有病毒BAC的感受态细胞,经抗性筛选及PCR鉴定等获得正确的重组子;第二步是构建带有外源基因及两端含有同源臂序列的表达盒,利用电转化方式将其导入含有重组子的感受态细胞,经反向抗性筛选获得删除了标记基因的重组子。除了利用抗药性筛选法,还可利用营养缺陷型筛选法,将半乳糖激酶(Galk)基因作为筛选基因,在重组过程中通过观察细菌能否在只含有半乳糖的培养基中生长来判断是否重组成功。
基于RecA系统或利用Red/ET重组技术同样能进行病毒BAC的修饰,两者的修饰技术相似,都是在体外构建含有标记基因或外源基因的DNA分子,将其与大肠杆菌内的病毒BAC进行重组,但在RecA系统中为了诱发重组酶的表达,同源臂长度是Red/ET系统的十余倍。陈柳等[18]在DEV疫苗株细菌人工染色体克隆pDEV-EF1的基础上,将5个重组表达框分别通过Red/ET两步重组技术克隆至pDEV-EF1突变体的US7和US8基因之间,构建了携带不同启动子调控的Es突变体克隆pDEV-pro-Es。
Cre/loxP重组酶系统也被广泛用于基因修饰。Cre/loxp重组酶系统包括Cre重组酶和重组酶的识别位点loxP,Cre重组酶不需要其他辅助因子就能完成活体内和体外细胞中的DNA重组,且重组效率高达80%,远高于其他重组酶,通过特异性识别基因组上的2个34 bp长度的loxP位点,从而对位点之间的基因序列进行修饰。此外,由于Cre重组酶对loxP位点的序列突变具有一定的包容性,大大增加了该系统的应用范围。但就本质而言Cre/loxP并非真正意义上的位点特异性重组系统,因为作为重组事件所必需的顺式元件loxP位点需人工导入,而导入过程仍需借助同源重组程序。同时由Cre重组酶介导的整合和删除反应是可逆的,敲除的靶基因有可能重新返回原来的位点,整合的基因也同样可能从整合位点掉下来。朱佳[19]以IBDV XD2010超强毒株为模板,通过RT-PCR扩增其VP2基因,利用HVT FC126疫苗株基因组US2同源序列、CMV启动子和绿色荧光蛋白(EGFP)基因,构建含有VP2基因的转移载体质粒pCMV-EGFP-VP2,经转染、纯化得到带EGFP基因的重组病毒rHVT-EGFP-VP2,并利用Cre重组酶去除rHVT-EGFP-VP2基因组中的EGFP基因,重新转染CEF细胞,经筛选、纯化得到不含EGFP基因的重组病毒rHVT-VP2。
目前已成功构建出PRV BAC[20]、HVT BAC[21]等,基于病毒BAC平台对病毒基因组进行遗传修饰,简化了重组病毒的构建,有效且可靠。
1.3 基于Fosmid文库的构建方法
利用传统同源重组方法获得重组病毒的效率低,将疱疹病毒全基因组与BAC质粒进行连接,在电转化过程中往往会出现片段缺失,也会影响重组病毒的获得效率。通过构建病毒基因组Fosmid文库,在细菌中对庞大的疱疹病毒基因组进行基因的缺失、插入或突变,能极大提升获得病毒突变体的效率。
构建疱疹病毒Fosmid文库首先需将病毒庞大的基因组随机剪切成各个片段,而后将各片段末端补平修饰后与平末端的Fosmid载体连接,经体外噬菌体包装蛋白包装后侵染大肠杆菌,经抗性筛选后挑取单克隆进行测序鉴定及质粒提取,构建出涵盖疱疹病毒全基因组的Fosmid文库。选取包含病毒全长基因组的质粒组合共转染病毒易感的真核细胞,待产生细胞病变后收毒。外源基因一般通过基因工程技术导入到含有疱疹病毒基因片段的Fosmid质粒中,通过各片段之间的重组从而将外源基因导入到病毒基因组中。
李奇蒙等[22]利用Gateway LR克隆技术将含有IBDVVP2基因的重组转移质粒pENTR-VP2与构建的重组黏粒f5354ccdBK+共同参与基因片段互换反应,构建重组黏粒f5354-VP2,将该重组黏粒与其他4个相互重叠覆盖HVT全基因组的黏粒经酶切线性化后共同转染CEF细胞,成功拯救出重组病毒rHVT-VP2。吴红霞[23]成功构建了中国PRV经典毒株SC株的Fosmid文库,并利用PRV SC株的Fosmid文库成功拯救出重组病毒,同时结合Red/ET所介导的同源重组技术,构建了在PRV SC的UL36基因N-端插入EGFP报告基因的重组病毒rPRVSC-UL6-EGFP。Abid等[24]利用实验室已建立的PRV Fosmid文库平台,构建了gE/gI/TK基因缺失且共表达猪瘟病毒(Classical swine fever virus,CSFV)E2基因和PCV2 Cap蛋白的重组PRV。
基于病毒基因组Fosmid文库插入的外源基因片段较小,但Fosmid文库具有稳定性好、没有偏向性、构建周期短及操作简便等优点,为快速构建突变病毒提供了良好的平台。
1.4 CRISPR/Cas9系统
CRISPR/Cas9介导的基因组编辑技术是基于核酸内切酶Cas9蛋白识别导向性RNA(gRNA)从而对基因组的特定位点进行精确切割,诱发DNA损伤修复机制,细胞随之利用非同源末端连接(NHEJ)或同源重组(HR)方式对切割位点进行修复,实现DNA水平基因敲除或精确编辑。与之前的ZFNs和TALENs基因编辑技术相比,CRISPR/Cas9系统仅需sgRNA便可对特定位点进行修饰,可极大地降低成本、缩短时间[25],同时也可与其他基因敲除技术结合使用,如λ-Red同源重组技术[26]等。在实际操作中,首先需针对特定位点设计出sgRNA,将其退火成双链后与含有Cas9蛋白基因的载体通过酶切连接构成CRISPR/Cas9复合体,将其与含有外源基因的转移质粒及病毒基因组共转染真核细胞,Cas9蛋白通过识别与sgRNA互补结合的DNA链进行切割形成DNA双链断裂,细胞随之对断裂处进行修复,从而进行特定位点的缺失或替换。
经试验证实,切割部位依照同源重组的方式进行修复的概率不足10%,因此,研究者将CRISPR/Cas9系统与同源重组结合起来,使用转移质粒将同源序列转入到细胞中,在提高CRISPR/Cas9系统精确修复率的同时又能改善同源重组技术效率低等问题。张华伟等[15]采用CRISPR/Cas9介导的同源重组技术对分离到的PRV HB2017株进行基因编辑,并利用蚀斑纯化等方法成功获取基因缺失株。白银荣[27]利用CRISPR/Cas9基因编辑技术建立了HVT的载体平台,并拯救获得在US2或US10基因内表达外源基因的重组HVT。 Chang等[28]首先针对HVT的UL45-46基因间区域合成了sgRNA,将其克隆到质粒pX459-v2中,并利用基因特异性引物扩增H7N9亚型禽流感病毒(Avian influenza virus,AIV) HA或EGFP的完整编码区,分别将其克隆到供体质粒pHVT-UL45-46中,将pX459-v2与供体质粒共转染CEF细胞,在感染后72 h收集转染产物并进行噬斑纯化,最终成功构建出表达H7N9亚型AIV HA蛋白的重组毒株HVT-H7N9 HA。
以上常用来构建重组疱疹病毒的各个方法的优缺点见表1。

表1 重组疱疹病毒构建方法的优缺点
2 外源基因的表达方式及插入位点的筛选
在对重组病毒活载体疫苗进行效能评价时,外源基因的表达效果是重要的评价指标。外源基因的起始转录是基因表达的关键步骤,转录起始的速率是基因表达的限速步骤,选择可调控的启动子和相关调控序列是构建一个良好表达系统的前提。外源基因的表达调控结构包含启动子、增强子、Kozac序列和终止密码子等。同其他DNA病毒一样,疱疹病毒表达量的高低主要取决于上游启动子的强弱,一般选用强启动子[29]。同时外源基因的高效表达还与细胞内基因的拷贝数密切相关,随着拷贝数的增加,蛋白的表达量也会逐步升高[1]。改变宿主细胞的特性如延长细胞周期、提高细胞内蛋白糖基化水平等也可促进外源蛋白的表达。
构建重组PRV所选用的主要是gG和gE启动子,其结构独特且活性较强,还有gD和CMV等启动子,一般是启动子序列距外源基因起始密码子越近表达效果越好[30]。不同启动子对外源基因表达的影响不同,陈柳等[18]为了探讨不同启动子对鸭坦布苏病毒(Duck Tembusu virus,DTMUV)E基因C-端截短形式E451-dk(Es)在DEV载体中表达的影响,选取pCAG、pSV40、pRSV、p1.8k(MDV)和pgB(MDV)这5种启动子通过常规基因克隆的方法替换pCMV启动子,经生物学特性分析得出启动子pRSV活性最强,Es在pRSV的调控下表达量最高。
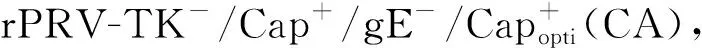
为验证外源基因是否成功表达,需将体外试验与体内试验相结合。Abid等[24]首先利用Fosmid文库平台构建了共表达CSFV E2蛋白和PCV2 Cap蛋白的gE/gI/TK三基因缺失重组PRV,其遗传稳定及生长特性与亲本株无差别,通过家兔和猪的免疫评价结果表明,该重组株对家兔和猪是安全的,且从免疫后家兔和猪的血清中均能检测出抗PRV的抗体,但未能检测到抗CSFV和PCV2的抗体,推测是由于插入外源基因的位置不合适,或E2和Cap蛋白的表达量太低不足以诱导抗体产生。
一直以来,研究者们在选择外源基因的插入位点时,首先考虑病毒的复制非必需区域,虽然疱疹病毒的基因组序列含有大量的复制非必需区,但这些区域与病毒的毒力、病毒的免疫逃避机制或是宿主范围关系等基础理论还有待进一步研究,同时外源基因在载体上的表达既受到表达载体启动子的影响,又受到外源基因在插入过程中所引起的插入位点效应的影响。疱疹病毒载体的常用插入位点及相关重组信息见表2。
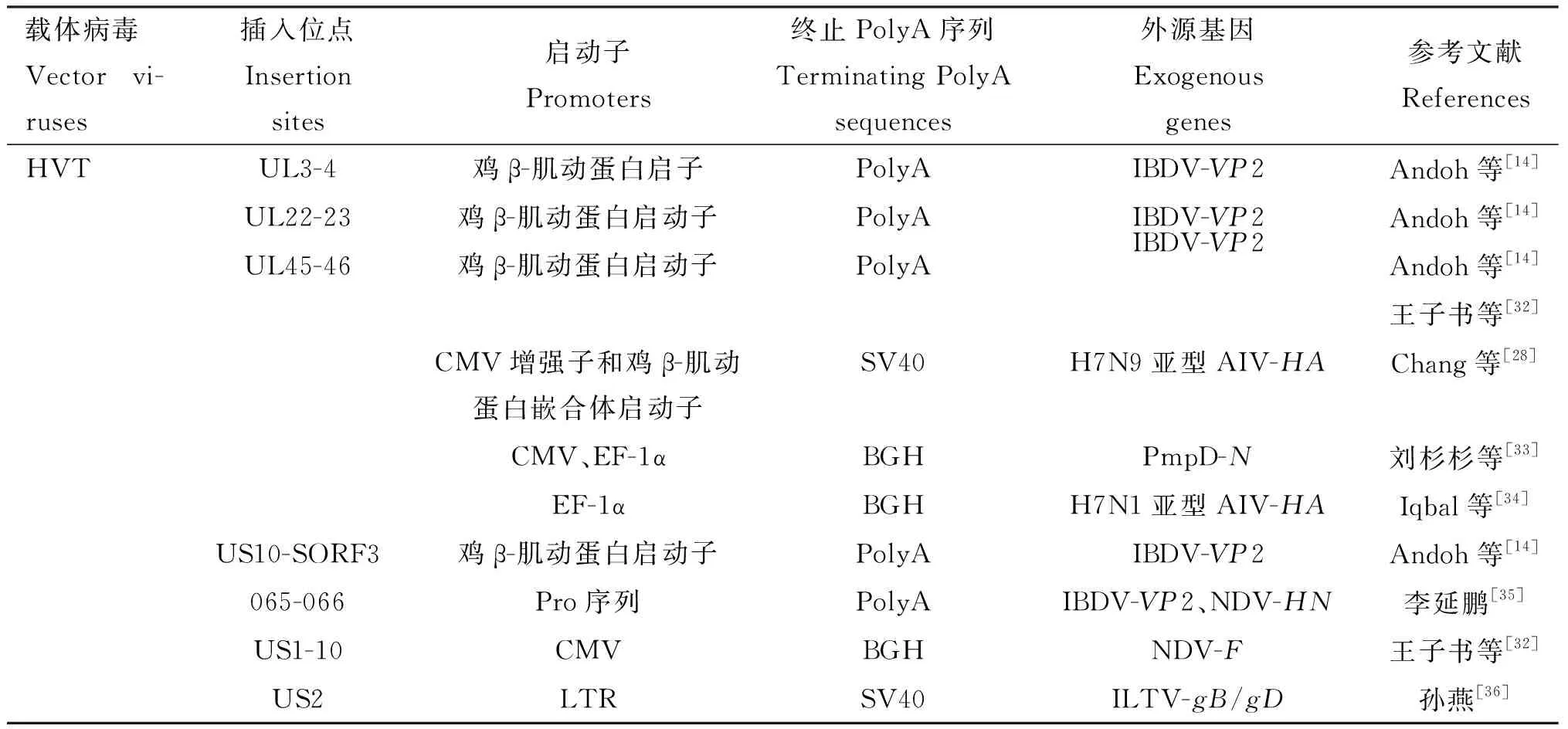
表2 疱疹病毒载体的常用插入位点及相关重组信息
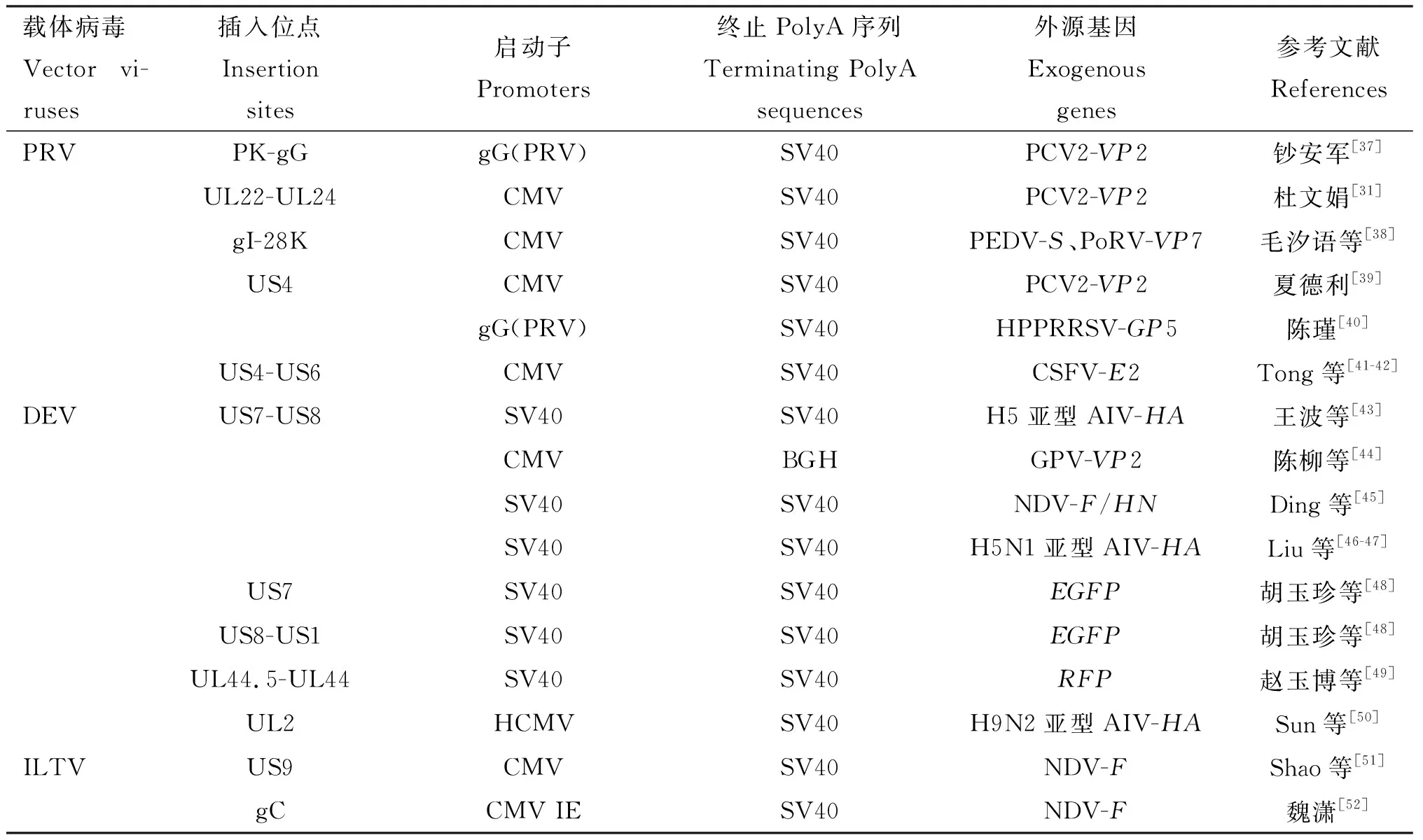
续表
3 重组疱疹病毒活载体疫苗研究进展
3.1 以HVT为载体构建的重组病毒活疫苗

3.2 以PRV为载体构建的重组病毒活疫苗
近年来,随着对PRV分子生物学研究的深入,其作为重组病毒表达载体的类型越来越丰富,单毒力基因缺失及多毒力基因共缺失株的构建为疫苗株的安全性提供了保障,并通过多种成熟的重组技术,实现了将多种猪的重大疫病病毒抗原基因作为外源基因成功插入到PRV的非必需区。Feng等[56]利用同源重组技术将非洲猪瘟病毒(African swine fever virus,ASFV)的CD2V基因插入到TK、gE、gI基因缺失的PRV基因组中,获得重组毒株PRV-ΔgE/ΔgI/ΔTK-(CD2V)。经试验证明了其遗传稳定性、毒力、免疫原性和保护能力,为非洲猪瘟疫苗的有效研发奠定了基础;毛汐语等[38]利用同源重组技术构建共表达猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)S蛋白和猪轮状病毒(Porcine rotavirus,PoRV)VP7蛋白的伪狂犬三联基因工程疫苗株,结果显示该重组株外源基因稳定存在,毒力基因稳定缺失,增殖特性差异不大,为PRV、PEDV和PoRV基因工程三联苗研究奠定了基础。
目前,PCV2的Cap蛋白基因作为外源基因插入到PRV基因组的PK-gG基因之间[37]、UL22-UL24基因之间[31]、US3-US6基因之间[39]等,经PCR鉴定及间接免疫荧光试验(IFA)等验证了重组病毒的成功构建,但重组病毒的免疫原性却参差不齐,这可能与表达盒的启动子及插入位点有关;同样成功插入到PRV基因组中的还有高致病性猪繁殖与呼吸综合征病毒(High pathogenic porcine reproductive and respiratory syndrome virus,HPPRRSV)GP5基因[40]、CSFVE2基因[41]、猪细小病毒(Procine parvovirus,PPV)VP2基因[57]等,构建出的重组病毒经一系列生物学特性分析证明了其稳定性、有效性与安全性,为相应基因工程疫苗的研发奠定了坚实的基础。
3.3 以DEV为载体构建的重组病毒活疫苗
随着对DEV基因结构与功能认识的不断深入,大量的毒力基因、保护性抗原基因和复制非必需基因已得到分析鉴定,常被用作水生家禽疫苗研制中的病毒载体。
Niu等[58]通过构建DEV C-KCE疫苗株的Fosmid文库,在病毒感染性克隆的基础上,将鸭甲型1型肝炎病毒(Duck hepatitis A virus,DHAV-1)的VP0基因插入疫苗株DEV C-KCE基因组的UL41区,构建了重组病毒rDEV-UL41VP0。分析得知VP0基因在被感染的细胞中稳定表达,且不影响DEV C-KCE在细胞中的复制。重组病毒对DEV致死株CSC的攻毒保护率达100%,对DHAV-1 161/79提供70%的保护;王波等[43]同样通过构建DEV的Fosmid文库,将H5亚型AIV 2.3.2.1d分支代表病毒CK/LN/SD007株的HA基因插入DEV基因组中,构建了重组病毒rDEV H5-12,经试验证明了其良好的稳定性、生长特性及免疫原性;陈柳等[44]在DEV疫苗株细菌人工染色体克隆pDEV-EF1的基础上,利用Red/ET两步重组法将密码子优化的小鹅瘟病毒(Goose parvovirus,GPV)的VP2基因框插入到DEV的US7和US8基因之间,获得了重组病毒rDEV-VP2和删除Bac质粒序列的rDEV-VP2-Cre。对重组病毒进行体内外一系列生物学特性分析得出重组毒株生长特性与亲本株基本一致,且能诱导鸭产生GPV VP2的特异性抗体;Ding等[45]构建了2株分别表达NDV F蛋白(rDEV-F)和HN蛋白(rDEV-HN)的重组DEV,经评估得出这2株重组DEV在SPF鸡中的保护功效不同,经rDEV-F免疫后的鸡能对致死性NDV产生100%的抵抗力,而rDEV-HN没有诱导有效的保护。
3.4 以ILTV为载体构建的重组病毒活疫苗
ILTV与其他疱疹病毒相比,在基因组结构、宿主范围及侵入途径等方面存在特异性,目前对于ILTV的研究热点着重于毒株的分离与鉴定,以及将ILTV的有效免疫蛋白VP2基因作为外源基因插入到合适的病毒载体中,如鸡痘病毒、杆状病毒、腺病毒及NDV等。
以ILTV为载体构建重组病毒时,可根据基因同源关系的差异,选择与ILTV差异大且抗原性强的病毒基因。Shao等[51]经同源重组技术将NDV F蛋白基因插入到US9基因缺失的ILTV基因组中,得到重组毒ILTV-ΔUS9-F。并经试验证明ILTV-ΔUS9-F的生长特性与亲本病毒相似,且F基因能稳定存在于ILTV-ΔUS9-F的基因组中并稳定表达。动物感染试验结果显示,ILTV-ΔUS9-F对SPF鸡无致病性,且单次免疫后即可对ILTV强毒株和中国流行的基因Ⅶ型及经典基因Ⅸ型NDV强毒株的攻击提供有效的保护,且与现在广泛应用的NDV商品化活疫苗相比,ILTV-ΔUS9-F能更好地抑制基因Ⅶ型NDV感染后的复制和排毒。
4 重组活载体疫苗的应用
随着基因工程技术的愈发成熟,重组病毒构建研究越来越多,大量重组病毒构建工作经验逐渐累积,相关生物制品成功研制并且应用。笔者统计了部分已注册的重组疱疹病毒活载体疫苗的相关生物制品(表3),包括HVT、DEV、PRV、ILTV的相关活疫苗、灭活疫苗等,以及部分具有专利权保护的重组疱疹病毒(表4),包括以HVT、DEV、PRV、ILTV为载体构建的相关重组病毒等。

表3 部分已注册的重组疱疹病毒活载体疫苗的相关生物制品

表4 具有专利权保护的部分重组疱疹病毒
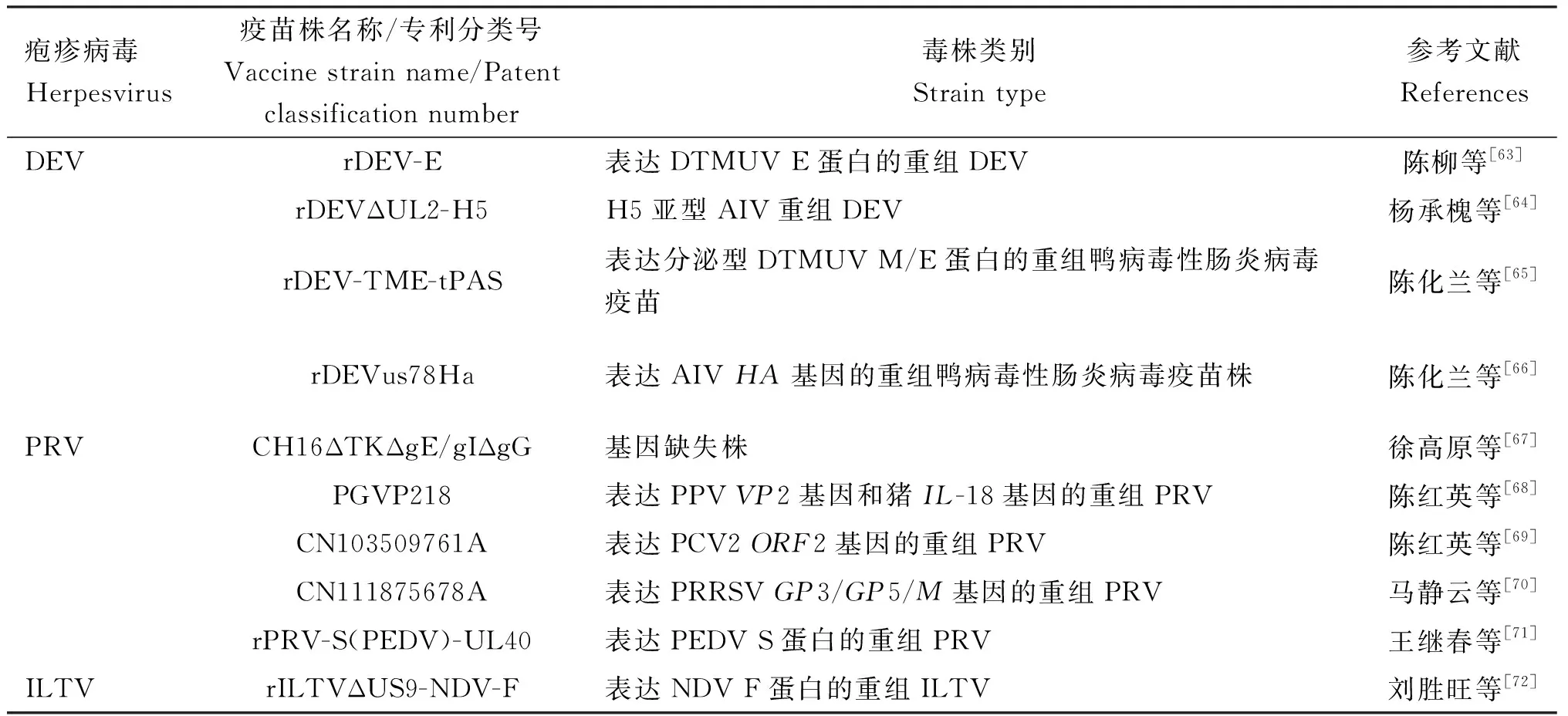
续表
5 小结和展望
基因工程活载体疫苗作为一类新型疫苗,有效地规避了传统疫苗的缺陷,简化了养殖产业中的免疫程序,提高了疫病防控工作效率。随着研究的深入,研究者们在广泛应用同源重组技术的同时,BAC技术、Fosmid文库和CRISPR/Cas9技术等也被应用于重组病毒的构建,大大提高了重组病毒活载体疫苗的研发效率。除了疱疹病毒,同样经常被用作重组病毒活载体的病毒还有痘病毒、腺病毒及NDV等,这更加凸显了重组病毒活载体疫苗在研制效率及免疫效果方面的强大优势。
但随着重组活载体疫苗的大量研发,某些问题也逐渐被重视,免疫原基因的选择及如何保证重组病毒的遗传稳定性和安全性也需着重研究。在进行免疫原基因的选择时,不能单一地只考虑其免疫原性,其表达效率及对动物的安全性同样应作为选择依据。目前,重组病毒的遗传稳定性一般是通过细胞传代试验结合实验室鉴定及基因组测序分析得到,这种传统方法准确率高但耗时长,因此,亟需一种新的方法来快速衡量重组病毒的稳定性。而重组病毒安全性一般是经临床动物试验进行测定,通过实时记录靶动物接种合适剂量的病毒之后的各项生命体征指标来间接反映重组病毒的安全性,虽然在当前重组动物疱疹病毒活载体疫苗的研发过程中,作为病毒载体的疱疹病毒往往缺失了主要毒力基因,对动物体的致病力大大减弱,但其安全性还需进行长期且全面深入的分析。
疱疹病毒庞大的基因组中广泛存在的复制非必需区为重组位点的优化研究提供了基础,选择更优的外源基因插入位点,更安全高效的表达元件,特别是高效启动子是重组活载体疫苗推广应用的基础。重组疱疹病毒活载体疫苗优势得到充分的研究与利用后,将会在未来的动物疫病防控中发挥重要作用。
