绿色荧光蛋白的真核表达及其单克隆抗体制备
2022-02-15胡换仪汪建中刘昌锦刘小兰魏黄思梧邓舜洲
胡换仪,汪建中,刘昌锦,林 敏,刘小兰,魏黄思梧,邓舜洲
(江西农业大学动物科学技术学院,南昌 330045)
1962年,Shimonura等[1]在维多利亚水母中发现了一种能释放出生物荧光的绿色荧光蛋白(green fluorescent protein,GFP)。GFP的分子质量约27 ku,是一条由238个氨基酸组成的多肽链,经紫光或蓝光照射会发出绿色荧光。GFP的荧光来源于生色团,由3个氨基酸残基Ser65-Tyr66-Gly67形成的对羟基苯咪唑啉酮构成。GFP的独特之处在于有氧条件下无需任何辅助因子或特定的酶即可产生荧光[2]。但野生型GFP在蓝光激发下荧光强度偏低,在几种哺乳动物细胞中表达不稳定,针对此情况,Zhang等[3]对GFP的氨基酸进行了替换(Ser65→Thr,Phe64→Leu),即为增强型GFP(enhanced GFP,EGFP),其荧光强度提高了35倍。GFP具有性质稳定、无毒、灵敏度高、载体构建简单等优点,因此,近二十多年已在各个领域被广泛应用,主要用于显像和示踪技术、报告基因、活细胞内的荧光感受器、筛选和纯化及抗体生产等方面[4]。
在利用GFP对内源蛋白进行定量时,活体细胞本身存在的自荧光物质会影响试验结果,导致无法准确定量;此外,组织或细胞在各种理化处理过程中荧光易淬灭,不利于对组织中GFP标记蛋白进行细胞内定位及所在组织的结构和功能的原位分析[5]。因此,如果有针对GFP的高特异性、高灵敏度抗体,可在一定程度上弥补上述不足,作为一种有效的补充手段提高GFP检测的灵敏度和准确度,扩大荧光检测范围。
本研究以猪痘病毒(Swinepox virus,SWPV)TK基因为外源基因插入位点,采用同源重组技术构建重组SWPV表达GFP,在此基础上,制备抗GFP的单克隆抗体,以期为今后建立GFP的免疫学检测方法提供特异性抗体。
1 材料与方法
1.1 材料
1.1.1 质粒、毒株和细胞 含有SWPVTK基因左右臂的基础质粒载体pSW[6]、SWPV-JX20G株、PK15细胞、SP2/0骨髓瘤细胞、原核表达的EGFP-His蛋白和抗PCV2单克隆抗体6E2均由江西农业大学预防兽医室构建或保存;EGFP-N1质粒(含P28-EGFP-His片段)由南京金斯瑞生物科技有限公司合成。
1.1.2 主要试剂NotⅠ和XhoⅠ均购自Thermo公司;T4 DNA连接酶、PCR反应相关试剂均购自TaKaRa公司;新生牛血清、高糖DMEM培养基、OPTI-MEM均购自Gibco公司;Lipofectamine 2000购自Invitrogen公司;Western blotting相关试剂均购自Solarbio公司;HRP标记的羊抗鼠IgG购自北京全式金生物技术有限公司;His标签蛋白纯化试剂盒购自康为世纪生物科技有限公司;PEG2000、HAT、HT、低熔点琼脂糖和弗氏佐剂均购自Sigma公司。
1.1.3 试验动物 6~8 周龄雌性BALB/c小鼠和成年昆明小鼠均购自湖南斯莱克景达实验动物有限公司。
1.1.4 P28启动子序列 根据Winslow等[7]对痘苗病毒启动子P28的相关报道,本试验采用的P28启动子大小为33 bp,序列为:5′-CTTTTT-TTTTTTTTTTTTTTTGGCATATAAATG-3′。
1.2 方法
1.2.1 EGFP-His蛋白的表达及纯化
1.2.1.1 目的基因扩增 以EGFP-N1质粒为模板,PCR扩增P28-EGFP-His片段,上游引物EGFP-F:5′-AAATATGCGGCCGCCCCGGGCTT-TTTTTTTTTTTTTTTTTTGGCATATAAATG-GTGAGCAAGGGCGA-3′,5′-端加上NotⅠ酶切位点(下划线处);下游引物EGFP-R:5′-CCTCGAG-TTAATGATGGTGGTGATGATGCTTGTACAGCT-CGTCCATGCCGAGAGTGATCC-3′,5′-端加上XhoⅠ酶切位点(下划线处),预期扩增片段大小为768 bp,含有P28启动子、EGFP基因和6×His标签。引物由南京金斯瑞生物科技有限公司合成。PCR反应体系50 μL:HiFi Buffer Ⅰ 5 μL,dNTP 4 μL,上、下游引物各0.5 μL,HiFi酶0.5 μL,模板2 μL,ddH2O 37.5 μL。PCR反应条件:94 ℃预变性5 min;94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸1 min,共32个循环;72 ℃延伸10 min;4 ℃保存。PCR产物经1.0%琼脂糖凝胶电泳进行鉴定。
1.2.1.2 重组SWPV转移载体的构建及鉴定 P28-EGFP-His片段和pSW质粒分别经NotⅠ和XhoⅠ双酶切、纯化,T4 DNA连接酶连接后转化大肠杆菌Trans5α感受态细胞,挑取单个菌落进行PCR鉴定、双酶切鉴定,筛选阳性克隆进行测序。按高纯度质粒小提中量试剂盒说明书操作,大量制备用于转染的重组质粒pSW-EGFP-His,测量质粒浓度,计算转染体积,-20 ℃保存备用。
1.2.1.3 重组质粒转染及重组SWPV(rSWPV-EGFP-His)纯化 培养PK15细胞汇合度至80%,感染SWPV-JX20G株,吸附2 h后,按照Lipofectamine 2000试剂盒说明书进行转染。转染细胞培养48 h时,观察有无荧光及细胞病变,维持5~6 d收毒。参考刘昌锦等[8]方法进行重组病毒蚀斑纯化。
1.2.1.4 rSWPV-EGFP-His的PCR鉴定 根据SWPV-JX20G株的TK基因序列,设计1对检测引物,上游引物TK1:5′-GGACCTATGTTCTCTG-GAAAGAGT-3′;下游引物TK2:5′-TGTTCCA-TCTAATGCAGCAACG-3′,亲本SWPV预期扩增片段大小为309 bp,rSWPV-EGFP-His预期扩增片段大小为1 077 bp,引物由南京金斯瑞生物科技有限公司合成。反应体系及反应条件同1.2.1.1。
1.2.1.5 EGFP-His蛋白表达和纯化 将表达EGFP-His蛋白的rSWPV-EGFP-His接种PK15细胞进行扩大培养,病毒吸附4~5 h后加入适量含5%血清的DMEM培养液,48~72 h观察细胞荧光,细胞达100%荧光时用无血清DMEM培养液洗涤细胞3 次,加入适量无血清DMEM培养液继续培养至细胞全部病变后收毒。 病毒液冻融3 次后取1 mL 12 000 r/min离心10 min,分别收集上清和沉淀,SDS-PAGE观察EGFP-His蛋白表达形式。按照His标签可溶性蛋白纯化试剂盒说明书纯化EGFP-His蛋白,SDS-PAGE观察纯化效果。
1.2.2 抗EGFP-His单克隆抗体的制备
1.2.2.1 小鼠免疫 将纯化的EGFP-His蛋白与弗氏完全佐剂乳化,蛋白含量为100 μg/0.2 mL,免疫5 只6~8 周龄雌性BALB/c小鼠,皮下多点注射,0.2 mL/只,每隔10 d加强免疫一次(第2次免疫开始用弗氏不完全佐剂),共免疫5 次,每次免疫前及第5次免疫后10 d断尾采血取血清。融合前加强免疫,尾静脉注射EGFP-His蛋白(50 μg/只),3 d后取脾细胞与SP2/0骨髓瘤细胞进行融合。
1.2.2.2 抗原最佳包被浓度和血清最佳稀释度的确定 按照方阵滴定法,将纯化后的EGFP-His蛋白用0.05 mol/L pH 9.6 碳酸盐缓冲液连续稀释(浓度分别为0.625、1.25、2.5、5、10和20 μg/mL),100 μL/孔,4 ℃包被酶标板过夜;5%脱脂牛奶37 ℃封闭2 h;将阳性小鼠血清(免疫小鼠血清)和阴性小鼠血清稀释(1∶4 000、1∶8 000、1∶16 000、1∶32 000、1∶64 000、1∶128 000、1∶256 000和1∶512 000),100 μL/孔,同时设空白对照,37 ℃湿盒孵育1 h;PBST洗板3 次,加HRP标记山羊抗鼠IgG(1∶2 000稀释),100 μL/孔,37 ℃湿盒孵育1 h;PBST洗板4~5次,加OPD底物溶液,100 μL/孔37 ℃湿盒避光显色15~20 min;每孔加50 μL终止液终止显色。酶标仪读D492 nm值,选择阳性小鼠血清D492 nm值接近1.0,P/N值最大时对应的浓度为抗原最佳包被浓度和血清最佳稀释度。
1.2.2.3 免疫小鼠抗体水平检测 将待测免疫小鼠血清1∶1 000稀释,利用条件优化后建立的间接ELISA方法检测免疫小鼠抗体水平。
1.2.2.4 杂交瘤细胞的制备和筛选 取血清抗体效价最高的小鼠脾细胞与SP2/0细胞以适当比例混合均匀,参考王雅文等[9]方法进行细胞融合。融合后10~15 d,采用间接ELISA方法对杂交瘤细胞进行2次筛选,第1次筛选时包被抗原为真核表达的EGFP-His蛋白,第2次筛选时抗原为原核表达的EGFP-His蛋白。筛选到的阳性杂交瘤细胞按照常规方法进行亚克隆。
1.2.2.5 单克隆抗体腹水的制备、纯化和效价测定 取成年雌性BALB/c小鼠,腹腔内注射液体石蜡0.5 mL/只;10 d后接种杂交瘤细胞,腹腔注射0.2 mL/只;7~10 d后,根据腹水产生情况采集腹水;4 000 r/min离心10 min,除去油脂及细胞成分,收集腹水,测腹水抗体效价。 按照辛酸-硫酸铵法纯化腹水中的单克隆抗体,SDS-PAGE分析腹水纯化效果,采用间接ELISA方法检测纯化腹水抗体效价。
1.2.2.6 单克隆抗体Western blotting的鉴定 参考1.2.1.5制备SWPV载体表达的EGFP-His蛋白样品,经SDS-PAGE后转印至PVDF膜上,分别以9株抗EGFP-His单克隆抗体(待检样品)和1株抗PCV2单克隆抗体6E2(阴性对照)为一抗,以1∶2 000稀释的HRP标记的羊抗鼠IgG为二抗,通过DAB显色系统对单克隆抗体进行Western blotting检测。
2 结 果
2.1 EGFP-His的表达及纯化
2.1.1 EGFP-His基因片段的扩增 以合成质粒EGFP-N1为模板扩增P28-EGFP-His片段,扩增产物大小为768 bp(图1),与预期一致。
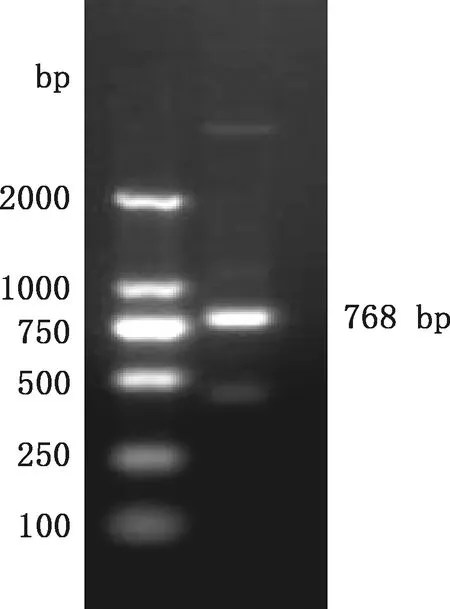
图1 P28-EGFP-His的PCR扩增结果Fig.1 PCR amplification result of P28-EGFP-His
2.1.2 重组SWPV转移载体的鉴定 构建好的重组质粒用引物EGFP-F/EGFP-R进行PCR验证,结果均得到大小约768 bp的明显条带(图2),与预期相符。提取重组质粒,用NotⅠ和XhoⅠ双酶切,得到大小约768和4 700 bp的2个条带(图3),与预期相符。测序结果显示,插入的基因碱基序列、位置和方向均正确,证明重组转移载体构建成功。

M,DL2000 DNA Marker;1~6,重组克隆菌M,DL2000 DNA Marker;1-6,Recombinant bacteria clonies图2 重组质粒pSW-EGFP-His的PCR鉴定Fig.2 PCR identification of recombinant plasmid pSW-EGFP-His

M1,DNA Marker Ⅳ;1,pSW质粒;2,pSW-EGFP-His重组质粒;M2,DL2000 DNA MarkerM1,DNA Marker Ⅳ;1,pSW plasmid;2,Recombinant plasmid pSW-EGFP-His;M2,DL2000 DNA Marker图3 重组质粒pSW-EGFP-His的酶切鉴定Fig.3 Identification of recombinant plasmid pSW-EGFP-His by enzyme digestion
2.1.3 rSWPV-EGFP-His的纯化与扩增 rSWPV-EGFP-His在第1轮纯化时荧光斑较小,荧光细胞比较分散,荧光斑的数量也较少(图4A)。经过7轮纯化,荧光斑变大、变亮且致密(图4B)。一般经过7~8轮纯化可得到纯化的重组病毒,将经验证的重组病毒依次用24孔板、6孔板、25 cm2培养瓶进行扩增培养,直至在荧光显微镜下能观察到所有细胞均发荧光(图4C)。

A,第1轮纯化;B,第7轮纯化;C,增殖的荧光斑A,The first round of purification;B,The seventh round of purification;C,Fluorescent plaques after proliferation图4 rSWPV-EGFP-His纯化、增殖荧光斑(100×)Fig.4 Purification and proliferation fluorescence of rSWPV-EGFP-His (100×)
2.1.4 rSWPV-EGFP-His的PCR鉴定 提取纯的rSWPV-EGFP-His和亲本SWPV-JX20G的DNA,用引物TK1/TK2进行PCR扩增。结果显示,亲本病毒扩增出一条大小为309 bp的条带,符合预期;重组病毒rSWPV-EGFP-His仅扩出一条大小为1 077 bp的条带,而无309 bp的条带(图5),表明EGFP-His基因成功插入到SWPVTK基因中并成功纯化到rSWP-EGFP-His。

M,DL2000 DNA Marker;1;SWPV-JX20G strain;2,rSWP-EGFP-His图5 rSWPV-EGFP-His的PCR扩增结果Fig.5 PCR amplification results of rSWPV-EGFP-His
2.1.5 EGFP-His蛋白的表达与纯化 由图6可知,EGFP-His蛋白存在于重组病毒的细胞培养上清中,蛋白大小约27 ku,为可溶性表达。培养液上清浓缩透析后,采用镍柱纯化,获得了高纯度的EGFP-His蛋白(图7)。原核表达的EGFP-His溶液为无色,而SWPV载体表达的EGFP-His在可见光下呈现绿色荧光(图8)。

M,预染蛋白质分子质量标准;1,rSWPV-EGFP-His病毒液悬液;2,rSWPV-EGFP-His病毒液上清;3,rSWPV-EGFP-His病毒液沉淀M,Pre-staining Protein Marker;1,Virus suspension of rSWPV-EGFP-His;2,Supernatant of virus solution of rSWPV-EGFP-His;3,Precipitation of virus solution of rSWPV-EGFP-His图6 EGFP-His蛋白可溶性分析Fig.6 Soluble analysis of EGFP-His protein

M,预染蛋白质分子质量标准;1,rSWPV-EGFP-His细胞悬液;2~4,EGFP-His蛋白第2、3、4管洗脱液M,Pre-staining Protein Marker;1,Cell suspensions of rSWPV-EGFP-His;2-4,Tube 2,3,4 elution of EGFP-His protein图7 EGFP-His蛋白纯化Fig.7 Purification of EGFP-His protein

1,SWPV载体表达的EGFP-His;2,原核载体表达的EGFP-His1,EGFP-His expressed by SWPV vector;2,EGFP-His expressed by prokaryotic vector图8 不同载体表达的EGFP-His蛋白Fig.8 EGFP-His protein expressed in different expression vectors
2.2 抗EGFP-His单克隆抗体的制备
2.2.1 最佳抗原包被浓度和血清稀释度的确定 由表1可知,EGFP-His蛋白浓度为5 μg/mL,阴阳性小鼠血清稀释度为1∶64 000时,阳性小鼠血清D492 nm值接近1.0,P/N值最大,因此,选择上述浓度作为抗原最佳包被浓度和血清最佳稀释度。

表1 最佳抗原包被浓度和血清稀释度的确定
2.2.2 免疫小鼠血清EGFP抗体水平检测 间接ELISA结果显示,随免疫次数增加免疫鼠抗体效价明显上升(图9),其中,5号小鼠免疫效价最高,为1∶256 000,表明SWPV载体表达的EGFP-His蛋白具有良好的免疫原性。
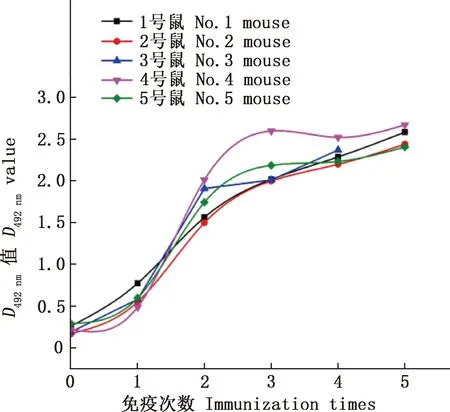
图9 免疫小鼠血清抗体水平Fig.9 Serum antibody level of immunized mice
2.2.3 杂交瘤细胞筛选结果 选择效价最高的免疫鼠脾细胞与SP2/0骨髓瘤细胞进行细胞融合,经间接ELISA筛选到9株能稳定分泌抗EGFP单克隆抗体的杂交瘤细胞株,分别命名为7E12、2F2、4B3、11H6、9H8、17C8、9A10、18A6和17H2。这9株单克隆抗体均能与SWPV载体表达的EGFP-His蛋白反应,其中7株(2F2、4B3、11H6、9H8、17C8、18A6和17H2)能与原核表达的EGFP-His蛋白反应,2株(7E12和9A10)不与原核表达的EGFP-His蛋白反应。
2.2.4 单克隆抗体制备、纯化及效价测定 制备的单克隆抗体效价在1∶8×103至1∶2.048×106之间。SDS-PAGE结果显示,在大小约52和26 ku的位置出现2条明显的条带且无其他杂带(图10),表明纯化到单克隆抗体,2条条带分别对应抗体的重链和轻链,纯化效果较好。

M,预染蛋白质分子质量标准;1,抗EGFP-His单克隆抗体17H2腹水;2,纯化的抗EGFP-His单克隆抗体17H2M,Pre-staining Protein Marker;1,Ascites of monoclonal antibody 17H2 against EGFP-His;2,Purified monoclonal antibody 17H2 against EGFP-His图10 EGFP-His单克隆抗体纯化结果Fig.10 Purification results of EGFP-His monoclonal antibody
2.2.5 单克隆抗体Western blotting检测结果 由图11可知,经Western blotting检测,2F2、4B3、11H6、9H8、17C8、18A6和17H2这7株单克隆抗体在27 ku处均有明显的特异性反应条带,说明其能与变性的SWPV载体表达的EGFP-His蛋白反应,而7E12和9A10这2株单克隆抗体在27 ku处没有条带,说明其不能与变性的SWPV载体表达的EGFP-His蛋白反应。抗PCV2单克隆抗体6E12在27 ku处没有条带,与预期一致。

M,预染蛋白质分子质量标准;1~4,抗EGFP-His单克隆抗体17C8、4B3、9A10和2F2;5,抗PCV2单克隆抗体6E12;6~10,抗EGFP-His单克隆抗体11H6、9H8、17H2、18A6和7E12M,Pre-staining Protein Marker;1-4,Monoclonal antibodies 17C8,4B3,9A10 and 2F2 against EGFP-His,respectively;5,Monoclonal antibody 6E12 against PCV2;6-10,Monoclonal antibodies 11H6,9H8,17H2,18A6 and 7E12 against EGFP-His,respectively图11 单克隆抗体Western blotting检测结果Fig.11 Detection results of monoclonal antibody by Western blotting
3 讨 论
随着分子生物学的发展,基因工程表达外源蛋白取得较大进展,迄今为止,已开发出多种原核和真核表达系统用于外源蛋白的表达,主要包括大肠杆菌、酵母细胞、杆状病毒、哺乳动物细胞表达系统等。大肠杆菌表达系统为原核表达系统,具有表达背景清楚,表达水平高,操作简单,培养周期短,抗污染能力强等优点,但其表达产物往往易形成包涵体且难以复性,表达真核基因缺乏翻译后修饰功能[10]。酵母表达系统为真核表达系统,表达量高,可大规模生产,对异源蛋白有一点简单的修饰作用,但其发酵过程中常大量产热、产气,需要复杂的处理系统。杆状病毒表达系统具有完善的加工修饰功能,表达产物可组装成病毒样颗粒(VLPs),具有与天然蛋白近似的功能,但其生产需要昂贵的细胞培养基和血清,生产成本较高,且外源蛋白处于极晚期病毒启动子的调控之下,由于病毒感染引发细胞凋亡,导致细胞生存时间短无法进行连续性表达,表达量低[11]。哺乳动物表达系统能产生正确折叠的蛋白,提供复杂的N型糖基化和准确的O型糖基化等翻译后修饰功能,表达产物更接近于天然蛋白,是多种基因工程药物的生产平台[12-13]。研究发现,原核表达的GFP大部分以不可溶的包涵体形式存在,即使是经过改造的EGFP表达产物也只是少部分可溶,且在细菌系统中产生的大多数非细菌蛋白无法形成天然构象,相反,真核表达系统具有一系列翻译后加工修饰体系,表达的外源蛋白更接近于天然蛋白[14]。朱反修等[15]用杆状病毒表达载体表达的GFP在日光下可见微弱绿色,具有与天然GFP相似的生物活性。为获得正确折叠及具有生物活性的GFP,本研究采用SWPV表达载体在猪肾上皮细胞中表达EGFP-His蛋白,该蛋白为可溶性表达,与原核表达的EGFP-His相比,在可见光下呈现明显绿色。
GFP发色团的形成取决于肽链的正确折叠,其对温度敏感,高于65 ℃时荧光形成不稳定[16],热变性的GFP无法有效复性或恢复荧光[17]。研究表明,GFP抗原结构中含有构象依赖型的抗原表位,经变性后会丢失,Nakamura等[18]制备了针对热变性GFP的多克隆抗体,可识别经热处理和变性剂处理后暴露的GFP表位,该多克隆抗体针对的是GFP的线性表位。为获得不同种类的抗GFP单克隆抗体,本试验分别利用SWPV载体和原核载体表达的EGFP-His蛋白为检测抗原进行间接ELISA,共筛选到9株抗EGFP-His单克隆抗体。 间接ELISA和Western blotting结果显示,其中有2株单克隆抗体(7E12和9A10)既不与原核表达的EGFP-His蛋白反应,也不与经SDS处理的SWPV载体表达的EGFP-His蛋白反应。这是因为2株单克隆抗体针对的是天然GFP的构象表位,该表位在蛋白变性(如热处理和尿素处理)后可被破坏,从而导致针对构象表位的单克隆抗体无法和抗原发生反应。其余7株单克隆抗体均可识别变性和非变性形式的GFP,针对的是GFP的线性表位。
GFP自发现以来被作为理想的基因表达标记,已被广泛应用于跟踪蛋白在细胞、组织和生物体中的定位和相互作用,检测外源基因表达情况等[19-22]。通过荧光显微镜观察或流式细胞仪可进行GFP定量检测,Gerena-lópez等[23]通过流式细胞术对转染的Molt-4T细胞系的EGFP表达进行了定量;苟吉庆等[24]利用荧光分光光度计对植物组织中的GFP表达水平进行定量分析,其结果与荧光显微镜观察结果高度一致;张垲等[25]建立了一套通过定量检测细胞荧光强度从而测定EGFP表达水平的方法,该方法简单有效,且不依赖于大型仪器设备,具有较高的准确性与灵敏度,但上述方法均存在一定局限性,结果判定主观性强,无法进行准确定量。制备抗GFP的特异性抗体可用于建立免疫学检测方法,对GFP或GFP标记的融合蛋白进行定量或半定量检测[26]。刘全等[27]以GFP兔抗血清为一抗,辣根过氧化物酶标记的羊抗兔血清为二抗,建立了GFP定量检测的间接ELISA方法,该方法能正确反映蓝氏贾第鞭毛虫病毒(GLV)介导的GFP表达情况,可用于GFP定量方析。本研究在表达EGFP-His蛋白的基础上制备了抗EGFP-His的单克隆抗体,可用于今后建立免疫学检测方法,对GFP进行定性/定量检测,为SWPV表达载体的相关研究奠定基础。
4 结 论
本研究利用SWPV载体成功表达并纯化了EGFP-His蛋白,大小为27 ku,为可溶性表达,可见光下呈现明显绿色。采用杂交瘤技术制备了9株抗EGFP-His蛋白单克隆抗体,其中2株针对GFP的构象表位,其余7株针对GFP的线性表位。本研究制备的EGFP-His蛋白和9株抗EGFP-His单克隆抗体为后续建立GFP的免疫学检测方法提供了必备材料。
