丝状支原体山羊亚种LPPA蛋白原核表达及间接ELISA方法的建立
2022-02-15朱二鹏张双翔程振涛
陈 静,吴 燕,李 梅,岳 筠,朱二鹏,2,文 明,2,张双翔,程振涛,2
(1.贵州大学动物科学学院,贵阳 550025;2.贵州省动物疫病与兽医公共卫生重点实验室,贵阳 550025;3.贵州省动物疫病预防控制中心,贵阳 550008)
丝状支原体山羊亚种(Mycoplasmamycoidessubsp.capri,Mmc)属于丝状支原体簇,感染山羊及绵羊后可导致羊支原体性肺炎(Mycoplasmapneumonia of goats and sheep,MPGS),其临床症状主要以高热、咳嗽、胸膜及肺脏发生炎症为主[1-2]。近年来,许多地区羊群中均有MPGS发生,该病波及范围广、传播速度快且发病率高,严重制约了中国养羊业的发展。疫苗免疫是防制该病的主要措施,而疫苗免疫效果评估是防控本病的有力保障[3]。目前,用于疫苗免疫效果评估的主要手段有血凝试验、血凝抑制试验及ELISA等,其中ELISA方法在灵敏度及特异性等方面占有很大的优势,是最常用的方法之一[4-5]。
糖脂和膜蛋白是细胞膜抗原的主要结构成分,在特定的条件下能与抗原诱导的抗体等物质进行特异性结合[6]。支原体表面具有大量结构复杂的膜蛋白,这些膜蛋白具有识别和免疫的作用,在一定条件下既能刺激机体产生免疫应答反应,又与支原体致病力的强弱密切相关[7-9]。研究发现,Mmc拥有庞大、结构复杂的基因组,而Mmc LPPA蛋白是整个丝状支原体簇均存在的一种膜脂蛋白,该蛋白具有高度保守性。其基因序列位于Mmc 251-1 822位碱基,除了N-端5-25位氨基酸外,LPPA蛋白绝大部分区域均具有较强的抗原性。但关于Mmc LPPA蛋白的功能研究目前尚不明确,推测其可能在支原体进入到宿主细胞过程中发挥着关键作用[10]。近年来,Mmc已在世界多国流行,成为阻碍山羊养殖业发展的病原之一,给羊产业造成了重大经济损失。目前常用的诊断方法有支原体分离培养、PCR及实时荧光定量RT-PCR等[11-13]。关于疫苗效果评估方法的报道极少,ELISA方法以其简便、检测样本量大等优点,多用于疫苗免疫效果的评价。但对于Mmc的ELISA诊断方法目前报道较少,Mmc抗体检测技术仍处于起步阶段,严重制约了该病的有效诊断与防治工作。因此,建立一种针对Mmc的快速、特异、敏感的检测方法对羊支原体肺炎的诊断、监控及流行病学调查工作具有重要意义。本研究原核表达Mmc LPPA蛋白,并将纯化的重组蛋白作为包被抗原,建立了一种Mmc重组LPPA蛋白的间接ELISA抗体检测方法,以期为Mmc抗体水平检测、流行病学调查、疫苗免疫效果评价提供重要的技术手段。
1 材料与方法
1.1 菌株、质粒及血清样本
Mmc PG3标准株购自中国微生物菌种资源库保存中心;大肠杆菌BL21(DE3)和DH5α感受态细胞、大肠杆菌原核表达质粒pCold-Ⅰ均由贵州省动物疫病与兽医公共卫生重点实验室保存;绵羊肺炎支原体(Mo)和Mmc标准阳性及阴性血清、弓形虫(Tox)标准阳性血清、Mmc正向间接血凝诊断试剂盒均购自中国农业科学院兰州兽医研究所;蓝舌病病毒(BTV)和小反刍兽疫病毒(PPRV)标准阳性血清均购自北京天之泰公司;羊口蹄疫病毒(FMDV)标准阳性血清购自武汉科前动物生物制品有限责任公司;山羊痘病毒(GPV)标准阳性血清购自中国兽医药品监察所;184份临床检测血清及92份经Mmc正向间接血凝诊断试剂盒检测抗体阴性的羊血清均采自贵州省遵义市某规模养羊场。
1.2 主要试剂
支原体基因组小量提取试剂盒购自Biomiga公司;E.Z.N.A.TMGel Extraction Kit、E.Z.N.A.TMPlasmid Kit均购自Omega公司;蛋白纯化试剂盒购自Invitrogen公司;限制性内切酶Hind Ⅲ和XhoⅠ、Prestained Protein Ladder、T4 DNA连接酶均购自ThermFisher公司;DL2000 DNA Marker和DL5000 DNA Marker均购自天根生化科技(北京)有限公司;IPTG购自Sigma公司;兔抗羊IgG-HRP购自北京博奥森生物技术有限公司;DAB购自北京中杉金桥生物技术有限公司。
1.3 重组蛋白诱导表达及纯化
1.3.1 引物设计与合成 参照GenBank已登录的MmcLPPA基因序列(登录号:AF072715.1),利用Primer Premier 5.0软件设计特异性引物。引物序列为:Mmc-LPPA-F:5′-CTCGAGACCACCA-TGAGTTTGCAAGAAACAGACAAAGATG-3′;Mmc-LPPA-R:5′-TTTAGCTGCTGCTACTGA-3′,预期扩增片段大小为450 bp。引物由生工生物工程(上海)股份有限公司合成。
1.3.2LPPA基因原核表达载体的构建 以支原体基因组小量提取试剂盒提取Mmc PG3株基因组DNA,以Mmc-LPPA-F和Mmc-LPPA-R为引物扩增目的基因。 PCR反应体系25 μL:2×TaqPCR MasterMix 12.5 μL,上、下游引物(10 μmol/L)各1 μL,模板DNA 2 μL,ddH2O 8.5 μL。PCR反应条件:94 ℃预变性3 min;94 ℃变性45 s,58 ℃退火40 s,72 ℃延伸1 min,共34个循环;72 ℃延伸10 min。PCR产物经1.5%琼脂糖凝胶电泳后,利用E.Z.N.A.TMGel Extraction Kit纯化目的片段,纯化后的目的片段用T4 DNA连接酶与pCold-Ⅰ载体于16 ℃过夜连接,转化大肠杆菌DH5α感受态细胞,构建重组质粒,经菌液PCR、双酶切及测序鉴定后获得表达质粒载体pCold-Ⅰ-LPPA。
1.3.3 重组蛋白的诱导及表达 将酶切和测序正确的质粒pCold-Ⅰ-LPPA转化大肠杆菌BL21(DE3)感受态细胞,挑取LB(含Amp)固体培养基的单个菌落,接种于LB液体培养基中培养,加入终浓度为0.8 mmol/L的IPTG进行诱导表达(时间为3 h),收集菌体用预冷的PBS洗涤2~3次并超声破碎,破碎完毕后,9 000 r/min离心10 min,收集上清和沉淀,分别制样,进行SDS-PAGE,鉴定其表达情况与可溶性。
1.3.4 蛋白纯化及反应原性分析 根据His·tag融合蛋白纯化试剂盒步骤纯化蛋白并采用Western blotting和琼脂扩散血清学试验分析其与Mmc阳性血清的反应原性。Western blotting:将SDS-PAGE产物转移至PVDF膜上,随后加入5%脱脂奶粉于37 ℃封闭2 h;封闭结束后用TBST洗涤3次,加入稀释好的一抗高免血清4 ℃过夜,TBST洗涤3次后加入HRP标记酶标二抗,37 ℃孵育1 h;TBST洗涤3次,将PVDF膜置于DAB底物显色溶液中显色,待目的条带清晰后迅速置于蒸馏水中终止显色反应,观察并分析结果。琼脂扩散血清学试验:取新制作的琼脂扩散平板,经打孔、封板后在中央孔加入纯化的Mmc LPPA重组蛋白,在周围孔分别加入Mmc标准阳性血清、标准阴性血清和临床阳性血清,置于湿盒中,37 ℃恒温箱中放置12~24 h后观察结果。
1.4 Mmc LPPA蛋白抗体ELISA检测方法的建立
1.4.1 反应体系的建立与优化 用包被缓冲液将重组纯化蛋白Mmc LPPA分别稀释为0.1、0.5、1.0、1.5、2.0、2.5、3.0和3.5 μg/100 μL,加入96孔酶标板中,100 μL/孔,室温包被过夜。按方阵滴定法,加入不同稀释度(1∶10、1∶50、1∶100、1∶200、1∶300和1∶500)的Mmc标准阳性血清、阴性血清到同一个稀释度的抗原包被孔中,100 μL/孔,37 ℃孵育1 h,每孔做一次重复,并做空白对照试验。最佳优化条件:P/N值最大(P=阳性对照D630 nm平均值-空白对照D630 nm平均值;N=阴性对照D630 nm平均值-空白对照D630 nm平均值)、阴性对照值较小的抗原浓度、阳性血清及阴性血清稀释度。
通过已确定的优化条件,分别以1%明胶、3%明胶、0.5% BSA、1% BSA、3% BSA、1%脱脂奶粉、3%脱脂奶粉、5%脱脂奶粉进行0.5、1.0、1.5及2.0 h不同时间的封闭,同时以不封闭孔及空白孔作为对照孔,每孔做一次重复。通过测定每个样品的D630 nm值计算P/N值,取P/N值最大时所对应条件为最佳封闭液和封闭时间。
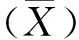
1.4.3 ELISA方法性能评估 应用上述方法,以Mmc标准阳性血清及阴性血清为阳性对照和阴性对照,每孔重复1次。分别对Mo、BTV、FMDV、弓形虫、GPV及PPRV的标准阳性血清进行检测,测定D630 nm值,对该方法的特异性进行评估。
批内重复试验:准备抗原包被酶标板(同批制备)和4份临床羊血清(随机抽取),用已确定的间接ELISA反应程序进行检测,每份血清均做8次重复性试验。批间重复试验:准备4份临床羊血清(随机选取),采用8个抗原包被酶标板(不同批次),进行间接ELISA检测。应用统计学原理分别对批内及批间重复试验的差异性进行评估,变异系数<10%,即可判定为该ELISA方法的重复性较好[15]。
1.5 间接ELISA方法的临床应用
分别应用本研究建立的间接 ELISA方法和Mmc正向间接血凝诊断试剂盒对从贵州省某规模羊场采集的184份血清样本进行平行检测,并对其结果进行比较分析。
2 结 果
2.1 重组质粒鉴定
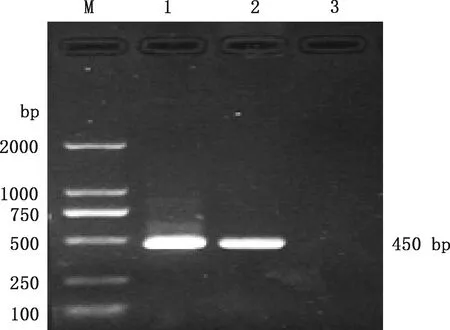
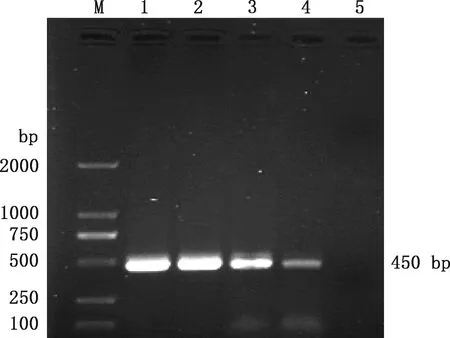
以从Mmc贵州分离株提取的DNA为模板,经PCR扩增得到大小为450 bp的目的基因片段(图1),与预期大小相符。 将目的基因片段连入pCold-Ⅰ载体质粒,对重组质粒进行PCR、双酶切及测序鉴定,结果显示重组质粒PCR扩增出大小为450 bp的目的条带(图2),双酶切鉴定得到大小为4 407 bp的载体条带和450 bp的目的条带(图3),且重组质粒测序结果正确,表明pCold-Ⅰ-LPPA原核表达质粒构建成功。
M,DL2000 DNA Marker;1、2,Mmc LPPA基因;3,阴性对照M,DL2000 DNA Marker;1 and 2,Mmc LPPA gene;3,Negative control图1 Mmc LPPA基因PCR扩增结果Fig.1 PCR amplification results of Mmc LPPA gene
M,DL2000 DNA Marker;1~3,重组质粒;4,阳性对照;5,阴性对照M,DL2000 DNA Marker;1-3,Recombinant plasmids;4,Positive control;5,Negative control图2 Mmc pCold-Ⅰ-LPPA重组质粒鉴定Fig.2 Identification of Mmc recombinant plasmid pCold-Ⅰ-LPPA
M,DL5000 DNA Marker;1~3,重组质粒双酶切产物;4,菌液PCR产物;5,空载体对照M,DL5000 DNA Marker;1-3,Recombinant plasmid double digestion products;4,Bacterial liquid PCR product;5,Empty vector control图3 Mmc pCold-Ⅰ-LPPA 重组质粒双酶切鉴定Fig.3 Double enzyme digesting identification of recombinant plasmid of Mmc pCold-Ⅰ-LPPA
2.2 重组蛋白诱导表达及纯化
将含有重组表达载体pCold-Ⅰ-LPPA的重组菌在适宜条件下进行诱导表达和纯化,重组蛋白超声裂解结果分析显示,在23 ku附近出现目的条带,主要以包涵体形式表达(图4)。SDS-PAGE检测结果显示,重组蛋白被洗脱,且杂蛋白较少(图5),表明目的蛋白纯化成功。
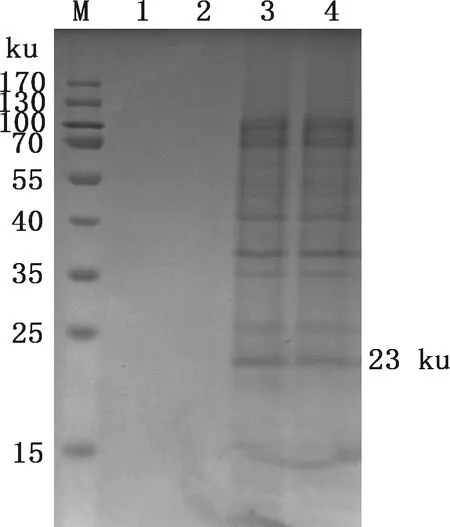
M,蛋白质分子质量标准;1、2,重组蛋白上清;3、4,重组蛋白沉淀M,Protein Marker;1 and 2,Supernatant of recombinant protein;3 and 4,Precipitate of recombinant protein图4 Mmc pCold-Ⅰ-LPPA重组蛋白可溶性分析Fig.4 Solubility analysis of Mmc recombinant protein pCold-Ⅰ-LPPA
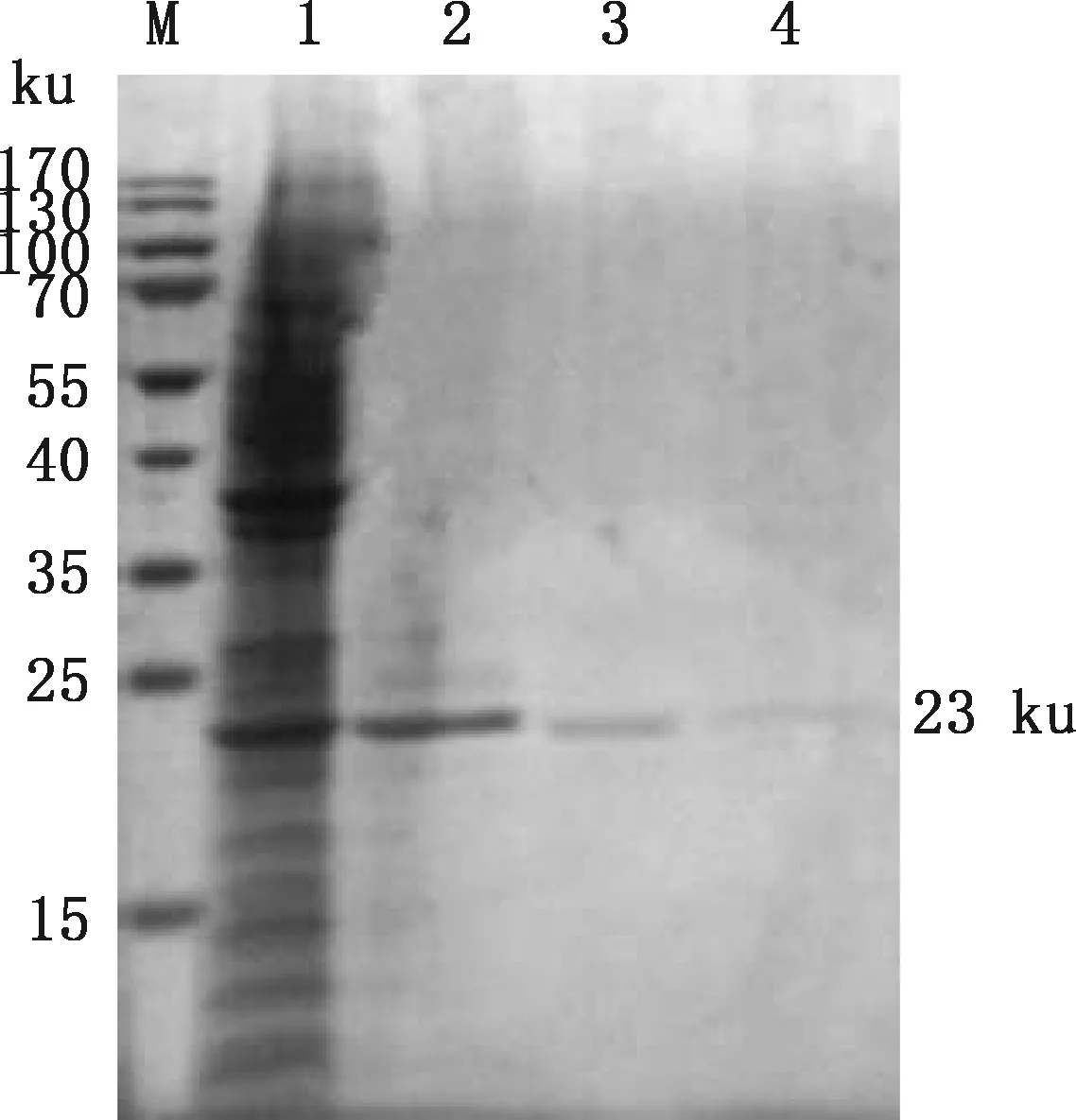
M,蛋白质分子质量标准;1,重组蛋白沉淀;2~4,纯化1、2和3 h后收集的重组蛋白M,Protein Marker;1,Recombinant protein precipitation;2-4,Recombinant protein collected after 1,2 and 3 h,respectively图5 Mmc pCold-Ⅰ-LPPA 重组蛋白纯化结果Fig.5 Purification results of recombinant protein pCold-Ⅰ-LPPA
2.3 重组蛋白反应原性检测结果
2.3.1 琼脂扩散试验 琼脂扩散试验结果显示,重组蛋白与Mmc标准阴性血清孔之间无沉淀线,而Mmc标准阳性血清孔和临床阳性血清孔与纯化重组之间均出现明显的沉淀线,表明pCold-Ⅰ-LPPA重组蛋白具有良好反应原性(图6)。
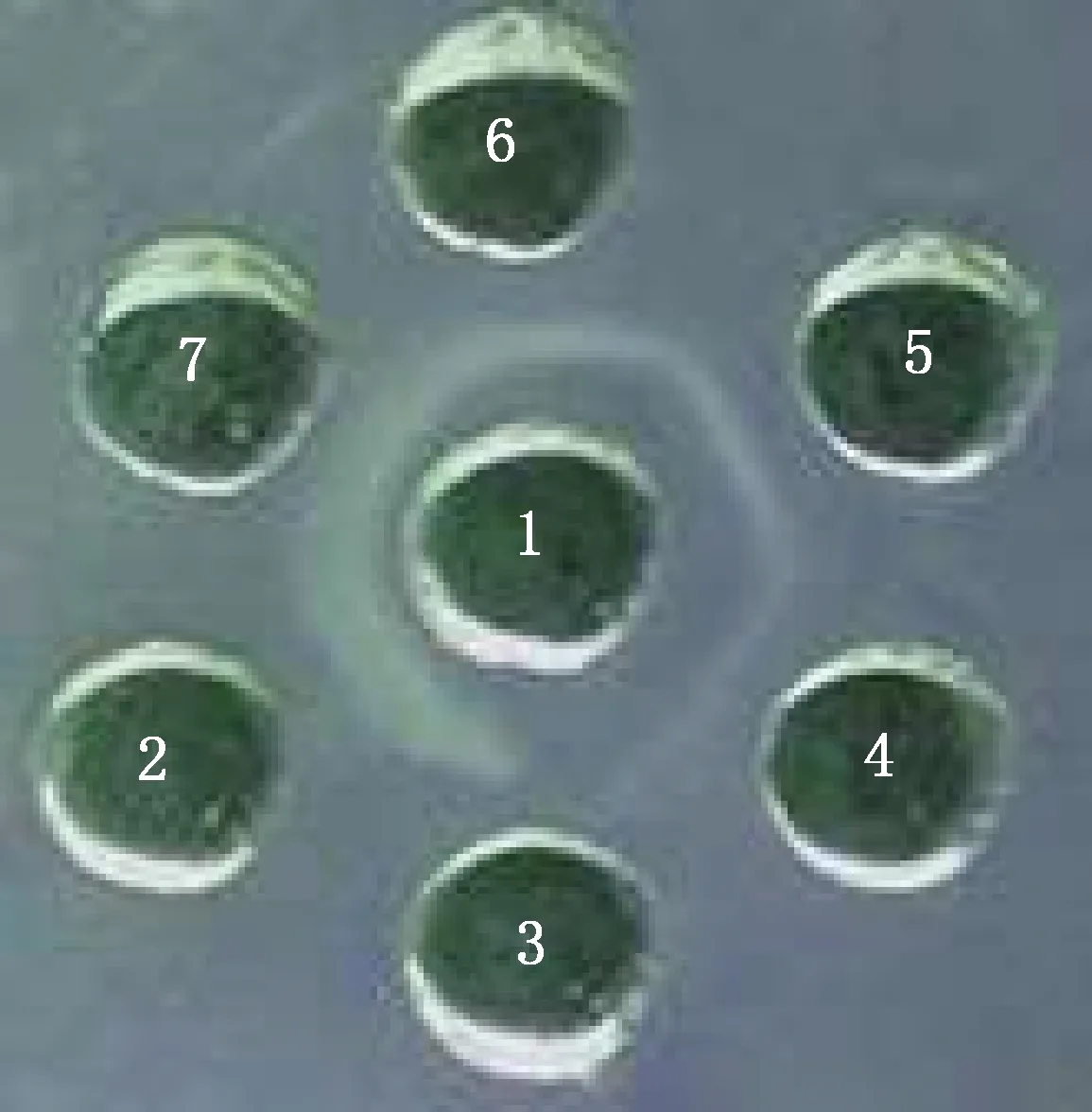
1,pCold-Ⅰ-LPPA重组蛋白;2,Mmc标准阳性血清;3,Mmc标准阴性血清;4~7,临床阳性血清1,Recombinant protein pCold-Ⅰ-LPPA;2,Standard positive serum of Mmc;3,Standard negative serum of Mmc;4-7,Clinical positive sera图6 pCold-Ⅰ-LPPA重组蛋白反应原性检测结果Fig.6 Detection of reactivity of recombinant protein pCold-Ⅰ-LPPA
2.3.2 Western blotting试验结果 Western blotting试验结果显示,纯化后的蛋白能与Mmc阳性血清特异性反应,在23 ku处出现特异条带(图7),表明pCold-Ⅰ-LPPA重组蛋白具有良好的反应原性。
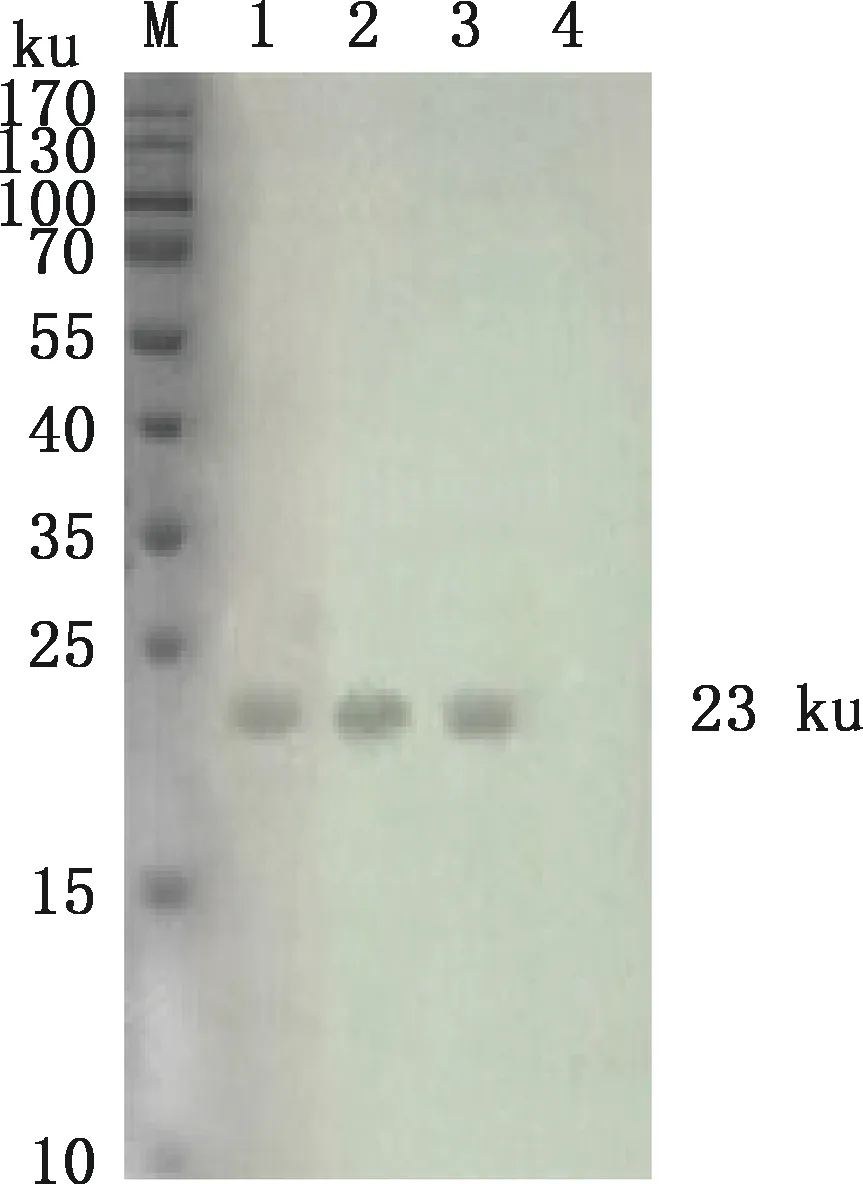
M,蛋白质分子质量标准;1~3,纯化的pCold-Ⅰ-LPPA重组蛋白;4,pCold-Ⅰ空载体M,Protein Marker;1-3,Purified recombinant protein pCold-Ⅰ-LPPA;4,pCold-Ⅰ empty vector图7 pCold-Ⅰ-LPPA重组蛋白Western blotting鉴定Fig.7 Identification of recombinant protein pCold-Ⅰ-LPPA by Western blotting
2.4 基于Mmc LPPA蛋白的间接ELISA方法的建立
2.4.1 抗原及血清最佳工作浓度测定结果 采用矩阵法设计不同稀释度重组蛋白pCold-Ⅰ-LPPA与不同稀释度Mmc标准阳性、阴性血清反应,取阴性对照值达到最低,且P/N值达到最大时的抗原及血清浓度作为最佳优化条件。最终确定抗原最佳包被量为2.0 μg/100 μL,血清最佳稀释度为1∶300(表1)。
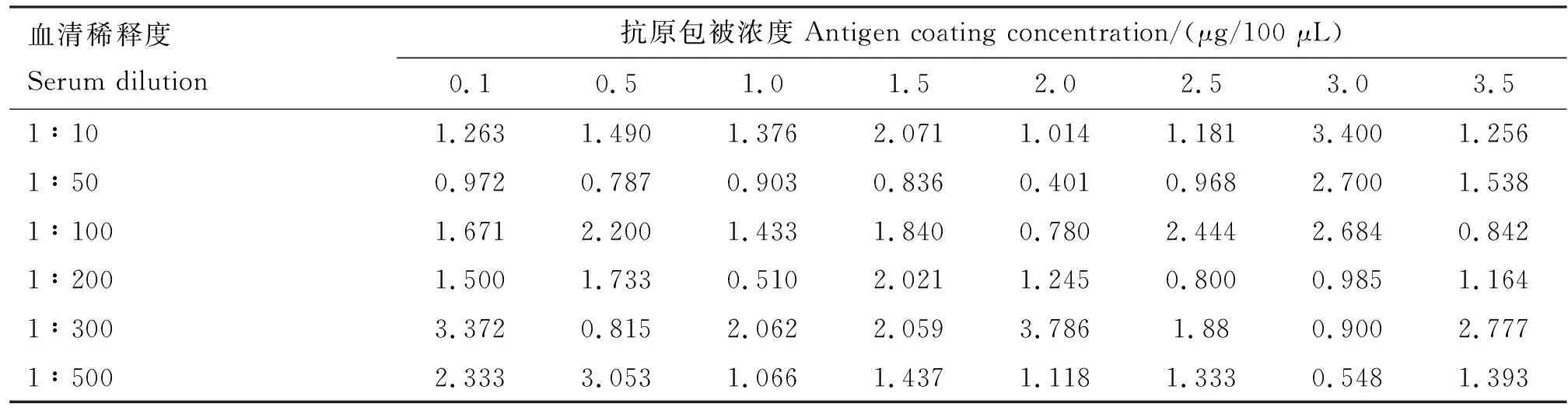
表1 最佳抗原包被浓度和血清稀释度测定结果(P/N值)
2.4.2 封闭液及封闭时间优化结果 在优化条件下,根据矩阵法分别对不同封闭液、不同封闭时间进行比较,封闭液为3% BSA,封闭时间为1.0 h时P/N值最大(表2),确定3% BSA封闭1.0 h为最佳封闭条件。
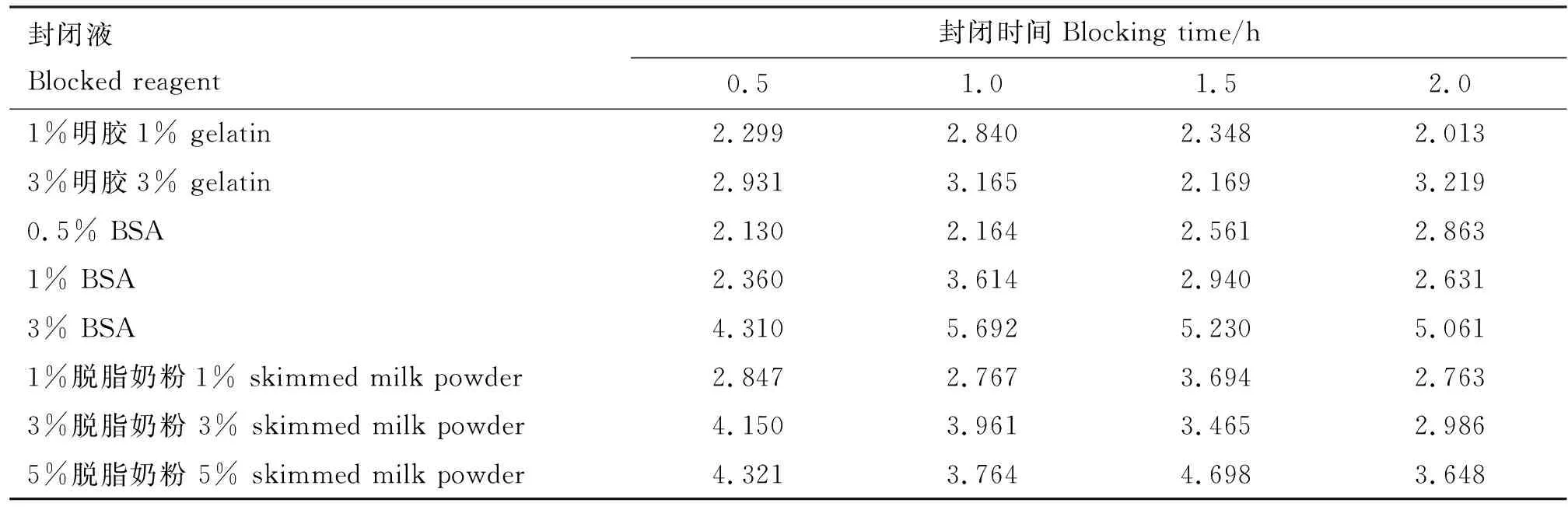
表2 封闭液及封闭时间优化结果(P/N值)
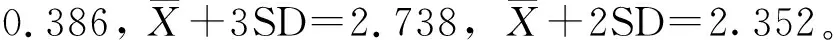
2.5 ELISA方法性能评估
应用本试验建立的间接ELISA方法检测Mmc标准阳性血清的P/N值为2.846;而检测Mo、BTV、FMDV、弓形虫、GPV及PPRV标准阳性血清的P/N值为1.427~1.741,均为阴性,说明建立的间接 ELISA特异性良好。
重复性试验结果显示,建立的ELISA方法批内变异系数在1.83%~5.41%之间;批间变异系数在2.95%~9.01%之间,批内及批间变异系数均<10%(表3),表明该方法的重复性良好。

表3 重复性试验结果(n=8)
2.6 间接ELISA方法的临床应用
分别应用正向间接血凝诊断试剂盒和本研究建立的间接 ELISA方法对贵州省某规模羊场采集的184份血清样本进行平行检测分析,结果显示本试验建立的ELISA方法检测的蛋白抗体阳性率为52.72%(97/184),而正向间接血凝诊断试剂盒检测蛋白抗体阳性率为40.76%(75/184),2种方法的阳性符合率为93.33%(70/75),阴性符合率为75.23%(82/109),相对符合率为82.61%。
3 讨 论
羊支原体肺炎的诊断方法较多,如病原分离培养、血清学诊断和分子生物学诊断等[16]。其中病原分离培养为鉴定该病的主要方法,但由于Mmc对培养基营养要求高、培养周期长、培养困难,羊支原体肺炎的病原分离培养方法不适用于临床检测[17-18]。血清学诊断方法是对Mmc感染进行流行病学调查、检测和疫苗免疫效果评价的重要手段。其中,ELISA方法特异性强、灵敏度高、高效省时,可用于大量样本的筛选[19]。目前已建立的Mmc血清学检测方法中,间接血凝试验存在保质期短、试验结果判定主观性较强等问题,且尚无特异针对Mmc检测的标准商业化试剂盒。因此,对于Mmc的临床诊断及病原防控仍需一种快速、特异、敏感的间接ELISA检测方法。本研究基于膜蛋白LPPA建立ELISA方法,为Mmc感染动物后的疫苗效果评估及流行病学监测提供一种快速、准确、有效的检测手段。
选择合适的抗原包被蛋白是建立ELISA检测方法的关键。支原体脂蛋白的抗原性较强,常被用于血清学诊断,膜脂蛋白LPPA存在于丝状支原体簇的表面,是重要的抗原组成成分[20]。Dedieu等[21]对与Mmc同属于丝状支原体簇的牛传染性胸膜肺炎支原体的4种蛋白进行分析发现,LPPA作为其免疫优势蛋白,能诱导强烈的体液免疫。张玲等[22]对脂蛋白Mmc LPPA蛋白进行诱导表达,证实了其具有良好的免疫原性和反应原性。基于以上研究及贵州省动物疫病与兽医公共卫生重点实验室前期对该基因的生物信息学分析,推测Mmc LPPA蛋白可作为一种免疫原性蛋白初步应用于免疫学相关研究。本试验通过原核表达系统对Mmc LPPA蛋白进行了表达。原核表达系统在蛋白的融合表达中具有操作简单、成本低廉、表达量高、纯度高、纯化方式简易、可短时间大量制备且不易散毒等优点[23]。本研究选择原核表达载体pCold-Ⅰ在表达蛋白的末端加入His-tag,成功诱导表达了目的蛋白,但表达蛋白主要以包涵体存在。通常情况下以包涵体形式表达的重组蛋白在纯化环节操作较为复杂,且包涵体蛋白的反应原性比可溶性蛋白差,应用价值相对较低[24]。但本试验通过优化表达条件后成功获得纯化的LPPA蛋白,纯化过程简单,表达量可观;琼脂扩散试验结果显示,纯化蛋白与Mmc阴性血清无特异性反应,但与Mmc阳性血清能够发生特异性反应,综合Western blotting试验再一次表明该蛋白具有良好的反应原性,可将其作为建立间接ELISA方法的包被蛋白。
特异性是评价血清学检测技术的一个重要指标。储岳峰等[25]将丝状支原体山羊亚种PG3株经处理后获得灭活抗原,建立了检测丝状支原体山羊亚种抗体的间接血凝试验方法,但采用完整病原体作为包被抗原时,由于抗原成分复杂,很难避免与其他病原特别是亲缘关系近的病原的抗体发生交叉反应,从而难以保证检测方法的特异性。本试验以纯化后的Mmc LPPA蛋白作为包被抗原,单一包被抗原较好地避免了因抗原成分复杂带来的病原间的抗体交叉反应。李敏杰等[26]建立A型口蹄疫抗体固相竞争ELISA方法时,以其能特异性检测A型FMDV标准阳性血清而不能检出其他病毒的阳性血清来说明所建方法的特异性较强。本研究使用相同方法进行ELISA性能评估,建立的间接ELISA方法能特异性检测Mmc标准阳性血清而未与Mo、BTV、FMDV等6种病原体的标准阳性血清发生交叉反应,进一步说明Mmc LPPA纯化蛋白的纯度较高,以该蛋白为包被原建立的ELISA方法特异性较强。重复性试验结果显示,本方法变异系数在1.83%~9.01%之间,证明所建的ELISA方法具有良好的重复性。敏感性是评价血清学检测技术的另一指标。由于目前没有针对该Mmc的商品化的ELISA检测试剂盒,因此本研究使用商品化的间接血凝诊断试剂盒对184份血清样本进行对比检测,本方法对临床样品的检测阳性率比间接血凝诊断试剂盒高,证明本方法具有更高的敏感性,能检测到较低水平的血清抗体滴度。这与张焕容等[27]得出的样品检测阳性率愈高证明ELISA方法敏感性愈高这一结果相符。综上所述,本研究建立的ELISA方法能在保持特异性的同时,还具有较好的敏感性和重复性,能准确地对Mmc抗体水平进行检测,为Mmc的检测及流行病学调查提供了一种可靠的方法,为Mmc的防控提供参考。
4 结 论
本研究通过原核表达纯化的方法,成功表达并纯化了Mmc LPPA蛋白,以其为包被蛋白,通过检测条件的优化,初步建立了Mmc LPPA蛋白间接ELISA抗体检测方法。该方法具有良好的特异性和重复性。临床样品检测结果表明,该方法与间接血凝诊断试剂盒具有较高的检测符合率,在Mmc血清学诊断防治研究中具有一定的临床应用价值。
