猪塞尼卡谷病毒单克隆抗体的制备及鉴定
2022-02-15莫红芳刘文强陈焕春李祥敏
莫红芳,揭 凯,陈 鑫,文 威,刘文强,陈焕春,钱 平,李祥敏
(1.华中农业大学,农业微生物学国家重点实验室,武汉 430070;2.广西农业职业技术大学,南宁 530007)
猪塞尼卡谷病毒(SenecaValleyvirus,SVV)是小RNA病毒科(Picornaviridae)塞尼卡病毒属(Senecavirus)的唯一成员[1],基因组序列大小约为7.2 kb,包含1个开放阅读框(ORF),编码含2 181个氨基酸的多聚蛋白[2-3],编码1个先导蛋白质L和3个前体蛋白(P1、P2和P3)[4]。P1前体蛋白编码结构蛋白VP0、VP1和VP3,VP0成熟后裂解成VP2和VP4,构成病毒衣壳;P2和P3前体蛋白编码7个非结构蛋白(2A~2C和3A~3D),与病毒毒力密切相关,共同参与病毒复制[4]。SVV衣壳与宿主细胞膜受体相结合,已作为其参与天然免疫的依据[5]。 目前,关于SVV疫苗和免疫诊断研究的报道相对较少,但由于SVV与口蹄疫病毒(FMDV)属于同科病毒,基因和蛋白质结构比相似,因此,SVV疫苗类型和免疫诊断产品与FMDV相似[6]。
自2007年有国家发现猪群感染SVV后,美国、巴西、加拿大等国家也陆续报道了该病[7]。2015年以来,中国广东、湖北、广西、安徽、河南、辽宁等地区陆续出现了猪感染SVV的报道[8]。至此,SVV在中国猪群中明确存在且有蔓延趋势[6],应引起国内养猪行业的高度关注[9]。由于猪塞尼卡谷病毒病具有与口蹄疫(FMD)、猪水疱性疹(VES)、猪水疱病(SVD)和水疱性口炎(VS)等严重危害养猪业的疫病相似的临床症状[4],因此需借助实验室手段进行确诊。当前,用于SVV诊断的实验室方法主要为病毒分离、免疫荧光抗体检测、病毒中和试验(VNT)、免疫组化(IHC)、酶联免疫吸附试验(ELISA)、反转录PCR、新型RNA原位杂交技术等,其中ELISA方法用于常规筛查,其余方法用于进一步确诊[9]。
作为猪的新发传染病,目前尚无有效的SVV商品化疫苗和诊断试剂,使得猪塞尼卡谷病毒病的防控面临巨大的挑战[10]。近年来,SVV单克隆抗体被广泛应用于免疫组化及竞争ELISA检测[11]。SVV结构蛋白VP1~VP4较保守,其中VP1和VP2是主要的抗原表位区域[12],VP1包含多个中和结构域、相对保守,是衣壳蛋白中免疫原性最强的,已被用于确定多种小RNA病毒的血清型,能与宿主细胞结合产生特异性免疫应答[13-15],为SVV诊断提供了重要保障[16]。本研究拟在SVV-CH-HB2016病毒颗粒基础上制备其结构蛋白的单克隆抗体,以期为血清学检测方法的建立提供生物学材料,也为SVV抗体诊断试剂盒、疫苗的研发及结构蛋白的功能研究奠定基础。
1 材料与方法
1.1 材料
1.1.1 毒株、质粒、细胞及试验动物 SVV-CH-HB2016、SVV CH/GXI09/2016、SVV AH01-2017毒株、真核质粒pTRIP-3Flag-SVV-CH-HB2016-VP1/VP2/VP3、仓鼠肾细胞(BHK-21)、小鼠骨髓瘤细胞(SP2/0)、人源肾上皮细胞(293T)均由华中农业大学农业微生物学国家重点实验室保存提供。6周龄SPF级雌性BALB/c小鼠购自华中农业大学实验动物中心。
1.1.2 主要试剂 SVV-CH-HB2016 VP1兔源多克隆抗体由华中农业大学农业微生物学国家重点实验室制备;FITC羊抗小鼠IgG购自ABclonal公司;羊抗兔IgG-HRP酶标二抗、羊抗小鼠IgG-HRP酶标二抗均购自武汉安特捷生物技术有限公司;RPMI-1640培养基购自HyClone公司;Sucrose、50% PEG4000、HAT/HT培养基干粉、Hisopaque-1083淋巴细胞分离液、弗氏完全佐剂及弗氏不完全佐剂均购自Sigma公司;ELISA显色液及终止液均购自武汉科前生物股份有限公司;SuperSignal Chemiluminescent Substrates显色液、Pierce®Rapid ELISA Mouse mAb Isotying Kit均购自Thermo Fisher Scientific公司。
1.2 方法
1.2.1 SVV纯化与鉴定 参照彭成成等[17]方法制备、浓缩与纯化病毒,参照杨文静等[18]Western blotting方法鉴定病毒特异性。将SVV-CH-HB2016毒株接种BHK-21细胞进行增殖,室温反复冻融3次后,于4 ℃、10 000 r/min离心30 min以除去细胞碎片,超高速离心和蔗糖密度梯度离心方法浓缩、纯化SVV全病毒颗粒,脱糖处理后通过12% SDS-PAGE检测纯化后目的蛋白纯度。依次以SVV-CH-HB2016 VP1兔源多克隆抗体、羊抗兔IgG-HRP酶标二抗孵育后,Western blotting方法鉴定病毒颗粒特异性,再利用实时荧光定量PCR检测病毒拷贝数,最终以纯度好、拷贝数高的病毒颗粒免疫BALB/c小鼠。
1.2.2 动物免疫 参照周曼莉等[19]方法进行小鼠免疫。将30 μg纯化的SVV-CH-HB2016病毒颗粒与等体积弗氏完全佐剂乳化,用颈背部皮下两点注射法对6周龄SPF级雌性BALB/c小鼠进行首次免疫。分别于2和4周后更换为弗氏不完全佐剂以同样剂量和方法进行第2、3次免疫。三免10 d后进行断尾采血,检测血清抗体效价及其特异性,以判断是否需进行第4次免疫。细胞融合前3~5 d进行加强免疫,即腹腔注射与前几次免疫等剂量的病毒颗粒。
1.2.3 间接ELISA检测方法的建立 参照赵月龙等[20]方法,通过方阵滴定法确定抗原的最佳包被浓度及血清最佳稀释倍数。
1.2.4 免疫小鼠血清效价检测 采用间接ELISA方法检测免疫血清效价。按抗原最佳包被浓度包被纯化的SVV-CH-HB2016病毒颗粒,4 ℃孵育过夜。将分离得到的待检阳性及空白小鼠阴性血清从1∶200倍开始稀释,依次2倍倍比稀释至1∶25 600作为一抗,用1.2.3建立的间接ELISA方法检测免疫小鼠的血清效价。当待检血清与阴性血清的D630 nm比值(P/N)≥2.1,且待检血清的D630 nm值≥0.4时的最大稀释倍数为该免疫小鼠的血清效价。
1.2.5 细胞融合及亚克隆 参照项自来等[21]方法进行细胞融合及筛选。取800 μL 50% PEG4000诱导免疫脾细胞(1×108)与SP2/0骨髓瘤细胞(1×107~2×107)进行物理性融合。融合后用含2% HAT、20% FBS的RPMI-1640培养基重悬,并与饲养细胞混合培养,第5天更换为2% HT培养基,培养至11 d采用间接ELISA结合间接免疫荧光试验(IFA)方法筛选阳性杂交瘤细胞。将阳性杂交瘤细胞利用有限稀释法进行3次亚克隆,直至细胞培养上清阳性率100%,将细胞扩大培养并冻存。
1.2.6 单克隆抗体Western blotting检测 参照林伟东等[22]方法,利用Western blotting检测单克隆抗体与SVV结构蛋白的反应性。以真核质粒pTRIP-3Flag-SVV-CH-HB2016-VP1/VP2/VP3表达的3种重组结构蛋白作为抗原,置于5%脱脂牛奶中室温封闭2 h,阳性杂交瘤细胞上清为一抗室温孵育1 h,再用羊抗小鼠IgG-HRP酶标二抗(1∶5 000稀释)室温孵育1 h,加入SuperSignal Chemiluminescent Substrates显色液(1∶1)在Bio-Rad照膜仪上进行避光显色读取反应结果。
1.2.7 抗体亚型鉴定 采用Pierce Rapid ELISA Mouse mAb Isotyping Kit进行单克隆抗体的亚型鉴定,具体操作方法按照试剂盒说明书进行。
1.2.8 杂交瘤细胞染色体计数 将建立细胞株后的阳性杂交瘤细胞接种至24孔细胞板,细胞生长至对数期时在培养基中添加终浓度为0.6 μg/mL的秋水仙素,置于37 ℃恒温培养箱连续培养3 h。轻轻吹下杂交瘤细胞,1 000 r/min离心10 min收集细胞沉淀,加入37 ℃预热的0.075 mol/L KCl低渗溶液1 mL,重悬细胞沉淀,于37 ℃恒温箱静置30 min。 加入新配制的固定液(甲醇∶冰醋酸=1∶3)处理细胞,吸取50 μL细胞悬液滴至4 ℃预冷的载玻片上,使液面均匀展开,并于室温下自然干燥,取10% Giemsa染色液染色10~15 min,ddH2O冲洗染色液后自然晾干。光学显微镜下初步观察确定染色体位置,转换油镜头再观察染色体的形态和数目。
1.2.9 单克隆抗体的IFA鉴定 待BHK-21细胞长至汇合度为80%~90%时,以感染复数(multiplicity of infection,MOI)为0.1的剂量接种SVV-CH-HB2016病毒液,设置不接种病毒的细胞对照组,于37 ℃、5% CO2细胞培养箱中培养10 h。加入固定液(甲醇∶丙酮=1∶1)100 μL/孔,于-20 ℃固定30 min;每孔加入含2% BSA的PBS缓冲液100 μL,37 ℃恒温培养箱封闭1 h;加入阳性杂交瘤细胞上清作一抗,于37 ℃恒温培养箱与抗原结合1 h;避光加入Cy3 Goat Anti-Mouse IgG二抗(1∶2 000稀释) 100 μL/孔,37 ℃恒温培养箱反应1 h,在倒置荧光显微镜下进行观察和拍照。
1.2.10 单克隆抗体的病毒中和试验 为观察制备的单克隆抗体对SVV的中和效应,取杂交瘤细胞培养上清50 μL依次作2倍倍比稀释至1∶28,分别接入SVV-CH-HB2016、SVV CH/GXI09/2016和SVV AH01-2017毒株,接种剂量为200 TCID50/100 μL,孵育1 h后感染BHK-21细胞。每株杂交瘤细胞作4排重复孔,设立病毒和细胞对照孔,24 h后观察细胞病变情况并记录结果。
1.2.11 病毒吸附试验 为探究中和单克隆抗体是否通过影响SVV-CH-HB2016毒株吸附过程来抑制病毒增殖,通过实时荧光定量PCR和空斑试验检测其在293T细胞的吸附情况。首先测定具有中和作用的单克隆抗体培养基上清的IgG浓度,取IgG含量为2 mg的上清与2×106TCID50的SVV-CH-HB2016毒株于37 ℃感作1 h,加入4×106个293T细胞于4 ℃转盘上反应1 h,4 ℃低速离心弃掉上清,用预冷的PBS洗涤4次,分别加入100 μL无血清DMEM反复冻融,收集病毒进行空斑检测,加入1 mL Trizol裂解细胞进行实时荧光定量PCR检测,设立IgG对照组。
1.2.12 抗体相加试验 参照裴超[23]方法进行抗体相加试验。采用间接ELISA法进行相加试验,计算相加指数(AI)来分析抗原表位。分别用纯化的VP1、VP2和VP3蛋白包被酶标板,然后每孔加入各种单克隆抗体培养上清各100 μL,以及两两组合各50 μL,37 ℃孵育1 h,以羊抗小鼠IgG-HRP作为二抗进行ELISA检测,用酶标仪读取D630 nm值,记录并根据下列公式计算AI。
AI=(A1+2-A1)/A2
式中,A1、A2分别为各株单克隆抗体单独反应后的A值;A1+2为两两组合的混合单克隆抗体反应后的A值;AI>10%表示两株单克隆抗体细胞株针对不同的抗原表位,具有相加效应;AI<10%则表示两株单克隆抗体细胞株针对的抗原表位相同或相近。
1.2.13 小鼠腹水制备与纯化 采用小鼠体内诱生腹水法来进行单克隆抗体的大量制备。选取8~10周龄的雌性BALB/c小鼠20只,通过腹腔注射0.5 mL弗氏不完全佐剂的方式进行刺激,5~7 d后收集扩大培养的阳性杂交瘤细胞(105~106个)注射到小鼠腹腔内,7~10 d后待小鼠腹腔变得极度肿胀,用注射器无菌抽取腹水,经1 000 r/min离心10 min分离的上清即为单克隆抗体腹水,再利用辛酸-硫酸铵沉淀方法纯化腹水及SDS-PAGE方法检测纯化效果。 将纯化好的单克隆抗体置于10 mmol/L Tris-HCl (pH 9.0)缓冲液中透析72 h,透析结束后与甘油按1∶1比例混合,于-20 ℃保存。
1.2.14 小鼠腹水效价的测定 采用间接ELISA方法检测抗体效价。用浓度为1 μg/mL的SVV-CH-HB2016病毒颗粒包被酶标板,将小鼠腹水从1∶200倍开始2倍倍比稀释至1∶25 600作为一抗,设立SP2/0培养上清对照组。以羊抗小鼠IgG-HRP作为二抗,以630 nm处吸光度的P/N值>2时的腹水最大稀释倍数为其抗体效价。
1.2.15 统计分析 病毒吸附试验各组样本的差异均采用双样本等方差t检验进行处理,使用生物软件GraphPad Prism进行显著性分析,P>0.05表示差异不显著,P<0.05表示差异显著。
2 结 果
2.1 SVV纯化与鉴定
将SVV-CH-HB2016毒株接种BHK-21细胞,利用蔗糖密度梯度超速离心法进行病毒的浓缩与纯化,结果显示在蔗糖梯度20%~35%(W/V)、35%~45%(W/V)和45%~60%(W/V)之间均有一条明显的病毒带(图1)。SDS-PAGE检测结果显示,蔗糖梯度35%~45%之间有3条明显的条带,大小分别为39、37和34 ku,与SVV-CH-HB2016毒株的结构蛋白VP2、VP1和VP3大小一致(图2)。以SVV-CH-HB2016 VP1兔源多克隆抗体为一抗进行Western blotting鉴定,结果显示有一条大小为37 ku的特异性条带(图3),与VP1蛋白大小一致。经实时荧光定量PCR检测,蔗糖梯度35%~45%之间病毒含量为1.7×1012拷贝/mL,测定蛋白浓度达400 μg/mL,以此作为抗原免疫BALB/c小鼠。

图1 SVV-CH-HB2016蔗糖密度梯度离心Fig.1 Sucrose density gradient centrifugation of SVV-CH-HB2016
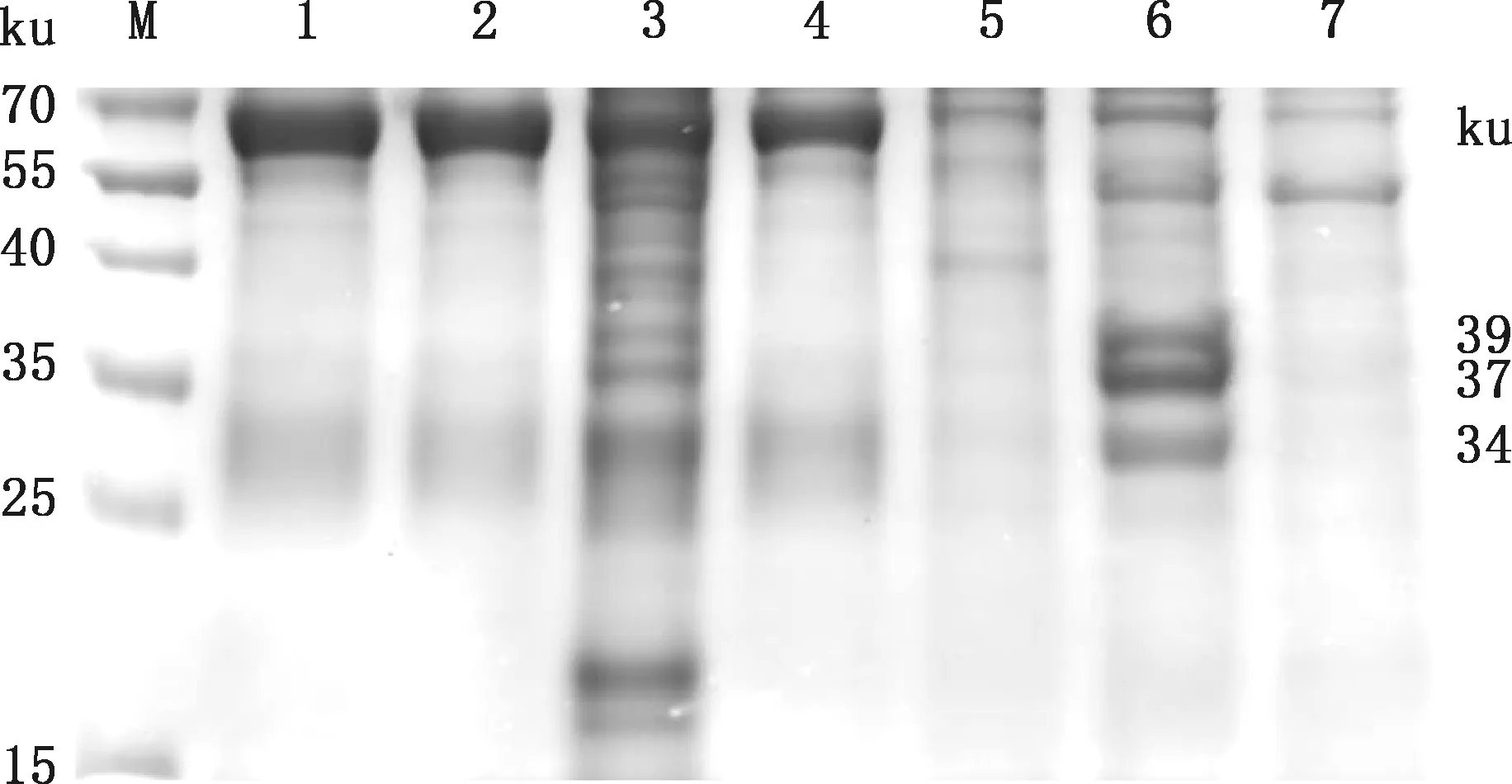
M,蛋白质分子质量标准;1,浓缩前;2,浓缩上层;3,浓缩下层;4,超高速离心最上层;5~7,蔗糖密度梯度分别为20%~35%、35%~45%和45%~60%M,Protein Marker;1,Before concentration;2,Concentrated upper layer;3,Concentrated lower layer;4,Super-detached top layer;5-7,Sucrose density gradient were 20%-35%,35%-45% and 45%-60%,respectively图2 SVV-CH-HB2016蔗糖密度梯度离心SDS-PAGE检测Fig.2 SDS-PAGE detection of sucrose density gradient centrifuged of SVV-CH-HB2016
1,BHK-21细胞;2,浓缩前;3,浓缩上层;4,浓缩下层;5,超高速离心最上层;6~8,蔗糖密度梯度分别为20%~35%、35%~45%和45%~60%;M,蛋白质分子质量标准1,BHK-21 cells;2,Before concentration;3,Concentrated upper layer;4,Concentrated lower layer;5,Super-detached uppermost layer;6-8,Sucrose density gradient were 20%-35%,35%-45% and 45%-60%,respectively;M,Protein Marker图3 SVV-CH-HB2016蔗糖密度梯度离心Western blotting鉴定Fig.3 Western blotting detection of sucrose density gradient centrifuged of SVV-CH-HB2016
2.2 免疫小鼠血清效价检测
3次免疫完成后,对小鼠进行断尾采血,通过间接ELISA方法检测血清抗体效价水平。结果显示,SVV-CH-HB2016病毒颗粒免疫的3只小鼠血清抗体效价均达到了1∶12 800,其中2号小鼠免疫效果最佳(图4),故首先选择其进行细胞融合试验。
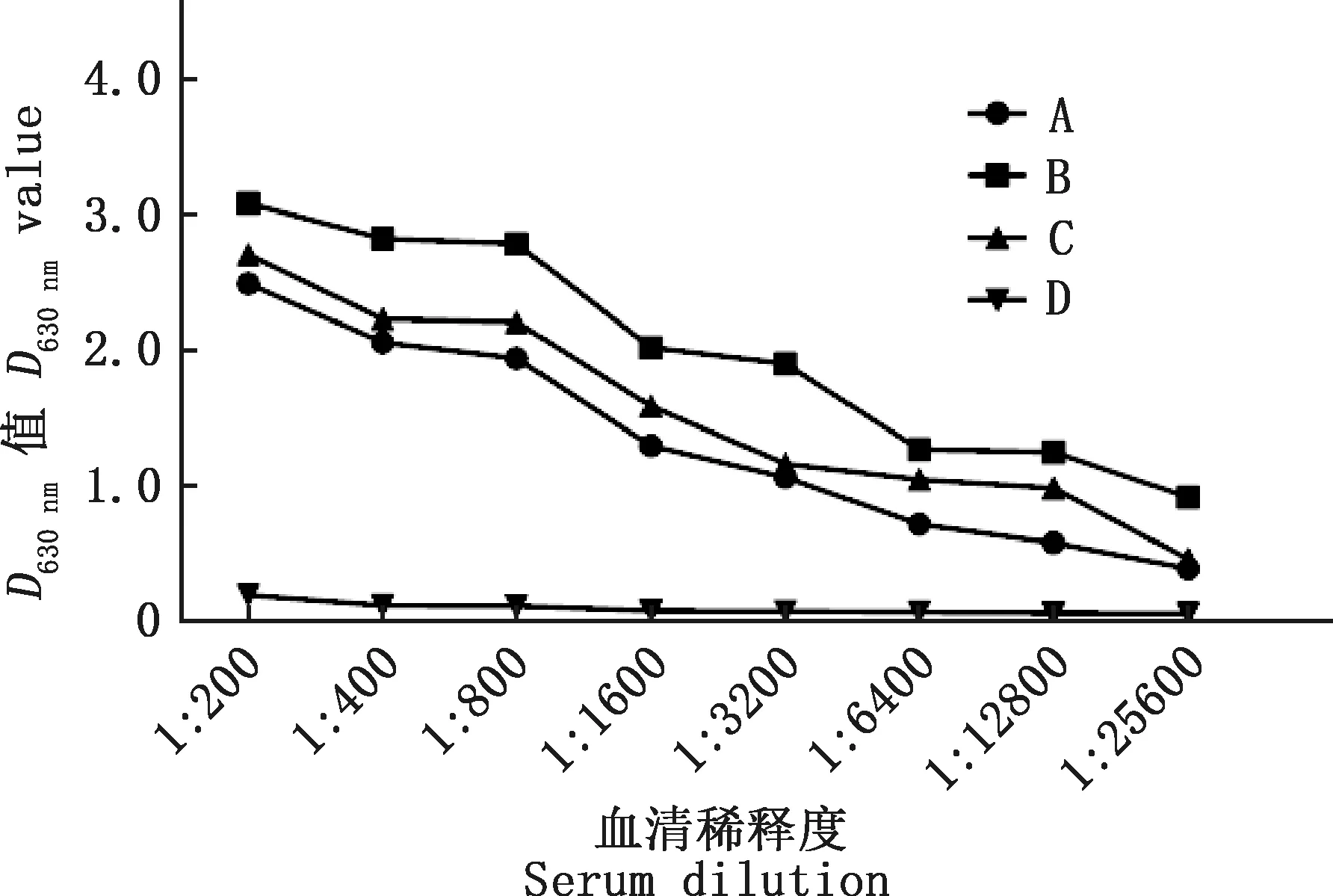
A,1号小鼠血清;B,2号小鼠血清;C,3号小鼠血清;D,阴性血清A,Serum of No.1 mouse;B,Serum of No.2 mouse;C,Serum of No.3 mouse;D,Negative serum图4 间接ELISA检测免疫小鼠血清效价Fig.4 Detection of serum titer of immunized mice by indirect ELISA
2.3 阳性杂交瘤细胞筛选结果
用纯化的SVV-CH-HB2016病毒颗粒作为包被原,通过方阵滴定法确定抗原最佳包被浓度为1 μg/mL,以此浓度包被酶标板,利用间接ELISA结合IFA方法筛选阳性杂交瘤细胞,采用有限稀释法进行3次亚克隆直至阳性率达到100%,最终筛选出17株能稳定分泌特异性单克隆抗体的杂交瘤细胞株,分别命名为1A3、1A5、1C2、1E7、1F5、1C12、2A5、2B9、2E1、2G6、3D1、3E2、3F2、4A3、4B8、4C11和4F11。
2.4 单克隆抗体的Western blotting分析
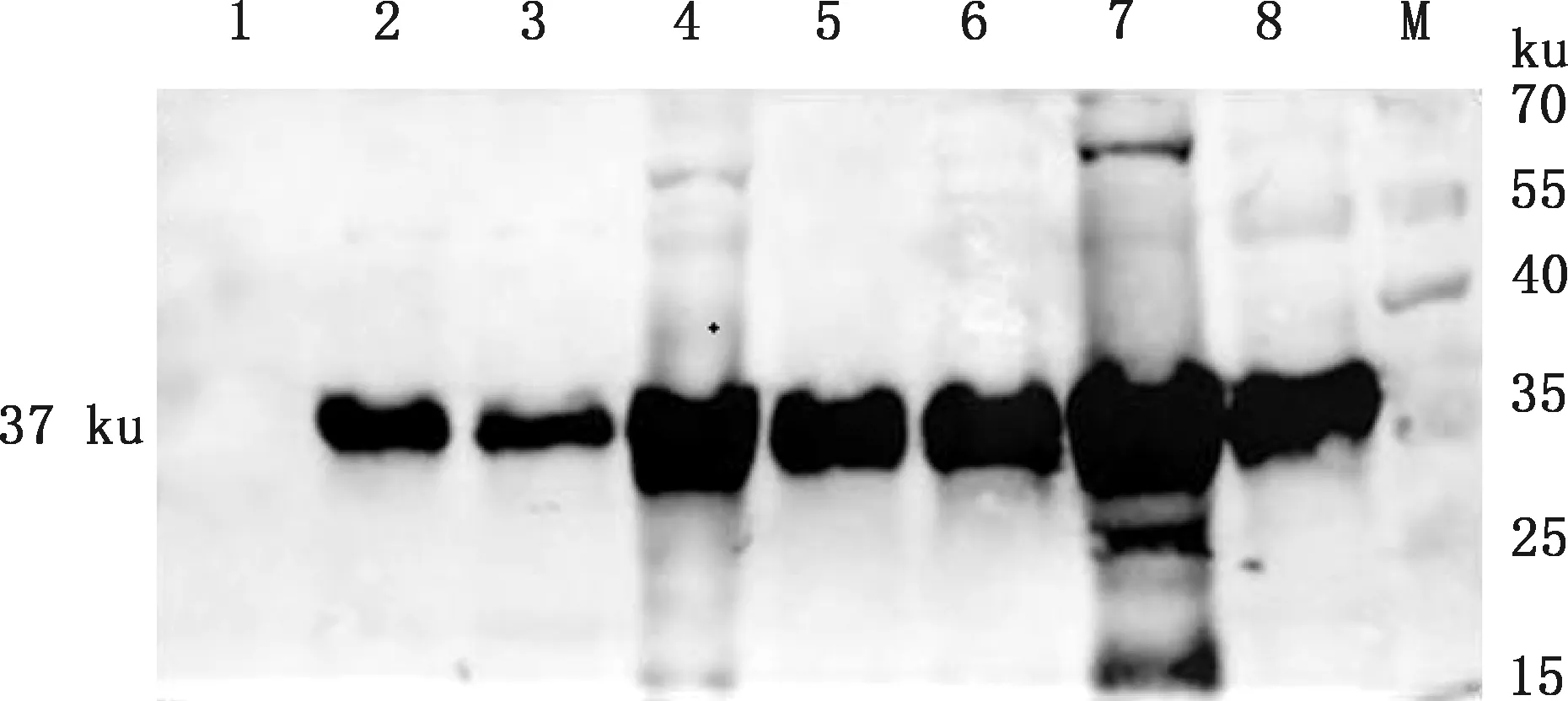
Western blotting检测结果显示,14株杂交瘤细胞分泌的抗体分别能与SVV 3种重组结构蛋白发生特异性作用,其中1C2、1E7、1F5、2E1、2G6和4C11株单克隆抗体能与VP1蛋白特异性结合,1A3、1C12、3E2、3F2、4B8和4F11株单克隆抗体能与VP2蛋白特异性作用,1A5和2A5株单克隆抗体能与VP3蛋白特异性反应。Western blotting部分结果见图5。
①A~I,分别以1A5、1C12、1E7、1F5、2A5、2G6、3E2、4C11和4F11株单克隆抗体为一抗。②M,蛋白质分子质量标准;1~3,分别为重组蛋白VP1、VP2和VP3①A-I,Monoclonal antibody of 1A5,1C12,1E7,1F5,2A5,2G6,3E2,4C11,4F11 strain as first antibody,respectively.②M,Protein Marker;1-3,Recombinant protein VP1,VP2 and VP3,respectively图5 单克隆抗体Western blotting分析Fig.5 Western blotting analysis of monoclonal antibodies
2.5 单克隆抗体亚型鉴定
SVV-CH-HB2016单克隆抗体细胞株亚型鉴定结果显示,1A3、1C2、1E7、1C12、2A5、2E1、2G6、3D1、4A3、4B8、4C11和4F11株单克隆抗体亚型均为IgG/Kappa,1A5、1F5、2B9、3E2和3F2株单克隆抗体亚型均为IgM/Kappa。
2.6 杂交瘤细胞染色体计数
染色体计数结果显示,17株杂交瘤细胞染色体数目均在90~110对之间,表明这17株杂交瘤细胞的染色体数目约为脾细胞与SP2/0细胞染色体数目之和,是融合成功的细胞株。
2.7 单克隆抗体的IFA鉴定
IFA结果显示,17株单克隆抗体均能与SVV不同毒株发生反应,具有较强的荧光信号,而阴性对照则无任何荧光信号,表明该17株杂交瘤细胞均是特异性针对SVV的单克隆抗体。IFA部分结果见图6。
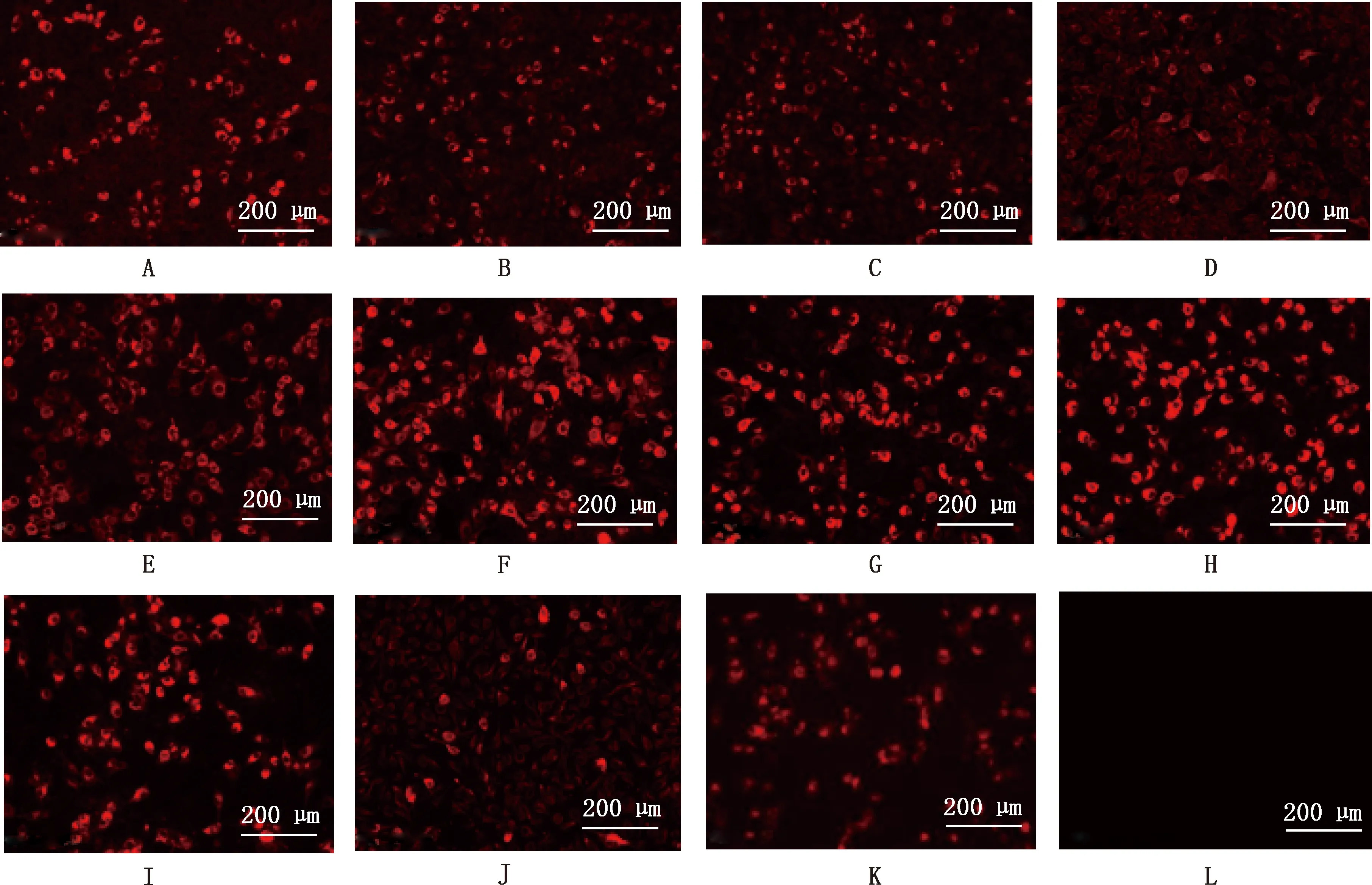
A~K,分别以1C2、1E7、1F5、1C12、2A5、2G6、3D1、4A3、4B8、4C11和4F11株单克隆抗体为一抗;L,BHK-21细胞对照A-K,Monoclonal antibody of 1C2,1E7,1F5,1C12,2A5,2G6,3D1,4A3,4B8,4C11,4F11 strain as first antibody respectively;L,BHK-21 cell control图6 单克隆抗体IFA鉴定(20×)Fig.6 IFA identification of monoclonal antibodies (20×)
2.8 单克隆抗体的病毒中和试验结果
中和试验48 h后,观察病毒对照组BHK-21细胞出现明显变圆、皱缩及脱落等病变,试验组中SVV CH/GXI09/2016、SVV AH01-2017毒株感染的单克隆抗体处理组的细胞均呈现典型细胞病变现象,而仅有SVV-CH-HB2016感染的单克隆抗体处理组细胞无病变或仅少数孔出现病变。结果表明,2G6、4C11、4A3 3株单克隆抗体对SVV-CH-HB2016毒株感染的细胞具有明显中和保护效果,而对SVV CH/GXI09/2016和SVV AH01-2017毒株无保护效果(表1)。
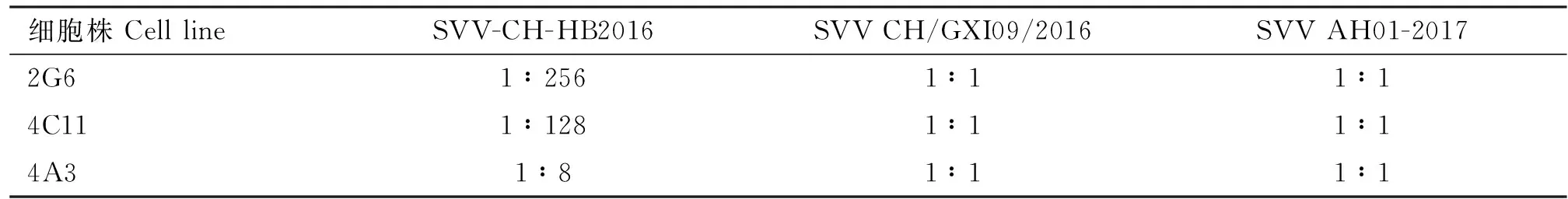
表1 单克隆抗体对不同SVV毒株的中和效价测定
2.9 病毒吸附试验结果
实时荧光定量PCR试验结果显示,2G6、4C11、4A3 3株具有中和作用的单克隆抗体可极显著抑制SVV-CH-HB2016毒株吸附293T细胞的过程(P<0.01),其中2G6单克隆抗体株的抑制吸附效果最好(图7)。
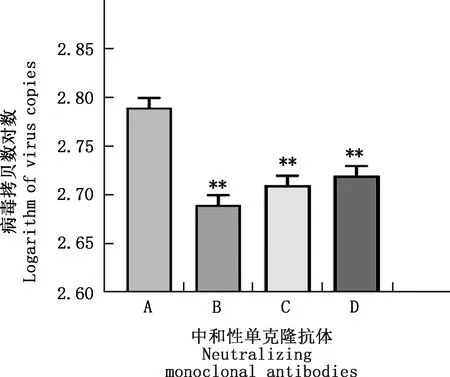
①A,IgG对照;B~D,分别为2G6、4C11和4A3株单克隆抗体。 ②与对照组相比,**,差异极显著(P<0.01)。 图8同A,IgG as control;B-D,Monoclonal antibody of 2G6,4C11 and 4A3 strains,respectively.②Compared with control group,**,Extremely significant difference (P<0.01).The same as fig.8图7 实时荧光定量PCR检测SVV-CH-HB2016毒株的吸附效果Fig.7 Adsorption effect of SVV-CH-HB2016 strain detected by Real-time PCR
空斑试验结果显示,2G6、4C11和4A3 3株中和性单克隆抗体可极显著抑制SVV-CH-HB2016毒株对293T细胞的吸附(P<0.01),其中2G6单克隆抗体株的抑制吸附效果最好(图8)。
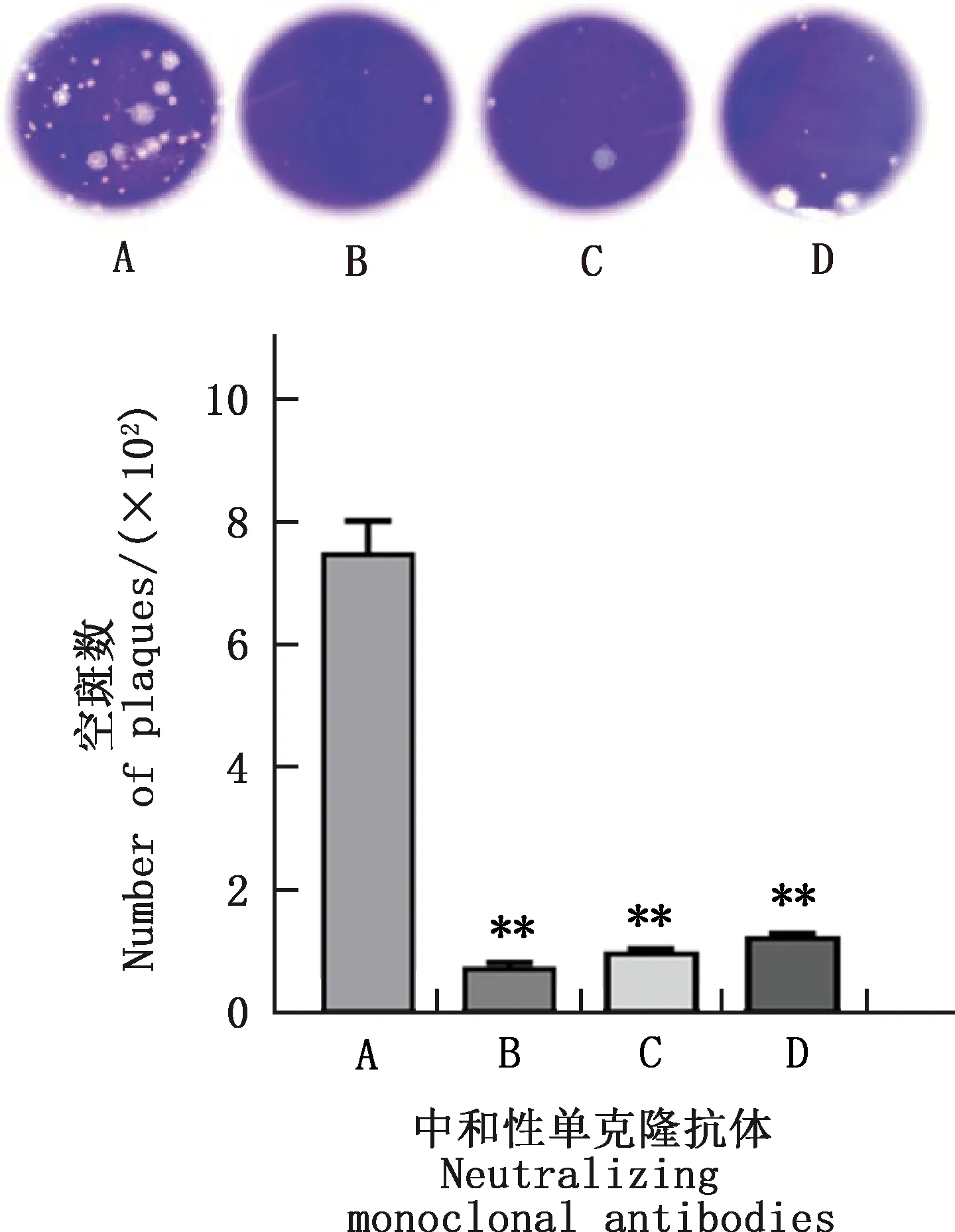
图8 空斑试验检测SVV-CH-HB2016毒株的吸附效果Fig.8 Adsorption effect of SVV-CH-HB2016 strain detected by plaque assay
采用以上2种研究方法检测2G6、4C11和4A3 3株中和性单克隆抗体对SVV-CH-HB2016毒株吸附293T细胞过程的抑制效果,均表明3株中和性单克隆抗体可极显著抑制SVV-CH-HB2016毒株对细胞的吸附,其中2G6单克隆抗体株的抑制吸附效果最好。
2.10 抗体相加试验结果
抗体相加试验结果表明,除1F5与2E1、4B8与4F11的AI值<10%外,其余10株单克隆抗体的AI值均>10%,说明1A3、1A5、1C2、1E7、1C12、2A5、2B9、2G6、3D1、3E2、3F2、4A3和4C11 10株单克隆抗体分别针对不同的抗原表位(表2~4)。

表2 抗VP1蛋白单克隆抗体的抗体相加指数

表3 抗VP2蛋白单克隆抗体的抗体相加指数
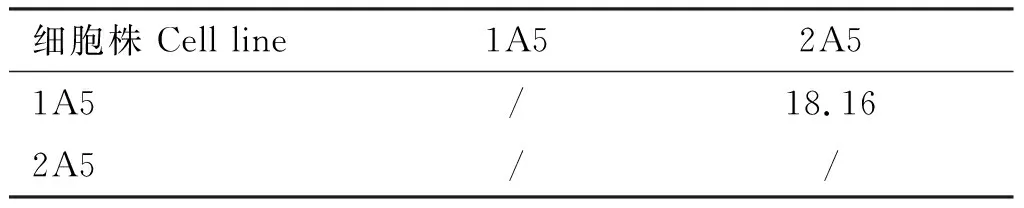
表4 抗VP3蛋白单克隆抗体的抗体相加指数
2.11 单克隆抗体腹水制备与纯化
利用SDS-PAGE方法检测纯化的单克隆抗体腹水,可见两条大小分别为55和25 ku的明显条带,无任何杂带,说明纯化的单克隆抗体回收率较高、纯度较好。
2.12 小鼠腹水效价测定
用间接ELISA方法检测小鼠腹水效价,结果显示,17株杂交瘤细胞制备的小鼠腹水抗体效价均达到了较高水平,其中2E1、3D1和4C11株腹水效价达到了1∶6 553 600。
3 讨 论
SVV是一种新出现的动物病原,近年来发现其感染与猪的特发性水疱病(porcine idiopathic vesicular disease,PIVD)和流行性暂时性新生仔猪死亡(epidemic transient neonatal losses,ETNL)相关[12]。SVV主要感染猪,不同性别、年龄阶段的猪均易感,但在不同的病例中表现的临床症状有所差异[24]。感染的繁殖母猪和公猪鼻吻、冠状带及蹄部可观察到病变,成年猪通常呈亚临床感染,1~4日龄新生仔猪病死率可达30%~70%[25]。作为一种新发的家畜传染病,猪塞内卡病毒病的暴发与流行已给全球养猪业造成了较大的经济损失[26]。随着SVV在中国的传播,亚临床感染在国内养猪场也频繁发生[27]。大量亚临床感染和商用疫苗的缺乏增加了中国对该病防控和净化的难度[28]。
SVV感染的诊断主要依靠病原学和血清学方法[20],目前国内外尚无检测该病的商品化试剂盒,常用病毒分离鉴定、RT-PCR方法进行检测[29],ELISA方法具有操作简便、敏感性高、适于大规模样品检测的优点,是实验室常用的检测方法[20]。鉴于该病在中国目前的流行态势,迫切需要开发出SVV的快速诊断方法,单克隆抗体以其良好的特异性、准确性和敏感性在疾病诊断方面具有良好的效果[30]。SVV VP1结构蛋白有重要的抗原性,病毒衣壳底部和前部之间最明显的差异位于VP1结构蛋白[4],开发出基于VP1结构蛋白的单克隆抗体,在SVV诊断方面具有重要意义[30]。
单克隆抗体在生物学领域较多,开发出相应的单克隆抗体意义重大[30],目前国内极少有SVV单克隆抗体的相关报道,更无中和性单克隆抗体的研究成果。赵月龙[20,30]利用pET-32a(+)表达系统表达A型塞尼卡谷病毒(SVA) VP1(rVP1),纯化上清中rVP1蛋白作为包被抗原,初步建立了SVA间接ELISA抗体检测方法,同时利用其作为免疫原制备了抗rVP1蛋白的单克隆抗体。陈露露[31]将截短的VP3片段序列插入pCold Ⅱ原核表达载体,制备能稳定分泌针对SVA VP3蛋白的单克隆抗体杂交瘤细胞株,并进行了其抗原表位的精确鉴定。本研究制备的17株单克隆抗体稳定性好、纯度高、特异性强,经过IFA验证能在病变的细胞中定位病毒粒子,Western blotting检测该单克隆抗体与SVV结构蛋白具有良好的反应性,其中14株单克隆抗体可同时识别构象表位与线性表位,3株单克隆抗体只能识别构象表位。值得一提的是,本研究在国内首次成功筛选出3株具有中和作用的SVV单克隆抗体,经Western blotting鉴定2G6、4C11株单克隆抗体均只与结构蛋白VP1发生特异性结合,以此验证了VP1基因上确实存在中和结构域。这为下一步重组亚单位疫苗的研发奠定了基础,也为基于单克隆抗体的双抗夹心ELISA方法的建立、胶体金试纸条的开发提供了条件。
本研究第一次细胞融合发现原本阳性的细胞孔经亚克隆后转阴,可能是由于杂交瘤细胞状态不佳,分裂过程中导致染色体丢失,进而引起抗体分泌停止,此外非分泌抗体细胞和抗体细胞之间的竞争也可能会致使阳性亚克隆丢失[30]。筛选出的5株单克隆抗体为IgM,这可能与抗原对机体的免疫调节有关,抗原量增加引起免疫耐受,进而易诱导产生IgM抗体[30]。本研究测定了17株单克隆抗体与SVV 3种不同毒株的中和效价,筛选得到的3株中和性单克隆抗体除了对免疫小鼠用的SVV-CH-HB2016毒株有较好的中和效果外,对其余2种毒株的中和效价均为1∶1,说明中和性单克隆抗体与SVV其他2种毒株的反应性非常弱,不具有中和保护作用,造成中和性单克隆抗体在以后应用性研究方面有较大局限性。病毒中和试验中,由于病毒吸附细胞发生于进入细胞之前,病毒进入效率可能受吸附效率影响。 因此,根据试验结果初步得出以下结论:中和单克隆抗体可有效抑制SVV-CH-HB2016毒株对293T细胞的吸附过程,而其对病毒进入的影响则不清楚。陈露露[31]报道了中和抗体在防止小RNA病毒感染中起关键作用,目前中国SVA毒株在抗原性上与其他毒株密切相关,并具有共同的中和表位。尽管存在共同的表位,但衣壳蛋白(VP1、VP2和VP3)中的氨基酸变化导致不同SVA毒株的抗原性存在差异,所以有必要在流行病学调查中监测抗原性的变化[31]。
4 结 论
本研究成功纯化了SVV-CH-HB2016毒株的病毒颗粒,免疫小鼠后制备了17株特异性针对SVV-CH-HB2016毒株结构蛋白的单克隆抗体细胞株,验证了17株单克隆抗体均能与SVV-CH-HB2016毒株发生IFA作用及其中14株单克隆抗体能与SVV-CH-HB2016毒株重组结构蛋白发生Western blotting反应,并成功筛选出了3株对SVV-CH-HB2016毒株感染具有中和保护效果的单克隆抗体,为SVV ELISA方法的建立、胶体金试纸条的开发及病毒感染机制的研究提供了物质材料与理论依据。
