马脐带不同部位间充质干细胞的分离培养及成软骨诱导分化
2022-02-15唐小云周桂珍周正娜邓雅迪张欣如王旭光
唐小云,周桂珍,周正娜,邓雅迪,张 慧,张欣如,王旭光
(新疆农业大学动物科学学院,新疆马繁育与运动生理重点实验室,乌鲁木齐 830052)
间充质干细胞(mesenchymal stem cells,MSCs)来源十分广泛,最初在骨髓中分离得到,但骨髓间充质干细胞(bone marrow mesenchymal stem cells,BM-MSCs)受供体年龄和健康状况的影响,并且其收集过程会对供体造成创伤[1]。近年来,脐带MSCs(umbilical cord mesenchymal stem cells,UC-MSCs)成为BM-MSCs的理想替代物,能表达多种胚胎干细胞特有的分子标志,分化潜力大、增殖能力强、免疫原性低、取材方便、无伦理道德问题的限制[2-5],是最具临床应用前景的多能干细胞之一。然而,随着对UC-MSCs的深入研究,人们发现不同实验室分离培养得到的UC-MSCs在MSCs特性上存在差异,这可能与物种、供体和细胞分离培养方法有关[6-7]。来自成年和胎儿组织的MSCs具有不同的特性,在胎儿MSCs中,特别是脐带MSCs在临床应用方面更具优势[8]。Semenova等[9]对人脐带华通氏胶、脐血管周围间隙和脐带羊膜3个区域的MSCs进行比较,华通氏胶MSCs具有高且稳定的增殖潜力和表型,并且可以作为医学应用的优选细胞来源。周桂珍等[10]利用野生动物盘羊的脐带也成功分离培养得到MSCs,保存了珍稀动物的遗传资源。
马作为大型家畜,适合作为不同自发性疾病的动物模型,这些疾病在临床上与类似的人类疾病相关,包括马在内的大型动物实验模型的开发,可能会为研究MSCs的生理学及其在人类及兽医再生医学的应用开辟替代策略。由于物种不同,所获得的脐带长度不同,其分离培养方法也不相同。绵羊脐带长度仅为5 cm左右,而马的脐带长15~20 cm,马脐带中MSCs的分布是否均一及哪个部位获得的华通氏胶分离后可以得到纯度较高的MSCs还鲜见报道。本研究以刚分娩马胎儿附着的脐带为材料,采用组织块分离法制备不同部位的马脐带间充质干细胞(equine umbilical cord mesenchymal stem cells,eUC-MSCs)并进行生物学特性以及成软骨诱导分化潜能的检测,通过比较来自同一脐带不同部位MSCs的特性,检测其在增殖能力、细胞表面标记、多潜能性表达和成软骨诱导分化上性能的异同,旨在明确更适合分离MSCs的马脐带部位。
1 材料与方法
1.1 材料
刚分娩的马雌性胎儿脐带,无菌处理,4 ℃保存。
1.2 主要试剂
胎牛血清(FBS)、DMEM/F12、0.25%胰蛋白酶(1×)均购自Gibco公司;PBS(1×)购自Solarbio公司;微量样品总RNA提取试剂盒、反转录试剂盒、荧光定量PCR试剂盒(SYBR Green)均购自天根生化科技(北京)有限公司;其他试剂除特别说明外均购自Merck公司。
1.3 方法
1.3.1 eUC-MSCs分离培养 无菌收集马胎儿的整段脐带,将其分为靠近胎儿部分(近端)、整段脐带中间部分(中段)、靠近胎盘部分(远端)3个不同区域的脐带(4~5 cm)。采用组织块分离法分别分离3个部位的细胞,剔除脐带外层羊膜、两条脐动脉和一条脐静脉;将胶状物质(华通氏胶)剪碎为1 mm3的组织块,移入T-25细胞培养瓶(Corning)中,加入3 mL含10% FBS的DMEM/F12,置于38.5 ℃、5% CO2的饱和湿度培养箱内培养。 第7天进行换液,之后每3 d换1次液。 在细胞贴壁生长至80%~90%时,使用0.25%胰蛋白酶进行消化,1 000 r/min离心5 min清洗、收集细胞,按1∶2的比例传代培养,在荧光倒置显微镜(OLYMPUS,IX71)下观察细胞生长状况。
1.3.2 eUC-MSCs增殖能力测定 将P3代生长状况较好的3组eUC-MSCs以1×104/mL的密度接种至六孔板(Corning)中,分别在第3、5、7、9、11、13天进行细胞计数,绘制3组eUC-MSCs的生长曲线,按照如下公式计算各组细胞倍增时间。
TD=t(log2/logNt-logN0)
TD为细胞倍增时间;t为培养时间;N0为接种细胞数;Nt为培养t时间后的细胞数。
1.3.3 eUC-MSCs多潜能性和表面标记分子检测 通过NCBI查找基因序列,利用AlleleID 6.0软件,分别设计多潜能基因NANOG(nanog homeobox)、八聚体结合转录因子(POU class 5 homeobox 1,POU5F1)和Y染色体性别决定区基因盒2(SRY-box transcription factor 2,SOX2),表面标记分子单核细胞分化抗原CD14(CD14 molecule,CD14)、B-淋巴细胞表面抗原B4(CD19 molecule,CD19)、造血祖细胞抗原CD34(CD34 molecule,CD34)、蛋白酪氨酸磷酸酶受体C型(protein tyrosine phosphatase receptor type C,CD45)、5′-核苷酸外切酶(5′-nucleotidase ecto,CD73)、B细胞抗原受体复合物相关蛋白α链(CD79a molecule,CD79a)、Thy-1细胞表面抗原(Thy-1 cell surface antigen,CD90)和内皮糖蛋白(endoglin,CD105),软骨诱导分化特异性基因Y染色体性别决定区基因盒9(SRY-box transcription factor 9,SOX9)、蛋白聚糖(aggrecan,ACAN)和Ⅱ型胶原蛋白1链(collagen type Ⅱ alpha 1 chain,COL2A1)的PCR引物(表1),引物均由生工生物工程(上海)股份有限公司合成。通过微量样品总RNA提取试剂盒提取P1代和P5代3组eUC-MSCs的总RNA,反转录后,通过实时荧光定量PCR检测多潜能性基因NANOG、POU5F1、SOX2和表面标记分子CD14、CD19、CD34、CD45、CD73、CD79a、CD90、CD105的表达。 PCR反应体系20 μL:2×Pre Mix 10 μL,上、下游引物各0.6 μL,cDNA模板1 μL,ddH2O补足20 μL。PCR反应程序:95 ℃预变性15 min,95 ℃变性10 s,60 ℃延伸32 s,共40个循环。
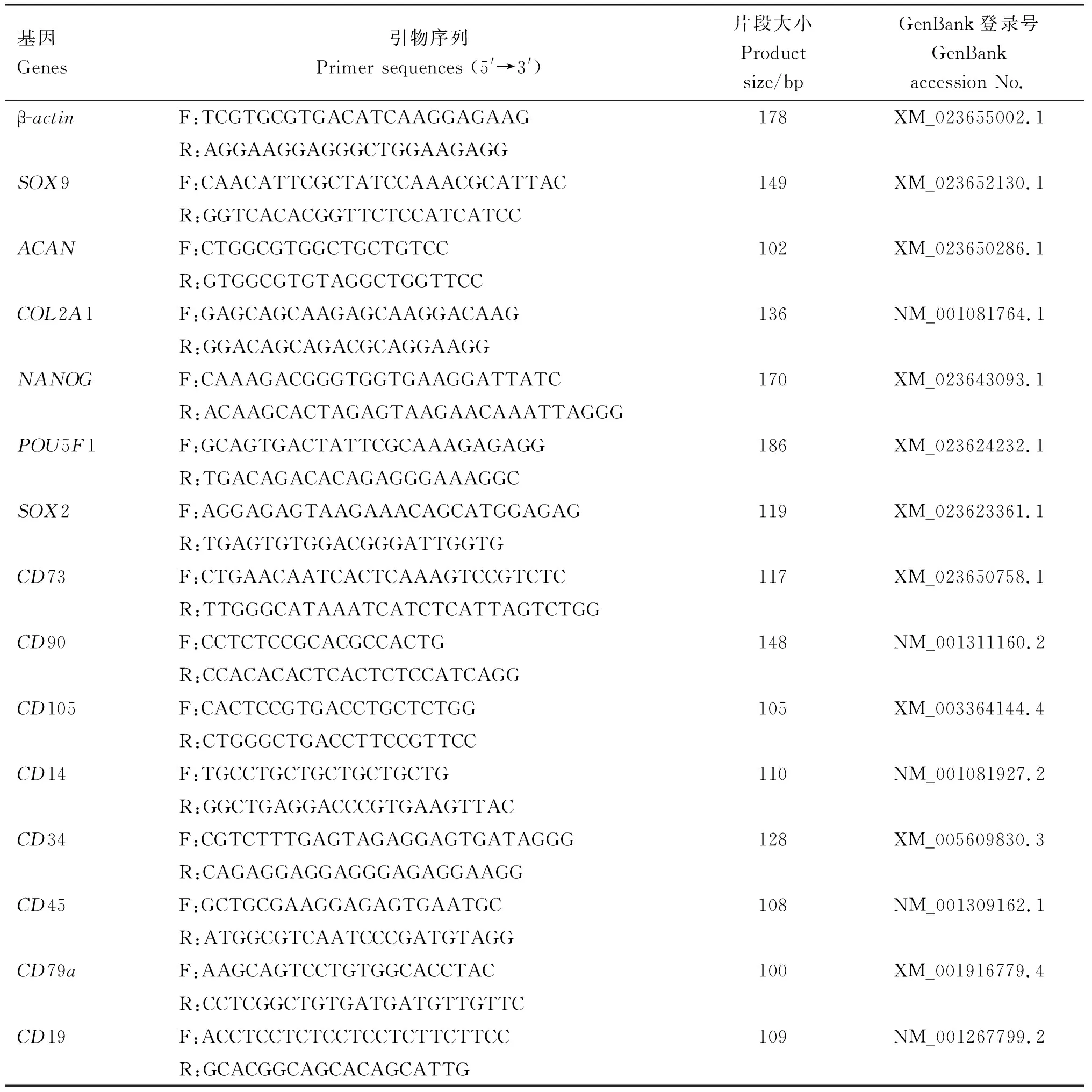
表1 引物信息
1.3.4 eUC-MSCs成软骨诱导分化及鉴定 将P2代的3组eUC-MSCs以2×104/mL接种在6孔板中,使用含10% FBS的DMEM/F12培养液培养细胞,直至细胞汇合度达到80%左右,将诱导分化组的培养液更换为成软骨诱导分化培养液(含1% FBS、0.1 μmol/L地塞米松、10 ng/mL TGF-β3、50 nmol/L抗坏血酸-2-磷酸、6.25 μg/mL胰岛素、100 IU/mL青-链霉素的DMEM/F12),每2 d换1次液。未诱导分化的对照组继续使用含10% FBS的DMEM/F12培养液培养。分别在诱导分化第7、14、21天提取各组的总RNA,反转录后,通过实时荧光定量PCR检测成软骨细胞特异性基因SOX9、ACAN和COL2A1的相对表达量;且在诱导分化第7、14、21天对各组细胞进行阿利新蓝染色,主要步骤如下:弃去原有培养液,用PBS清洗3~5次,4%多聚甲醛固定30 min,用ddH2O清洗3~5次,使用阿利新蓝染色液染色30 min,再用ddH2O清洗3~5次,每孔加入适量ddH2O,防止干燥,于荧光倒置显微镜下观察并拍照。
1.4 数据分析
使用Excel对实时荧光定量PCR获得的各基因Ct值进行统计整理,采用2-△△Ct方法计算各基因的相对表达量。采用SPSS 19.0软件进行单因素方差分析,结果用平均值±标准差表示。P<0.05表示差异显著,P<0.01表示差异极显著。
2 结 果
2.1 eUC-MSCs形态学观察
在原代细胞分离培养第1天3组eUC-MSCs均可见大量圆形细胞和一些红细胞;在第2天有细胞开始贴壁,呈梭形,连片分布;第7天进行换液以去除未贴壁细胞和组织块,当细胞长至80%~90%进行传代。传代后的细胞继续贴壁生长,呈集落状,随后细胞向四周延伸呈典型的成纤维状,当细胞之间相互接触后开始出现克隆状生长,细胞呈克隆状、簇状,各组细胞培养至P5代时,细胞的形态未发生变化,呈成纤维状和簇状(图1)。

图1 eUC-MSCs形态(100×)Fig.1 Cell morphology of eUC-MSCs (100×)
2.2 eUC-MSCs倍增时间测定
由图2可知,3组eUC-MSCs的生长曲线都呈S型。中段eUC-MSCs接种后1~5 d为潜伏适应期,第6天细胞开始增殖,之后进入对数生长期,第9天达到对数生长期的高峰,之后进入平台期。近端和远端eUC-MSCs培养的延滞期较中段eUC-MSCs稍长,培养至第7天后进入对数生长期,与中段eUC-MSCs相比增长速度较慢。经计算得知3组eUC-MSCs细胞倍增时间分别为:35.4(近端)、25.5(中段)和34.9 h(远端),3组细胞的平均倍增时间为31.9 h,中段细胞的倍增时间显著低于近端和远端细胞(P<0.05)。
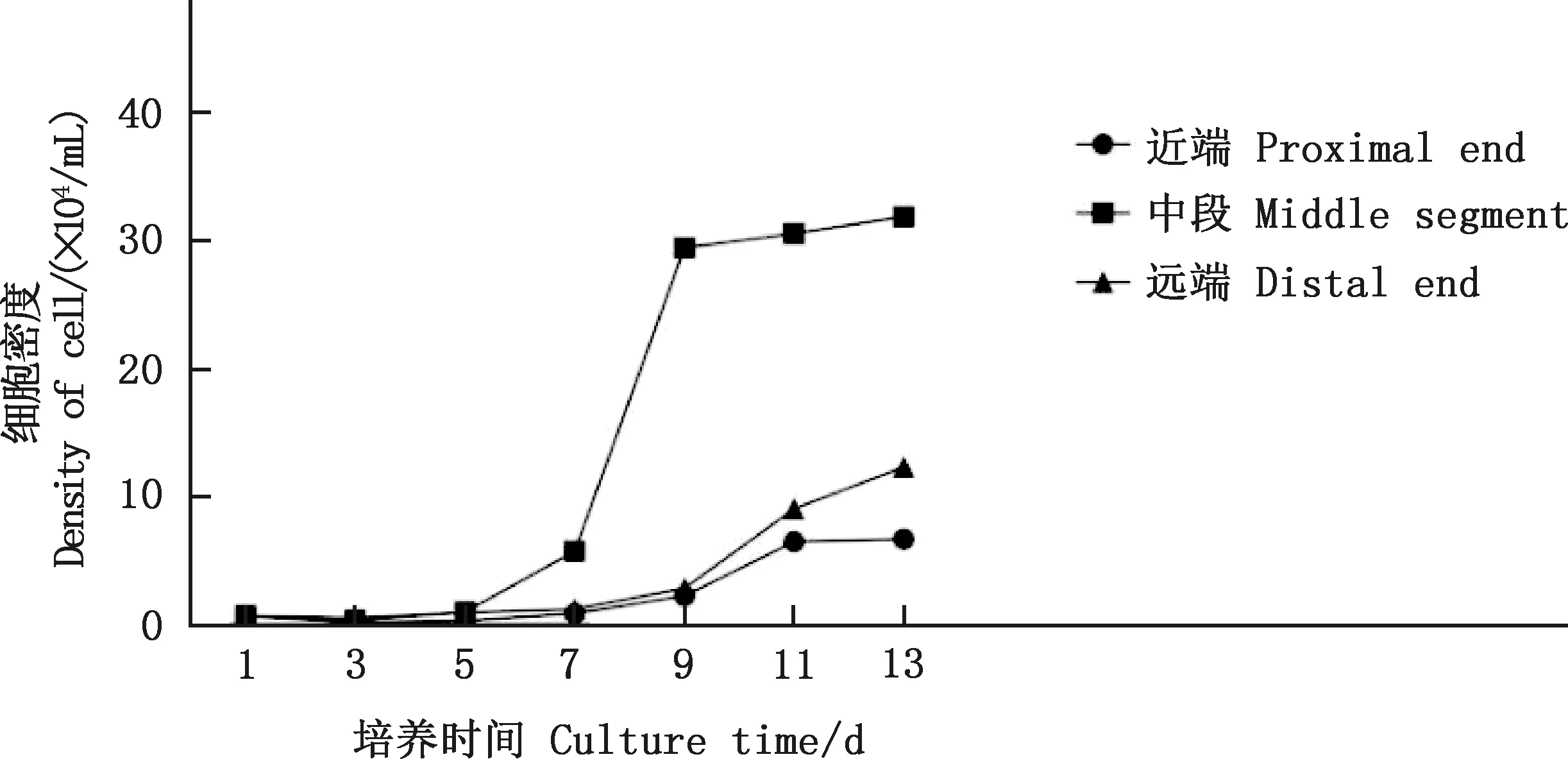
图2 eUC-MSCs生长曲线Fig.2 Growth curve of eUC-MSCs
2.3 eUC-MSCs多潜能性基因和表面标记分子的表达
2.3.1 多潜能性基因的表达 实时荧光定量PCR检测发现,多潜能性基因NANOG相对表达量在P1代中段细胞显著高于近端细胞(P<0.05),在P5代各组细胞无显著差异(P>0.05);POU5F1基因相对表达量在P1代各组细胞均无显著差异(P>0.05),在P5代近端细胞显著高于中段细胞(P<0.05),且极显著高于远端细胞(P<0.01),SOX2基因的相对表达量在各组细胞之间差异不显著(P>0.05)(图3)。
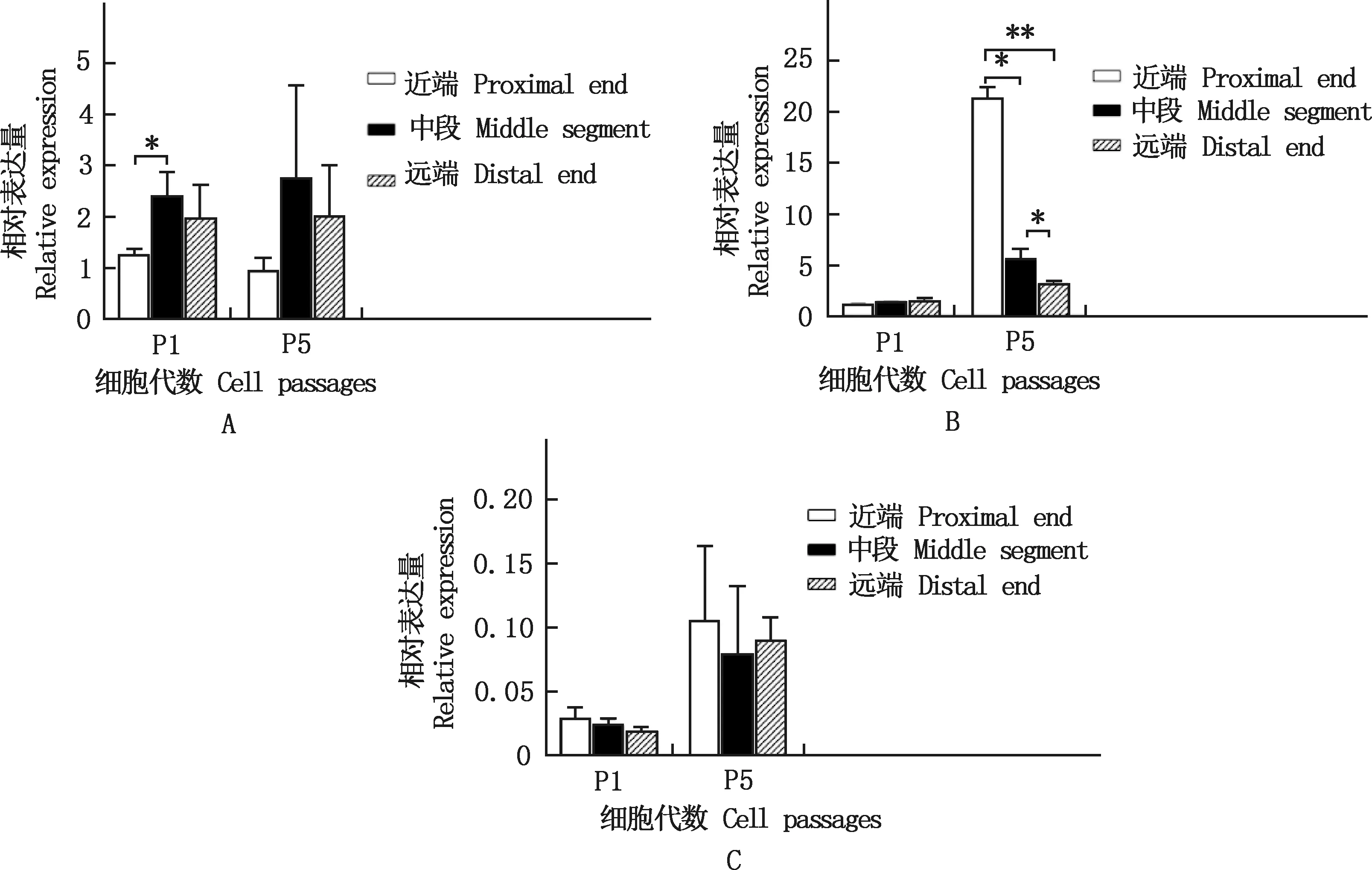
①A~C,NANOG、POU5F1、SOX2基因的相对表达量。②*,差异显著(P<0.05);**,差异极显著(P<0.01);无*,差异不显著(P>0.05)。下同①A-C,The relative expression of NANOG,POU5F1 and SOX2 genes,respectively.②*,Significant difference (P<0.05);**,Extremely significant difference (P<0.01);No*,No significant difference.The same as below图3 不同部位eUC-MSCs多潜能性基因的相对表达量Fig.3 Relative expression of eUC-MSCs pluripotency genes at different parts
2.3.2 表面标记分子的表达 3组eUC-MSCs均高表达CD34、CD73、CD90和CD105,低表达CD14、CD19、CD45和CD79a。CD14的相对表达量在P5代近端细胞显著高于中段和远端细胞(P<0.05);CD19、CD45和CD73的相对表达量均为近端细胞显著高于中段和远端细胞(P<0.05);CD34的相对表达量是远端细胞显著高于近端和中段细胞(P<0.05);CD79a的相对表达量在P5代远端细胞显著高于近端和中段细胞(P<0.05);CD90的相对表达量在P1代远端细胞极显著高于近端和中段细胞(P<0.01),在P5代远端细胞显著低于近端和中段细胞(P<0.05);CD105的相对表达量在各组细胞之间差异不显著(P>0.05)(图4)。
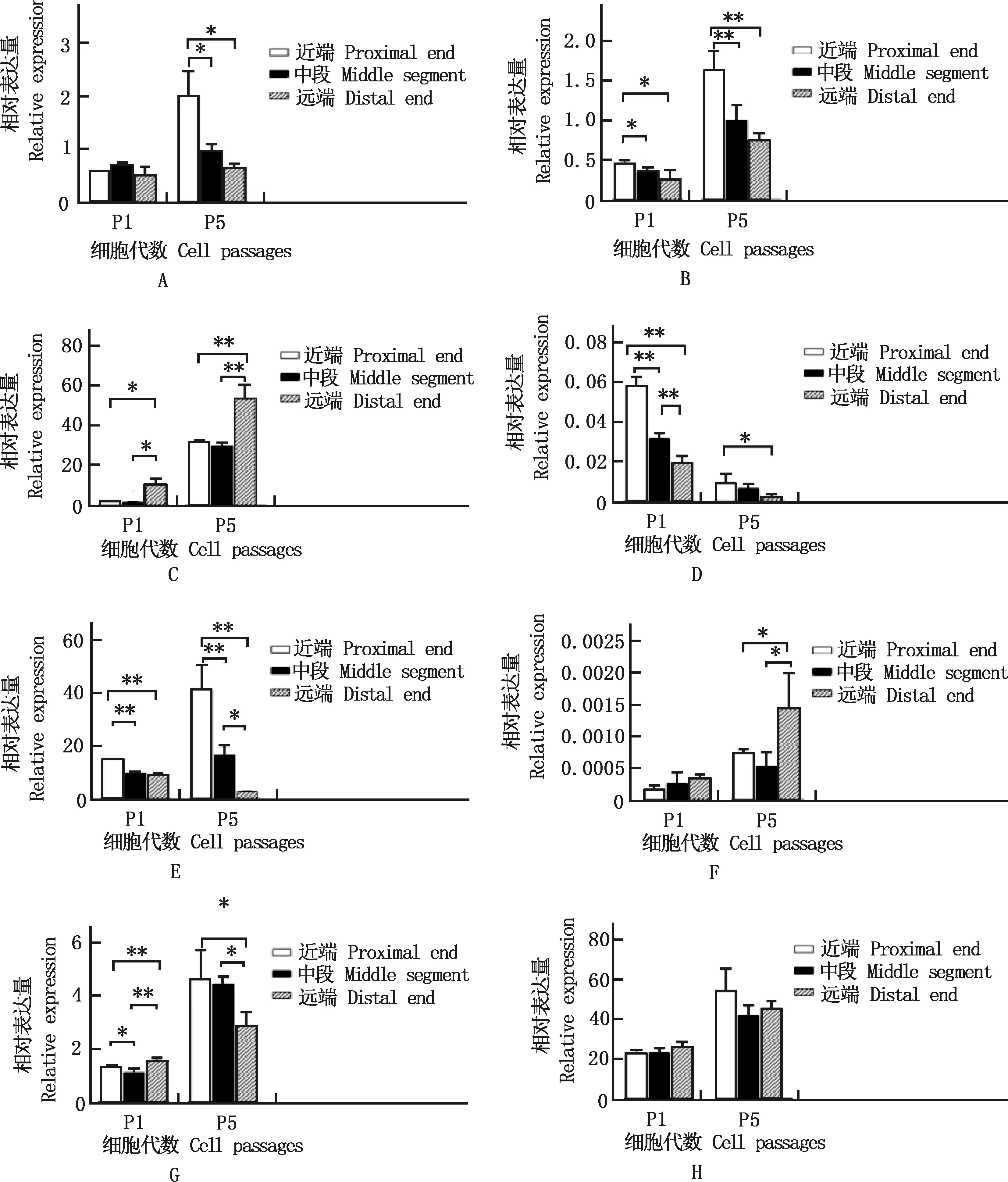
A~H,CD14、CD19、CD34、CD45、CD73、CD79a、CD90和CD105的相对表达量A-H,The relative expression of CD14,CD19,CD34,CD45,CD73,CD79a,CD90 and CD105,respectively图4 不同部位eUC-MSCs表面标记分子的相对表达量Fig.4 Relative expression of eUC-MSCs surface marker molecules at different parts
2.4 eUC-MSCs成软骨分化能力检测
2.4.1 成软骨特异性基因的表达 3组eUC-MSCs诱导分化为成软骨细胞后,其特异性基因的相对表达量如图5所示。由图5可知,在诱导分化第7天,各组细胞SOX9基因的相对表达量无显著差异(P>0.05),第14天时近端细胞的相对表达量极显著高于远端细胞(P<0.01),诱导21 d后远端细胞的相对表达量极显著高于中段细胞(P<0.01);在诱导第7和14天,中段细胞ACAN和COL2A1基因相对表达量均极显著高于近端和远端细胞(P<0.01),第21天时均显著高于近端和远端细胞(P<0.05)(图5)。
2.4.2 阿利新蓝染色结果 经阿利新蓝染色后,3组eUC-MSCs在诱导第7、14、21天均都可见特异性着色,3组细胞染色结果无明显差异,而未诱导分化的对照组没有特异性着色(图6)。

图6 eUC-MSCs成软骨诱导分化染色结果Fig.6 Staining results of eUC-MSCs for chondrogenic induction of differentiation
3 讨 论
3.1 eUC-MSCs的分离培养及增殖能力
UC-MSCs因无伦理问题,易于获得,无创分离,产量高,具有更大的分化和免疫调节潜力,是最有前景的多潜能性细胞之一。目前关于eUC-MSCs的报道较少,且对于马脐带不同部位MSCs的研究鲜有报道。Merlo等[6]报道马脐带细胞基质存在原始多能干细胞的替代来源,分离得到的MSCs贴壁生长呈成纤维状,具有分化为骨、脂肪、软骨和神经元细胞的能力,可以在出生时以非侵入性的方式收集并储存,以备将来用作供体细胞治疗马病。有研究证明使用组织块分离法比酶消化法更有优势,因为采用酶消化法可能会引起细胞损伤[11]。为了避免酶对原代细胞的影响,本研究采用组织块分离法获得eUC-MSCs,细胞呈成纤维状和簇状,3组细胞传代至P5代,细胞仍保持较好的增殖能力,各组细胞形态未发生明显变化,表明整段脐带都可分离得到eUC-MSCs。
使用MSCs用于临床治疗时,细胞的产量、存活性和倍增时间均要得到保证,因为细胞存活性更高和细胞倍增时间更低具有更好的疗效。在本研究中,3组eUC-MSCs的生长曲线显示,在第1~5天的培养过程中,细胞生长速度较慢,当进入对数生长期时,生长速度迅速增加。近端和远端eUC-MSCs具有几乎相同的细胞倍增时间,而中段eUC-MSCs更快进入对数生长期,且细胞倍增时间显著低于其他两组细胞。Iacono等[12]分离的eUC-MSCs从原代到P8代的细胞平均倍增时间为48 h。Passeri等[13]分离的eUC-MSCs传代至P12代后细胞的平均倍增时间为36.5 h,都高于本研究的平均倍增时间(31.9 h),近端和远端eUC-MSCs倍增时间与Passeri等[13]研究相似,可能是本研究对不同部位eUC-MSCs进行增殖能力测定,且不同部位的倍增时间不同。其次,本研究只针对P3代细胞进行增殖能力测定,而Passeri等[13]研究中使用传代至P12代的细胞进行增殖能力测定,由此可以看出针对脐带不同部位获取的eUC-MSCs及不同代数在倍增时间上存在一定的差异。
3.2 eUC-MSCs多潜能性和表面标记分子的表达
多能干细胞表达一组维持干细胞特性所必需的独特因子,包括POU5F1、NANOG和SOX2[14-16],这些转录因子参与多能性、自我更新和增殖的调节[17]。POU5F1是启动哺乳动物胚胎发育所必需的,对于胚胎内细胞团的形成和胚胎干细胞的维持至关重要[18]。SOX2调节POU5F1的表达,维持干细胞的多能状态,而NANOG是维持干细胞未分化状态和自我更新所必需的[17]。
通过实时荧光定量PCR检测多潜能性基因POU5F1、NANOG和SOX2 mRNA表达水平,随着细胞从P1代传至P5代,多潜能性基因的相对表达量明显升高,间接说明了分离细胞的纯度相对较高。P1代中段细胞NANOG基因的相对表达量显著高于近端细胞;P1代3组细胞POU5F1基因相对表达量都较低,但在P5代中,近端细胞的基因相对表达量显著高于中段细胞、极显著高于远端细胞;SOX2基因在3组细胞中差异均不显著。前人研究表明,在马脐带、脐带血、骨髓和脂肪MSCs的研究中,只有UC-MSCs表达了干细胞转录因子POU5F1[19],也印证了本研究结果。
国际细胞治疗学会曾报道,MSCs对CD73、CD90、CD105呈阳性表达,对CD14、CD19、CD34、CD45、CD79a呈阴性表达[20]。本研究中分离得到的3组eUC-MSCs高表达典型间充质表面分子CD73、CD90和CD105,低表达造血分子CD14、CD19、CD45和CD79a。CD34标记的是原始造血祖细胞和内皮细胞[20],但本研究中CD34呈阳性表达,在P1代时相对表达量较低,传代至P5代时出现高表达。 在Merlo等[8]和Iacono等[21]的研究中UC-MSCs阳性表达CD34,CD34的表达取决于细胞生长环境、体外培养的细胞代次或细胞来源[22-23]。
3.3 eUC-MSCs成软骨诱导分化
在本研究中,3组细胞诱导为成软骨细胞,经阿利新蓝染色后各诱导组的染色结果均可见特异性着色点,但各组间无明显差异,说明3组细胞分化程度相同。成软骨诱导分化的特异性基因ACAN和COL2A1在中段细胞的相对表达量均高于近端和远端细胞。随着诱导时间增加,COL2A1特异性基因的相对表达量逐渐增加,但ACAN基因的相对表达量逐渐下降,SOX9基因相对表达量只有在远端细胞中随着诱导时间增加而增加。ACAN基因是软骨的主要结构成分之一,在维持软骨结构和功能方面发挥着多种作用。SOX9基因主要负责正向调节软骨细胞中胶原和细胞外基质基因的表达,COL2A1基因形成软骨基质的基本网络,马脐带血MSCs诱导分化为软骨细胞时,在诱导7 d后可检测到特异性基因SOX9基因mRNA表达,但在诱导分化21 d后检测不到,在这两个时间都可检测到特异性基因COL2A1[24]。在不同部位人UC-MSCs体外诱导分化为成骨、成软骨和成脂细胞的研究中,脐带中段分离的MSCs在成软骨细胞诱导分化中特异性基因COL-11和ACAN表达量均显著高于靠近胎盘端和靠近胎儿端的细胞[25]。Merlo等[6]在研究人与马的UC-MSCs体外诱导分化时,发现eUC-MSCs表现出较高的成软骨和成骨分化能力。
综上所述,马同一脐带不同部位分离得到的eUC-MSCs,虽在形态上无明显差异,但中段eUC-MSCs细胞倍增时间显著低于近端与远端细胞;通过对多潜能性和表面标记分子的检测可知,3组细胞均表达多潜能基因和间充质表面标记分子,不表达造血分子,且随着传代后细胞纯度提高,大部分基因的相对表达量都有所增加;阿利新蓝对3个部位eUC-MSCs软骨诱导后染色结果相似,无法从染色结果上判断差异性,但软骨特异性基因的检测表明只有远端eUC-MSCs各基因相对表达量是随着诱导时间持续上升的,说明本研究中设计的诱导时间节点更适合远端eUC-MSCs进行诱导分化,而中段细胞对于软骨特异性基因ACAN和COL2A1的相对表达量显著高于近端和远端eUC-MSCs。
4 结 论
本研究通过组织块分离法得到3组eUC-MSCs,其形态呈成纤维状和簇状。3组eUC-MSCs细胞倍增时间分别为35.4(近端)、25.5(中段)和34.9 h(远端),平均倍增时间为31.9 h。3组eUC-MSCs均表达MSCs多潜能性基因NANOG、POU5F1和SOX2,高表达CD34、CD73、CD90和CD105,低表达CD14、CD19、CD45和CD79a表面标记分子,且具有分化为成软骨细胞的潜能;随着诱导时间的增加,成软骨分化的特异性基因ACAN和COL2A1在中段细胞的相对表达量高于近端和远端细胞。总的来说,在马整段脐带上都可以分离得到有价值的MSCs,但中段eUC-MSCs增殖能力和软骨分化潜能优于近端和远端分离得到的MSCs。
