基于网络药理学的黄芪抗肺纤维化机制预测与验证研究
2022-02-15黎金浓何娅娜周辉邓桂明
黎金浓 何娅娜 周辉 邓桂明







〔摘要〕 目的 通过网络药理学分析和实验验证阐释黄芪抗肺纤维化作用机制。方法 从中药系统药理学数据库和分析平台、中药分子机制的生物信息学分析工具中获取黄芪所有化学成分和对应靶点,从DrugBank和DisGeNET数据库获取肺纤维化疾病相关靶点,两者取交集,获得黄芪治疗肺纤维化潜在作用靶点,采用Cytoscape构建成分-靶点图,拓扑分析后通过Degree值筛选黄芪治疗肺纤维化关键活性成分,通过STRING构建靶点蛋白相互作用图,筛选核心靶点,通过基因在线富集分析工具Enrichr分析获得黄芪治疗肺纤维化所涉及的通路;观察黄芪提取物对博来霉素诱导的大鼠肺泡巨噬细胞TGF-β、PTGS2和p-ERK1/2蛋白表达的影响。结果 黄芪含有76个化学成分,作用于563个靶点,肺纤维化疾病相關靶点932个,交集靶点97个,黄芪活性成分-肺纤维化疾病靶点网络图中Degree值排名前4的成分依次为槲皮素(quercetin)、山柰酚(kaempferol)、大豆苷元(daidzein)、刀豆氨酸(canavanine),预测核心靶点分别为PTGS2、MAPK1、MAPK14、EGF、JUN等,涉及糖尿病并发症相关AGE-RAGE、流体切应力与动脉粥样硬化、癌症、IL-17等信号通路;低、中、高剂量黄芪提取物均能够降低博来霉素诱导的NR8383细胞TGF-β1、PTGS2的含量(P<0.05),并下调其p-ERK1/2的表达(P<0.05或P<0.01)。结论 黄芪能够通过多成分、多靶点、多作用途径干预肺纤维化病理过程,其机制与抑制肺泡巨噬细胞TGF-β、PTGS2和p-ERK1/2表达有关,为进一步研究黄芪治疗肺纤维化作用机制奠定基础。
〔关键词〕 肺纤维化;黄芪;网络药理学;效应机制;肺泡巨噬细胞
〔中图分类号〕R259 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2022.02.018
Mechanism prediction and validation research of Huangqi (Astragali Radix) in the
treatment of pulmonary fibrosis based on network pharmacology
LI Jinnong, HE Yana, ZHOU Hui, DENG Guiming*
(The First Affiliated Hospital of Hunan University of Chinese Medicine, Changsha, Hunan 410007, China)
〔Abstract〕 Objective To explore the potential mechanism of Huangqi (Astragali Radix) in the treatment of pulmonary fibrosis based on network pharmacology and experimental verification. Methods All chemical components and corresponding targets of Huangqi (Astragali Radix) were obtained from traditional Chinese medicine systems pharmacology database and analysis platform and a bioinformatics analysis tool for molecular mechanism of traditional Chinese medicine, and pulmonary fibrosis disease related targets were obtained from DrugBank and DisGeNET databases. The intersection of the two was taken to obtain the potential targets of Huangqi (Astragali Radix) in the treatment of pulmonary fibrosis. The component-target map was constructed by Cytoscape. After topological analysis, the key active components of Huangqi (Astragali Radix) in the treatment of pulmonary fibrosis were screened by Degree value. The target protein interaction map was constructed by STRING to screen the core targets. The pathways involved in the treatment of pulmonary fibrosis by Huangqi (Astragali Radix) were obtained by Enrichr analysis. The effects of Huangqi (Astragali Radix) extract on the expression of TGF-β, PTGS2 and P-ErK1/2 proteins in bleomycin-induced rat alveolar macrophages was observed. Results Huangqi (Astragali Radix) contained 76 chemical components that acted on 563 targets, 932 targets related to pulmonary fibrosis disease and 97 targets of intersection. The top 4 components in the map of Huangqi (Astragali Radix) components-targets of pulmonary fibrosis disease network were quercetin, kaempferol, daidzein, canavanine. The suppositional targets were PTGS2, MAPK1, MAPK14, EGF, JUN, involving AGE-RAGE in diabetic complications, fluid shear stress and atherosclerosis, cancer, IL-17 signaling pathway and so on. Low, medium and high doses of Huangqi (Astragali Radix) extract could down-regulate the content of TGF-β1 and PTGS2 in bleomycin-induced NR8383 cells (P<0.05), and down-regulate the expression of P-ERK1/2(P<0.05, P<0.01). Conclusion Huangqi (Astragali Radix) can act on the whole course of pulmonary fibrosis through multi-component, multi-target and multi-action pathway, the mechanism may be related to down-regulating the expression of TGF-β, PTGS2 and p-ERK1/2 in pulmonary macrophage, which provides a basis for studying on the mechanism of Huangqi (Astragali Radix) in treating pulmonary fibrosis.
〔Keywords〕 pulmonary fibrosis; Huangqi (Astragali Radix); network pharmacology; effect mechanism; alveolar macrophages
肺纤维化(pulmonary fibrosis, PF)是一种慢性的、进行性的肺间质疾病,其病理特征体现为肺泡结构破坏、细胞外基质沉积、炎症细胞浸润以及纤维化伴蜂窝肺的形成,患者最终因呼吸衰竭而死亡[1-2]。该病发病率和死亡率呈逐年上升趋势,临床多采用抗炎、抗纤维化等药物进行治疗,但效果不甚理想[3]。
近年来,中医药治疗PF在临床试验研究中取得较大进展,中医学认为PF属于“肺痿”“肺痹”等范畴[4]。《素问·六节藏象论》曰:“肺者,气之本。”《证治汇补·胸膈门·咳嗽》曰:“久咳肺虚……为肺痿之病。”在气虚、血瘀、痰凝等病机中,气虚贯穿病程始末[5]。因此,多数医家在辨治PF时多以补气扶正为主。研究表明,中医治疗PF的处方中,黄芪出现频率最高[6],这充分体现了中医治病求本的中心思想。黄芪富含皂苷、黄酮、多糖等活性成分,药理实验表明,黄芪具有大补肺脾、益气固表、补气升阳、增强免疫等作用[7],近期研究报道,黄芪总黄酮可有效减轻特发性PF小鼠的炎症反应、PF,抑制TGF-β表达[8],另有研究表明,黄芪甲苷具有调控miR-29的作用,抑制TGF-β1/Smad3信号通路,从而改善PF病理损伤[9]。但缺少系统的黄芪改善PF的机制研究。本研究采用网络药理学结合实验验证的方法,从整体、系统的角度探究药物活性成分、作用靶点和疾病之间的关系,为黄芪治疗PF机制研究提供理论与实验依据。
1 材料与方法
1.1 數据库及软件
中药系统药理学数据库和分析平台(traditional Chinese medicine systems pharmacology database and analysis platform, TCMSP, http://tcmspw.com/tcmsp.php),中药分子机制的生物信息学分析工具(a bioinformatics analysis tool for molecular mechanism of traditional Chinese medicine, BATMAN-TCM, http://bionet.ncpsb.org/batman-tcm/),UniProt数据库(http://www.uniprot.org),DrugBank数据库(https:/go.drugbank.ca),DisGeNET数据库(https://www.disgenet.org/),Enrichr数据库(https://maayanlab.cloud/Enrichr/),Cytoscape软件(V3.2.1)。
1.2 黄芪活性成分与靶点收集
以“黄芪”或“HUANG QI”为检索词,分别在TCMSP和BATMAN-TCM中检索黄芪活性成分和对应靶点,并将靶点名称通过UniProt数据库统一转换成Gene Names,收集整理黄芪活性成分对应的所有靶点。
1.3 PF疾病靶点收集
在DisGeNET数据库、DrugBank数据库搜索“pulmonary fibrosis”相关的疾病靶点,通过UniProt数据库统一转换为Gene Names。
1.4 黄芪活性成分作用PF疾病靶点网络拓扑分析
参考文献[10]将黄芪活性成分作用靶点与PF疾病相关靶点合并取交集,得到黄芪治疗PF的作用靶点,通过Cytoscape软件构建成分-靶点网络图,行拓扑分析,并做可视化处理。
1.5 黄芪治疗PF潜在靶点富集分析
将上述交集靶点输入Enrichr数据库,查看KEGG通路富集分析结果。
1.6 细胞实验验证
1.6.1 实验细胞及药物 大鼠肺泡巨噬细胞NR8383(中国药科大学中药学院馈赠,批号:CRL-2192)。黄芪饮片(湖南华夏湘众药业饮片有限公司,批号:200111);注射用盐酸博来霉素(日本化药株式会社,批号:200501)。
1.6.2 主要试剂及仪器 大鼠TGF-β1、PTGS2/COX-2 ELISA试剂盒(武汉Elabscience生物科技公司,批号:AK0020OCT11001、AK0020MAY05001);抗p-ERK1/2(美国CST公司,批号:4390);兔多抗ERK1/2(武汉三鹰生物技术公司,批号:16443-1-AP);胎牛血清FBS、高糖培养基DMEM(美国Gibco公司,批号:42A0378K、8119361);CO2培养箱(美国赛默飞世尔公司,型号:Form311);酶标仪、双垂直电泳槽(北京六一生物科技有限公司,型号:WD-2102B、DYCZ-25D)。
1.6.3 CCK8法检测细胞增殖 取指数生长期NR8383大鼠肺泡巨噬细胞,制备成5×104细胞/mL的细胞悬液,按每孔100 μL接种于96孔板中,分别加入不同浓度博来霉素和黄芪提取物,继续培养12 h或24 h。取出细胞培养板,向每孔加入10 μL CCK8溶液,继续培养2 h。在酶联免疫检测仪450 nm处测量各孔的吸光度值。同时设置调零孔(培养基、CCK8)、对照孔(细胞、相同浓度的药物溶解递质、培养基、CCK8),每组设定3复孔。计算各组细胞的相对增殖率。
1.6.4 博来霉素诱导NR8383细胞活化模型最优条件筛选 参考文献[11-12],选用博来霉素诱导巨噬细胞活化模型。CCK8法考察50、100、150 μg/mL博来霉素在12、24 h对细胞活力值的影响,ELISA法测定细胞上清中TGF-β1含量。
1.6.5 ELISA法测定细胞上清中TGF-β1和PTGS2含量 按照试剂盒说明书绘制标准曲线,然后分别设空白孔(空白对照孔不加样品及酶标试剂,其余各步操作相同)、待测样品孔。在酶标包被板上待测样品孔中先加样品稀释液40 μL,然后再加待测样品10 μL。将样品加于酶标板孔底部,尽量不触及孔壁,轻轻晃动混匀,按照说明书孵育、洗涤、加酶、显色,终止后用酶标仪在450 nm波长下测定吸光度,通过标准曲线计算样品中TGF-β1和PTGS2浓度。
1.6.6 分组与给药 分别称取黄芪提取物冻干粉和盐酸博来霉素粉末加DMSO溶解后过滤,分别制成1 mg/mL母液,使用时加培养基稀释成相应浓度。实验分为空白组、博来霉素组及黄芪低、中、高剂量组,除空白组外其余各组分别加入150 μg/mL博来霉素,然后黄芪低、中、高剂量组分别加入黄芪提取物20、40、60 μg/mL[5],并置于CO2培养箱中培养一段时间。
1.6.7 Weastern blot检测NR8383细胞中ERK1/2、p-ERK1/2 蛋白质水平 按照上述实验设计将细胞培养于6孔板,培养、干预后,洗净培养液,用含PMSF的裂解液冰上裂解细胞,30 min后,设置为4 ℃,12 000 r/min,离心半径6 cm,离心5 min,提取上清液,BCA法测定蛋白质浓度。取Marker和样品,总蛋白量为40 μg进行电泳。转PVDF膜,封闭1.5 h后,孵一抗,4 ℃,过夜。TBS-T缓冲液洗涤4次,每次10 min,孵育二抗,室温1.5 h,洗涤5次,每次10 min,用显色剂ECL试剂显色、曝光。观察各组细胞中ERK1/2和p-ERK1/2蛋白表达水平。
1.6.8 统计学方法 采用SPSS 19.0软件进行统计分析,符合正态分布且各组间方差齐时数据以“x±s”表示,采用单因素方差分析,两两比较采用LSD检验,方差不齐时,用Games-Howell(A)检验。以P<0.05为差异有统计学意义。
2 结果
2.1 黄芪活性成分及PF疾病靶点
通过检索DisGeNET和DrugBank,共收集整理得到PF疾病相关靶点932个;通过检索TCMSP和BATMAN-TCM数据库,共收集整理得到黄芪活性成分76个,其对应靶点共计563个,其中97个与PF疾病靶点重合。见图1。
2.2 黄芪活性成分-PF疾病靶点网络构建和拓扑分析
将黄芪活性成分-靶点数据通过Cytoscape软件绘制出黄芪活性成分-PF疾病靶点相互作用网络图,同时行拓扑分析。黄芪活性成分Degree值排名前4的是槲皮素(quercetin)、山奈酚(kaempferol)、大豆苷元(daidzein)、刀豆氨酸(canavanine)。见图2。
2.3 黄芪干预PF核心靶点预测
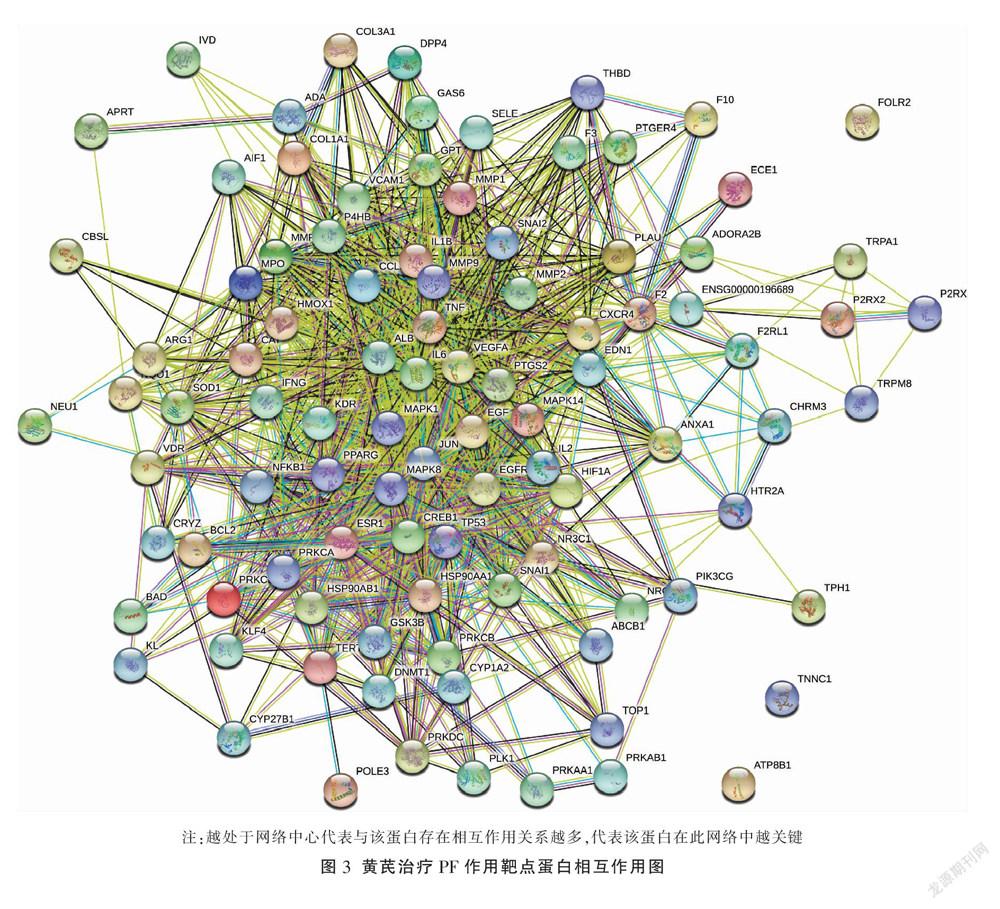
將上述黄芪作用于PF疾病的97个靶点蛋白相互作用关系分析,靶点PTGS2、MAPK14、EGF、JUN、MAPK1、IL-6、TNF、VEGFA等处于核心位置。见图3。
2.4 黄芪治疗PF靶点KEGG通路富集分析和可视化
将获得的黄芪治疗PF的97个靶点进行富集分析,分析结果P<0.05的KEGG通路共有169条,按照P值从小到大排序,展示前10条通路,依次为糖尿病并发症相关AGE-RAGE、流体切应力与动脉粥样硬化、癌症、IL-17等信号通路。见图4。将所富集获得的通路进行可视化处理,黄芪治疗PF的作用靶点有JUN、IL-6、PTGS2等。见图5。
2.5 博来霉素诱导NR8383活化模型最优条件筛选
博来霉素50、100、150 μg/mL组在12、24 h两个条件下,细胞活力与空白组比较,差异均无统计学意义(P>0.05)。博来霉素50、100 μg/mL组在12、24 h两个条件下,TGF-β1含量与空白组比较,差异均无统计学意义(P>0.05)。博来霉素150 μg/mL组在12 h条件下,TGF-β1含量高于空白组(P<0.05);在24 h条件下,TGF-β1含量显著高于空白组(P<0.01)。见图6。
2.6 黄芪提取物降低博来霉素诱导的NR8383细胞TGF-β1和PTGS2的含量
与空白组比较,博来霉素组TGF-β1和PTGS2含量均显著升高(P<0.05);经不同浓度黄芪提取物干预后,TGF-β1和PTGS2含量均显著降低(P<0.05)。见表1。
2.7 黄芪提取物抑制博来霉素诱导的NR8383细胞中p-ERK1/2表达
与空白组比较,博来霉素组p-ERK1/2表达水平升高(P<0.01)。与博来霉素组比较,黄芪低、中、高剂量组p-ERK1/2表达水平均降低(P<0.05或P<0.01)。而博来霉素组ERK1/2表达水平与空白组比较,差异无统计学意义(P>0.05)。黄芪低、中、高剂量组ERK1/2表达水平与博来霉素组比较,差异均无统计学意义(P>0.05)。见图7。
3 讨论
本研究通过网络药理学方法对黄芪治疗PF的物质基础与作用机制进行了探析。从不同数据库共收集到黄芪活性成分76个,作用靶点563个,其中与PF相关靶点97个,说明黄芪治疗PF涉及多个成分和靶点,黄芪活性成分-PF疾病靶点网络图的拓扑分析结果显示Degree值较高的成分有槲皮素、山奈酚、大豆苷元、刀豆氨酸等,提示其可能是黄芪治疗PF的主要活性物质,其中槲皮素Degree值为41,代表槲皮素能够作用于41个PF相关靶点,槲皮素作为黄芪中重要的黄酮类成分之一,具有广泛的生理活性,有文献报道称口服槲皮素能够有效降低博来霉素诱导的PF大鼠肺组织中胶原沉积和氧化-抗氧化失衡[13],并且降低支气管肺泡灌洗液中促纤维化介质IL-13、PDGF-β和TNF-α浓度[14],与本研究预测结果相一致,或许可以为后期对槲皮素进一步开发提供思路。
通过分析黄芪治疗PF的作用靶点,其中PTGS2的Degree值为38,表明黄芪76个活性成分中38个成分均与该靶点存在作用关系,后经蛋白相互作用分析研究发现,PTGS2处于网络核心,推测该靶点在黄芪治疗PF过程中扮演重要角色。PTGS2是环氧合酶-2(cyclooxygenase-2, COX-2)的编码基因,而COX-2是诱导型酶,在各种细胞中可被促炎细胞因子、肿瘤促进剂、有丝分裂原和生长因子等高度诱导,从而参与炎性反应、细胞增殖、细胞凋亡等多种病理过程[15]。有报道称COX-2在博来霉素诱导PF组织中高度表达[16],COX-2为微粒体型,在炎症模型中对PGE2的上调起主要作用。PGE2可刺激Th2型细胞因子IL-10、IL-13的产生,还可抑制Th1型细胞因子如IFN-γ、IL-12的合成,从而导致Th1/Th2型细胞因子的平衡失调,从而造成肺泡炎症的进一步扩大,最终导致PF。在PF的发生发展过程中,肺泡巨噬细胞发挥了重要的调节作用[17]。有研究表明博来霉素能够诱导肺泡巨噬细胞发生表型转化,产生M2型肺泡巨噬细胞,从而分泌TGF-β1,而TGF-β1能够促进成纤维细胞活化、增殖[18]。而TGF-β1对细胞的调控与ERK信号通路是密切相关的[19]。ERK1/2能调控多种炎性介质、细胞因子的表达,在成纤维细胞增生和细胞外基质沉积中起着关键作用。有研究表明,博来霉素诱导的PF动物模型中存在p-ERK1/2表达增加的现象[20],活化后的ERK一方面可以停留在胞浆中,对胞浆蛋白具有催化作用,参与细胞形态的调节和细胞骨架的重分布,另一方面可移位至细胞核,通过磷酸化而调节c-JUN、c-Fos、NF-κB等转录因子活性,调控基因表达。PF过程中复杂的细胞因子网络成员包括TNF-α、IL-1、IL-6和参与组织修复与纤维化进展的TGF-β、PDGF、CTDGF等之间存在相互调控、相互影响,其交互作用与ERK通路密切相关。研究证实,IL-1β可激活ERK,而使用ERK抑制剂PD98059可阻断IL-1β促TGF-β1表达和分泌作用[21]。本文通过细胞实验发现黄芪低、中、高剂量组均能降低博来霉素诱导的大鼠肺泡巨噬细胞NR8383中TGF-β1、PTGS2含量(P<0.05),并下调其p-ERK1/2的表达(P<0.01),是对上述网络药理学预测的黄芪作用机制的有力佐证。
除上述靶点之外,我们通过富集分析得到了一些黄芪治疗PF的潜在信号通路和生物过程。如晚期糖基化终末产物及其受体(糖尿病并发症相关AGE-RAGE信号通路)信号通路可能诱导一系列信号传导级联反应参与免疫损伤与异常修复,最终导致肺组织中细胞外基质的过度积聚和成纤维细胞灶的形成[22]。IL-17信号通路可直接参与多种炎症性疾病和自身免疫性疾病的发生发展,同时IL-17作为一种多功能的细胞因子,同时具备强大的募集各种炎性细胞和粒细胞的功能。IL-17可以通过激活下游MAPK、NF-κB信号通路,引起TNF-α、IL-6等炎性细胞因子的释放,导致级联“炎症瀑布”反应的发生,或激活PI3K使GSK3β磷酸化失活,从而抑制GSK3β活性,加快PF进展[23]。研究表明,中和内源性IL-17,能显著改善BLM诱导的PF,降低TGF-β1产生,抑制PI3K/Akt/mTOR信号通路,激活细胞自噬[24]。此部分预测结果还需进一步动物实验进行验证。
综上所述,本文通过网络药理学对黄芪多成分、多靶点、多通路干预PF的复杂网络关系进行研究探讨,初步阐明黄芪治疗PF的主要活性物质、靶点和通路,并以博来霉素诱导NR8383细胞表型转化模型验证黄芪提取物的作用,为进一步研究黄芪抗PF作用机制提供依据。
参考文献
[1] 丁大力,沈学彬,姚佳慧,等.中药治疗肺纤维化的研究进展[J].中草药,2021,52(22):7006-7024.
[2] 范亚丽,叶 俏.肺纤维化疾病诊断与风险预测的生物标志物[J].中华医学杂志,2021,101(12):893-898.
[3] 邓 龙,邹晓青,姜德建.治疗肺纤维化药物的评价与开发进展[J].中国新药杂志,2021,30(8):712-717.
[4] 郑 钰,吕晓东,庞立健,等.中医药治疗特发性肺纤维化临床研究方法初探[J].辽宁中医药大学学报,2019,21(11):102-105.
[5] 彭艳芳,张莹雯,张亚兵,等.芪归方有效组分治疗特发性肺纤维化的实验研究[J].世界中医药,2020,15(12):1719-1723,1728.
[6] 马林纳,王瑞,苗明三.基于数据挖掘的治疗肺纤维化中药用药规律分析[J].中草药,2020,51(6):1406-1411.
[7] 葛春蕾,张兴彩,李珂珂.单味中药及其提取物在肺纤维化治疗中的研究进展[J].中医药学报,2020,48(6):67-72.
[8] 敬小莉,孙续禄,张俊,等.黄芪提取物对特發性肺纤维化小鼠的治疗效果及TGF-β、VEGF分析[J].中华中医药学刊,2021,39(4):248-250.
[9] 童佳欢,刘肇恒,龙 杞,等.黄芪甲苷对博来霉素肺纤维化模型小鼠miR-29b及其相关因子表达的影响[J].环球中医药,2021,14(6):1013-1019.
[10] 杨梦琳,周小青,伍大华,等.基于网络药理学探讨何首乌-丹参治疗阿尔茨海默病的作用机制[J].湖南中医药大学学报,2021,41(4):558-565.
[11] 詹天玮.坎格雷洛缓解博来霉素诱导的小鼠肺纤维化的作用机制研究[D].杭州:浙江大学,2019.
[12] 吕凌燕,李瑞琴,孙春霞,等.瓜蒌薤白汤含药血清对博来霉素诱导的大鼠肺泡巨噬细胞纤维化的影响[J].中医学报,2020,35(4):827-830.
[13] 魏巧凤.槲皮素在博来霉素诱导的大鼠肺纤维化中的治疗作用及机制研究[D].济南:山东大学,2017.
[14] MALAYERI A R, HEMMATI A A, ARZI A, et al. A comparison of the effects of quercetin hydrate with those of vitamin E on the levels of IL-13, PDGF, TNF-α, and INF-γ in bleomycin-induced pulmonary fibrosis in rats[J]. Jundishapur Journal of Natural Pharmaceutical Products, 2016, 11(2): e27705.
[15] AMBATI G G, JACHAK S M. Natural product inhibitors of cyclooxygenase (COX) enzyme: A review on current status and future perspectives[J]. Current Medicinal Chemistry, 2021, 28(10): 1877-1905.
[16] WANG Y D, WEI Y H, HE N, et al. Evaluation of cyclooxygenase-2 fluctuation via a near-infrared fluorescent probe in idiopathic pulmonary fibrosis cell and mice models[J]. Journal of Materials Chemistry, 2021, 9(31): 6226-6233.
[17] 郭兆娟,翟华强,王宁宁,等.巨噬细胞极化在肺纤维化中的作用及信号通路研究[J].中国中药杂志,2018,43(22):4370-4379.
[18] XIANG J, CHENG S, FENG T L, et al. Neotuberostemonine attenuates bleomycin-induced pulmonary fibrosis by suppressing the recruitment and activation of macrophages[J]. International Immunopharmacology, 2016, 36: 158-164.
[19] 张彦伟,张志强,吴丽贤,等.雷公藤内酯醇减少放射性肺纤维化中肌成纤维细胞活化与抑制TGF-β1/ERK/Smad3通路相关[J].中国药理学通报,2017,33(5):630-636.
[20] 谭婧瑾. FGF2、FGFR2、p-ERK1/2在特发性肺纤维化和非小细胞肺癌中的表达及意义[D].长春:吉林大学,2017.
[21] 冯 莉,王献华.转化生长因子-β1介导的ERK/MAPK信号通路与肺纤维化[J].中国煤炭工业医学杂志,2008,11(10):1621-1623.
[22] SERBAN A I, STANCA L, GEICU O I, et al. RAGE and TGF-β1 cross-talk regulate extracellular matrix turnover and cytokine synthesis in AGEs exposed fibroblast cells[J]. PLoS One, 2016, 11(3): e0152376.
[23] 劉理静,钱 红,尹辉明,等.IL-17单克隆抗体对肺纤维化大鼠的保护作用及部分机制研究[J].中国药理学通报,2015,31(11):1586-1592.
[24] 宋桂芹,赵铁军,唐红悦,等.中和白介素-17对博来霉素诱导的特发性肺纤维化及PI3K/Akt/mTOR信号通路的影响[J].南京医科大学学报(自然科学版),2020,40(11):1617-1622.
