金刚丸对骨质疏松大鼠骨代谢和血清骨钙素的影响
2022-02-15匡浩铭沈琳玲曹闲雅匡建军柳卓毛果蔡萍戎宽杨惠
匡浩铭 沈琳玲 曹闲雅 匡建军 柳卓 毛果 蔡萍 戎宽 杨惠



〔摘要〕 目的 探討金刚丸对骨质疏松大鼠骨代谢和血清骨钙素的影响。方法 将60只SPF级大鼠随机分为正常对照组、模型组及高、中、低剂量组和己烯雌酚组,每组10只。高、中、低剂量金刚丸组每天分别以3.24、1.62、0.81 g/kg的剂量灌胃1次;己烯雌酚组大鼠每天给予1.0 mg/kg灌胃1次;正常对照组及模型组给予等体积的生理盐水。给药6周后取股骨,测量股骨最大载荷和断裂载荷;HE染色法观察骨小梁结构;ELISA法测定股骨组织中血清骨源性碱性磷酸酶(bone alkaline phosphatase, BALP)、雌二醇(estradiol E2)和血清骨钙素(bone gla-containing protein, BGP)、骨保护蛋白(osteoprotegerin, OPG)、核因子-κB受体活化因子(receptor activator of NF-κB, RANK)及核因子-κB受体活化因子配体(receptor activator of NF-κB ligand, RANKL)的水平;采用光子骨密度(bone mineral density, BMD)测试仪测定BMD;采用Western blot法检测瞬时受体电位阳离子通道亚族V成员6 (transient receptor potential cation channel subfamily V member 6, TRPV6)蛋白相对表达量。结果 模型组骨小梁形态模糊、广泛断裂,骨髓腔增宽,骨细胞排列散乱;高、中、低剂量组可见骨小梁形态较模型组改善、结构较为紧密,骨髓腔减小,骨外膜排列改善。与正常对照组相比,模型组体质量、BALP、BGP、RANK、RANKL水平明显升高,E2、BMD、最大负荷、断裂负荷、TRPV6、OPG水平均明显降低(P<0.05)。与模型组相比,高、中、低剂量组体质量、BALP、BGP、RANK、RANKL水平降低,E2、BMD、最大负荷、断裂负荷、OPG、TRPV6水平显著升高(P<0.05)。结论 金刚丸通过提高绝经后骨质疏松大鼠雌激素水平,调节骨代谢,提高生物力学性能和BMD,起到抗骨质疏松的疗效和骨保护作用,其机制可能是通过影响TRPV6表达上调OPG表达,下调RANKL表达。
〔关键词〕 骨质疏松;金刚丸;血清钙;骨代谢;瞬时受体电位阳离子通道亚族V成员6;骨保护素
〔中图分类号〕285.5 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2022.02.010
Effects of Jingang Pill on bone metabolism and serum osteocalcin in osteoporosis rats
KUANG Haoming1, SHEN Linling1, CAO Xianya1, KUANG Jianjun2, LIU Zhuo3, MAO Guo3, CAI Ping2,
RONG Kuan2*, YANG Hui1*
(1. Hunan University of Chinese Medicine, Changsha, Hunan 410208, China; 2. Hunan Academy of Traditional Chinese Medicine, Changsha, Hunan 410006, China; 3. Hunan Academy of Traditional Chinese Medicine Affiliated Hospital,
Changsha, Hunan 410006, China)
〔Abstract〕 Objective To investigate the effects of Jingang Pill on bone metabolism and serum osteocalcin in osteoporosis rats. Methods 60 SPF rats were randomly divided into control group, model group, high, medium and low dose Jingang Pill groups and diethylstilbestrol group, with 10 rats in each group. The high, medium and low dose Jingang Pill groups were given intragastric administration of 3.24, 1.62, 0.81 g/kg per day respectively; the rats in the diethylstilbestrol group were given diethylstilbestrol 1.0 mg/kg every day; rats in the control group and model group were given equal volume of normal saline. After 6 weeks of administration, the femur was taken to detect the maximum load and fracture load; bone trabecular structure was observed by HE staining; the levels of serum bone alkaline phosphatase (BALP), estradiol (E2) and serum bone gla-containing protein (BGP), osteoprotegerin (OPG), receptor activator of NF-κB (RANK) and receptor activator of NF-κB ligand (RANKL) were measured by ELISA; bone mineral density
(BMD) was measured by BMD tester; the relative expression of transient receptor potential cation channel subfamily V member 6 (TRPV6) protein was detected by Western blot. Results In the model group, bone trabecular morphology was blurred and extensively fractured, bone marrow cavity was widened, and bone cells were scattered. Compared with the model group, bone trabecular morphology and structure were improved in high, medium and low dose groups, bone marrow cavity was reduced, and bone membrane arrangement was improved. Compared with the control group, the levels of body weight, BALP, BGP, RANK and RANKL in model group were significantly increased, while the levels of E2, BMD, maximum load, breaking load, OPG and TRPV6 were significantly decreased (P<0.05). Compared with the model group, the levels of body weight, BALP, BGP, RANK and RANKL in medium and high dose groups were significantly increased, while the levels of E2, BMD, maximum load, breaking load, OPG and TRPV6 were significantly decreased (P<0.05). Conclusion Jingang Pill has the effect of anti-osteoporosis and bone protection by increasing the estrogen level, regulating bone metabolism, improving biomechanical properties and BMD in postmenopausal osteoporosis rats, and mechanism may be through affecting the expression of TRPV6, so as to up-regulate the expression of bone protective protein and down-regulate the expression of RANKL.
〔Keywords〕 osteoporosis; Jingang Pill; serum calcium; bone metabolism; transient receptor potential cation channel subfamily V member 6; osteoprotegerin
骨質疏松症(osteoporosis, OP)是一种代谢失衡导致的骨量减少、骨组织结构破坏、易发骨折骨的代谢性疾病[1]。绝经后骨质疏松症(postmenopausal osteoporosis, PMOP)是导致老年妇女骨折的重要原因,增加了患者病残率和死亡率[2-4]。PMOP发病率呈上升趋势,严重影响妇女的心理和生活质量[5]。因此,各种途径寻找行之有效的OP防治方法是目前相关学科研究者关注的焦点。研究表明,绝经后妇女雌激素缺乏导致骨吸收异常是OP发生的主要原因之一,雌激素水平降低影响成骨细胞和破骨细胞的分化,抑制了骨代谢,使得OP的发生[6]。临床上常用雌激素和孕酮治疗,但是长期用于治疗OP会导致显著的不良反应。和西药相比,中医药防治OP具有很多优势,多靶向且对人体不良反应相对较少,适合临床长期应用。通过辨证施治,中药可作用于多个病理环节,能够改善患者多种伴随的症状,从而提高患者生存质量,减少患者经济负担。金刚丸最早记载于《素问·病机气宜保命集》,是金朝著名医家刘完素治疗肾虚型骨萎的经典名方,在古代医案中治疗骨萎多有良效。而课题组对金刚丸前期的研究表明,其治疗OP临床疗效确切,金刚丸能够通过调节整合素β1、αVβ3表达水平,降低骨代谢指标,维持骨丢失与骨形成之间的代谢平衡,从而具有一定的抗OP的作用[7-8]。本研究应用去卵巢大鼠模型以及成熟的指标探索瞬时受体电位阳离子通道亚族V成员6(transient receptor potential cation channel subfamily V member 6, TRPV6)、骨保护蛋白(osteoprotegerin, OPG)、核因子-κB受体活化因子(receptor activator of NF-κB, RANK)及核因子-κB受体活化因子配体(receptor activator of NF-κB ligand, RANKL)与OP的关系,并初步研究金刚丸抗OP代谢的作用机制。
1 材料与方法
1.1 动物及分组
由湖南省中医药研究院动物实验中心代为采购的60只SPF级、10月龄、雌性大鼠,体质量(220±40) g,动物许可证号:43602500000352。动物均喂养在SPF级动物房中,保证通风和光线充足,相对湿度50%左右,并在室温下适应1周,使用标准饲料和饮用水。适应性喂养,将60只SPF级大鼠按照数字表法随机分为正常对照组、模型组、己烯雌酚组及高、中、低剂量组,每组10只。
1.2 实验药物
金刚丸制作:肉苁蓉(酒浸)、菟丝子(酒浸)、杜仲(盐炒)、萆薢,各120 g等分为细末,与酒煮猪腰子蜜制成丸。金刚丸(陕西天洋制药有限公司,规格:3.5 g/丸,国药准字:Z61020726,批号:202004)。己烯雌酚片(天津利盛制药有限公司,规格:0.5 mg/片,国药准字:H12020154,批号:219A )。
1.3 主要试剂
上样缓冲液6X(批号:CW0610)、mRNA逆转录试剂盒(批号:CW2569)、miRNA逆转录试剂盒(批号:CW2141)均購自中国北京康为世纪有限公司;EDTA(中国大连美伦公司,批号:MB2514);核酸染料(中国北京普利莱公司,批号:PB11141);OPG、RANK、RANKL、TRPV6酶联免疫吸附试剂盒(上海酶联生物科技有限公司,批号:ml133271、ml601105、ml003065、
ml347206);TRPV6抗体(批号:ab740201)、OPG抗体(批号:ab73400)、RANKL抗体(批号:ab45039)均购自英国abcam公司;青霉素(华北制药股份有限公司,批号:L201008)。
1.4 主要仪器
台式高速冷冻离心机(湖南湘仪实验室仪器开发有限公司,型号:H1650R);多功能酶标分析仪(深圳市汇松科技发展有限公司,型号:MB-530);电热恒温培养箱(北京市永光明医疗仪器有限公司,型号:DHP-500);摇床(中国江苏其林贝尔公司,型号:TS-1);荧光定量RCP仪(美国Thermo公司,型号:PIKOREAL96)荧光PCR板(美国Thermo公司,型号:SPL0960)。
1.5 模型建立
参照文献研究[8],将大鼠固定在无菌手术台上使其平卧夹紧,腹腔注射(10%,0.3 mg/kg)水合氯醛麻醉。常规消毒后,其腹部经切口切开,用手术线结扎卵巢下输卵管,切除双侧卵巢,切口部位消毒缝合。模型组、己烯雌酚组及高、中、低剂量组均摘取双侧卵巢。手术后,术后连续3 d肌注青霉素以预防感染,5万单位/只,1次/d。
1.6 药物处理及取材
高、中、低剂量组每天分别给予3.24、1.62、0.81 g/kg的金刚丸水溶液灌胃;己烯雌酚组每天给予1.0 mg/kg的己烯雌酚水溶液灌胃;正常对照组和模型组均以等量生理盐水灌胃。连续给药6周后,处死大鼠,检测指标。详细记录各组大鼠的体力活动与体质量。处死前,取各组大鼠腹主动脉血5 mL,分离血清,置-80 ℃冰箱保存,待用。
1.7 指标检测
1.7.1 体质量 给药6周后,各组大鼠均禁食12 h,不禁水,于次日上午称体质量。
1.7.2 HE染色 石蜡切片制备:大鼠右侧胫骨以4%多聚甲醛固定后,用10% EDTA溶液脱钙,每3天换液1次,室温下连续脱钙6周,以注射液针头剌无阻力感为脱钙完成标准。取胫骨上段1 cm左右长度,进行梯度乙醇脱水(70%、80%、90%、95%、100%、100%、100%,每个溶液浸泡15 min);用二甲苯透明切片(2次,共40 min);取冠状面向外,常规石蜡包埋,石蜡切片厚度为5 μm,42 ℃水浴展片后,裱片于载玻片上,60 ℃烤片5 h备用。
染色:石蜡切片用二甲苯脱蜡(梯度酒精下行至水);在BOUIN氏固定液中再固定1 h,流水冲洗至切片无色;HE染液浸染10 min,用蒸馏水冲洗切片,至水澄清;用1%磷钼酸分色5~10 min,至骨小梁褪色即可;0.5%固绿染液浸染5 min,梯度乙醇脱水(70%、80%、90%、95%、100%、100%、100%,每个浓度溶液浸泡5 min)后,用二甲苯透明化处理,最后使用中性树胶封片,镜下观察。
1.7.3 BMD检测 从每个骨标本中取出右股软组织,用双能双光子骨密度(bone mineral density, BMD)仪测量BMD。采用AG-IX生物力学通用试验机测量出最大载荷和断裂载荷。大鼠的左股骨均置于试验机上,跨度为20 mm,加载速度保持在10 mm/min,下压探头至胫骨中段,直至其发生断裂,记录载荷变形曲线,并分析数据。
1.7.4 ELISA法 采用ELISA法检测血清BALP、E2、BGP、OPG、RANK、RANKL水平。取血清标本,用全自动生化仪检测。标准品的加样、加酶、配液、洗涤、显色测定:以空白孔调零,450 nm波长依序测量各孔的吸光度(OD值)。测定应在加终止液后15 min以内进行。
1.7.5 Western blot法 蛋白提取:用冰预冷PBS洗组织,加入300 μL RIPA裂解液于生物样品均质仪中;裂解10 min;4 ℃,12 000 r/min离心15 min(离心半径8 cm);将离心后的上清液进行制胶、凝胶电泳,转膜,放入1×PBST中洗1 过夜,次日室温放置30 min。一抗(1∶1000)二抗(1∶3000)孵育结束,1×PBST洗3次,每次10 min。ECL显色曝光:使用ECL化学发光液与膜孵育1 min,用滤纸吸尽液体,在成像系统仪中拍照。
1.8 统计学分析
统计分析使用SPSS 21.0数据包,实验中所有结果以“x±s”表示,数据进行正态性、方差齐性检测,符合正态分布与方差齐性则用采用单因素方差分析,不符合则用Dunnett-t检验,均以P<0.05表示差异有统计学意义。
2 结果
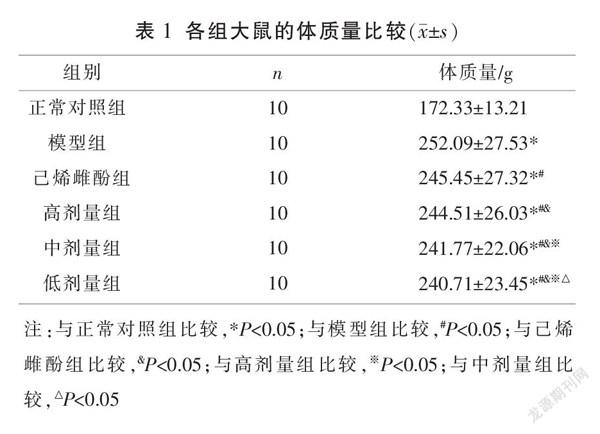
2.1 各组大鼠体质量比较
与正常对照组比较,模型组体质量明显升高(P<0.05);与模型组比较,高、中、低剂量组和己烯雌酚组体质量明显降低(P<0.05);与己烯雌酚组比较,高、中、低剂量组体质量均降低(P<0.05);且高、中、低剂量组体质量降低呈剂量依赖性(P<0.05)。见表1。
2.2 HE染色结果显示
正常对照组骨小梁形态完整、无明显断裂,骨髓腔正常,骨细胞排列均匀;模型组骨小梁形态模糊、广泛断裂,骨髓腔增宽,骨细胞排列散乱;己烯雌酚组及高、中、低剂量组可见骨小梁形态较模型组改善、结构较为紧密,骨髓腔减小,骨外膜排列接近正常对照组。见图1。
2.3 各组大鼠BMD水平比较
与正常对照组比较,模型组体BMD水平明显下降(P<0.05);与模型组比较,高、中、低剂量组和己烯雌酚组BMD水平升高(P<0.05);与己烯雌酚组比较,高剂量组BMD水平升高,中、低剂量组BMD水平降低(P<0.05);高、中、低剂量组BMD水平降低呈剂量依赖性(P<0.05)。见表2。
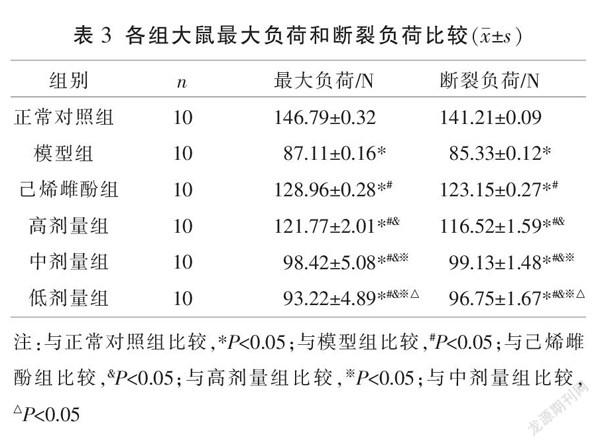
2.4 各组大鼠最大负荷和断裂负荷比较
与正常对照组比较,模型组最大負荷及断裂负荷降低(P<0.05);与模型组比较,高、中、低剂量组和己烯雌酚组最大负荷及断裂负荷升高(P<0.05);与己烯雌酚组比较,高、中、低剂量组最大负荷及断裂负荷降低(P<0.05);高、中、低剂量组最大负荷和断裂负荷降低呈剂量依赖性(P<0.05)。见表3。
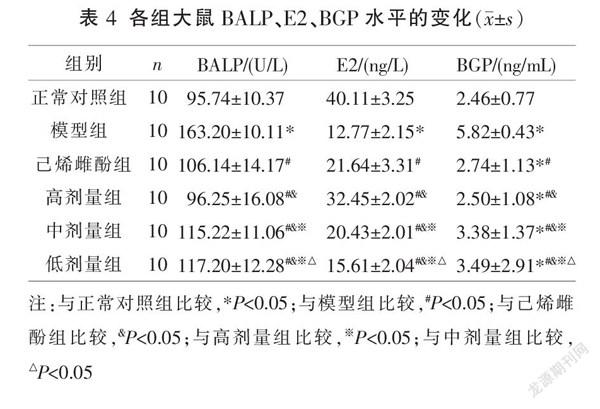
2.5 各组大鼠BALP、E2和BGP水平比较
与正常对照组比较,模型组BALP和BGP水平升高,E2水平明显降低(P<0.05);与模型组相比,高、中、低剂量组和己烯雌酚组BALP和BGP水平降低,E2水平升高(P<0.05);与己烯雌酚组相比较,高剂量组BALP、BGP降低,E2水平升高;中、低剂量组BALP、BGP升高,E2水平降低(P<0.05);高、中、低剂量组BALP、E2和BGP水平表达呈剂量依赖性(P<0.05)。见表4。
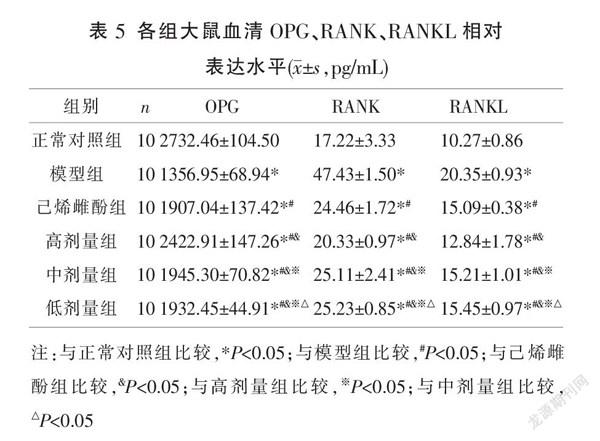
2.6 各组大鼠血清OPG、RANK、RANKL相对表达水平比较
与正常对照组比较,模型组OPG降低,RANK、RANKL含量升高(P<0.05);与模型组比较,高、中、低剂量组和己烯雌酚组OPG升高,RANK、RANKL降低(P<0.05);与己烯雌酚组比较,高剂量组OPG升高,RANK、RANKL降低,中、低剂量组OPG、RANK、RANKL升高(P<0.05);高、中、低剂量组OPG、RANK、RANKL水平升高呈剂量依赖性(P<0.05)。见表5。
2.7 各组大鼠TRPV6相对表达水平比较
与正常对照组比较,模型组TRPV6明显下降(P<0.05);与模型组比较,高、中、低剂量组和己烯雌酚组TRPV6升高(P<0.05);与己烯雌酚组比较,高剂量组TRPV6升高,中、低剂量组降低(P<0.05);高、中、低剂量组TRPV6相对表达水平降低呈剂量依赖性(P<0.05)。见表6、图2。
3 讨论
随着我国进入老年化社会,OP发病率逐年上升,且以绝经后妇女最为多见,是我国老年女性最为常见的全身骨代谢性疾病[9]。女性绝经后由于雌激素水平降低、成骨细胞与破骨细胞偶联失衡而出现的以腰背痛、短缩畸形、脊柱关节退变甚至脆性骨折为主要表现的一种骨代谢紊乱的疾病,对我国中老年妇女的身体健康及生活质量产生了极大的威胁,因此,充分认识PMOP并了解其发病机制,在此基础上进行对症治疗,研究并发现抗OP效验方具有重要的社会及科研价值。
骨生物力学反应的是骨质微结构的变化以及骨量的综合反应,是多种微量元素代谢的正常与紊乱的表现,骨组织处在吸收和形成平衡状态,平衡被打破时骨生物力学就会发生改变。骨代谢异常导致骨量丢失,正常结构布局的合理性遭到了破坏,骨干强度降低,更加容易发生骨折,测量的载荷值反映了骨强度,在一定程度上反映了骨代谢的变化。BMD是骨质量的一个重要标志,与骨骼强度和内环境稳定密切相关,是反映OP程度,预测骨折危险性的重要依据[10]。BALP与成骨细胞代谢活性有关,在骨组织重建过程时,BALP的活性会相应增高[11]。有报道称,血浆骨特异性碱性磷酸酶可作为成骨细胞活性指标,并认为骨特异性碱性磷酸酶作为骨代谢指标比碱性磷酸酶更灵敏[12]。TRPV6是瞬时性受体电位通道超家族主要成员,高选择性钙离子通道主要存在于人体中具有钙离子跨膜转运功能的器官组织[13],而E2是雌激素之一,也是卵巢分泌的主要性激素之一,E2、BALP、BGP等多种因素对钙离子代谢产生影响有可能是通过TRPV6通路影响到骨代谢过程中的骨细胞分化-形成-吸收-破坏等环节,然后通过钙离子通道的调控直接影响骨的代谢[14-16]。有研究表明,在人成骨细胞中存在TRPV6 mRNA,敲除鼠的TRPV6会导致股骨BMD下降,发生OP[17-18]。因此,通过调节TRPV6钙离子通道的状态,进而改变成骨细胞、破骨细胞的增殖分化行为,最终改善机体骨代谢状况,可能是临床治疗OP等骨代谢疾病的新探索[19]。OPG/RANKL/RANK系统在骨代谢过程中起着至关重要的作用,其可以促进破骨细胞的分化及骨吸收活性[20]。成骨细胞及骨髓基质细胞分泌表达OPG可与RANKL竞争性结合,从而阻断RANKL与RANK之间的相互作用[21]。OPG作为一种可溶性的分泌型糖蛋白起到抑制骨吸收的作用,而RANK作为一种跨膜蛋白,诱导破骨细胞分化增殖,与RANKL结合后成为一种强促破骨细胞分化成熟剂,推动体内骨吸收[22-23]。
在本次研究中,与正常对照组相比,模型大鼠的BALP、BGP、RANK、RANKL水平明显升高,E2、BMD、OPG、TRPV6均明显降低。与模型组相比,高、中、低剂量组BALP、BGP、RANK、RANKL、最大负荷、断裂负荷水平降低,E2、BMD、OPG、TRPV6、最大负荷、断裂负荷水平显著升高。高、中、低剂量组和己烯雌酚组大鼠体质量增加明显,模型组骨小梁形态模糊、广泛断裂,骨髓腔增宽,骨细胞排列散乱;高、中、低剂量组和己烯雌酚组均可见骨小梁形态较模型组改善、结构较为紧密,骨髓腔减小,骨外膜排列改善。
综上,本研究通过对成熟可靠的指标研究确认金刚丸对OP骨代谢的作用。结果表明,金刚丸可能通过提高PMOP模型大鼠雌激素水平,调节骨代谢,提高生物力学性能和BMD,达到抗OP的疗效和骨保护作用,其机制可能是通过影响TRPV6表达上调OPG表达,下调RANKL表达。但具体的分子机制还未完全探索清楚,特别是TRPV6是否在骨代谢中起到关键作用,需要进一步的深入研究。
参考文献
[1] 中华中医药学会.绝经后骨质疏松症(骨痿)中医药诊疗指南(2019年版)[J].中医正骨,2020,32(2):1-13.
[2] 张昌攀,陈 凯,陈海鹏.中西医药物治疗原发性骨质疏松症研究进展[J].中医药临床杂志,2018,30(1):171-175.
[3] 陈 沙,王桂云,刘平安,等.雌性大鼠手术去势骨质疏松症模型建立及评价[J].湖南中医药大学学报,2020,40(11):1315-1319.
[4] MIGNOT M A, TAISNE N, LEGROUX I, et al. Bisphosphonate drug holidays in postmenopausal osteoporosis:effect on clinical fracture risk[J]. Osteoporosis International, 2017, 28(12): 3431-3438.
[5] MIYAUCHI A, DINAVAHI R V, CRITTENDEN D B, et al.. Increased bone mineral density for 1 year of romosozumab, vs placebo, followed by 2 years of denosumab in the Japanesesubgroup of the pivotal FRAME trial andextension[J]. Arch Osteoporos, 2019, 14(1): 59.
[6] 智 信,陈 晓,苏佳灿.绝经后骨质疏松症发病机制研究进展[J].中国骨质疏松杂志,2018,24(11):1510-1513,1534.
[7] 匡建军,张信诚,武 昌,等.超微金刚治疗绝经后骨质疏松症60例[J].中医伤科,2011,27(4):40-42.
[8] 戎 寬,胡余飞,蔡 萍,等.超微金刚对去势大鼠骨密度的影响的实验研究[J].中医药导报,2014,20(5):91-93.
[9] WEAVER C M, GORDON C M, JANZ K F, et al. The National Osteoporosis Foundation's position statement on peak bone mass
development and lifestyle factors: a systematic review and implementation recommendations[J]. Osteoporos International 2016, 27(4): 1281-1386.
[10] 张紫铭.虎潜丸对去卵巢大鼠骨质疏松模型骨密度及转化生长因子-β2表达的影响[D].长沙:湖南中医药大学,2014.
[11] 岳海振,蔡 军,马新强,等.葛根素对绝经后骨质疏松大鼠骨代谢、骨密度及骨生物力学的影响[J].中国骨质疏松杂志,2021,27(1):77-78.
[12] 高卫辉,向艳华,刘 云,等.中药杜仲-牛膝配伍对去卵巢大鼠骨质疏松症的干预实验研究[J].湖南中医药大学学报,2016,36(6):43-46.
[13] HOENDEROP J G, NILIUS B, BINDELS R J. Molecular mechanism
of active Ca2+ reabsorption in the distal nephron[J]. Annual Review of Physiology, 2002, 64: 529-549.
[14] 柳辰玥.基于AGEs/RAGE/Nox4/NF-κB和TRPV6/CaBP-28k/VDR通路探讨桑叶对DOP大鼠作用机制[D].北京:北京中医药大学,2018.
[15] 张国民.壮骨止痛方醇提A部位对去势雌鼠骨质疏松症雌激素相关因子的调节作用[D].长沙:湖南中医药大学,2011.
[16] 连 娟,刘佳贤,暴雪丽,等.黄瓜籽复合物对去势大鼠骨质疏松症的影响[J].湖南中医药大学学报,2021,41(4):523-527.
[17] 马 骏.钙离子通道蛋白TRPV6对小鼠骨代谢和破骨细胞形成的调控作用及其机制研究[D].上海:中国人民解放军海军军医大学,2019.
[18] 李绍烁,赵京涛,何昌强,等.山茱萸总甙干预骨质疏松模型大鼠骨代谢:TRPV6、TRPV5通路的变化[J].中国组织工程研究,2019,23(11):1749-1754.
[19] 王延涛,杨智华,陈 怡,等.肉苁蓉治疗骨质疏松作用机制的网络药理学研究[J].中国药房,2019,30(5):645-651.
[20] 黄 刚,罗海恩,苏新平,等.止痛健骨方对原发性骨质疏松症患者骨密度及OPG、RANKL的影响及疗效观察[J].湖南中医药大学学报,2020,40(12):1544-1547.
[21] 向 益,郑 烽,王 显.基于OPG/RANKL/RANK通路探讨单味中药治疗骨质疏松的研究进展[J].中国中医骨伤科杂志,2019,27(2):86-88.
[22] VAN DAM P A, VERHOEVEN Y, TRINH X B, et al. RANK/RANKL signaling inhibition may improve the effectiveness of checkpoint blockade in cancer treatment[J]. Critical Reviews in Oncology/Hematology, 2019, 133: 85-91.
[23] 王梦蝶,吴 虹,王荣慧,等.RANKL介导的诱导破骨细胞分化的相关经典信号通路研究进展[J].中国药理学通报,2020,36(7):898-902.
