口腔癌细胞通过传递性内质网应激影响胰岛β细胞功能的初探
2022-02-14李若焓黄颖昭廖乃麟吴沉洲李一
李若焓 黄颖昭 廖乃麟 吴沉洲 李一
口腔疾病研究国家重点实验室 国家口腔疾病临床医学研究中心 四川大学华西口腔医院头颈肿瘤外科,成都610041
内质网是蛋白合成的重要细胞器,参与蛋白的生产、折叠、修饰、成熟、质量控制和降解[1-2]。内质网与蛋白质稳定的维持密切相关,当内质网稳态被各种干扰破坏时,就会触发一种称为“内质网应激(endoplasmic reticulum stress,ERS)”的细胞状态。
为了克服应激并恢复蛋白质稳定,ERS会激活未折叠蛋白反应(unfolded protein response,UPR)[3]。UPR可以减少蛋白质合成,增强内质网蛋白质折叠能力,降解错误折叠或未折叠的蛋白质[4]。如果UPR不能协助细胞摆脱应激,那么UPR信号会从促生存转为促死亡[5-8]。普遍认为癌症可导致ERS及UPR信号通路的激活[9-11]。ERS对癌症的发生、发展有双向调控作用:如能及时解决ERS,UPR将有利于癌细胞的生存、转移、血管生成和耐药性的提高;如果内质网中错误折叠或未折叠的蛋白质大量积累,超过了内质网的自我调节能力,将激活ERS下游凋亡通路,诱导细胞凋亡[12]。
ERS除了直接影响癌细胞外,还参与细胞之间的交流。2011年,Mahadevan等[13]首次报道了前列腺癌细胞在ERS状态下会释放某些“可溶性的因子”,诱导骨髓来源的髓系细胞也出现ERS,这种细胞间的ERS传递现象称为传递性内质网应 激(transmissible endoplasmic reticulum stress,TERS)。
研究[14-16]发现,ERS状态的胰岛β细胞会引发多种反应,这些反应包括细胞凋亡、细胞功能受损、胰岛素分泌障碍等。目前许多研究认为,口腔癌对患者身体的损害不仅仅是由于癌症对进食器官的毁损,还由于包括胰岛功能下降等在内的诸多代谢紊乱,这些破坏对口腔癌患者的生活质量和预后造成了较大的负面影响。本研究的目的是为探究口腔癌细胞是否通过TERS影响了胰岛β细胞的功能。
1 材料和方法
1.1 实验材料
人口腔鳞癌细胞系CAL-27、SCC-25,小鼠胰岛素瘤6细胞系的MIN6细胞(四川大学口腔疾病研究国家重点实验室提供),达尔伯克改良伊格尔(Dulbecco’s modified eagle medium,DMEM)培养基,DMEM/F-12培养基,洛斯维·帕克纪念研究所-1640(Roswell Park Memorial Institute-1640,RPMI-1640)培养基,胎牛血清(fetal bovine se‐rum,FBS),0.25%胰蛋白酶(Gibco公司,美国),磷酸缓冲盐溶液(phosphate buffer saline,PBS)(武汉赛维尔生物科技有限公司),衣霉素(tunicamycin,TM)(北京市华中海威基因科技有限公司),RNA提取试剂(Trizol试剂)(TAKARA公司,日本),逆转录试剂盒(Thermo Fisher Sci‐entific公司,美国),实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction,qPCR)扩增试剂盒(Bimake公司,美国),甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate de‐hydrogenase,GAPDH)、β-肌动蛋白(β-actin)、结合免疫球蛋白(binding immunoglobulin protein,BiP)、剪切型X-盒结合蛋白1(spliced form of Xbox binding protein 1,XBP1S)、CAAT区/增强子结合蛋白同源蛋白(C/EBP-Homologous Protein,CHOP)、胰岛素(insulin,INS)-1、INS-2的qP‐CR引物(上海市生工生物工程股份有限公司),兔抗BiP抗体,兔抗微管蛋白(tubulin,TUB)抗体(杭州华安生物技术有限公司),鼠抗INS单克隆抗体(Sigma-Aidrich公司,美国),抗兔二抗、抗鼠二抗(SAB公司,美国),脱氧核苷酸末端转移酶介导的脱氧尿苷三磷酸缺口末端标记(TdTmediated dUTPnick-end labeling,TUNEL)细胞凋亡检测试剂盒,二喹啉甲酸(Bicinchoninic acid,BCA)蛋白浓度测定试剂盒(上海碧云天生物技术有限公司),小鼠INS酶联免疫吸附测定(enzyme linked immunosorbentassay,ELISA)试剂盒,小鼠C肽ELISA试剂盒(上海茁彩生物科技有限公司)。
1.2 细胞培养
CAL-27细胞用含10%FBS的DMEM培养基,SCC-25细胞用含10%FBS的DMEM/F-12培养基,MIN6细胞用含10%FBS的RPMI-1640培养基,置于37℃、5%CO2的培养箱培养。细胞传代时用0.25%胰蛋白酶消化贴壁细胞,用相应的培养基终止消化并离心,重悬后接种于培养瓶中。
1.3 诱导口腔癌细胞ERS
1.3.1 诱导口腔癌细胞CAL-27产生ERS用TM(2μg·mL-1)作为ERS应激剂,持续刺激组使用TM持续处理3、6、17、24 h后收样;间歇刺激组加入TM处理2 h,PBS清洗3次确保无TM残留后,换成正常培养基,继续培养1、4、15、22 h后,0.25%胰蛋白酶消化贴壁细胞,收样。
1.3.2 诱导口腔癌细胞SCC-25产生ERS 用TM(2μg·mL-1)作为ERS应激剂,持续刺激组使用TM持续处理3、6、24 h后收样,间歇刺激组加入TM处理2 h,PBS清洗3次确保无TM残留后,换成正常培养基,继续培养1、4、22 h后,0.25%胰蛋白酶消化贴壁细胞,收样。
1.4 诱导MIN6细胞ERS
用TM(2μg·mL-1)作为ERS应激剂,MIN6细胞使用TM持续处理3、6、17、24 h后,0.25%胰蛋白酶消化贴壁细胞,收样。
1.5 制作条件培养基
加入0.2%二甲基亚砜(dimethyl sulfoxide,DMSO)或2μg·mL-1TM处理口腔癌细胞2 h后,PBS清洗3次确保无DMSO或TM残留后,换成正常培养基,继续培养12 h后,收集上清液,离心(1 000 r·min-1,5 min)、过滤(0.22μm孔径),去除杂质及细胞碎片。收集的条件培养基分别称为对照条件培养基(control conditional medium,CCM)、介导TERS效应的条件培养基(TERSconditional medium,TCM)。SCC-25细胞的CCM、TCM称为CCM25、TCM25,CAL-27细胞的CCM、TCM称为CCM27,TCM27。
1.6 TERS实验
MIN6细胞以60万/孔密度铺于6孔板中。使用DMSO(0.2%,阴性对照)、TM(2μg·mL-1,阳性对照)、CCM25、TCM25、CCM27、TCM27处理MIN6细胞24 h、48 h后,0.25%胰蛋白酶消化贴壁细胞,收样。
1.7 qPCR检测
用Trizol法提取细胞总RNA,溶于无酶水中,用紫外分光光度计进行浓度和纯度的检测。取10μL总RNA,用逆转录试剂盒逆转录为互补脱氧核糖核酸(complementary deoxyribonucleic acid,cDNA),用qPCR扩增试剂盒进行扩增。使用GAPDH作为CAL-27、SCC-25细胞的内参,使用β-actin作为MIN6细胞的内参。反应体系为10μL:5μL qPCR预混液,0.5μL上游引物,0.5μL下游引物,4μL cDNA。设置3个复孔,反应条件为:预变性95℃3 min,95℃5 s,55℃30 s,72℃30 s,40个循环。用2-ΔΔCT统计学方法计算目的基因相对表达量。相关引物序列见表1。

表1 引物序列Tab 1 Primer sequence
1.8 WB检测
用蛋白裂解液提取细胞总蛋白,在蛋白液中加入蛋白上样缓冲液,99℃、1 400 r·min-1、5 min进行变性。样品进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳后转膜,用5%牛血清白蛋白溶液室温封闭30 min,洗涤缓冲液清洗。孵育一抗:抗TUB(1∶5 000),抗BiP(1∶1 000),抗INS(1∶500),4℃过夜。洗涤缓冲液洗涤3次,每次为20 min。室温孵育二抗1 h。增强化学发光显影,并进行灰度分析,“目的蛋白/内参蛋白”表示。
1.9 MIN6细胞的细胞凋亡实验
MIN6细胞以2万/孔密度铺于96孔板中。使用DMSO(0.2%,阴性对照)、TM(2μg·mL-1,阳性对照)、CCM27、TCM27处理MIN6细胞24 h。PBS洗涤一次,加入免疫染色固定液固定细胞30 min。PBS洗涤一次,加入免疫染色强力通透液,室温孵育5 min。PBS洗涤2次,加入TUNEL检测液染凋亡细胞,37℃避光孵育60 min。PBS洗涤3次,加入4’,6-联脒-2’-苯基吲哚(4’,6-di‐amidino-2’-phenylindole,DAPI)染色液染所有细胞的细胞核,室温孵育5 min。PBS洗涤3次,加入抗荧光淬灭封片液,在荧光显微镜下观察。于200倍倒置荧光显微镜下,计数6个视野中凋亡细胞数和总细胞数,取均值,计算细胞凋亡率:细胞凋亡率=凋亡细胞数/总细胞数×100%。
1.10 MIN6细胞的克隆形成实验
MIN6细胞以500个/孔密度铺于12孔板中。使用DMSO(0.2%,阴性对照)、TM(2μg·mL-1,阳性对照)、CCM25、TCM25、CCM27、TCM27处理MIN6细胞24 h后,使用正常培养基继续培养7 d后吸弃上清,用4%多聚甲醛室温固定10 min,再加入结晶紫染色,10 min后用PBS洗涤2次,拍照记录实验结果并计算每孔中的细胞群落数,克隆形成率=(克隆数/接种细胞数)×100%。
1.11 MIN6细胞的分泌功能实验
1.11.1 葡萄糖刺激胰岛素分泌(glucose-stimulat‐ed insulin secretion,GSIS)实验 MIN6细胞以60万/孔密度铺于6孔板中。使用DMSO(0.2%,阴性对照)、TM(2μg·mL-1,阳性对照)、CCM27、TCM27处理MIN6细胞24 h后,用克雷布斯林格缓冲液(Krebs-Ringer Buffer,KRB)洗涤2次,并在KRB缓冲液中培养1 h后,一组换液成含3.3 mmol·L-1葡萄糖的培养基,另一组换液成含16.7 mmol·L-1葡萄糖的培养基。继续培养1 h后,收集细胞及上清液,用小鼠INSELISA试剂盒检测细胞内及上清液中的INS含量,MIN6细胞的INS分泌量采用“上清液INS浓度/细胞内INS浓度”表示。
1.11.2 葡萄糖刺激C肽分泌实验 MIN6细胞以60万/孔密度铺于6孔板中。使用DMSO(0.2%,阴性对照)、TM(2μg·mL-1,阳性对照)、CCM27、TCM27处理MIN6细胞24 h后,用KRB缓冲液洗涤2次,并在KRB缓冲液中培养1 h后,一组换液成含3.3 mmol·L-1葡萄糖的培养基,另一组换液成含16.7 mmol·L-1葡萄糖的培养基。继续培养1 h后,收集细胞及上清液,用BCA试剂盒检测细胞总蛋白含量,用小鼠C肽ELISA试剂盒检测上清液中的C肽含量,MIN6细胞的C肽分泌量采用“上清液C肽浓度/总蛋白”表示。
1.12 统计学分析
采用Graphpad Prism 8软件对实验结果进行统计分析,两组之间比较使用t检验,多组之间比较使用方差分析,P<0.05表示差异具有统计学意义。
2 结果
2.1 诱导口腔癌细胞ERS实验结果
在CAL-27细胞中,ERS标志物BiP在持续刺激组和间歇刺激组中4个时间点的mRNA相对表达量及蛋白表达量均高于0 h(图1 A、D、E),ERS标志物XBP1S、CHOP的mRNA相对表达量在持续刺激组的3 h和间歇刺激组的3 h+均高于0 h(图1B、C),BiP、XBP1S、CHOP的mRNA相对表达量及BiP的蛋白表达量在持续刺激组和间歇刺激组组间同时间点比较的差异无统计学意义(图1)。

图1 CAL-27细胞的ERS标志物表达Fig 1 Expression of ERSmarkers in CAL-27 cells
在SCC-25细胞中,BiP、XBP1S、CHOP在持续刺激组和间歇刺激组中3个时间点的mRNA相对表达量均高于0 h,持续刺激组和间歇刺激组组间同时间点比较的差异无统计学意义(图2)。

图2 SCC-25细胞的ERS标志物表达Fig 2 Expression of ERSmarkers in SCC-25 cells
2.2 诱导MIN6细胞ERS实验结果
3、6、17 、24 h的BiP、XBP1S、CHOP的mRNA相对表达量高于0 h(图3A~C),3、6、17、24 h的BiP的蛋白表达量高于0 h(图3D、E)。

图3 MIN6细胞的ERS标志物表达Fig 3 Expression of ERSmarkers in MIN6 cells
2.3 MIN6细胞的细胞凋亡实验结果
TM组相较0组、TCM27组相较CCM27组,镜下见MIN6细胞的细胞凋亡比例增加(图4),细胞凋亡率增加(图5)。

图4 MIN6细胞TUNEL染色结果 倒置荧光显微镜 ×200Fig 4 TUNEL staining of MIN6 cells inverted fluorescence microscope ×200
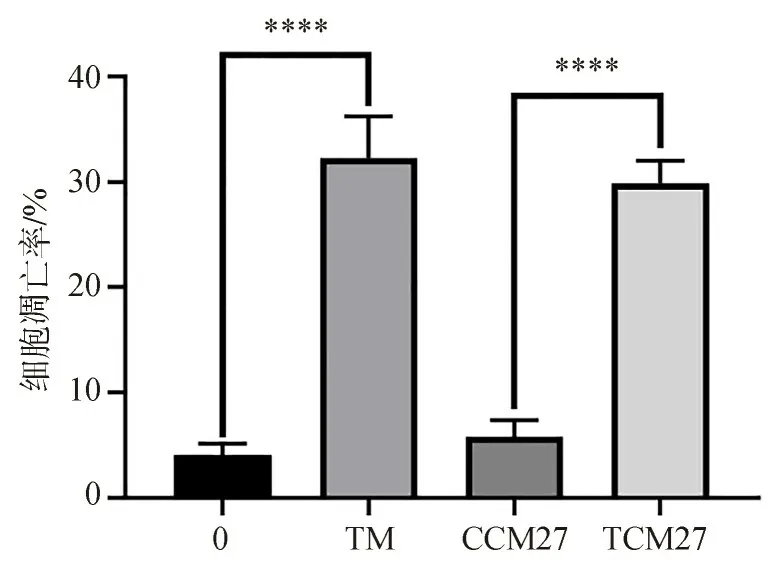
图5 MIN6细胞凋亡率Fig 5 Apoptosis rateof MIN6 cells
2.4 MIN6细胞的克隆形成实验结果
TM组相较0组、TCM25组相较CCM25组、TCM27组相较CCM27组,MIN6细胞克隆形成的群落数减少,克隆形成率降低(图6)。
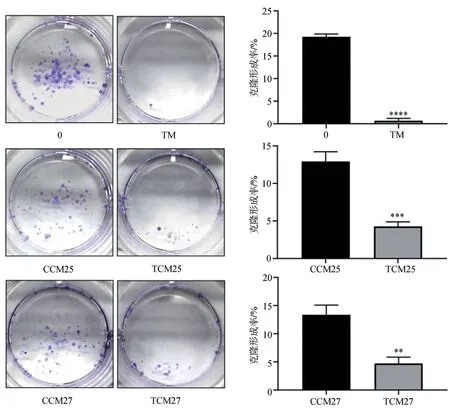
图6 MIN6细胞的克隆形成能力Fig 6 Colony formation ability of MIN6 cells
2.5 TERS实验结果
TM组相较0组、TCM25组相较CCM25组、TCM27组相较CCM27组,BiP、XBP1S的mRNA相对表达量上调(图7A~D),BiP的蛋白表达量上调(图7E~H)。

图7 MIN6细胞的ERS标志物表达Fig 7 Expression of ERSmarkersin MIN6 cells
TM组相较0组、TCM25组相较CCM25组、TCM27组相较CCM27组,INS的蛋白表达量下调(图8A~D),INS的mRNA相对表达量上调(图8 E~H)。
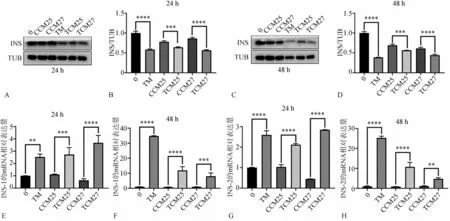
图8 MIN6细胞的INS表达Fig 8 Expression of INSin MIN6 cells
2.6 MIN6细胞的分泌功能实验结果
2.6.1 GSIS实验结果 在3.3、16.7 mmol·L-1两种浓度的葡萄糖刺激下,TM组相较0组、TCM27组相较CCM27组,INS分泌量降低(图9)。

图9 MIN6细胞的INS分泌量Fig 9 INSSecretion in MIN6 cells
2.6.2 葡萄糖刺激C肽分泌的实验结果 在3.3、16.7 mmol·L-1两种浓度的葡萄糖刺激下,TM组相较0组、TCM27组相较CCM27组,C肽分泌量降低(图10)。

图10 MIN6细胞的C肽分泌量Fig 10 C-peptide Secretion in MIN6 cells
3 讨论
TM可以阻断N-连接糖基化,从而影响真核细胞糖蛋白的折叠,产生ERS,激活UPR,是ERS常用应激剂之一。UPR的激活是因为内质网中累积的错误折叠或未折叠蛋白质竞争性地与BiP结合,3种ERS感受器(蛋白激酶RNA样内质网激酶、肌醇需要酶1、激活转录因子6)与BiP解离并激活[17-18],启动下游3个主要信号通路(蛋白激酶RNA样内质网激酶/真核起始因子2α、肌醇需要酶1/x-盒结合蛋白1、激活转录因子6)[19]。通过查阅文献[20]确定TM处理细胞的浓度范围,进行预实验。预实验中,不同浓度的TM分别处理CAL-27、SCC-25、MIN6细胞,镜下观察细胞状态,并通过qPCR检测ERS标志物的表达。预实验发现TM浓度在2μg·mL-1时,镜下细胞未有大面积漂浮现象,并通过qPCR检测ERS标志物明显上调,确定了本研究TM浓度为2μg·mL-1。
在诱导CAL-27细胞ERS实验中,发现ERS标志物的表达在持续刺激组和间歇刺激组组间同时间点比较的差异无统计学意义。表明对CAL-27细胞施加TM刺激2 h后撤除TM,与持续施加TM刺激,两种刺激方式的ERS效应无明显差别。在诱导SCC-25细胞ERS实验中,选择与诱导CAL-27细胞ERS实验相同的TM刺激时长2 h,发现ERS标志物的表达在持续刺激组和间歇刺激组组间同时间点比较的差异无统计学意义,可得出与CAL-27细胞相同的结论,意味着可收集TM刺激2 h后不含TM的口腔癌细胞条件培养基供后续实验。诱导MIN6细胞ERS实验发现,MIN6细胞可以产生ERS现象。
TERS实验发现,ERS的口腔癌细胞可将ERS传递给MIN6细胞,TERS导致MIN6细胞的胰岛素合成减少,在翻译水平抑制胰岛素的合成。MIN6细胞的细胞凋亡实验发现,TERS的MIN6细胞凋亡现象增加。MIN6细胞的克隆形成实验发现,TERS的MIN6细胞增殖能力下降,这可能意味着TERS的胰岛β细胞存活能力下降。MIN6细胞的分泌功能实验发现,MIN6细胞的分泌功能下降。
在TERS实验和MIN6细胞的分泌功能实验中,MIN6细胞的胰岛素合成在转录水平上调,在翻译水平下调,胰岛素分泌下调,这三者结果出现矛盾。内质网是加工分泌性蛋白质的主要场所,ERS引起了蛋白质分泌的变化;内质网和核糖体偶联密切,是具有翻译功能的机器,ERS抑制了蛋白质的合成,导致细胞内胰岛素的减少;转录水平胰岛素上调的现象,可能原因是ERS状态下的胰岛β细胞尝试自我修复,加强负荷,代偿性地在转录水平合成更多胰岛素,具体机制尚不清楚,有待进一步的研究。
有研究表明,癌症恶病质能降低参与胰岛素分泌的相关胰岛蛋白的表达。Violato等[21]研究发现,与对照组小鼠相比,在皮下接种实体艾氏肿瘤细胞的小鼠中,参与胰岛素分泌不同通路的关键蛋白在胰腺中表达明显减少。也有研究[22]表明,恶性肿瘤能抑制胰岛素的分泌,与对照组相比,Walker 256荷瘤大鼠的胰岛在受到葡萄糖刺激时,胰岛素分泌减少。ERS可导致胰岛β细胞衰竭,表现为胰岛素分泌的丧失和因凋亡导致的胰岛β细胞数量下降[23-24]。
关于是何种介质导致TERS现象的发生,有研究表明产生TERS现象的介质可能与外泌体有关。Javeed等[14]发现,胰腺癌将富含肾上腺髓质素的外泌体释放到血液中,胰岛β细胞摄入此类外泌体后会出现ERS,导致胰岛素分泌障碍、胰岛功能受损。本实验初步探究了口腔癌细胞通过TERS对胰岛β细胞功能的影响,为TERS的机制研究打下基础,有一定临床研究价值,在为口腔癌患者提供有效的治疗策略以提高患者预后方面有一定的临床意义。
本实验存在一定的局限性。首先由于没有公认的小鼠口腔鳞状细胞癌细胞系和人的胰岛β细胞系的限制,本实验使用了人的口腔鳞状细胞癌细胞系的CAL-27、SCC-25细胞和小鼠胰岛素瘤6细胞系的MIN6细胞。MIN6细胞与胰岛β细胞有共同的形态生理特征,当受到刺激时,它们会分泌胰岛素并表达特定的UPR标志物,因此被广泛用于研究[25]。前期研究发现,ERS的CAL-27、SCC-25细胞分别与相应同种细胞培养,后者能产生ERS;本实验研究发现,ERS的CAL-27、SCC-25细胞上清加入MIN6细胞,后者也能产生ERS,这在一定程度上体现了TERS现象物种的保守性。其次,本实验研究均为体外实验,未进行体内实验,实验结果证据较弱,未来可通过对小鼠定期注射TM、TCM、CCM,记录小鼠的体重、血糖、血清胰岛素变化,以及用免疫组化法检测ERS标志物和胰岛素表达情况等实验方法,进行进一步的研究。
综上所述,本实验发现了口腔癌细胞可通过TERS引起胰岛β细胞应激,导致其凋亡增加,存活能力下降,合成及分泌胰岛素能力下降,在研究口腔癌症恶病质对胰岛β细胞功能障碍中有一定的意义。
利益冲突声明:作者声明本文无利益冲突。
