葡萄籽原花青素对牙龈上皮细胞炎症介质表达的影响
2022-02-14张秀娟吴伟陈欣房芷纯叶金香欧晓艳
张秀娟 吴伟 陈欣 房芷纯 叶金香 欧晓艳
南昌大学附属口腔医院·江西省口腔生物医学重点实验室,南昌330006
牙周炎(periodontitis)是一种复杂的慢性炎症感染性疾病[1]。牙菌斑生物膜被认为是牙周炎发病的始动因子,主要毒力因子为牙龈卟啉单胞菌脂多糖(lipopolysaccharide,LPS)[2]。在牙周炎的发生发展过程中,牙菌斑首先导致牙龈的炎症反应。细胞因子介导的宿主免疫反应在牙周组织的破坏和发展中发挥着重要的作用[3]。其最具代表性的促炎细胞因子是肿瘤坏死因子(tumor necro‐sis factor,TNF)-α、白介素(interleukin,IL)-1β及IL-6。而IL-4、IL-10为强有力的抗炎细胞因子。在众多的抗炎细胞因子中,转化生长因子(transforming growth factor,TGF)-β和IL-10是控制免疫反应的关键因素[4]。
葡萄籽原花青素(grape seed proanthocyani‐dins,GSPs)是从葡萄籽中提取,属于多酚类物质,具有很强的生物活性,能清除自由基,是天然的抗氧化剂,同时还具有较低的毒性[5-6]。GSPs广泛应用于食品、医药、化妆品等领域。在预防或减缓疾病发生的同时,还能提高机体免疫力,预防心血管疾病,在糖尿病[7-8]和全身炎症性疾病等领域的应用已有报道[9-10]。
本课题组前期通过检测GSPs对牙龈卟啉单胞菌的最低抑菌浓度并采用鲎试验测定GSPs对牙龈卟啉单胞菌产生LPS及生物膜的影响,发现GSPs对牙周致病菌分泌的内毒素有抑制作用,同时对生物膜有破坏作用[11-12];后期采用结扎大鼠第一磨牙并给予LPS刺激建立牙周炎模型,通过机械治疗联合GSPs的对照研究发现GSPs有助于改善牙周组织炎症及牙槽骨吸收程度、促进牙槽骨改建[13]。本研究假设GSPs对牙龈上皮细胞炎症有预防作用并从促炎细胞因子TNF-α、IL-1β、IL-6和抗炎细胞因子IL-4、IL-10及TGF-β入手,研究GSPs对炎症反应中细胞因子表达的影响以进一步揭示GSPs预防牙周炎的作用机制。
1 材料和方法
1.1 药品和试剂
人牙龈上皮细胞(human gingival epithelial cells,HGECs)(上海佰晔生物科技中心),GSPs(天津尖峰天然产物有限公司),LPS(Sigma公司,美国),DMEM培养基(Gibco公司,美国),青链霉素双抗、胰蛋白酶-乙二胺四乙酸(ethylene di‐amine tetraacetic acid,EDTA)消化液(苏州新赛美生物科技有限公司),胎牛血清、PBS(CellMax公司,澳大利亚),CCK-8试剂(APExBIO公司,美国),二甲基亚砜(dimethylsulfoxide,DMSO)(北京索莱宝科技有限公司),引物序列(深圳华大基因科技有限公司),TNF-α、IL-1β、IL-4、IL-6、IL-10、TGF-β酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)试剂盒(北京四正柏科技有限公司),SYBR Green试剂盒、FastKing cDNA、TRNzol试剂盒[天根生化科技(北京)有限公司]。
1.2 主要仪器
电子精密天平(Mettler Toledo公司,瑞士),倒置相差显微镜(Olympus公司,日本),台式低温冷冻高速离心机(Eppendorf公司,德国),超净工作台(ESCO公司,美国),逆转录仪(Bio-Rad公司,美国),ABIStepone Plus实时荧光定量聚合酶链反应(polymerase chain reaction,PCR)仪(ABI公司,美国),CO2培养箱、NanoDrop超微量紫外线分光光度计(Thermo Fisher公司,美国),多功能酶标仪(Tecan公司,瑞士)。
1.3 实验方法
1.3.1 细胞培养 HGECs培养于含10%胎牛血清、100 U·mL-1青霉素、100μg·mL-1链霉素的DMEM高糖培养基,5%CO2、37℃恒温培养箱中。每天更换1次培养基,每2~3 d传代1次,取生长状况良好的细胞进行实验。
1.3.2 CCK-8检测细胞增殖活性 HGECs以5×103·mL-1的密度接种至96孔板12 h后吸出培养液,PBS清洗2次后加入含有不同浓度GSPs(0、1、5、10、20、40、60、80、100μg·mL-1)的细胞培养液,作为实验组,设空白组(不含细胞),每组各设5个复孔,分别培养6、12、24、48 h后,弃液,PBS清洗2次,每孔加100µL DMEM培养基和10µL CCK-8的无血清试剂混合液,培养3 h,用酶标仪测定各组在450 nm处的吸光度(OD值),计算各组细胞增殖率。
1.3.3 ELISA法测定TNF-α、IL-1β、IL-6、IL-4、IL-10、TGF-β水平 HGECs以2×104·mL-1的密度接种于6孔板中,每孔1 mL。待细胞贴壁后,根据CCK-8实验结果进行分组。实验组:以不同浓度GSPs(10、20、40μg·mL-1)处理细胞24 h后加入1.0μg·mL-1LPS,同时设对照组(Control组,仅采用培养基培养不做任何处理)、LPS组(GSPs浓度为0μg·mL-1,培养基中加入1.0μg·mL-1LPS),孵育24 h后收集上清。具体操作按照ELISA试剂盒说明书进行,酶标仪测定吸光度OD450nm值。样品中TNF-α、IL-1β、IL-6、IL-4、IL-10、TGF-β含量,根据各自的标准曲线计算。
1.3.4 实时荧光定量PCR(quantitative real-time PCR,QRT-PCR)法 检 测TNF-α、IL-1β、IL-6、IL-4、IL-10、TGF-β的mRNA表达水平 预处理及分组同1.3.3,孵育24 h后弃液,PBS清洗2次。Trizol提取总RNA。使用逆转录试剂盒将1μg总RNA反转录成cDNA。利用引物设计软件Primer 5.0设计TNF-α、IL-1β、IL-6、IL-4、IL-10、TGFβ引物(表1)。使用ABI Stepone Plus实时荧光定量PCR仪和SYBRGreen试剂检测TNF-α、IL-1β、IL-6、IL-4、IL-10、TGF-βmRNA表达水平。cD‐NA样品反应条件为95℃、30 s,95℃15 min,60℃30 s,40个循环,循环延伸末端收集荧光信号。QRT-PCR数值的分析计算用2ΔΔCt分析。

表1 QRT-PCR所采用的引物Tab 1 Primers used QRT-PCR
1.4 统计学分析
采用SPSS 22.0软件进行统计分析。采用方差分析比较各组炎症因子表达的差异。P<0.05为差异有统计学意义。
2 结果
2.1 不同浓度GSPs对HGECs增殖的活性影响
不同浓度GSPs对HGECs增殖的活性影响结果见图1。GSPs浓度为0~40μg·mL-1时细胞增殖无明显差异,且细胞增殖活性在24 h时最高。本研究选择10μg·mL-1、20μg·mL-1、40μg·mL-1GSPs预处理细胞24 h进行后续实验。
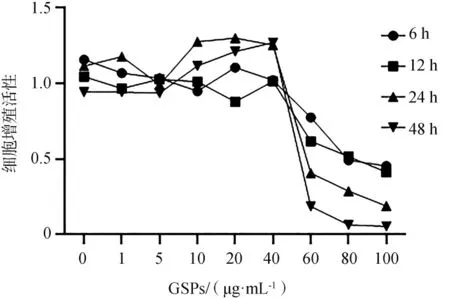
图1 不同浓度GSPs对HGECs增殖活性影响Fig 1 The effect of GSPs on the proliferation activity of HGECs
2.2 GSPs预处理对LPS诱导的炎症因子TNF-α、IL-1β、IL-4、IL-6、IL-10、TGF-β水平的影响
ELISA法检测结果(图2)显示,与对照组相比,LPS组TNF-α、IL-1β、IL-6、IL-10、TGF-β表达升高(P<0.05),IL-4表达无明显变化(P>0.05)。与LPS组相比,实验组TNF-α、IL-1β和IL-6表达降低(P<0.05),IL-4、IL-10和TGF-β表达升高(P<0.05)。
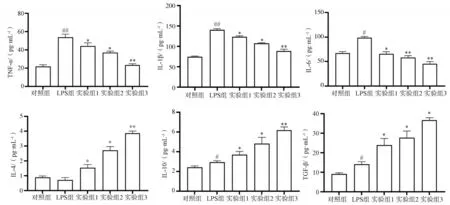
图2 不同浓度GSPs预处理对LPS诱导的炎症因子TNF-α、IL-1β、IL-4、IL-6、IL-10、TGF-β水平的影响Fig 2 The effect of pretreatment with different concentrations of GSPs on LPS-induced HGECs inflammatory factors TNF-α,IL-1β,IL-4,IL-6,IL-10 and TGF-βexpression levels
2.3 GSPs预处理对LPS诱导的炎症因子TNF-α、IL-1β、IL-4、IL-6、IL-10、TGF-βmRNA表达水平的影响
QRT-PCR法检测结果(图3)显示,与LPS组相比,实验组TNF-α、IL-1β、IL-6 mRNA表达降低(P<0.05),且随着GSPs浓度的增加依次递减;IL-4、IL-10、TGF-βmRNA表达升高(P<0.05),且随着GSPs浓度的增加依次递增。这表明,GSPs能明显抑制促炎细胞因子TNF-α、IL-1β、IL-6 mRNA表达,同时促进抗炎细胞因子IL-4、IL-10、TGF-βmRNA表达。
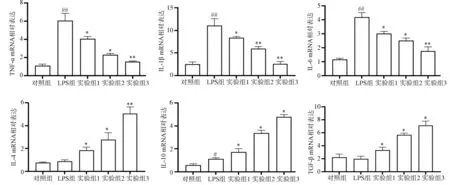
图3 不同浓度GSPs预处理对LPS诱导的炎症因子TNF-α、IL-1β、IL-4、IL-6、IL-10、TGF-βmRNA表达水平的影响Fig 3 The effect of pretreatment with different concentrations of GSPs on LPS-induced HGECs inflammatory factors TNF-α,IL-1β,IL-4,IL-6,IL-10 and TGF-βmRNA expression levels
3 讨论
牙周炎作为一种慢性炎症性疾病,与全身健康密切相关,是心脑血管疾病、糖尿病、呼吸系统和消化系统疾病的重要危险因素[14]。牙龈上皮细胞位于牙周组织表面,是宿主抵御外来病原微生物的第一道防线。除了充当物理屏障外,还能分泌多种细胞炎性因子,参与先天免疫[15]。因此,预防牙龈上皮细胞的炎症对于预防牙周炎至关重要。当牙周组织局部侵袭与宿主免疫反应失衡时,引发炎症反应,导致大量细胞因子的产生[16]。炎症反应中的细胞因子网络是错综复杂的,例如,LPS可以直接诱导牙周细胞产生TNF-α、IL-1和IL-6[17]。IL-1β和TNF-α作为促炎细胞因子还可以诱导继发性介质,例如趋化因子、基质金属蛋白酶和前列腺素E2,导致炎症反应扩展、结缔组织破坏和骨吸收[18-19]。LPS诱导的TNF-α可诱导IL-4和IL-10的合成[20]。IL-10是一种较全面地抑制人体免疫细胞合成和释放的细胞因子,可抑制促炎性细胞因子(如IL-1,IL-6和TNF-α)从单核细胞、巨噬细胞、中性粒细胞等中产生[21]。研究[22]发现,龈沟液中IL-4在治疗前较低而经基础治疗后明显上升。TGF-β对所有淋巴细胞的增殖有直接的抑制作用,同时对其他炎症细胞因子及所有的免疫密切相关细胞的功能有拮抗作用[23]。因此从细胞因子的角度预防炎症可能成为牙周炎预防的有效手段。
近年来关于GSPs的研究报道较多,很多学者将其应用于一些全身性疾病的预防研究,例如肺癌[24]、药物引起的肝脏毒性[9]、骨关炎[25]等的预防研究,由此可见GSPs对炎症有一定的预防作用。研究[10]发现,GSPs对LPS刺激的RAW264.7细胞中NO、IL-1β、IL-10、IL-6、TNF-α的炎症分子的mRNA表达有调节作用,通过抑制丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)和核因子κB(nuclear factorκB,NF-κB)信号转导途径的激活,显示出其抗炎性和免疫调节特性。Bashir等[26]研究GSPs在镉诱导的大鼠胰腺细胞氧化应激的作用发现,GSPs可通过Nrf-2/HO-1信号传导减弱氧化应激、炎症和细胞凋亡,从而预防镉诱导的大鼠氧化性胰腺炎;研究还发现镉中毒时促炎细胞因子(TNF-α,IL-1β和IFN-γ)水平升高,而GSPs治疗能够降低促炎细胞因子水平。Liu等[27]探讨了GSPs提取物在高脂饮食诱导肥胖中的作用发现,补充GSPs提取物可以显著降低血浆中炎性因子(如TNF-α,IL-6和MCP-1)的水平,由此可见GSPs能够通过多种途径调节炎性因子的表达水平。
本课题作为牙周炎天然药物预防研究的前期基础,研究结果显示GSPs浓度在0~40μg·mL-1时对HGECs增殖活性无明显影响,其低毒、安全性为后期实验提供依据。对于炎症的预防研究发现,GSPs能够抑制LPS诱导的促炎细胞因子IL-1β、IL-6、TNF-α的表达水平,同时提升抗炎细胞因子IL-4、IL-10、TGF-β的表达水平。因此,GSPs对炎性细胞因子具有调节作用,对HGECs炎症具有一定的预防作用。但本研究仅对HGECs炎症中促炎及抗炎细胞因子的表达水平进行研究,今后尚需对炎症因子的调节机制进一步研究。
利益冲突声明:作者声明本文无利益冲突。
