组氨酸激酶BaeS对溶藻弧菌毒力因子和环境应激的作用
2022-02-14李莹玉贺小贤蒋合阳曹娟娟
李莹玉, 贺小贤, 蒋合阳, 曹娟娟, 肖 苗, 芦 平, 刘 欢, 2*
(1.陕西科技大学 食品与生物工程学院, 陕西 西安 710021; 2.陕西农产品加工技术研究院, 陕西 西安 710021)
0 引言
溶藻弧菌(Vibrioalginolyticus)是海水环境中一种常见的条件致病菌.该菌为兼性厌氧菌,具有进行液体条件下游动的极生鞭毛和固体表面爬动的周生鞭毛系统,无芽孢和荚膜,最适生长温度为17 ℃~35 ℃.溶藻弧菌也是一种重要的食源性病原菌,主要分布在海洋、湖泊、河口和入海口等水体环境中,由溶藻弧菌引起的鱼体发病症状主要表现为出血症,呈现为受感染的鱼体行动变得迟缓,进食次数减少,皮肤暗淡无光,鱼鳞开始掉落,鱼体表面发生溃疡甚至出血,同时鱼体内部的腹膜、肝脏、鱼鳔以及肠壁毛细管出现充血现象.溶藻弧菌容易引起浅表伤口和耳部感染(中耳炎和外耳炎),如果人食用了被溶藻弧菌污染的海产品,会引起食物中毒、腹泻和肠胃炎等症状[1-3].为应对快速变化的环境,溶藻弧菌体内进化出了多种感染机制,包括菌落相变、生物被膜和群体感应等[4-6].这些机制通过细菌体内复杂的基因调控网络实现,而基因表达的调控包括表达过程的所有阶段,即转录、转录后、翻译以及翻译后修饰[7,8].
双组分系统(Two-component systems,TCS)是一种常见的细菌信号转导通讯模式,它们在生物体内感知和传递各种不同的输入信号,对细胞外和细胞内的环境变化进行适应性反应.在原核生物中,双组分系统通常是由一个膜结合传感器组氨酸激酶(Histitine kinase sensor,HK)和一个DNA结合响应调控元件(Responce regulator,RR)组成.当传感器激酶感知胞外信号后会发生自磷酸化,随后磷酸基团会转移至响应调控元件,使其由“非活性”转变为“活性”状态,激活后的响应调控元件通过与靶标DNA的结合影响其转录而实现对不同细胞功能的调控[9,10].TCS广泛参与调控细菌的各种生理功能,包括细胞生长繁殖、致病性、毒力因子表达、环境应激、营养获取和代谢以及抗生素耐药性等[11-15].细菌HK作为关键信号转导系统TCS的组分,已成为新型抑菌剂的潜在靶标而备受关注[16].在大肠杆菌中,BaeSR是五大细胞压力应激系统(BaeSR,CpxAR,RscBC,Psp和σE)之一,由组氨酸激酶BaeS和响应元件BaeR组成,参与多重耐药性、趋化性、鞭毛合成、六型分泌系统合成、渗透压、缺铁应激等多种生理功能的调控[17-20].而关于BaeSR在溶藻弧菌中的作用尚未见报道.本文对溶藻弧菌组氨酸激酶BaeS进行序列分析以及突变株的构建,通过对毒力因子表达以及不同环境压力下的生长分析,初步明确了BaeS对溶藻弧菌毒力、抗生素耐受性以及温度、SDS、吐温等不同环境应激的调控作用,为进一步研究BaeSR对溶藻弧菌生理功能的调控机制以及新型抑菌剂的开发奠定基础.
1 材料与方法
1.1 实验菌株、培养基及试剂
1.1.1 实验菌株
溶藻弧菌EPGS(WT),质粒pDM4,大肠杆菌DH5α,DH5αλpir,SM10λpir均为实验室保存;pDM19-T载体购于宝日医生物技术(北京)有限公司.
1.1.2 培养基及试剂
LB培养基:1%(w/v)NaCl、1%(w/v)胰蛋白胨、0.5%(w/v)酵母提取物.
LBS培养基:3%(w/v)NaCl、1%(w/v)胰蛋白胨、0.5%(w/v)酵母提取物.
固体培养基则添加1.5%(w/v)琼脂,溶藻弧菌在培养过程中添加氨苄青霉素(Ampicillin,Amp)100μg/mL,大肠杆菌则根据质粒特性添加对应的抗生素.
1.2 主要仪器与设备
Micro 17型低温高速离心机,芬兰赛默飞世尔科技有限公司;移液器,德国Eppendorf公司; WH-3型涡旋混合仪,上海沪西分析仪器厂有限公司;DSX-280B型手提式压力蒸汽灭菌锅,上海申安医疗器械厂;DK-98 II型核酸定量仪,美国Quawell;Agilent 2100型生物电泳图像分析系统,美国安捷伦;Varioskan Flash型酶标仪,芬兰赛默飞世尔科技有限公司.
1.3 实验方法
1.3.1 菌株生长条件
溶藻弧菌在LBS培养基30 ℃下培养,大肠杆菌在LB培养基37 ℃下培养,固体静置,液体则在200 rpm下震荡培养.
1.3.2 氨基酸序列比对及结构域分析
将BaeS氨基酸序列提交至Interpro(http://www.ebi.ac.uk/interpro/)进行其保守结构域的分析,同时利用Genedoc软件对不同细菌的BaeS氨基酸序列进行比对分析.
1.3.3ΔbaeS突变株的构建
根据NCBI数据库中已公布的溶藻弧菌EPGS全基因组序列,以baeS基因为模板,设计上游同源臂引物对baeSup-F/R和下游同源臂引物对baeSdown-F/R,由北京擎科生物科技有限公司合成.利用Overlap PCR构建ΔbaeS片段后与pDM4进行连接重组,并依次转化大肠杆菌DH5αλpir和SM10λpir,挑取阳性克隆株并进行菌落PCR验证,对重组克隆株进行保种.将溶藻弧菌WT与含有pDM4-ΔbaeS质粒的大肠杆菌SM10λpir供体菌分别于30 ℃和37 ℃摇床活化培养后,接种至对应的新鲜液体培养基中,培养至OD600为0.8左右,进行接合实验,通过两轮同源重组交换,筛选得到ΔbaeS突变株.
1.3.4 生长曲线的测定
将活化好的溶藻弧菌野生株WT和突变株ΔbaeS菌液浓度统一至OD600=1.0,按1%接种量分别将野生株WT和突变株ΔbaeS接种到50 mL LBS液体培养基中,同时添加100μg/mL Amp,30 ℃、200 rpm培养,每小时取样测定OD600,连续取12 h,绘制生长曲线,至少做三次独立重复实验.
1.3.5 运动性的测定
对于运动性的测定参考邓益琴等[21]的方法:将活化的菌液浓度调整至OD600=1.0,分别取2μL菌液,垂直悬空滴加到含有0.3%(软平板)和1.5%(硬平板)琼脂粉的LBS平板上,待菌液晾干后放于30 ℃恒温培养箱,硬平板倒置培养12 h,软平板正置培养9 h,取出拍照.
1.3.6 生物被膜的测定
采用结晶紫染色法测定生物被膜的形成[22],将活化后的菌液浓度稀释至相同值(OD600=1.0),用移液枪吸取30μL菌液滴加到含有10 mL LBS培养基的血清瓶中,放于30 ℃恒温培养箱,静置培养24 h,不可摇晃.轻轻地取出血清瓶,在每个血清瓶中滴入2%(w/v)结晶紫溶液,静置5 min后倒出培养液,并用纯净水缓慢地冲洗血清瓶直至流出的水呈无色状态,将血清瓶放置60 ℃干燥箱烘干,拍照保存;之后向每个血清瓶中加入1 mL 33%(v/v)冰乙酸溶解染色的生物被膜,在570 nm处测定其吸光值.每个菌株至少进行三个独立重复实验.
1.3.7 胞外蛋白酶活性测定
首先对溶藻弧菌胞外蛋白酶的活性进行定量检测,将活化后的菌液浓度统一至OD600=1.0,用移液枪各吸取1.5 mL菌液于EP管中,4 ℃,5 000 rpm离心10 min,取1 mL上清液于血清瓶,再加入1 mL PBS(pH 7.2)和0.05 g天蓝皮粉(HPA),摇匀后于37 ℃摇床200 rpm培养2 h,离心后对上清液进行600 nm处吸光度的测定.同时采用含1%(w/v)脱脂奶粉的LBS平板定性测定胞外蛋白酶活性,将活化后的菌液浓度统一至OD600=1.0,分别吸取2μL菌液滴加到1%(w/v)脱脂奶粉的LBS平板上,待菌液晾干后,倒置于30 ℃培养24 h,拍照观察透明圈大小.
1.3.8 对不同抗生素抗性实验
将过夜培养的WT和突变株ΔbaeS菌液浓度调整为OD600=1.0,用新鲜的LBS培养基对菌液梯度稀释(1、10-1、10-2、10-3、10-4),分别吸取2μL菌液平行3次滴定到各含有25μg/mL四种抗生素(氯霉素、链霉素、克林霉素和卡那霉素)的LBS固体培养基上,待菌液晾干后,于30 ℃倒置培养24 h,观察菌落形态并拍照.
1.3.9 环境应激能力实验
检测溶藻弧菌WT和突变株ΔbaeS在不同环境下的生存能力,即在LBS固体培养基中添加不同物质形成不同的环境压力,包括不同NaCl含量:3%、5%、10% NaCl(v/v);不同SDS含量:0.5%、1%、3%(w/v);不同吐温80含量:0.5%、1%、3%(w/v).步骤如下:将过夜培养的WT和突变株ΔbaeS菌液浓度调整为OD600=1.0,用新鲜的LBS培养基对菌液梯度稀释(1、10-1、10-2、10-3、10-4),分别吸取2μL菌液平行3次滴定到LBS固体培养基上,30 ℃倒置培养,观察菌落生长情况,同时进行拍照.
1.3.10 数据处理与分析
所有实验重复至少3次,每次实验设置3个平行;使用Origin9.1软件作图,显著性水平为5%.
2 结果与讨论
2.1 baeS序列分析
TCS通常由两个元件组成,即感知外界信号的受体蛋白(组氨酸激酶)和将信号转化为不同生理生化过程的响应蛋白,通常这两个蛋白由相邻近的基因编码.图1(a)为baeS基因(orf04422)在溶藻弧菌EPGS基因组中的位置,共由1 371 bp碱基组成.位于其上游的orf04421基因(666 bp)编码响应调控元件,即TCS中的RR;其上游的orf04420基因(711 bp)编码甘油磷酸二酯酶;位于baeS基因下游的orf04423基因(2 097 bp)则编码TonB依赖型的铁载体受体蛋白.可见,在溶藻弧菌中作为受体蛋白的BaeS及其响应元件是由两个相邻的基因编码的.
不同的组氨酸激酶所含有的结构域差异较大,但是通常都含有以下三个结构域,即感应区域(HK_Sensor),二聚化和组氨酸磷酸转移酶结构域(dimerization and histitine phosphotrasfer domain,DHp),以及ATP结合和催化结构域(catalysis and ATP-binding domain,CA).此外,还含有如HAMP(在histidine kinases,adenylyl cyclases,methyl-accepting proteins,phosphatases中存在的结构域),PAS,GAF等信号转导结构域[23].
利用Interpro在线分析了溶藻弧菌BaeS蛋白的结构域组成和细胞定位,结果如图1(b)和(c)所示.溶藻弧菌BaeS除了含有HK_Sensor,DHp和CA三个基本结构域外,还含有HAMP结构域.其中,244位为保守的组氨酸位点(H),在激酶状态下HK将ATP中的磷酸基团转移至该组氨酸位点,之后再转移至RR中的天冬氨酸位点,从而改变RR的转录,酶解或调控活性.通过对其结构域细胞定位分析发现,HK_sensor区域主要位于细胞周质空间,其两侧为两个跨膜区,HAMP、DHp以及CA区则位于细胞质中.此外,对不同细菌中BaeS氨基酸序列进行了比对分析,结果如图1(d)所示,BaeS在三个弧菌中保守性较高,溶藻弧菌(WP_005374264.1)与副溶血弧菌(WP_005459362.1)和哈氏弧菌(KIP66134.1)BaeS氨基酸序列的同源度分别达到82.45%和78.56%;与大肠杆菌(CAD6009838.1)和福氏志贺氏菌(AIL41268.1)BaeS氨基酸序列同源度分别为27.80%和28.16%,其中DHp结构域氨基酸组成较为保守,如组氨酸位点.

(a)baeS基因在溶藻弧菌EPGS基因组中的位置

(b)BaeS蛋白结构域分析

CM:细胞质区;TM:跨膜区;NCM:周质区(c)BaeS细胞定位分析

(d)BaeS氨基酸组成比对分析图1 BaeS基因组定位以及生物信息学分析
2.2 ΔbaeS缺失株的筛选鉴定
通过Overlap PCR获得缺失第4-279位碱基的片段,与自杀质粒pDM4进行重组后接合至溶藻弧菌野生型菌株中,对两次同源重组后的菌液进行PCR扩增,并以野生型菌株作为对照,结果如图2所示.由图可知,2号泳道的ΔbaeS突变株较1号泳道的野生株片段少约270 bp.为进一步确定敲除片段是否正确,对ΔbaeS缺失株进行基因组提取,并利用引物进行基因测序,结果发现ΔbaeS突变株第4-279位碱基缺失,表明ΔbaeS突变株成功构建.
2.3 BaeS对溶藻弧菌生长的影响
通过测定溶藻弧菌野生株WT和突变株ΔbaeS在LBS培养基中的吸光度,研究BaeS对溶藻弧菌生长的影响,结果如图3所示.由图可知,溶藻弧菌在LBS丰富培养基中生长迅速,经过1 h的短暂适应期后便进入对数生长期,11 h后逐渐进入稳定期.相比于溶藻弧菌野生株,ΔbaeS突变株虽然也能快速适应LBS培养基,但在对数期和稳定期其生长受到明显限制,菌体生长速度放缓,培养至12 h后菌液的吸光度仅为0.7左右,而野生株可达1.0左右.可见,BaeS对于溶藻弧菌在LBS丰富培养基中的生长具有一定的正调控作用.

图3 溶藻弧菌野生株WT和ΔbaeS突变株在LBS中的生长情况
2.4 BaeS对溶藻弧菌运动性的影响
溶藻弧菌野生株WT和突变株ΔbaeS运动性检测结果如图4所示.野生株具有较强的游动和爬动能力,培养一定时间后可在平板上形成一定运动距离的菌落;而ΔbaeS在软平板和硬平板上的运动能力均明显降低,基本丧失了爬动能力.即BaeS对溶藻弧菌的游动和爬动能力均具有一定的促进作用.

图4 WT和ΔbaeS突变株运动性测定
2.5 BaeS对溶藻弧菌生物被膜形成的作用
首先通过结晶紫染色法观察生物被膜的产生情况,如图5(a)所示.溶藻弧菌野生株可在试管壁上形成大量的生物被膜,突变株ΔbaeS生物被膜形成量明显较野生株减少;之后用冰乙酸对生物被膜进行充分溶解,在570 nm处测定吸光值,结果如图5(b)所示,突变株ΔbaeS生物被膜形成量较野生株减少.可见,BaeS参与溶藻弧菌生物被膜形成的调控过程.
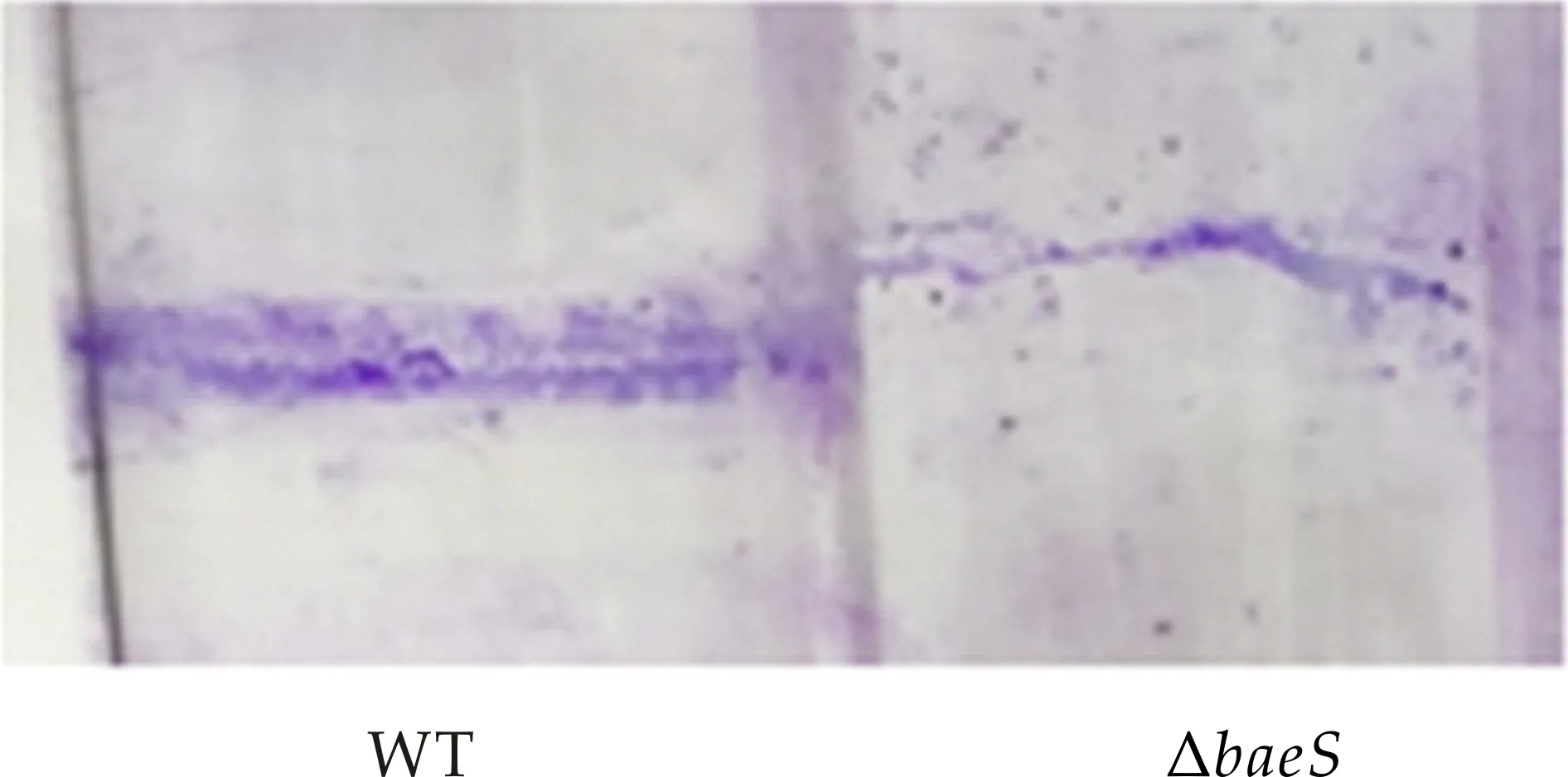
(a)结晶紫染色法测定生物被膜

(b)核酸定量仪测定OD570处吸光值图5 WT和ΔbaeS突变株生物被膜的形成
2.6 BaeS对溶藻弧菌胞外蛋白酶活性的调控作用
碱性丝氨酸蛋白酶Asp是溶藻弧菌主要的毒力因子.通过HPA定量测定了野生株WT和突变株ΔbaeS胞外蛋白酶的活性,结果如图6(a)所示.野生株能够产生大量的Asp,而basS基因缺失后,溶藻弧菌所分泌的Asp较野生株显著降低(p≤0.05).此外,利用脱脂牛奶平板定性分析了酪蛋白酶产量的变化,结果发现突变株ΔbaeS菌落直径虽变小,但是其仍可形成与野生株基本相同的透明圈,如图6(b)所示.可见,BaeS促进溶藻弧菌Asp的表达,而对于酪蛋白酶的合成影响不大.

(a)碱性丝氨酸蛋白酶活性测定

(b)酪蛋白酶活性测定图6 不同菌株胞外蛋白酶活性测定
2.7 BaeS对溶藻弧菌不同抗生素抗性的影响
选取四种抗生素氯霉素,链霉素,克林霉素和卡那霉素测试溶藻弧菌野生株WT和ΔbaeS突变株对抗生素的敏感性,结果如图7所示.野生株和ΔbaeS突变株对氯霉素均具有高度的敏感性,在含有25μg/mL氯霉素平板上培养后,均未见任何生长.相比野生株而言,ΔbaeS突变株对其他三种抗生素(链霉素,克林霉素和卡那霉素)也表现出不同程度的敏感性;其中对克林霉素最敏感(图7).由此可见,BaeS参与了溶藻弧菌耐受克林霉素的作用过程.TCS广泛参与细菌抗生素耐受性的调控,可通过细胞表面修饰,减少药物流入或增加药物流出,上调抗生素降解酶的表达,或者通过形成生物被膜等其他耐药形态来提高细菌对抗生素的耐受性[24].在大肠杆菌中,BaeSR通过上调MDR药物外排泵实现对新生霉素的耐药性[25].副溶血弧菌VbrKR则通过激活β-内酰胺酶基因的表达实现对β-内酰胺类抗生素的耐受性[26].溶藻弧菌BaeSR对克林霉素的耐受性的调控机制则需进一步深入研究.

图7 溶藻弧菌对不同抗生素耐受性的分析
2.8 BaeS对溶藻弧菌不同环境应激能力的影响
TCS在细菌中普遍存在,对维持体内平衡至关重要,使细菌能够感知环境的变化并做出相应的反应.首先检测了野生株WT和ΔbaeS突变株在不同盐浓度下的生长情况,结果如图8(a)所示.WT在0.5%、1.0%和3.0%(w/v)NaCl的平板上生长良好,但随着盐浓度的降低,在相同稀释度下的生长有所降低.ΔbaeS突变株在3个不同盐度下均能生长,但随着盐度的降低其菌落生长有所减弱;在相同盐度下,ΔbaeS突变株的菌落生长较野生型有所减弱,在稀释度为10-4时,在1.0%和3.0%(w/v)NaCl的平板上ΔbaeS突变株所形成的菌落较WT略显稀疏,而在0.5%(w/v)NaCl平板上WT仍可生长,而ΔbaeS突变株已无肉眼可见的菌落形成,这可能是由于BaeS对溶藻弧菌生长影响所引起的.可见,溶藻弧菌作为一种嗜盐菌,其生长随着盐度的降低而受到一定限制,而BaeS对溶藻弧菌在低盐条件下的适应并无明显的调控作用.
之后考察了不同浓度吐温对溶藻弧菌野生株WT和ΔbaeS突变株生长的影响,结果如图8(b)所示.由图可以看到,WT在添加了吐温的平板上可以生长,随着吐温浓度的增加,生长受到一定的抑制,在添加3%吐温平板上WT所形成的菌落较低浓度下更为疏松.而ΔbaeS突变株的生长也随着吐温浓度的增加而有所减弱,但相较于相同水平下的WT而言,ΔbaeS突变株对吐温具有较强的耐受性,在相同培养条件下所形成的菌落直径明显增大.可见,BaeS在溶藻弧菌响应外界吐温压力的过程中具有重要的调控作用.
在添加了不同浓度SDS平板上,WT均能较好地生长,且SDS浓度的增加对其生长的影响不显著.而ΔbaeS突变株在0.5%SDS平板上生长与WT基本一致,但在1%和3%SDS平板上其生长受到明显的抑制,尤其在3%SDS平板上,ΔbaeS突变株仅在未稀释时形成菌落,稀释10倍后便未有肉眼可见的菌落形成,见图8(c)所示.可见,BaeS在溶藻弧菌响应SDS的生理过程中扮演着至关重要的角色.在金黄色葡萄球菌Newman中,SDS可以直接作用于SaeSR双组份系统中组氨酸激酶SaeS,影响其激酶/磷酸酶活性,改变下游基因的表达,从而降低金黄色葡萄球菌对SDS的耐受[27].下一步可以深入研究SDS是否也能直接作用于BaeS影响其激酶/磷酸酶活性,从而调控溶藻弧菌在SDS压力下的响应活性.
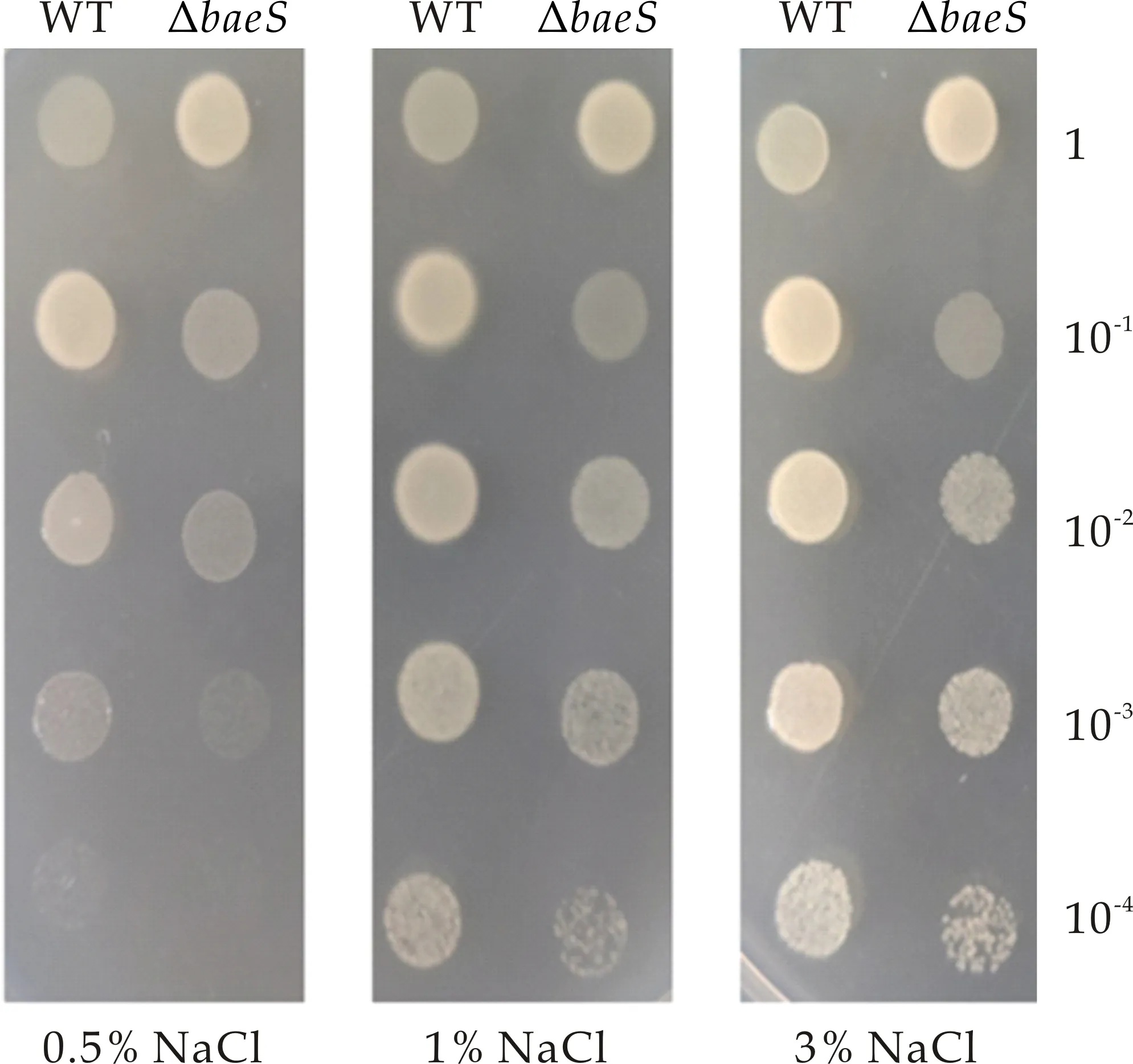
(a)不同盐浓度对WT和ΔbaeS突变株生长的影响

(b)不同浓度吐温对WT和ΔbaeS突变株生长的影响

(c)不同浓度SDS对WT和ΔbaeS突变株生长的影响图8 WT和ΔbaeS突变株在不同环境压力下的生长情况
3 结论
(1)成功构建了无标记基因缺失突变株ΔbaeS.BaeS含有HK_Sensor,HAMP,DHp和CA四个结构域,244位为进行磷酸化的组氨酸位点,此外,还含有两个TM结构域.溶藻弧菌BaeS氨基酸组成与副溶血弧菌和哈氏弧菌具有较高的相似度.
(2)BaeS对溶藻弧菌的生长和不同毒力因子,包括运动性、碱性丝氨酸蛋白酶、生物被膜等具有正向调控作用.
(3)BaeS对溶藻弧菌克林霉素耐受性以及对吐温、SDS等环境变化的应激能力具有重要的调控作用.
