绵羊肺炎支原体内蒙古分离株DnaJ基因克隆表达及其免疫原性研究
2022-02-14戴伶俐张月梅赵世华达来宝力格
戴伶俐,王 娜,刘 威,白 帆,张 帆,张月梅,宋 越,杨 斌,陈 伟,赵世华,达来宝力格
(内蒙古自治区农牧业科学院,内蒙古 呼和浩特 010031)
绵羊肺炎支原体(Mycoplasma ovipneumoniae,MO)能够引起绵羊和山羊非典型肺炎。该病临床上表现为咳嗽、流鼻涕、渐进性消瘦、腹泻和渗出性间质性肺炎[1],给养羊产业造成巨大的经济损失。在我国甘肃、辽宁、四川、新疆、内蒙古等地从患有肺炎的绵羊体内分离到该病原体[2]。近年来,研究人员对内蒙古自治区羊呼吸道疫病进行了流行病学调查研究及病原分离鉴定工作[3-5],发现绵羊肺炎支原体是引起绵羊、山羊呼吸道疾病的主要病原体,是严重威胁绵羊、山羊健康的重要病原之一。
热休克蛋白(heat shock protein,HSP)是细菌在应激条件下产生的一组对细菌自身具有保护作用的蛋白,有助于细菌快速适应环境,其诱导合成对于病原菌在宿主体内存活至关重要[1,6]。对多种病原菌的研究发现,热休克蛋白能够有效刺激宿主体液免疫和细胞免疫,对病原菌有显著的免疫保护效应,是较好的疫苗候选蛋白[7-10]。由DnaJ基因编码的DnaJ蛋白是保守的HSP40家族成员,是热休克蛋白HSP70分子伴侣蛋白,在多种生理活动和应激反应中发挥重要作用。近年来,越来越多的研究表明,DnaJ蛋白是细菌的毒力蛋白,具有良好的免疫原性[10-13]。DnaJ蛋白具有黏附—侵袭作用,在病原菌与宿主相互作用过程中发挥重要作用[12]。
绵羊肺炎支原体热休克蛋白HSP70被证明是具有免疫活性的蛋白[9,14-15],但对其伴侣蛋白DnaJ的研究尚属空白。该研究对绵羊肺炎支原体内蒙古分离株NM03-MO的DnaJ基因进行克隆表达,并对其序列进行分析与预测,初步验证其表达产物的免疫原性,为绵羊肺炎支原体感染机制研究以及新型疫苗研制提供依据。
1 材料与方法
1.1 试验材料
1.1.1 菌株与表达载体
绵羊肺炎支原体内蒙古分离株NM03-MO,于2017年由内蒙古自治区农牧业科学院兽医研究所分离鉴定并保存。pColdⅠ载体由内蒙古自治区农牧业科学院兽医研究所保存。
1.1.2 主要试剂
细菌基因组DNA提取试剂盒、DNA marker、质粒小量提取试剂盒、DH5α感受态细胞、大肠杆菌BL21(DE3),购自天根生化科技(北京)有限公司;PrimeSTARHSDNA Polymerase热启动高保真聚合酶、pMD19-Tsimple克隆载体、IPTG、氨苄青霉素、琼脂糖、PCR产物胶回收试剂盒购自生工生物工程(上海)股份有限公司;Eco RⅠ、Bam HⅠ限制性内切酶、T4 DNA连接酶购自NEB(北京)公司;His标签蛋白纯化试剂盒购自碧云天生物科技有限公司;驴抗绵羊IgG(H+L)-HRP抗体购自艾美捷生物科技有限公司。
1.1.3 试验动物
血清制备用绵羊为断奶小尾寒羊。
1.2 试验方法
1.2.1 DnaJ基因克隆与测序
按照细菌基因组提取试剂盒提取支原体NM03-MO株基因组DNA。根据GenBank支原体参考基因组序列,设计DnaJ基因CDS区PCR扩增引物MO-DNAJ-F(5′-CGCGGATCCGCGGCAAAACAAGATTACTAT-3′)和MO-DNAJ-R(5′-CCGGAATTCCGGTTATTCAAACTCTTTTAG-3′)。以NM03-MO基因组DNA为模板,采用PCR方法扩增DnaJ基因CDS区。PCR反应体系为50 μL:5×PrimeSTARBuffer 10μL,dNTPMixture(2.5 mmol/L each)4μL,MO-DNAJ-F(10μmol/L)1 μL,MO-DNAJ-R(10μmol/L)1μL,NM03-MO基因 组DNA 1μL,PrimeSTAR HS DNA Polymerase(2.5 U/μL)0.5μL,无菌去离子水32.5μL。扩增条件:95℃预变性5 min;95℃变性30 s,设置52、55、58、60℃4个不同退火温度,优化试验条件,退火时间为30 s,72℃延伸60 s,30个循环;72℃终延伸10 min;4℃保温。理论PCR扩增片段长度为1 128 bp。PCR产物经过琼脂糖凝胶电泳,切下目的片段凝胶块,用PCR产物胶回收试剂盒回收目的片段,按照说明书连接pMD19-Tsimple载体,连接产物转化DH5α感受态细胞,挑取阳性克隆菌于氨苄青霉素抗性液体培养基扩增培养,按照试剂盒说明书操作提取质粒,经过PCR鉴定,将含有目的片段的阳性克隆质粒送生工生物工程(上海)股份有限公司测序。
1.2.2 DnaJ蛋白序列分析
目的片段序列用NCBI在线BLSAT软件进行初步序列比对。采用DNAstar 7.1.0和Mega7.0软件将DnaJ基因序列翻译为氨基酸序列并分析其进化关系。利用生物信息搜索引擎ExPASy中的在线分析软件ComputepI/Mw(https://web.expasy.org/compute_pi/)和Protparam(https://web.expasy.org/protparam/)分析和预测蛋白质理论等电点。利用DNAstar 7.1.0中的Protean软件和Phyre在线分析软件(http://www.sbg.bio.ic.ac.uk/phyre2/html/page.cgi?id=index)分析和预测蛋白质二级和三级结构。从Uniprot网站(https://www.uniprot.org/)分别下载MO 14811株、肺炎链球菌(Streptococcus pneumoniae,S.pneumoniae)ATCCBAA-334株、大肠杆菌(Escherichia coli,E.coli)K12株DnaJ氨 基 酸 序列, 序 列 号 分 别 为A0A014NQY5、P95830、P08622,利用Phyre在线分析软件预测其三级结构,与分离株NM03-MO对比蛋白质三级结构差异。
1.2.3 pColdⅠ-DnaJ重组表达载体构建
选择经过测序鉴定序列正确的带有目的片段的克隆载体,使用Eco RⅠ和Bam HⅠ对其进行双酶切,切胶回收DnaJ基因目的片段,用T4 DNA连接酶将其与经Eco RⅠ和Bam HⅠ双酶切的pColdⅠ线性化载体连接,连接产物转化DH5α感受态细胞,挑取阳性克隆菌,提取质粒,进行双酶切鉴定,完成pColdⅠ-DnaJ重组表达载体构建。
1.2.4 DnaJ重组蛋白表达与纯化
将pColdⅠ-DnaJ表达载体转化BL21(DE3)表达感受态细胞中,经过PCR扩增和酶切鉴定,筛选阳性表达菌株。表达菌经16℃0.5 mmol/L IPTG诱导4 h后收集菌体,加入蛋白纯化试剂盒裂解液裂解菌体后,超声产物4℃12 000 r/min离心10 min,上清液和沉淀分别进行SDS-PAGE电泳。按照His标签蛋白纯化试剂盒说明书操作,从上清液中提取重组DnaJ蛋白。
1.2.5 DnaJ重组蛋白免疫原性研究
利用绵羊肺炎支原体NM03-MO株制备灭活疫苗免疫断奶绵羊,免疫5周后,ELISA检测其抗体效价达到1∶3 200以上,颈静脉采血分离血清,该血清作为Western blot检测用一抗。重组DnaJ蛋白纯化产物和表达菌裂解产物进行Western blot检测,一抗1∶1 000室温孵育2 h,用HRP标记的驴抗绵羊IgG抗体作为二抗,1∶5 000稀释后室温孵育40 min,ECL显色。
2 结果与分析
2.1 NM03-MO株DnaJ基因克隆测序结果
以NM03-MO株基因组DNA为模板扩增DnaJ基因片段,PCR退火温度从52℃到60℃均能够扩增大小约1 100 bp的特异性目的片段(见图1),由于退火温度为60℃条件下扩增目的片段产量低于其他3个温度条件,扩增效率有所降低,从退火温度52、55、58℃条件下选择较高退火温度以保证PCR扩增特异性,因而选择58℃为最终PCR退火温度进行目的片段扩增,切胶回收纯化目的片段连接克隆载体pMD19-T载体,构建克隆载体pMD19-DnaJ,并将阳性克隆质粒送生工生物工程(上海)股份有限公司测序,对插入目的片段测序,结果显示DnaJ编码基因全长1 128 bp。
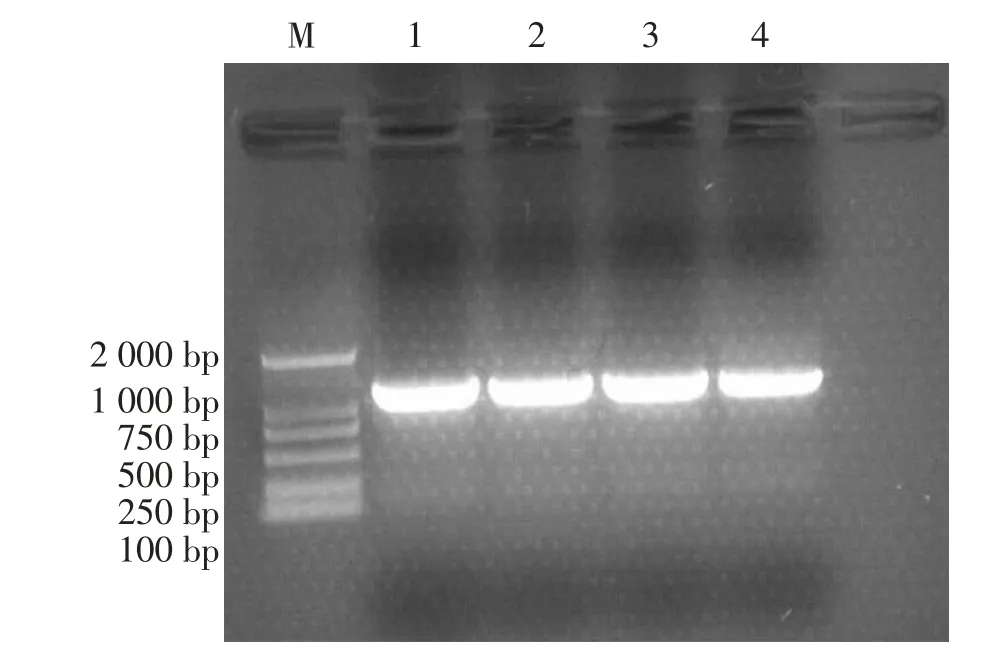
图1 绵羊肺炎支原体NM03-MO株DnaJ基因PCR扩增结果
2.2 NM03-MO株DnaJ氨基酸序列分析结果
NM03-MO株DnaJ基因编码376个氨基酸(见图2),其中包含53个强碱性氨基酸(K、R),42个强酸性氨基酸(D、E),101个亲水性氨基酸,116个极性氨基酸。预测分子量为41.65 kDa,等电点9.09。蛋白质二级结构预测分析结果表明DnaJ蛋白具有较强的亲水性及抗原性(见图3)。

图2 绵羊肺炎支原体NM03-MO株DnaJ氨基酸序列
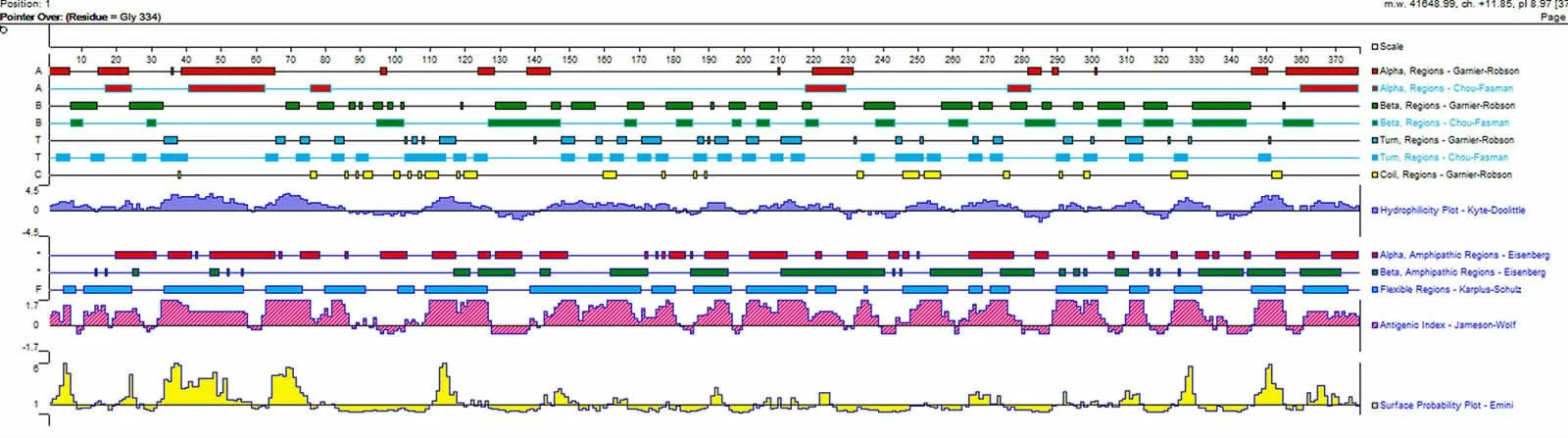
图3 绵羊肺炎支原体NM03-MO株DnaJ蛋白质二级结构预测分析结果
对下载的支原体和大肠杆菌DnaJ蛋白序列绘制遗传进化树,整体支原体DnaJ共处一个大分支,与大肠杆菌分属不同进化分支。绵羊肺炎支原体DnaJ与猪支原体亲缘关系较近,同属一个分支(见图4)。分离株NM03-MO与绵羊肺炎支原体贵州分离株14811株遗传进化距离最近。

图4 DnaJ蛋白序列遗传进化树
分别对绵羊肺炎支原体内蒙古分离株NM03-MO、MO 14811株、S.pneumoniae ATCC BAA-334株和E.coli K12株DnaJ蛋白质序列在线预测其三维结构(见图5),四者整体结构相似,但在与HSP70相互作用的区域,如图5黄色标记区域所示,绵羊肺炎支原体与大肠杆菌和肺炎链球菌的DnaJ结构有一定差异。
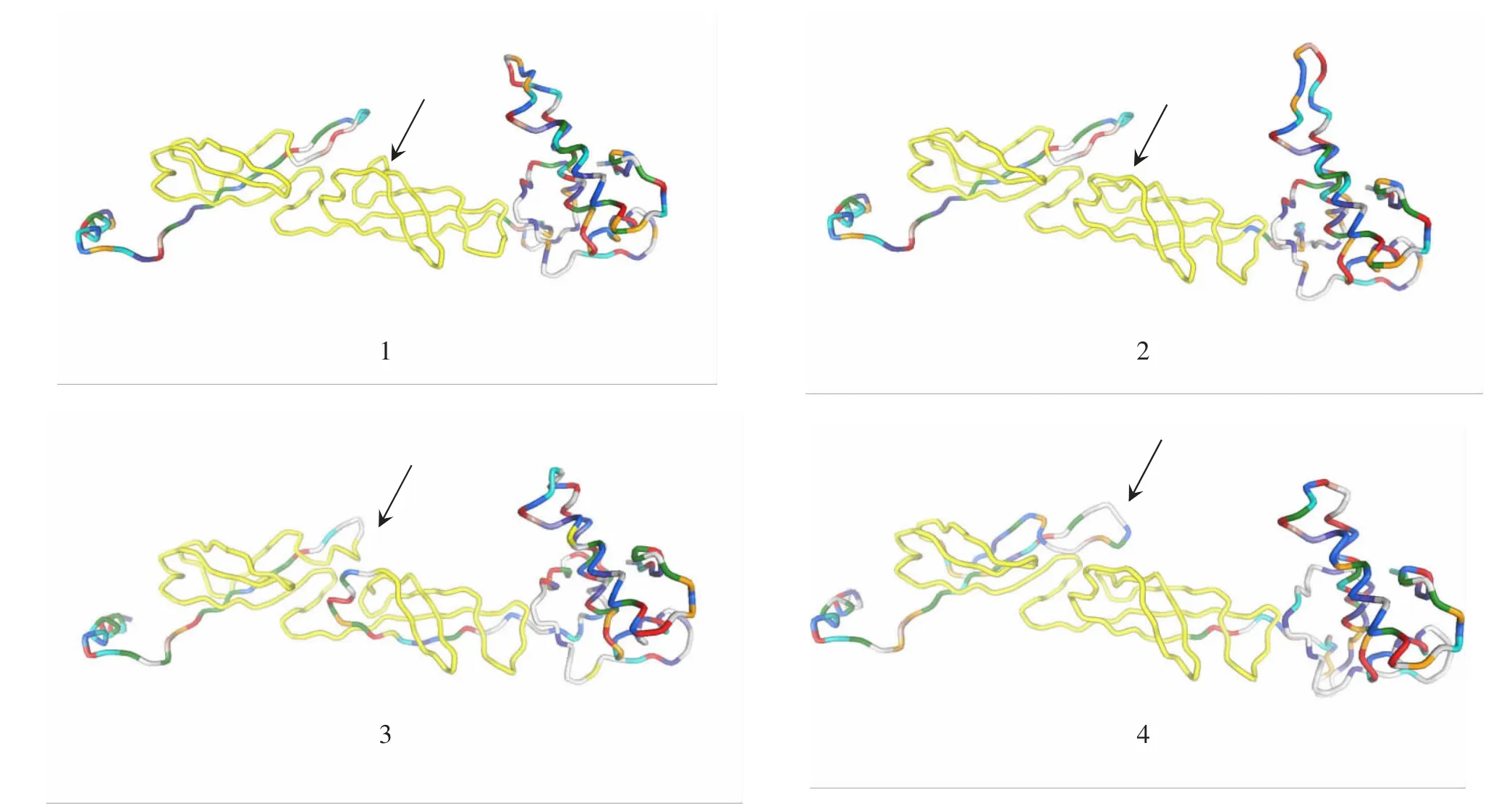
图5 DnaJ蛋白三维结构预测图
2.3 DnaJ重组表达载体构建
pMD19-DnaJ经过Eco RⅠ和Bam HⅠ双酶切,纯化DnaJ基因片段并连接同样经过Eco RⅠ和Bam HⅠ双酶切线性化的表达载体pColdⅠ,连接转化并挑取阳性克隆菌扩培后,提取质粒,进行酶切鉴定(见图6)。质粒双酶切产物为2条条带,大片段条带为载体条带,约为4 400 bp,小片段条带为DnaJ目的片段,大小约为1 100 bp;质粒单酶切产物约为5 500 bp,与理论大小相符,成功构建pColdⅠ-DnaJ重组表达载体。
2.4 DnaJ重组蛋白表达纯化
大肠杆菌BL21(DE3)表达重组DnaJ蛋白,经过条件优化,目的蛋白条带大小约为42 kDa,如图6箭头所示,与蛋白质理论大小一致。目的蛋白为上清表达,可直接用镍柱纯化His标签蛋白(见图7),由于用His标签蛋白纯化试剂盒粗提靶蛋白,能够去除大部分非特异性蛋白,但仍存在一定量的非靶蛋白,需要后续优化纯化条件,进一步提纯靶蛋白用于后续实验。
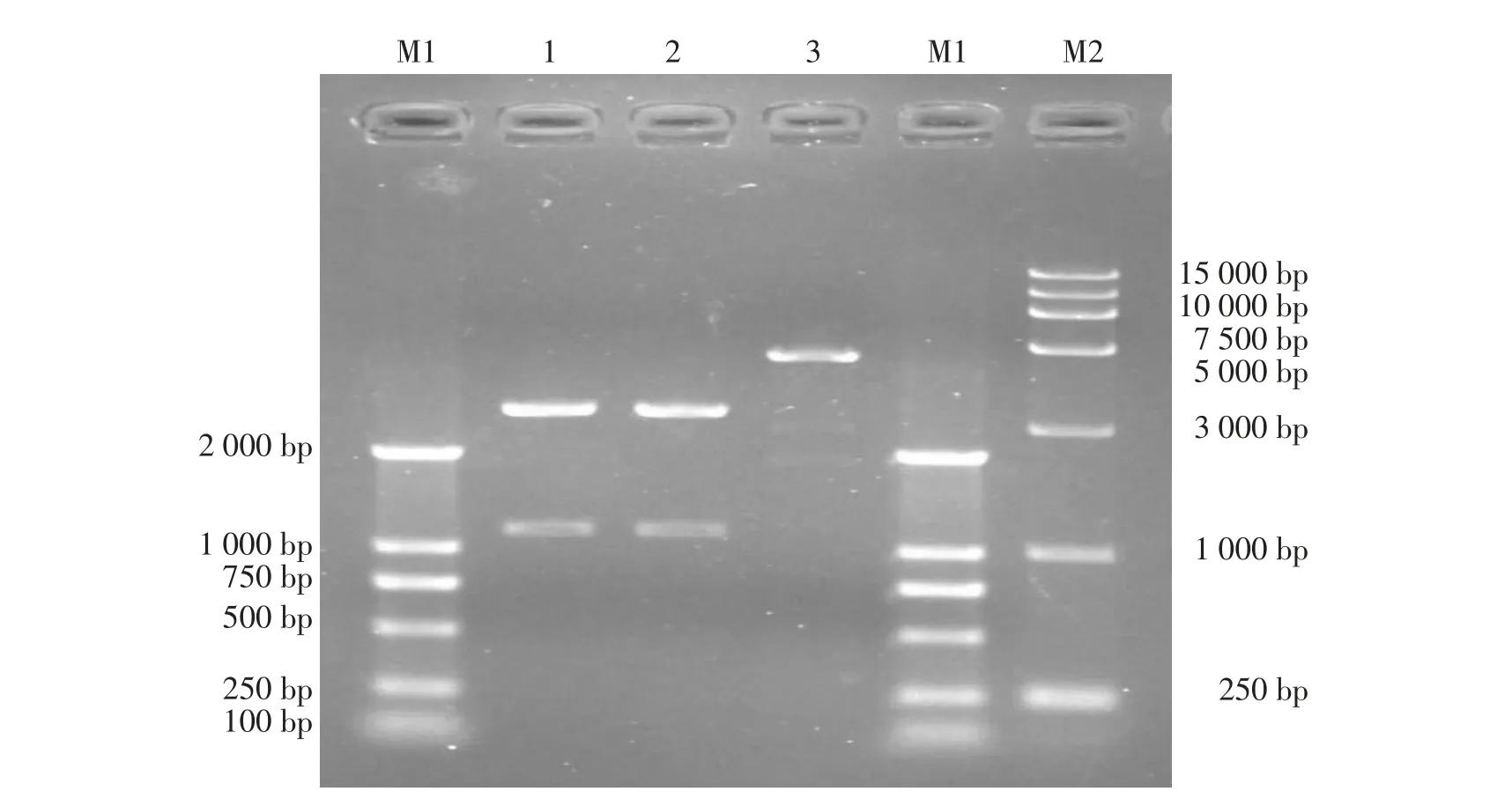
图6 p ColdⅠ-DnaJ重组表达载体酶切鉴定结果
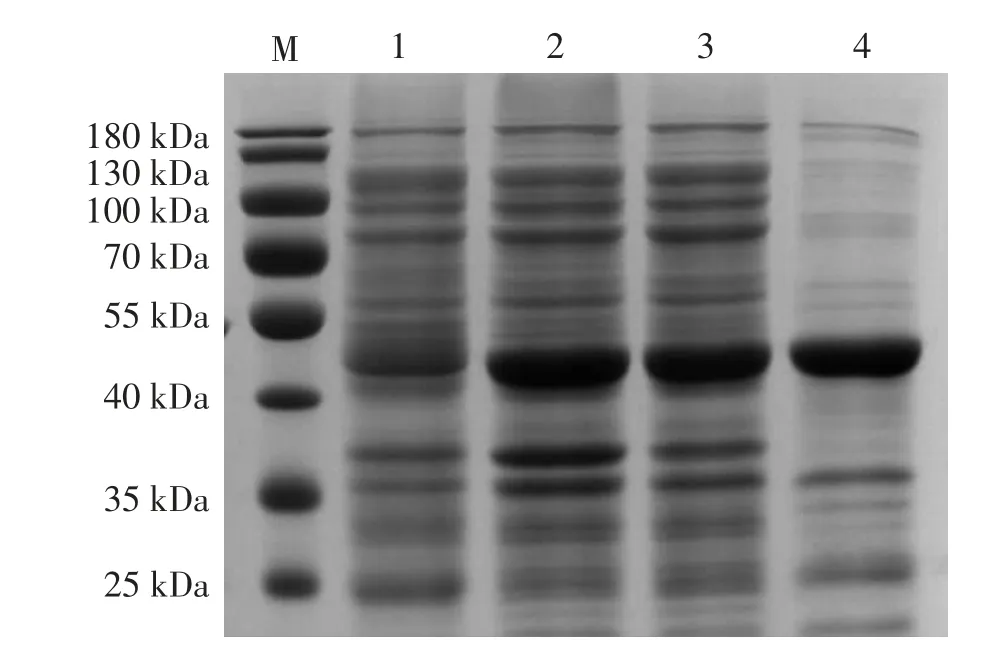
图7 DnaJ重组蛋白表达纯化结果
2.5 DnaJ重组蛋白免疫原性研究
为验证NM03-MO分离株DnaJ重组蛋白是否具有免疫原性,用分离株制备灭活疫苗免疫断奶绵羊5周后,分离血清,经过Western blot检测,证明重组DnaJ蛋白能够与血清抗体结合(见图8),从而证明了绵羊肺炎支原体DnaJ蛋白能够在体内刺激机体产生抗体,具有一定的免疫原性。
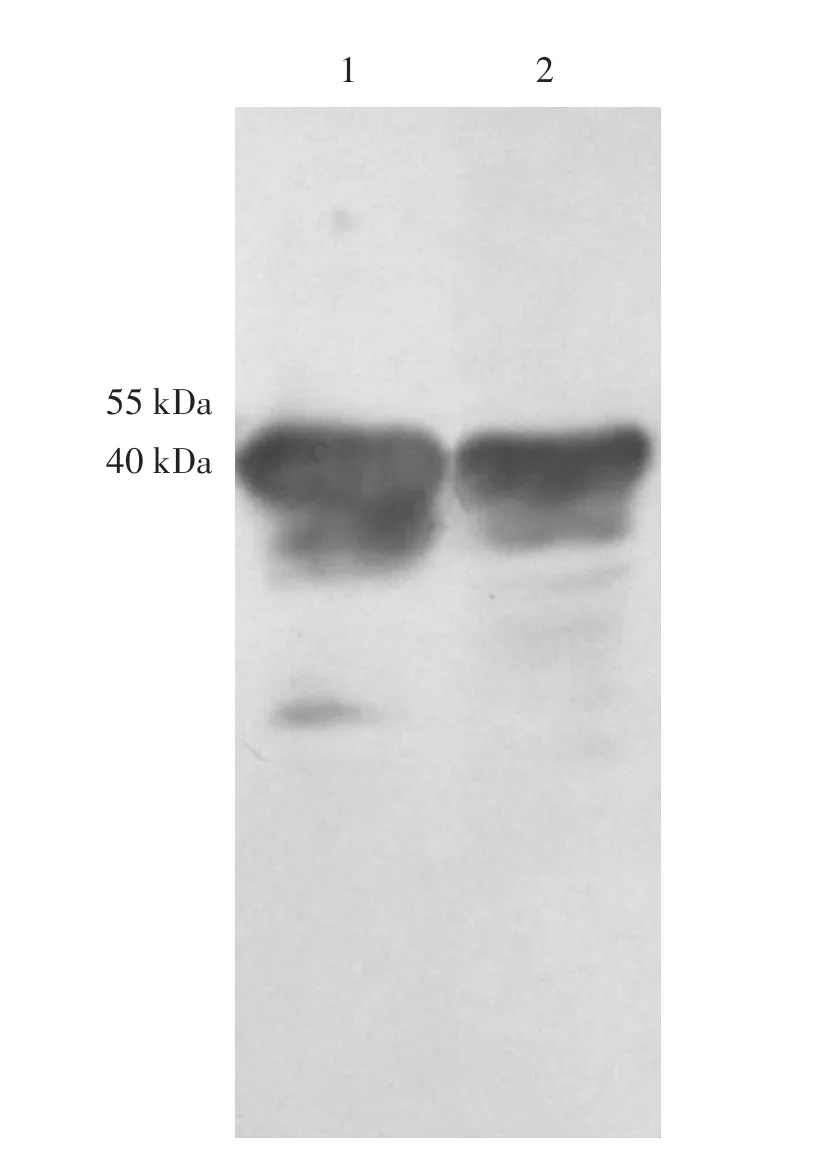
图8 DnaJ重组蛋白Western blot结果
3 讨论
绵羊肺炎支原体分子致病机制目前已有研究报道[9,16-18],但对其结构蛋白功能研究仍属于空白,严重影响对该疫病的分子致病机制的深入研究及解析,限制了高效特异的诊断方法和疫苗研制。
对于动物呼吸道疫病病原菌的DnaJ蛋白研究主要集中在对肺炎链球菌致病性及抗原保护性等方面。DnaJ缺陷型肺炎链球菌感染小鼠,能够降低小鼠对其天然免疫应答反应强度[19]。猪链球菌2型DnaJ蛋白功能与病原菌对温度敏感性有关,同时与病原菌对宿主细胞的黏附有关,因此,动物或人在感染后体温持续升高时,该菌可能通过上调DnaJ蛋白表达,从而提高对宿主细胞的黏附力[20],增强致病性。此外,DnaJ是一类J结构域蛋白,在肺炎支原体末端细胞器也存在J结构域蛋白,该蛋白能够与HSP70相互作用,影响末端细胞器的形成、支原体滑行运动以及细胞黏附作用[21],存在于肺炎支原体末端细胞器的J结构域蛋白是否就是绵羊肺炎支原体DnaJ蛋白,需要对DnaJ蛋白在MO中的定位深入探讨。
通过黏膜免疫途径免疫DnaJ抗原可以诱导宿主产生DnaJ抗体,同时刺激宿主提高IL-10、IFN-γ和IL-17A表达水平,可降低肺炎球菌在鼻内或肺脏的定殖。小鼠腹腔或黏膜免疫DnaJ蛋白可激发小鼠体液免疫和细胞免疫反应,可抵御多种血清型的肺炎链球菌感染[22-23],DnaJ蛋白能够诱导保护性的免疫应答反应,具有作为保守的肺炎链球菌蛋白疫苗研制潜力[24]。
虽然热休克蛋白和伴侣蛋白在真核和原核生物中的序列较为保守[10],但在不同种属之间仍然存在一定差异,这种差异也是生物进化形成的一种自保护方式。该研究通过对内蒙古分离株NM03-MO株DnaJ序列克隆测序及其表达蛋白三维结构预测,发现与绵羊肺炎支原体贵州分离株14811株均存在一定差异,结构差异可能会引起功能性差异,这种结构差异是否与支原体的致病性差异存在一定关系还有待验证。
该研究制备的绵羊肺炎支原体DnaJ重组蛋白与绵羊肺炎支原体阳性的绵羊血清有较好的结合活性,也证明该蛋白在宿主体内能激活宿主体液免疫,有较好的免疫原性,但是否能够刺激机体产生较好的黏膜免疫反应,仍有待研究。
4 结论
成功克隆表达绵羊肺炎支原体内蒙古分离株NM03-MO株DnaJ蛋白。重组DnaJ蛋白能够与血清抗体结合,具有较好的免疫原性,填补了国内外对绵羊肺炎支原体DnaJ蛋白研究的空白,为后续绵羊肺炎支原体致病机制研究,以及诊断试剂研发和新型疫苗研制提供试验支持。
