奶牛乳房炎金黄色葡萄球菌的分离鉴定及药敏试验
2022-02-14贾梓渤彭健康陈海峰
贾梓渤,彭健康,朱 燕,陈海峰,王 婧
(江苏农牧科技职业学院,江苏 泰州 225300)
奶牛乳房炎通常是由于病原菌感染、外界损伤或奶牛机体免疫力降低导致的奶牛乳腺的实质和间质性炎症[1]。据统计,全世界有大约34%的奶牛患有各种类型的乳房炎[2]。据不完全统计,我国奶牛乳房炎的感染率高达70%,46.4%~85.7%为隐性乳房炎[3]。因此,乳房炎作为奶牛三大常见疾病之一成为困扰养殖户的难题,严重制约了奶牛养殖业的发展。
奶牛乳房炎的发病原因较多,一般由病原微生物感染、胎次、饲喂环境、饲养管理水平、奶牛自身免疫力等因素综合影响[4]。根据炎症的严重程度,可将乳房炎分为临床型和隐性型,隐性型乳房炎是指在临床体征上无明显的变化,但对奶的质量和产量造成严重影响[5]。通常认为病原微生物感染是引起奶牛隐性乳房炎的主要因素,常见病原微生物包括大肠埃希菌、金黄色葡萄球菌、无乳链球菌、停乳链球菌、蜡样芽孢杆菌等,以及一些支原体、真菌等,又以金黄色葡萄球菌为主[6]。
金黄色葡萄球菌主要通过皮肤和口咽部入侵机体,随后定植于乳腺上皮细胞,损伤奶牛的乳腺组织,引起隐性和慢性乳房炎[7]。由于金黄色葡萄球菌侵入病牛乳房后,被炎症组织包围,抗菌药物不易到达损伤部位,导致耐药菌株逐年增加,因此,一旦侵入牛群便很难被根除[8]。金黄色葡萄球菌引发的乳房炎一般呈慢性过程。急性感染相对较少,但是一旦感染,该病原菌就会在乳腺组织中大量繁殖,造成动物反复感染,并在牛群之间连续传播。在该病原菌繁殖过程中产生的一系列毒素因子,也可引起急性坏疽性乳房炎[3,9]。
该研究主要针对江苏省泰州市某奶牛场中奶牛乳房炎奶样进行金黄色葡萄球菌的分离、鉴定及药敏测试,为该奶牛场乳房炎的预防和治疗用药提供依据。
1 材料与方法
1.1 主要试剂
Taq DNA聚合酶、DNA Marker 2 000、DNA提取试剂盒等均购自TAKARA生物公司;血平板、胰酪大豆胨琼脂培养基(TSA)、Baird-Parker琼脂基础、亚碲酸钾卵黄增菌剂、生化鉴定管、冻干血浆购自广东环凯微生物科技有限公司;Mueller-Hinton肉汤培养液和琼脂、细菌微量生化反应管、血平板、药敏纸片购自杭州滨河微生物试剂有限公司。
1.2 样品采集
2020年12月,于江苏省泰州市某奶牛场采集乳房炎奶样共9份。
1.3 细菌分离
将采集的奶样置于37℃恒温培养箱,振荡培养4 h左右,用灭菌棉签蘸取少量奶样均匀涂布于Baird-Parker平板中,37℃培养24 h。挑取黑色、有光泽性的疑似菌落,再次划线接种至TSA平板中进行培养,挑取单个黄色菌落至肉汤中增菌用于鉴定。
1.4 细菌的鉴定
1.4.1 革兰染色镜检
取少量菌液与灭菌水于载玻片上混匀,采用革兰染色进行染色镜检。
1.4.2 生化鉴定试验
取纯化的疑似菌株,接种于细菌微量生化鉴定管进行生化鉴定。接种后置于37℃培养箱中过夜,次日观察结果。
1.4.3 溶血性试验
用接种环蘸取少量上述纯培养肉汤,采用分区划线法将菌落接种于血平板中,放于37℃恒温培养箱中培养18~24 h。
1.4.4 血浆凝固酶试验
在冻干兔血清中加入0.5 mL灭菌生理盐水至完全溶解,再加入0.3 mL疑似菌落的肉汤培养液混匀,置于37℃培养5 h。观察结果时将西林瓶倾斜或倒置,内容物不流动则判为阳性,反之则为阴性,以不接菌的肉汤作阴性对照。
1.4.5 PCR鉴定
取500μL新鲜疑似菌液放入指形管,加热煮沸5 min,以此为模板,参考文献[10]进行16SrDNA和nuc基因片段的PCR扩增,并经1.5%电泳检测,将nuc基因检测为阳性的菌株扩增产物送生工生物工程(上海)股份有限公司测序。
1.5 药物敏感性试验
使用K-B纸片扩散法对鉴定为金黄色葡萄球菌的菌株进行药敏试验,随后按照美国临床实验室标准委员会标准,根据抑菌圈直径判断结果,重复3遍[11]。
2 结果与分析
2.1 病原菌的形态特征
金黄色葡萄球菌在Baird-Parker琼脂培养基上呈现为灰黑色,有光泽,边缘浅色,周围有不透明的圆圈,外有一清晰带。挑取灰黑色或黑色疑似菌落再次接种至TSA培养基进行纯培养后,挑取单个菌落接种于血平板,有溶血现象(见图1);染色镜检发现所有菌株呈葡萄串状样或短链样排列的革兰阳性球菌,共筛选出6株(分别编号为20210315D1、20210315D2、20210315D3、20210315 D4、20210315D5、20210315D6。进一步对其进行划线分离、纯化(见图2)。
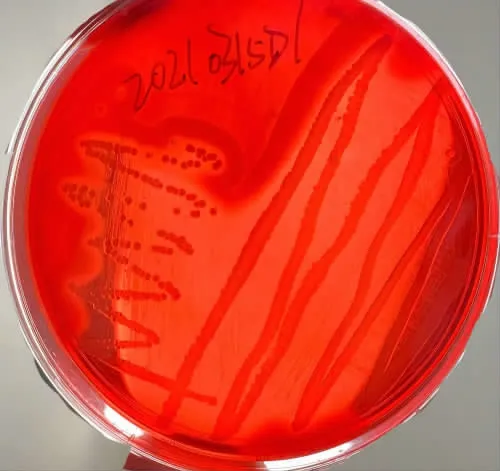
图1 分离菌的溶血性
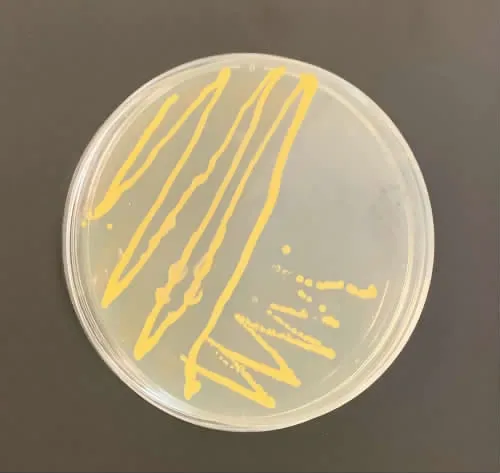
图2 分离菌的纯化
2.2 金黄色葡萄球菌的生化鉴定
将疑似菌株接种至微量生化鉴定管培养结束后,根据《常见细菌系统鉴定手册》确定6株细菌均属于葡萄球菌属。由于金黄色葡萄球菌致病菌多能分解甘露醇,产生凝固酶,因此,重点对这两个生化指标进行重复测定。结果显示,共有3株分离 菌 (分 别 编 号 为20210315D1、20210315D2、20210315D3)表现为甘露醇分解(见图3)和血浆凝固酶均为阳性(见图4),表明分离到致病性的金黄色葡萄球菌。

图3 甘露醇试验

图4 血浆凝固酶试验
2.3 金黄色葡萄球菌的PCR鉴定
nuc为金黄色葡萄球菌的耐热核酸酶基因,具有高度保守的特性,该试验根据参考文献[10]进行了nuc和16SrDNA片段的扩增,结果见图5和图6。将3株nuc基因扩增为阳性的菌株PCR产物送生工生物工程(上海)股份有限公司测序。对16SrDNA序列的BLAST比对分析表明,结果与甘露醇和血浆凝固酶试验一致,3株均为金黄色葡萄球菌。
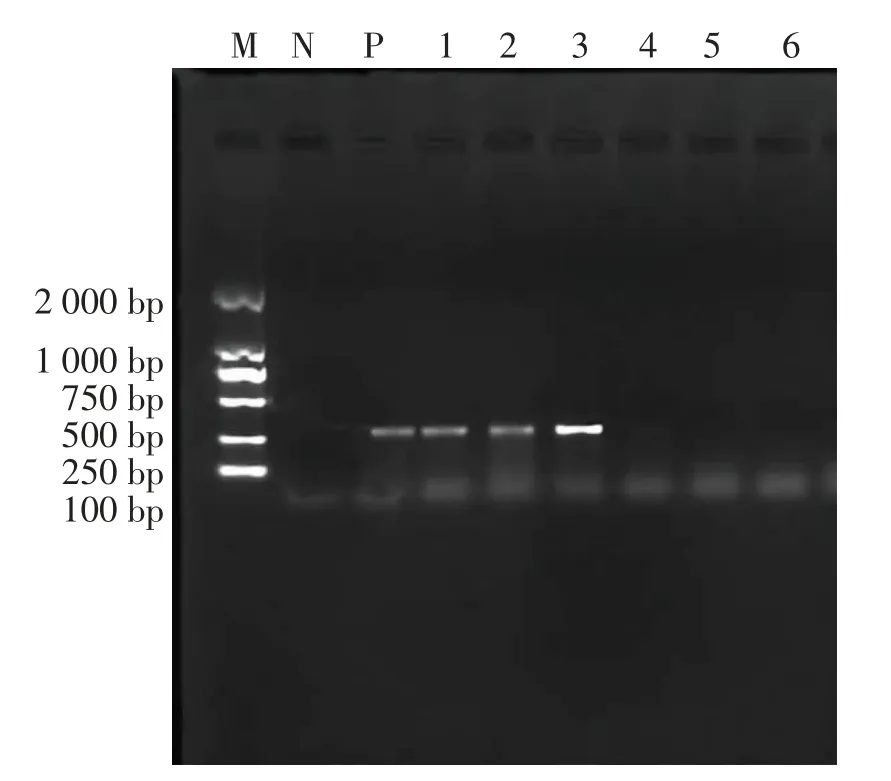
图5 nuc PCR结果
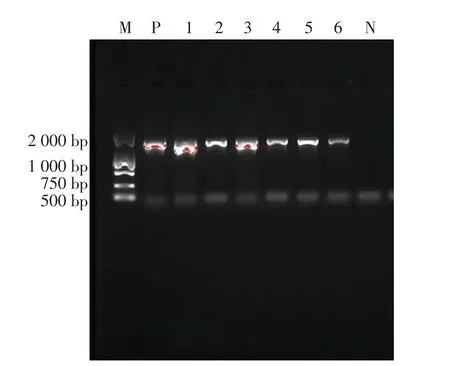
图6 16S r D NA PCR结果
2.4 药敏试验结果
进一步对分离到的金黄色葡萄球菌进行药物敏感性测试。试验共采用18种药敏纸片,试验结果见表1。由表1可知,3株临床分离的金黄色葡菌球菌均对青霉素G耐药;有2株菌对四环素耐药;2株菌对红霉素和苯唑西林表现为中介,其余均为敏感。

表1 金黄色葡萄球菌药敏结果
3 讨论
引起奶牛乳房炎的病原种类复杂多样,临床上多数奶牛乳房炎是由葡萄球菌、大肠杆菌和链球菌引起的。张峥臻等[12]对上海地区2009—2010年隐性乳房炎病原流调结果也显示,病原菌以凝固酶阴性葡萄球菌为主,其次为金黄色葡萄球菌。周国燕等[13]从四川地区乳腺炎奶样中分离到的病原菌主要有葡萄球菌、大肠杆菌、肺炎克雷伯菌、肠球菌和链球菌等。刘肖利等[14]从采自新疆等地的142份乳房炎样品中分离到5株金黄色葡萄球菌。张楠等[15]从邯郸地区采集的31份临床型奶牛乳房炎奶样中分离到金黄色葡萄球菌9株。试验采用特异性显色培养基对隐性乳房炎奶样中的金黄色葡萄球菌进行分离、纯化和微生物生化鉴定,并结合16SrDNA PCR测序从9份隐性乳房炎奶样中分离到6株葡萄球菌,其中3株为金黄色葡萄球菌,表明该奶牛场中存在金黄色葡萄球菌的感染,应进一步加强饲养管理并注意奶牛场的卫生状况。
进一步对分离到的金黄色葡萄球菌进行药敏分析发现,3株分离菌均对青霉素G耐药,其中2株对四环素耐药,这2种为常用的广谱抗生素,有报道称目前全球范围内有90%~95%的金黄色葡萄球菌耐青霉素[16],这也和国内一些报道一致[17-18]。有2株对红霉素和苯唑西林表现为中介,其余为敏感,为该奶牛场预防和治疗奶牛乳房炎合理选择抗生素提供了理论依据。
