黑水虻对三种病原菌的杀灭作用研究
2022-02-14王路逸李泽轩
王路逸,李泽轩,易 犁,冯 亮*
(1.中国地质大学(武汉)环境学院,湖北 武汉 430078;2.湖北大学生命科学学院,湖北 武汉 430062)
现代人对肉、蛋、奶等畜牧业产品的追求,使得畜牧业蓬勃发展,随着生产规模的不断扩大,畜禽粪便的产量也在迅速增加,仅2016年我国畜牧业产生的粪便就达到3.16×109t,带来了严重的环境污染问题[1]。畜禽粪便的传统处理方式包括焚烧法、堆肥法、沼气法和烘干膨化法等,这些处理方法虽然能在一定程度上利用粪便资源,但也会引起包括温室效应在内的其他环境污染问题[2-3]。畜禽粪便中通常含有大量的与畜禽各种病症相关的病原菌,其中也不乏能引起人畜共患病的病原菌种类,如引起副伤寒的沙门氏菌等[4]。堆肥是能通过高温有效杀灭畜禽粪便中各类有害病原菌的方法[5],但在堆肥过程中如果处理不当,粪堆容易对周边的土壤环境、水环境造成污染,并对附近的人、动物、植物健康产生威胁。近年来出现了多种生物治理粪便污染的方法来解决这一问题,如黑水虻(HermetiaillucensL.)处理粪便技术则是其中的方法之一。
黑水虻,又名亮斑扁角水虻,原产于南美洲地区,双翅目水虻科扁角水虻属,是一类营腐生的昆虫[6]。黑水虻的幼虫食量大、抗逆性强,能够快速处理包括粪便在内的有机废弃物,同时能生产诸如畜禽饲料、生物柴油和抗菌活性物质等多种具有经济价值的附加产品,是一种颇具应用前景的资源昆虫[7-10]。长期的试验研究发现,黑水虻在处理畜禽粪便时能有效杀灭粪便中的各类病原菌,包括食品防疫过程中重点关注的大肠杆菌和金黄色葡萄球菌等[11-13],但不同时期的试验结果并不完全一致,且对于同种病原菌如沙门氏菌等的杀灭规律也有存在矛盾的地方,这可能是试验条件的不同所致[14]。
黑水虻幼虫具有杀灭病原菌的能力通常被认为来源于其作为昆虫所具有的高效免疫防御系统,这种免疫防御系统由抗菌肽、凝集素和溶菌酶等物质与具有多种功能的血细胞共同构建,同时昆虫肠道内的微生物菌群也能对外源病原菌起到一定的抑制作用[15-17]。然而,在黑水虻杀灭病原菌的各种研究中,均只对黑水虻杀灭病原菌的规律做了详细的阐述,缺乏对相关杀灭机制的探讨,特别是具体到某种抑菌物质。
为了解决以上问题,本研究展开了黑水虻幼虫处理病原菌的试验,喂养黑水虻幼虫的饲料包括两种,分别为含病原菌菌液的无菌常规饲料和富含各类病原菌的鸡粪饲料,用以探究黑水虻幼虫对于某种病原菌杀灭的具体规律,并通过分离黑水虻幼虫的淋巴体液,对其中的抑菌物质溶菌酶的活性进行了检测,尝试解释黑水虻幼虫杀菌的机制,为黑水虻处理粪便这一技术的发展提供理论和试验依据。
1 材料与方法
1.1 试验材料的制备
1.1.1 供试黑水虻幼虫的制备
黑水虻虫卵来自于华中农业大学微生物农药国家工程研究中心自行建立的水虻饲养平台,将黑水虻虫卵置于28℃培养箱中孵化,于干净饲料中培养至3日龄。
1.1.2 饲料的制备
黑水虻常规饲料主要成分是麸皮和玉米粉,将其以3∶2的比例混合,在高压蒸汽灭菌锅中121℃、30 min下反复灭菌3次,确保各类植物孢子被有效杀灭,保证无菌条件;鸡粪饲料来自于华中农业大学实验鸡场,两种饲料使用时保持含水量在70%左右。
1.1.3 供试病原菌的制备
本试验选用的病原菌分别是:①大肠杆菌O157∶H7(EscherichiacoliO157∶H7),菌种编号ATCC43889;②沙门氏菌(Salmonella),菌种编号ATCC14028;③金黄色葡萄球菌(Staphylococcusaureus),菌种编号ATCC43300。3种病原菌均来源于实验室前期购买保种,以甘油形式保存。
3种病原菌的活化均采用胰蛋白胨大豆肉汤和其相关的琼脂培养基,配制方法为100 mL蒸馏水对应添加1.7 g胰蛋白胨、0.3 g大豆蛋白胨、0.5 g氯化钠、0.25 g磷酸氢二钾、0.25 g葡萄糖,琼脂培养基额外添加2 g琼脂,混匀后调节pH值至7.3±0.2,于115℃下灭菌30 min后使用。活化方案为将3种甘油菌分别涂布于胰蛋白胨大豆肉汤琼脂培养基上划线,并在37℃恒温倒置培养16 h,随后挑取单菌落接种于10 mL胰蛋白胨大豆肉汤中,置于恒温摇床中37℃、200 r/min过夜培养16 h,得到活化菌液。
后续平板计数使用相对应的选择性显色固体培养基,其中大肠杆菌O157∶H7(ATCC43889)使用的是伊红美蓝培养基,阳性菌落呈带有金属光泽的黑色;沙门氏菌(ATCC14028)使用的是SS培养基,阳性菌落带有黑色中心;金黄色葡萄球菌(ATCC43300)使用的是甘露醇氯化钠琼脂培养基,阳性菌落呈黄色且带有黄色环。以上培养基均购自于青岛海博生物技术有限公司,产品为含琼脂成分的粉末,按照产品说明添加至锥形瓶中与对应量蒸馏水混合,随后置于高压灭菌锅中121℃、30 min灭菌,最后倾倒在一次性培养皿中制成固体培养基,备用。
1.2 病原菌饲养方法
1.2.1 病原菌饲料饲养法
该试验设计在一个封闭的室内环境中进行,通过空调保证试验环境室内温度在(25±3)℃,以经过灭菌处理的泡沫盒为饲养容器,泡沫盒密封但钻有小孔以利于透气。试验组分为3个小组,分别对应添加大肠杆菌O157∶H7(ATCC43889)、沙门氏菌(ATCC14028)、金黄色葡萄球菌(ATCC43300)3种病原菌,每个试验组的对照组不添加黑水虻幼虫,其他条件类似,每个小组3个生物学重复。
试验设计饲养18 d,每6 d作为一个试验周期。第0天向饲养箱中添加250 g已灭菌的常规饲料,再分别添加对应的3 mL已过夜活化培养的病原菌菌液,搅拌均匀,取部分饲料样品进行病原菌平板计数,确定初始病原菌浓度,最后加入600只3日龄黑水虻幼虫进行处理。之后试验组每2 d从饲养箱中取出若干只黑水虻幼虫和5 g虫沙(黑水虻幼虫粪便),对照组则取饲养箱中的5 g饲料剩余物,作为虫沙的参照,供后续试验。第6天取样之后,再往饲养盒中添加250 g含病原菌的饲料,保持每2 d取一次黑水虻幼虫以及虫沙样品。第12天之后,打开泡沫盒,不再取样直到第18天收集全部虫沙样品。本试验方法主要参考文献[14]。
1.2.2 鸡粪饲料饲养法
饲养环境同上述饲养方法,但以鸡粪为饲料对黑水虻幼虫进行饲养。试验组添加500 g鸡粪和600只幼虫,对照组只加入鸡粪,每组3个生物学重复。试验设计饲养14 d,第0天便加入全部量的鸡粪与3日龄黑水虻幼虫,并保存部分初始鸡粪样品,之后试验组每2 d取5 g虫沙样品。对照组每2 d取5 g鸡粪,作为试验组虫沙的参照,以上鸡粪和虫沙样品均保存至-80℃冰箱中。
1.3 病原菌数量关系的测定方法
1.3.1 平板计数法
对于病原菌饲料饲养试验中病原菌存活数量的检测采用平板计数法,即试验期间每次收集完病原菌饲料饲养试验得到的虫沙和饲料样品之后,当天就进行梯度稀释,再涂布于上述配制好的选择性显色固体培养基中,最后进行计数。具体方案为:将得到的虫沙和饲料剩余物样品按照1∶10(W/V)比例添加pH值为7.4的PBS缓冲液,经振荡混匀后,静置10 min,取上清液;再使用PBS缓冲液进行10倍梯度连续稀释,取适宜稀释度的100 μL溶液,涂布于对应病原菌的选择性显色固体培养基上,于37℃恒温条件下倒置培养24 h,选择显阳性颜色的菌落计数,每个样品3个平行。该方法检测的极限是100 CFU/g,如果提高涂布的溶液量至1 mL即可提高检测极限到10 CFU/g。同时,对第6天和第12天取得的黑水虻幼虫进行体内病原菌检测,同样使用梯度稀释和平板计数法,但需要进行提前处理,具体操作为:先将黑水虻幼虫经半天的饥饿处理,随后用无菌水清洗表面,放入酒精中浸泡2 min,去除体表微生物,再用无菌水冲洗3次,擦干后放入2 mL灭菌离心管中;然后按照1∶10(W/V)的比例加入pH值为7.4的PBS缓冲液,倒入无菌碾钵中充分捣碎,经高速离心机以2 000 r/min转速离心5 min,得上清液后,进行梯度稀释和涂布平板计数。
1.3.2 高通量病原菌芯片检测法
由于鸡粪微生物群落复杂,传统的涂布平板计数法存在多种菌体干扰的问题,而基于SmartChip Real-Time PCR System的高通量病原菌芯片检测法则是通过检测各种病原菌的毒力基因或者16S rRNA相关基因的绝对拷贝数来作为病原菌总体存活数量的指标,有效避免了病原菌培养和计数困难的问题,因此对于鸡粪喂食试验中病原菌存活数量的检测则可以采用此方法。试验所用基因信息,见表1。

表1 试验所用基因信息
本检测由广东美格基因科技有限公司完成,具体检测流程为:先将上述鸡粪饲养试验中得到的虫沙、鸡粪样品送往公司进行总DNA的提取;随后利用相关芯片进行荧光定量PCR,以确定各种反应的CT值;最后代入根据混合质粒做成的标准曲线,则可推算出样品中各种病原菌相关检测基因的绝对拷贝数。
1.4 溶菌酶活性的检测
将上述病原菌饲料饲养试验得到的幼虫样品进行表面除菌处理,用采血针刺破尾部,收集淋巴体液[21],将体液以3 000 r/min转速离心15 min,取上清液得到粗酶液。后续溶菌酶活性检测方法主要参考《溶菌酶活性检测方法》(GB/T 30990—2014),具体步骤为:将购买于上海保藏生物技术中心的溶壁微球菌冻干粉按照产品说明进行活化,制备成溶液;然后用0.1 mol/L pH值为6.4的PBS缓冲液将标准溶液配成一定浓度的菌悬液,使其在分光光度计450 nm波长下检测光密度值约为0.7;最后取3 mL该菌悬液与100 μL粗酶液于试管中混匀,采用分光光度计于450 nm波长处测定其光密度值A0,并置于37℃水浴保温30 min,取出后立刻置于冰浴中10 min以终止反应,测定其在450 nm波长处的光密度值A,即溶菌酶活性(U)=(A0-A)/A0。对照组为无菌饲料喂养的同条件黑水虻幼虫,每个样品类型均为3个生物学重复。
1.5 数据处理方法
本研究主要通过Microsoft Excel 2019对数据进行整理和处理,并作图。
2 结果与分析
2.1 黑水虻幼虫对病原菌饲料中病原菌的杀灭效果
黑水虻幼虫对病原菌饲料中大肠杆菌O157∶H7(ATCC43889)、沙门氏菌(ATCC14028)和金黄色葡萄球菌(ATCC43300)的杀灭效果,见图1。
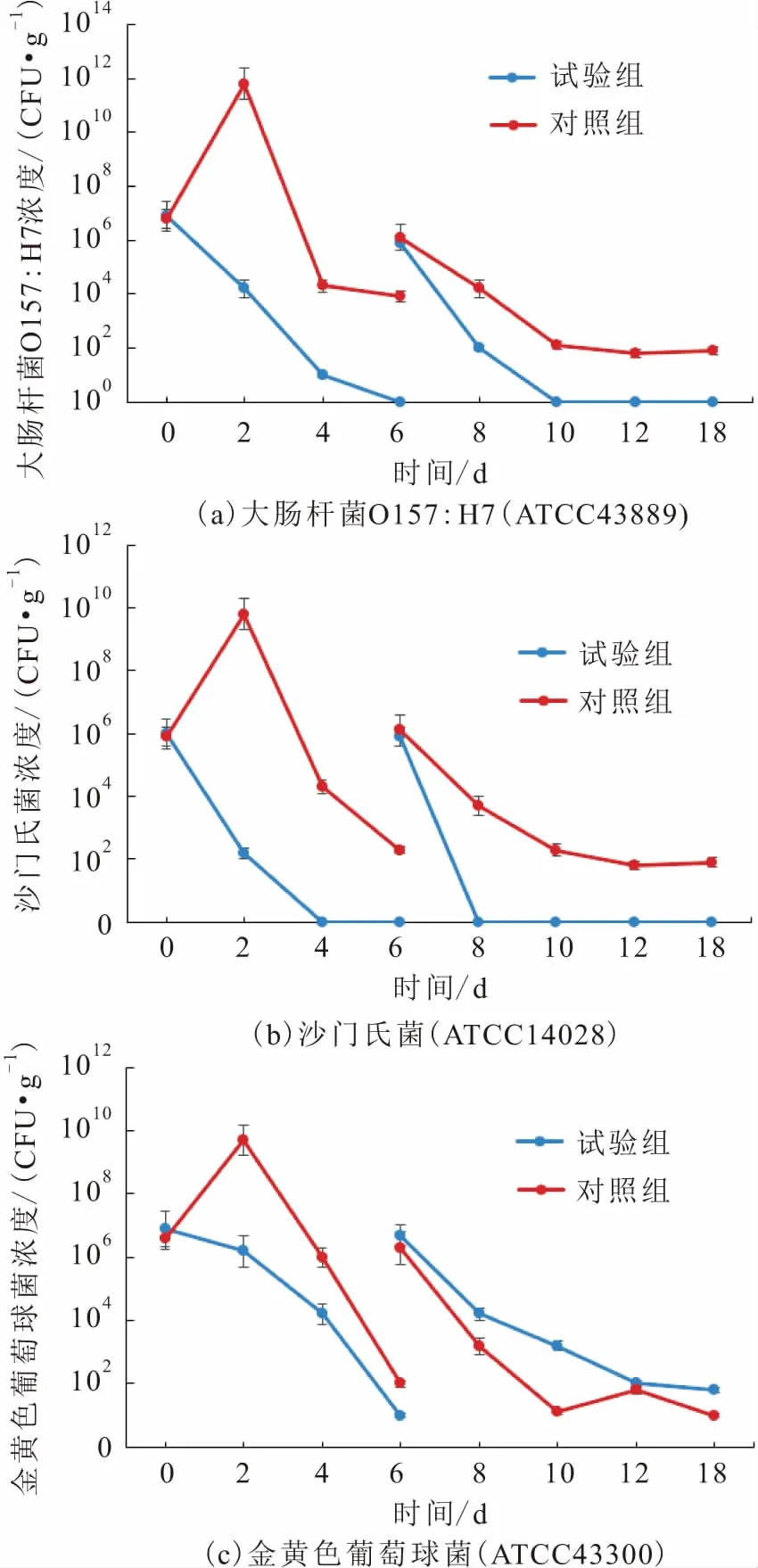
图1 黑水虻幼虫对病原菌饲料中病原菌的杀灭效果
由图1(a)可以看出:
(1) 试验组中,大肠杆菌O157∶H7(ATCC43889)的第一次接种浓度为106.9~107.1CFU/g,在第2~4天浓度快速下降,第6天其浓度降低到检测极限以下;在第6天大肠杆菌O157∶H7(ATCC43889)第二次接种后,其浓度达到105.6~105.8CFU/g,在第6~10天,相较第一次接种,其浓度下降的速度更快,并于第10天其浓度降低到检测极限以下。
(2) 对照组中,大肠杆菌O157∶H7(ATCC43889)的第一次接种浓度为 106.8~107.0CFU/g,在失去了黑水虻幼虫处理后,饲养箱中无菌的饲养环境给予了大肠杆菌O157∶H7(ATCC43889)适宜的繁殖条件,在第0~2天其浓度快速提高,但是在第2~4天其浓度开始急速下降,第4~6天其浓度下降速度变缓;在第6天大肠杆菌O157∶H7(ATCC43889)第二次接种后其浓度仍呈下降趋势,直至第18天依旧能检测到大肠杆菌O157∶H7(ATCC43889)的存在。后续黑水虻幼虫体内检测试验发现,第6 天和第12天的黑水虻幼虫经饥饿处理之后体内均检测不到大肠杆菌O157∶H7(ATCC43889)。
由图1(b)可以看出:
(1) 试验组中,沙门氏菌(ATCC14028)的第一次接种浓度为105.8~106.1CFU/g,在第2~4天其浓度快速下降,第4天其浓度降低到检测极限以下,在第6天沙门氏菌(ATCC14028)第二次接种后,其浓度达到105.7~105.9CFU/g,于第8天其浓度降低到检测极限以下。
(2) 对照组中,沙门氏菌(ATCC14028)的第一次接种浓度为106.1~106.3CFU/g,与大肠杆菌O157∶H7对照组类似,在失去了黑水虻幼虫处理后,饲养箱中无菌的饲养环境使得沙门氏菌(ATCC14028)在第0~2天快速繁殖,其浓度迅速提高,而在第2~6天其浓度开始下降;第二次接种沙门氏菌后,虽然沙门氏菌(ATCC14028)浓度呈一定的下降趋势,但在第18天仍能在病原菌饲料中检测到沙门氏菌的存在。后续黑水虻幼虫体内检测试验发现,第6天和12天的黑水虻幼虫经饥饿处理之后体内检测不到沙门氏菌(ATCC14028)的存在。
由图1(c)可以看出:
(1) 试验组中,金黄色葡萄球菌(ATCC43300)的第一次接种浓度为106.8~107.1CFU/g,在第2~6天其浓度下降,但未降低到检测极限以下,在第6天仍能检测到一定数量金黄色葡萄球菌(ATCC43300)的存在,最后其浓度为101.0~101.2CFU/g;第二次接种金黄色葡萄球菌(ATCC43300)后,金黄色葡萄球菌(ATCC43300)浓度达到106.7~106.9CFU/g,第6~12天其浓度呈下降趋势,但经过第2个处理周期,乃至第3个处理周期后,在第18天,金黄色葡萄球菌(ATCC43300)仍未被杀灭至检测极限以下,最后其浓度为101.6~102.0CFU/g。
(2) 对照组中,金黄色葡萄球菌(ATCC43300)的第一次接种浓度为106.5~106.8CFU/g,其浓度与大肠杆菌O157∶H7对照组和沙门氏菌对照组类似,呈先上升再下降的趋势,均不能降低到检测极限以下;在第二次接种到与试验组近似浓度后,后续能检测到的浓度水平均低于试验组。后续黑水虻幼虫体内检测试验发现,第6天经过涂平板发现黑水虻幼虫体内能够检测到金黄色葡萄球菌(ATCC43300)的存在,而第12天的黑水虻幼虫体内则检测不到金黄色葡萄球菌(ATCC43300)的存在。
综上所述,黑水虻幼虫能对病原菌饲料中摄取的3种病原菌产生一定的杀灭作用。在试验条件下,3日龄黑水虻幼虫在4~6 d的处理时间内就能将大肠杆菌O157∶H7(ATCC43889)和沙门氏菌(ATCC14028)的浓度降低到检测极限以下,可杀灭绝大部分的金黄色葡萄球菌(ATCC43300);9日龄黑水虻幼虫在2~4 d的处理时间内就能将大肠杆菌O157∶H7(ATCC43889)和沙门氏菌(ATCC14028)的浓度降低到检测极限以下,可杀灭绝大部分金黄色葡萄球菌(ATCC43300),但不能将金黄色葡萄球菌(ATCC43300)的浓度降低到检测极限以下。
2.2 黑水虻幼虫对鸡粪中病原菌的杀灭效果
黑水虻幼虫对鸡粪中病原菌的杀灭效果,见图2。
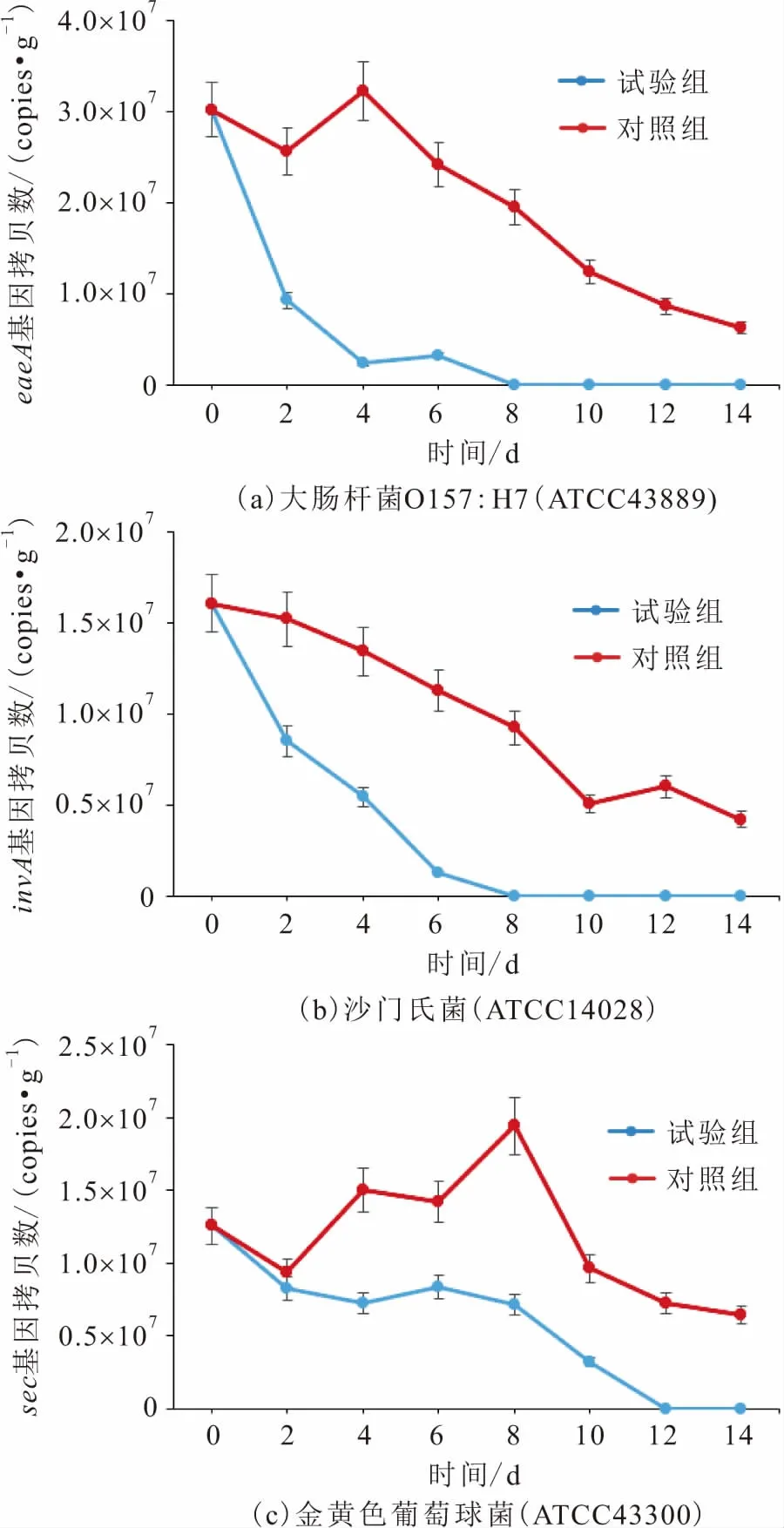
图2 黑水虻幼虫对鸡粪中病原菌的杀灭效果
由图2(a)可知:试验组中,在第0~2天,eaeA基因的拷贝数下降幅度较大,达到了69.4%,在第2~8天,eaeA基因的拷贝数的下降趋势变缓,直至第8天,eaeA基因的拷贝数才降低到检测极限以下;对照组中,在第0~2天,eaeA基因拷贝数先呈下降趋势,在第2~4天,eaeA基因的拷贝数呈一定的上升趋势,之后第4~14天,eaeA基因的拷贝数才呈现稳定下降的趋势,直到试验结束的第14天,与初始鸡粪中eaeA基因的拷贝数相比,其总体下降了79.3%。
由图2(b)可知:试验组中,在第0~8天,invA基因的拷贝数的下降趋势相比eaeA基因要较为平缓,但同样在第8天,invA基因的拷贝数降到检测极限以下;对照组中,invA基因的拷贝数也呈现一个相对稳定的下降趋势,在第14天,与初始鸡粪中invA基因的拷贝数相比,其下降了73.8%。
由图2(c)可知:试验组中,在第0~4天,sec基因的拷贝数呈现一定的下降趋势,但4 d的处理时间,sec基因的拷贝数只下降了42.6%,而在第4~6天,sec基因的拷贝数又出现上升趋势,随后在第6~12天,sec基因的拷贝数才呈现稳定的下降趋势,直至第12天,sec基因的拷贝数降低到检测极限以下;对照组中,在第0~8天,sec基因的拷贝数总体呈现一个上升的趋势,第8~14天,sec基因的拷贝数则呈现一个下降的趋势,在第14天,与初始鸡粪中sec基因的拷贝数相比,其下降了48.9%。
综上所述,在试验条件下处理鸡粪时,黑水虻幼虫对从鸡粪中摄取的3种病原菌具有一定的杀灭作用,8 d的处理时间内能将大肠杆菌O157∶H7(ATCC43889)和沙门氏菌(ATCC14028)基因的拷贝数降低到检测极限以下,12 d的处理时间内能将金黄色葡萄球菌(ATCC43300)基因的拷贝数降低到检测极限以下;而不经黑水虻幼虫处理的自然条件下,各病原菌基因的拷贝数也会降低,但均不能降低到检测极限以下。
2.3 黑水虻幼虫体内溶菌酶活性的检测结果
经病原菌饲料喂养之后,各试验组与对照组黑水虻幼虫体内的溶菌酶活性变化,见图3。
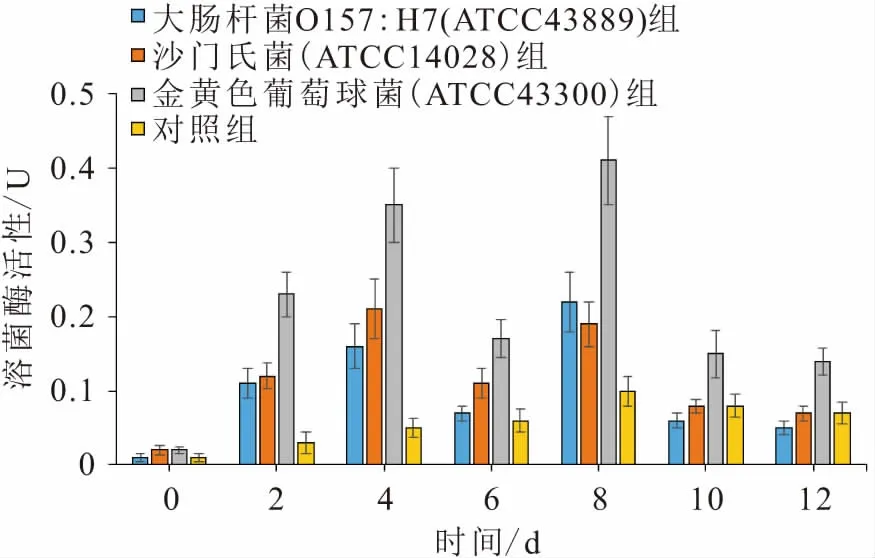
图3 黑水虻幼虫体内的溶菌酶活性变化
由图3可知:经病原菌饲料喂养之后,各试验组黑水虻幼虫淋巴体液中溶菌酶活性在前4 d会有较大的提高,其中金黄色葡萄球菌(ATCC43300)试验组溶菌酶活性的提高效果最为明显,沙门氏菌(ATCC14028)试验组其次,大肠杆菌O157∶H7(ATCC43889)试验组随后,但对照组溶菌酶活性提升不明显;第6天各试验组黑水虻幼虫体内溶菌酶活性比第4天低,根据前述病原菌饲料的试验结果,此时大肠杆菌O157∶H7(ATCC43889)试验组和沙门氏菌(ATCC14028)组中病原菌已经降低到检测极限以下,金黄色葡萄球菌(ATCC43300)组中病原菌数量也下降到了较低的水平;第2次添加病原菌饲料之后,环境中的病原菌数量增加,第8天各试验组黑水虻幼虫体内溶菌酶活性对比第6天均有提高,到达峰值且溶菌酶活性要高于第4天,第10天由于大肠杆菌O157∶H7(ATCC43889)试验组和沙门氏菌(ATCC14028)试验组中病原菌数量降低到检测极限以下,各试验组黑水虻幼虫体内溶菌酶活性均有降低,大肠杆菌O157∶H7(ATCC43889)试验组和沙门氏菌(ATCC14028)试验组达到对照组相似的水平,金黄色葡萄(ATCC43300)球菌组仍高于对照组,第12天各试验组和对照组黑水虻幼虫体内溶菌酶活性与第10天相比没有显著性差别(p>0.05)。
根据以上结果可知,黑水虻幼虫体内溶菌酶的活性变化与环境内的病原菌数量相关,病原菌数量增加时,黑水虻幼虫体内溶菌酶的活性也随之提高,病原菌数量降低时,黑水虻幼虫体内溶菌酶活性也会降低。因此,将第0天的各组病原菌数量对应第2天的各组溶菌酶活性,以此类推,利用CORREL函数计算出病原菌数量与黑水虻幼虫体内溶菌酶活性的相关系数r,见表2。

表2 病原菌数量与溶菌酶活性的相关系数
由表2可知,大肠杆菌O157∶H7(ATCC43889)组和沙门氏菌(ATCC14028)组的病原菌数量与溶菌酶活性存在中度正相关关系(0.5
3 讨 论
在人为富集单一病原菌并制成病原菌饲料喂食给3日龄黑水虻幼虫的试验条件下,大肠杆菌O157∶H7(ATCC43889)和沙门氏菌(ATCC14028)浓度在4~6 d的处理时间内会降到平板计数法的检测极限以下(10 CFU/g),这个检测极限较低,几乎可以认为大肠杆菌O157∶H7(ATCC43889)和沙门氏菌(ATCC14028)被完全清除,而金黄色葡萄球菌(ATCC43300)的存活数量高于检测极限,没有被完全清除,导致这种差异的可能原因是金黄色葡萄球菌(ATCC43300)为革兰氏阳性菌(G+),其抗逆性比大肠杆菌O157∶H7(ATCC43889)和沙门氏菌(ATCC14028)这两种革兰氏阴性菌(G-)强,黑水虻幼虫对其的杀灭能力有限,同时这也可能与昆虫应对G+和G-的免疫途径不同有关[22]。第二次添加病原菌饲料之后,病原菌接种的浓度与第一次接种处于相似水平,大肠杆菌O157∶H7(ATCC43889)和沙门氏菌(ATCC14028)被完全清除所需要的时间均减少了2 d,此时试验环境没有较大的改变,主要变量在于黑水虻幼虫的日龄,这说明日龄较大的黑水虻幼虫杀灭病原菌的能力更强,而溶菌酶活性检测试验中日龄大的黑水虻幼虫体内的溶菌酶活性峰值要大于日龄小的黑水虻幼虫,这与上述现象相符合。
在鸡粪喂食黑水虻幼虫试验中,鸡粪中的病原菌数量变化与病原菌饲料试验的结果类似,试验组在有黑水虻幼虫处理的情况下,作为数量指标的基因拷贝数对比对照组下降速度更快,不同的是,在病原菌饲料喂食试验中,金黄色葡萄球菌(ATCC43300)作为革兰氏阳性菌在整个18 d的试验周期内,并不能被完全清除,而在鸡粪喂食试验中,其相关的sec基因拷贝数在第12天就降低到芯片能检测到的极限以下。由于两组喂食试验的环境条件相似,以上现象可能是两个喂食试验存在的差异所致,即检测技术和饲料基质的不同。检测技术方面,平板计数法要求样品中的病原菌必须处于可培养的存活状态,病原菌生长状态受到培养条件的影响较大,因此单菌落的计数结果不能反映病原菌存活的准确数量,但仅比较各个样品间病原菌数量的多少,以及判断病原菌是否被完全清除这两个方面则相对可靠。高通量病原菌芯片检测法以qPCR为基本技术,通过检测相关基因的绝对拷贝数能够从侧面反映病原菌的存活数量,但此方法也存在一定的缺陷,即病原菌被杀灭后,其包含的相关基因不会立刻降解而是存在延时性,这会对病原菌存活的计数结果产生一定的干扰,而暴露在肠道环境下的DNA容易变性或者被水解吸收,不能长时间保持完整性,所以该干扰对各种病原菌被完全清除所用时间的结果影响较小。由于将一部分死菌也计入数量指标,高通量病原菌芯片检测法在说明病原菌是否被完全清除方面比平板计数法更为灵敏。在鸡粪喂食黑水虻幼虫试验中使用更为灵敏的检测技术发现,金黄色葡萄球菌(ATCC43300)被完全清除,说明以上现象不是检测技术产生的误差所致,更可能是饲养基质的不同导致的差别。两种饲料基质最大的区别在于其中的微生物群落多样性,鸡粪中的微生物群落组成远比含单一菌液的饲料复杂,其中优势菌群的生长会对非优势菌群的数量产生影响,金黄色葡萄球菌(ATCC43300)可能并非鸡粪中的绝对优势菌群,其本身的繁殖生长到某个阶段会受到其他微生物的抑制,在黑水虻幼虫协同处理后便会被完全清除。
检测黑水虻幼虫体内病原菌时发现,黑水虻幼虫在停止摄取病原菌并进行饥饿处理后,肠道内部检测不到大肠杆菌O157∶H7(ATCC43889)和沙门氏菌(ATCC14028),第6天的黑水虻幼虫体内能检测到金黄色葡萄球菌(ATCC43300),而第12天的黑水虻幼虫体内检测不到金黄色葡萄球菌(ATCC43300),其原因可能是金黄色葡萄球菌(ATCC43300)的抗逆能力强,能在黑水虻幼虫体内存在较长时间,而当黑水虻幼虫生长之后杀菌能力提升,金黄色葡萄球菌(ATCC43300)在体内就会被完全清除,这说明黑水虻幼虫在具有杀菌能力的同时,自身不会被这3种病原菌所感染,是一种较为安全的昆虫资源。
黑水虻幼虫体内的溶菌酶活性试验结果发现,溶菌酶的活性是伴随着病原菌数量的变化而变化的,病原菌数量处于较高水平时,溶菌酶活性会增加,病原菌数量处于低水平乃至被完全清除时,试验组溶菌酶活性会降到没有病原菌胁迫的对照组水平,通过病原菌数量与溶菌酶活性的相关系数也能发现两者呈现显著的正相关关系,而溶菌酶本身作为一种广谱的抑菌活性物质,其能通过催化细菌细胞壁肽聚糖的水解达到杀灭细菌的效果[23],因此可以推测溶菌酶参与了黑水虻幼虫杀灭病原菌的过程,但需要后续的提纯和体外试验进行验证。
除去上述提到的鸡粪中的微生物群落和溶菌酶参与了黑水虻杀灭病原菌的机制,黑水虻肠道内的微生物菌群同样可能参与了杀灭病原菌的机制。如江承亮[24]的研究发现,黑水虻幼虫处理含各种细菌的餐厨垃圾堆体时,其肠道内的部分菌群会定殖于堆体之中,这种堆体虽然有着更强的外界抵抗力,但是堆体的细菌群落多样性会降低,推测是黑水虻幼虫肠道内的微生物入侵所致,同时黑水虻幼虫肠道中的菌体群落也会受到堆体中菌群的影响。本研究虽然采用了与上述研究不同的饲料基质,但是饲料中病原菌被完全清除造成饲养环境中微生物群落多样性降低这一现象与上述研究相符,因而可能具有相同的灭菌机制。
4 结 论
(1) 通过两种喂养黑水虻幼虫的试验发现,黑水虻幼虫对于大肠杆菌O157∶H7(ATCC43889)、沙门氏菌(ATCC14028)、金黄色葡萄球菌(ATCC43300)均具有一定的杀灭能力。在单一病原菌饲料饲养条件下,3日龄黑水虻幼虫在4~6 d的处理时间内就能将大肠杆菌O157∶H7(ATCC43889)和沙门氏菌(ATCC14028)完全清除,并将金黄色葡萄球菌(ATCC43300)浓度降低到非常低的水平,抑制率在 99%以上,9日龄黑水虻幼虫则仅需要2~4 d的处理时间就能达到类似的杀菌效果,说明日龄大的黑水虻幼虫杀菌能力更强;在鸡粪饲养条件下,黑水虻幼虫在8 d的处理时间内就能完全清除大肠杆菌O157∶H7(ATCC43889)和沙门氏菌(ATCC14028),12 d的处理时间内能完全清除金黄色葡萄球菌(ATCC43300)。
(2) 黑水虻幼虫摄取病原菌一段时间后停止进食,肠道内的3种病原菌会被逐渐杀灭,自身不会受到病原菌的感染。
(3) 黑水虻幼虫体内的溶菌酶活性与病原菌数量呈显著的正相关关系,根据溶菌酶自身的功能,推测溶菌酶参与了黑水虻幼虫杀灭病原菌的过程。
