肝肺综合征大鼠模型肺组织巨噬细胞表型变化
2022-02-14李旭炯张慧英陈云霞田小霞来丽娜
李旭炯,张慧英 *,陈云霞,田小霞,来丽娜
长治医学院1.生理学教研室,2.病理生理学教研室,3.微生物学教研室,4.药理学教研室,山西 长治 046000
巨噬细胞是免疫系统的主要细胞成分,具有较强的异质性,在体内外不同的微环境影响下,可呈现出不同的功能表型,分泌不同的活性分子[1]。目前研究表明,在肝疾病特别是肝硬化发生时,肠道菌群紊乱,肠粘膜屏障及Kupffer细胞功能障碍,门体分流等因素致使大量细菌和内毒素从肠道吸收入血,这种情况下,由于肺对内毒素的敏感性及解剖特点,巨噬细胞聚集于肺组织并被激活,分泌大量的iNOS、NO、CO及血管内皮生长因子(VEGF)等细胞因子,对肺组织造成损伤的同时,促进肺血管扩张及新生血管,进而导致肝肺综合征(hepatopulmonary syndrome,HPS)。因此研究HPS发病过程中肺组织巨噬细胞表型特点及变化,对HPS的防治具有重要的意义。采用复合因素法复制HPS大鼠模型其病理阶段性变化分明,是理想的动物模型[2]。本研究采用该方法对SD大鼠进行处理,通过测定其肺组织中巨噬细胞表型标志分子及分泌产物,归纳其巨噬细胞表型变化特点,为临床该疾病的防治提供实验依据。
1 材料和方法
1.1 材料
1.1.1 实验动物 健康雄性SD大鼠36只,体重(225±25)g,购于中国人民解放军军事医学科学院实验动物中心。
1.1.2 主要试剂 四氯化碳(CCl4)分析纯购于天津市富宇精细化工有限公司;胆固醇购于天津市化学试剂公司;TNF-α、IL-10、iNOS和Arg-1 ELISA试剂盒购于上海科鉴生物科技有限公司;CD68小鼠单克隆抗体(ab955)购 自Abcam 公 司;总RNA提 取 试 剂RNAiso Plus,反转录试剂盒PrimeScript™RT Master Mix,实时荧光定量聚合酶链式反应(real-time fluorescence quantitative polymerase chain reaction,RTqPCR)试剂、SYBR®Premix Ex Taq™II等购自TaKaRa公司;CD86及CD206和18SRNA引物由生工生物工程(上海)股份有限公司合成。
1.2 方法
1.2.1 模型建立及分组 随机均分18只SD大鼠进入HPS模型4周组、6周组及8周组,采用复合致病因素法[2]进行造模,另18只动物分别被设立为同期正常对照组(Control组,n=6),给予标准饲料。上述各组动物分别于相应时间点禁食过夜后,经腹腔麻醉,于无菌、无内毒素的条件下经腹主动脉采血用于相关生化指标检测,同时摘取肺组织液氮冻存。
1.2.2 HE染色 石蜡包埋肝组织及肺组织,分别制备4μm切片,行HE染色。光学显微镜下观察肝及肺组织形态学改变。
1.2.3 免疫荧光法检测肺组织巨噬细胞 肺组织切片常规脱蜡至水,并行抗原修复。PBS冲洗,BSA封闭30 min,分别滴加一抗CD68(1:400),4℃过夜后加入相应的荧光二抗、室温下孵育1 h、含DAPI封片剂封片、镜检。
1.2.4 RT-qPCR检测巨噬细胞表面标志物CD86及CD206 mRNA表达 提取肝组织总RNA,合成cDNA(反转录条件为37℃15 min,85℃5 s)。以cDNA为模板,Primer Express 2.0和Beacon Designer软件设计引物(序列见表1)。SYBR®Green I荧光染料实时定量PCR法对目的基因进行检测。反应条件:CD86 58℃20 s、CD206 59℃20 s,18SRNA 61℃20 s,72℃1 min,共35个循环。以18SRNA为参照物计算,结果采用2-△△Ct表示。
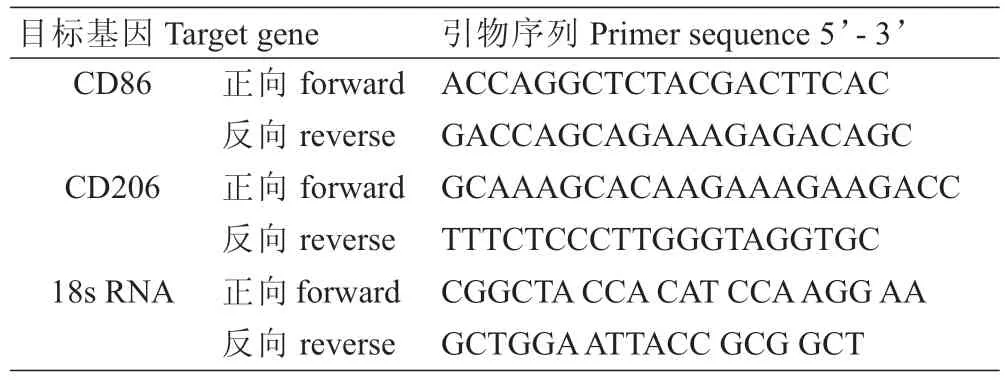
表1 引物序列Tab.1 Primer sequences for quantitative RT-PCR
1.2.5 肺组织匀浆中指标检测 按照说明制备肺组织匀浆,采用Elisa法对肺组织中TNF-α、IL-10、iNOS及Arg-1进行检测。
1.3 统计分析
各数据采用SPSS 19.0统计软件进行分析。以均数±标准差()表示。多样本均数之间进行F检验比较,各变量间相互关系采用Pearson相关性分析,P<0.05被认为有统计学意义。
2 结果
2.1 肝和肺组织病理变化
HE及VG染色显示模型组大鼠肝脂肪变性,随病程进展纤维增生逐渐加重,至第8周可见明显的假小叶形成(图1A、B)。肺组织HE染色显示,模型组从第4周起即可见肺泡间隔增厚、炎性细胞浸润,第6周可见明显的肺泡间隔增厚,腔内和间隔内巨噬细胞和中性粒细胞等炎性细胞积聚,第8周肺泡间隔进一步增厚,部分肺泡腔变小,巨噬细胞和中性粒细胞等炎性细胞大量聚集(图2A)。巨噬细胞标志物CD86免疫荧光结果显示:在模型组动物肺组织中,随着病程进展,可见其大量浸润(图2B)。

图1 肝组织病理变化 A:肝组织切片HE染色B:肝组织切片VG染色Fig.1 Pathological changes of liver tissues A:Liver tissuesof HEstaining;B:Liver tissuesof VGstaining

图2 肺组织病理变化 A:肺组织切片HE染色B:免疫荧光检测肺组织中CD68变化(红色)Fig.2 Pathological changes of lung tissues A:Lung tissues of HE staining;B:Pulmonary tissues of immunofluorescence staining for CD68(red)
2.2 肺组织中CD86及CD206 mRNA表达
模型组动物肺组织中CD86 mRNA表达随病程进展逐渐升高(P<0.05),至第6周达高锋,第8周出现明显回落,但仍明显高于同期正常对照组;CD206 mRNA第4周其表达未见明显变化,在第6周和8周其表达明显高于同期正常对照组(P<0.05),见图3。

图3 肺组织中CD86和CD206 mRNA表达水平*P<0.05,与正常对照组比较△P<0.05,与HPS模型4周组比较#P<0.05,与HPS模型6周组比较Fig.3 ThemRNA expression levelsof CD86 and CD206 in thelung tissues*P<0.05 vs normal control group;△P<0.05 vs 4th week HPSgroup;#P<0.05 vs 6th week HPSgroup
2.3 肺组织中TNF-α、IL-10、iNOS及Arg-1含量
HPS大鼠肺组织中iNOS和TNF-α水平在各个时间点均显著高于同期正常对照组(P<0.05),其中以第6周最高,4周组次之;Arg-1和IL-10的水平在第4周未见明显变化,在第6和第8周可见明显升高(P<0.05),见表2。
表2 肺组织中iNOS、Arg-1、IL-10及TNF-α水平(,n=6)Tab.2 Contents of iNOS,Arg-1,IL-10 and TNF-αin the lung tissues(Mean±SD,n=6)

表2 肺组织中iNOS、Arg-1、IL-10及TNF-α水平(,n=6)Tab.2 Contents of iNOS,Arg-1,IL-10 and TNF-αin the lung tissues(Mean±SD,n=6)
注:*P<0.05,与正常对照组比较△P<0.05,与HPS模型4周组比较#P<0.05,与HPS模型6周组比较Note:*P<0.05 vsnormal control;△P<0.05 vs4th week HPSgroup;#P<0.05 vs6th week HPSgroup
2.4 相关性分析
模型组动物肺组织iNOS与CD86表达呈显著正相关(r=0.903,P<0.01);Arg-1与CD206表达呈显著正相关(r=0.871,P<0.01);IL-10与CD206基因表达(r=0.769,P<0.05)呈显著正相关。
3 讨论
巨噬细胞在不同的微环境可呈现出不同的表型。按照功能,一般把以分泌促炎因子为主,发挥促炎功能的巨噬细胞称为M1型巨噬细胞,其常见的表面标志分子是CD86;而以降低炎症反应,修复组织为
主的巨噬细胞称为M2型巨噬细胞,其常见的表面标志分子是CD206[3]。在M1/M2极化中出现的失衡可能具有有害影响,可导致疾病或炎症状态[4]。
本研究中,根据肝及肺组织形态学的改变,表明HPS大鼠模型复制成功;并且在HPS发病过程中,聚集于肺组织的巨噬细胞呈现出一定规律表型变化特点:在HPS发病初期(第4周),M1明显增加,表明炎症反应是这一时期的主要特点。既往研究表明:为抵消过度的炎症,巨噬细胞可将其表型转化成M2型,以保护宿主免受极端伤害并触发伤口愈合。随着病程进展,炎性反应逐渐加强,至第6周达到高峰,M2开始明显增加,表明在这一时期开始出现明显的抗炎及组织修复反应。之后炎症反应开始降低,到第8周则主要表现为抗炎及组织修复反应,从第4周到第8周,M2/M1比值逐渐增加。但这一变化特点并不意味着病变减轻,相反不恰当的抗炎及修复反应常导致疾病加重,例如在纤维化和癌症等慢性疾病中常常可以观察到M2巨噬细胞的主导作用及高反应性[1]。
氨基酸代谢与巨噬细胞功能表型密切相关。iNOS及Arg1是精氨酸代谢中两个重要的酶。iNOS主要由M1巨噬细胞分泌。本研究发现iNOS与M1标志分子CD86具有一致的表达趋势,并在第6周达到高峰。iNOS可以通过分解L-精氨酸产生NO及ROS促使组织发生炎性损伤,而过量的NO是导致HPS患者肺血管异常扩张的主要原因。与之相对,M2巨噬细胞表达高水平的Arg1。Arg1可与iNOS竞争结合L-精氨酸,拮抗M1的炎性反应。Arg1通过精氨酸代谢途径产生大量的L-鸟氨酸和多胺,在组织修复中发挥重要的作用[5]。本研究发现肺组织Arg1从第6周开始明显增加,这一结果与上述模型肺组织中巨噬细胞表型变化特点是吻合的。
巨噬细胞表型的极化依赖于其微环境中的刺激物。在LPS、TNF-α等炎性介质的作用下巨噬细胞可极化为M1型。本研究结果显示HPS大鼠的肺组织中TNF-α含量随着病程进展逐渐增加,于第6周开始明显高于正常对照组。这与第6周M1型巨噬细胞标志分子CD86高度表达是一致的。但第8周,TNF-α与CD86呈现不一致的表达,CD86较第6周明显降低,而TNF-α变化并不明显。产生这种现象的原因很可能与M2巨噬细胞具有抑制M1巨噬细胞的作用及M2b亚型巨噬细胞对TNF-α的分泌有关[6,7]。对于M2巨噬细胞极化,主要由IL-4、IL-10等细胞因子所介导,本研究发现肺组织IL-10含量从第6周开始明显增加,这与从第6周开始M2型巨噬细胞明显增多是相一致。IL-10在推动和增强M2极化的同时,M2型巨噬细胞也分泌IL-10,在几种内源性因子如TNF-α和它自身的刺激下,IL-10的表达明显增加[8,9]。本研究中,第8周IL-10含量继续增加可能与此有关,进一步表明该时期肺组织反应以修复为主。
综上所述,在HPS的发病过程中,巨噬细胞经历了一系列的表型变化,并发挥不同作用。未来对HPS肺组织巨噬细胞极化及其在发病中所起作用及机制的深入研究,将会对临床防治HPS产生积极影响。