白藜芦醇对大鼠心肌缺血再灌注损伤心肌细胞铁死亡的影响
2022-02-13孙加燕刘婷婷
孙加燕,任 煜,刘婷婷
(安庆医药高等专科学校药学院,安徽 安庆 246052)
目前临床心内直视术、冠状动脉搭桥术、动脉搭桥、心脏外科体循环、心肺脑复苏以及器官移植等为了修复损伤结构、恢复组织与器官的功能的手术,心肌均会经历缺血后再灌注过程[1],而因此造成的心肌损伤常常会导致手术的失败或不良后果的发生[2]。其发病机制十分复杂,目前认为主要与细胞内氧自由基的大量产生造成的氧化应激损伤有一定关系[3]。铁死亡是一种新型细胞死亡方式,不同于细胞凋亡、细胞坏死、细胞自噬,其本质是铁离子依赖性的脂质过氧化产物大量堆积引发的以线粒体改变为主的氧化应激损伤,进而使铁离子的摄取与排放失衡,诱发机体产生大量活性氧类与脂质过氧化物,最终导致细胞铁死亡。有大量研究发现,铁死亡与心血管疾病及缺血再灌注损伤的发生发展具有密切联系[4]。白藜芦醇(Resveratrol,Res)是从葡萄、虎杖及花生等植物中分离提取出的一种抗氧化剂[5],能抑制血小板凝集、抗组织纤维化,从而抑制和减轻心血管病的发生与发展[6]。经Res预处理后可以缓解大鼠心肌损伤,但具体机制尚未明确。本研究通过探究Res对大鼠心肌缺血再灌注(Ischemia-reperfusion,I/R)损伤心肌细胞铁死亡的影响,探讨Res改善心肌损伤的机制,为临床心血管手术预防及改善心肌损伤提供实验依据。
1 材料与方法
1.1 实验试剂与药物RES(Solarbio,中国);ELISA试剂盒购自上海酶联生物科技有限公司;SYBR Green染料购自北京索莱宝科技有限公司;RNA引物由上海生工生物工程股份有限公司合成;TFRl、IREB2、FTH以及 β-actin抗体均购自北京博奥森生物技术有限公司;组织铁测定试剂盒购自南京建成生物工程研究所,
1.2 实验动物SD大鼠均由江苏艾菱菲生物科技有限公司提供,清洁级,体质量为(210±10)g。采用标准饲料与饮用水喂养,饲养温度保持在(25±2)℃,相对湿度保持在(40±2)%。
1.3 方法
1.3.1 动物培养与分组 选取清洁级健康SD大鼠72只,随机分为假手术组(Sham组,n=12)、心肌缺血再灌注组(I/R组,n=12)、心肌缺血再灌注+白藜芦醇低、中、高3剂量组(I/R+ResL组,I/R+ResM组,I/R+ResH组,n=12)、促红细胞生成素组(EPO组,n=12)3组,其中促红细胞生成素组作为阳性对照组。Sham组行假手术,I/R组、I/R+Res3组与EPO组进行心肌缺血再灌注损伤模型的制备。I/R+Res3组在I/R模型建立前分别连续7 d向大鼠腹腔注射白藜芦醇0.5 mg/100 g、1.5 mg/100 g、3 mg/100 g,EPO组注射促红细胞生成素300 u/100 g,Sham组与I/R组大鼠腹腔注射等容量的生理盐水。
1.3.2 动物模型的建立 给药7 d后,所有大鼠经腹腔注射水合氯醛麻醉,固定于手术台上,连接肢体心电图电极,经口行气管插管,连接呼吸机。备皮并消毒后行开胸术,暴露左心耳,在其下约1 mm处,用缝线结扎冠状动脉左前降支,可见结扎线以下心肌变白。心电图实时监测并记录,ST段持续抬高说明造模成功,缺血45 min后解除结扎线,再灌注2 h。以ST段下移及缺血心肌渐恢复红润为再灌注成功标志。
1.3.3 TTC染色 待观测大鼠心肌缺血再灌注情况完毕后当日,将大鼠断头处死,取心肌组织用生理盐水冲洗干净后保存于-20 ℃冰箱中冷冻30 min,随后取出大鼠心肌组织置于专用的槽中,以厚度为2 mm进行切片,之后避光放置于2% TTC溶液中37 ℃恒温孵育20 min以确保进行均匀染色,染色后取出样本置于10%甲醛溶液中固定24 h后进行拍照摄片。
1.3.4 HE病理学染色 待观测大鼠心肌缺血再灌注情况完毕后当日,收集各组大鼠心肌组织样品,并在冰冷条件下完成均质化,随后进行切片制成组织标本,然后通过苏木精染液与伊红染液进行染色,以此观察心肌组织病理状态。
1.3.5 免疫印迹试验(Western Blot) 待观测大鼠心肌缺血再灌注情况完毕后当日,收集各组大鼠心肌组织样品,将大鼠心肌组织500 mg通过组织破碎仪加入RIPA裂解液和PMSF蛋白酶抑制剂提取总蛋白,提取出的蛋白放入10 mL EP 管中,然后向其中加入5倍体积的十二烷基磺酸钠,混匀后放入95~100 ℃沸水中水煮变性,冷却后放入-20 ℃备用。每次向准备好的电泳配件中加入10 μL蛋白,设置 电泳条件为80 V恒压,30 min,结束后改变电泳条件为120 V恒压,50~60 min。当所需的蛋白分子量所在区域有一定分离度时可提前停止电泳。之后进行转模,条件为200 mA恒流,按分子量确定时间。转膜后分别孵育转铁蛋白受体1(TFRl)、铁反应元件结合蛋白2(IREB2)以及铁蛋白重链(FTH)抗体与相对应的辣根过氧化物酶标记的二抗,最后将含有蛋白标记的膜洗净,涂上化学发光显影液通过显影仪拍照,对结果用ImageJ软件对灰度值进行系统性分析。
1.3.6 血清乳酸脱氢酶(LDH )和肌酸激酶同工酶(CK-MB )浓度的测定 待观测大鼠再灌注过程2 h后,采集其腹主动脉血,以3 200~4 000 r/min条件离心后取上清液作为样品,随后通过ELISA试剂盒检测各组样品中心肌损伤标志物LDH与CK-MB的浓度来确定大鼠缺血再灌注后心肌损伤的程度。同时通过免疫组化检测心肌组织中LDH的表达,其阳性染色为黄色至棕色。
1.3.7 心肌细胞内铁沉积情况 待观测大鼠心肌缺血再灌注情况完毕后当日,收集各组大鼠心肌组织样品,通过铁测定试剂盒对手术后各组心肌组织样本进行检测。使用分光光度计记录样品在520 nm处的光密度(OD)值,通过比较各组OD值确定样品中的组织铁含量水平。
1.3.8 实时荧光定量试验(Real-timePCR ) 待观测大鼠心肌缺血再灌注情况完毕后当日,收集各组大鼠心肌组织样品,将大鼠心肌组织于液氮中磨碎,加入适量TRIzol试剂,通过匀浆机进行匀浆处理。室温放置后10 000 g离心15 min,转移水相,加入等体积异丙醇后再次离心10 min,弃上清液。加预冷75%乙醇溶液洗涤,弃上清后风干,加入40~200 μL的无酶水溶解制得RNA备用。通过制备的RNA反转录成cDNA,然后加入SYBR Green染料与上下游引物混合离心(引物序列见表1),随后于PCR仪上进行扩增,循环完成后做溶解曲线。以采集到的荧光信号值(Ct值)进行相对定量分析,比较各组心肌组织mRNA的表达水平。

表1 所选基因引物序列
1.3.9 流式细胞术检测ROS 待观测大鼠心肌缺血再灌注情况完毕后当日,收集各组大鼠心肌细胞,处理后加入含有荧光探针的DCFH-DA孵育,清洗后流式细胞仪上机检测细胞内ROS含量(激发波长488 nm,发射波长525 nm)。
1.4 统计学处理选用SPSS 24.0软件对实验数据进行分析,计量资料以 “均数±标准差 ”描述,使用t检验。当P<0.05时差异具有统计学意义。
2 结果
2.1 TTC染色检测心肌梗死水平Sham组大鼠心肌正常,I/R组(67.3±3.4)%及I/R+ResL组(44.5±5.8)%心肌梗死区域明显,I/R+ResM组(12.6±1.4)%、I/R+ResH组(10.8±1.7)%与EPO组(5.3±0.8)%心肌梗死区域明显低于I/R组(图1)。

图1 TTC染色结果
2.2 HE病理染色结果Sham组大鼠心肌细胞形态正常,胞浆染色均匀,无明显肌纤维裂状;I/R组心肌细胞核不规则,可见纤维间中性粒细胞,且心肌细胞间间隔较大,胞浆染色不均匀;与I/R组相比,I/R+ResM组病理染色情况较为改善(图2)。
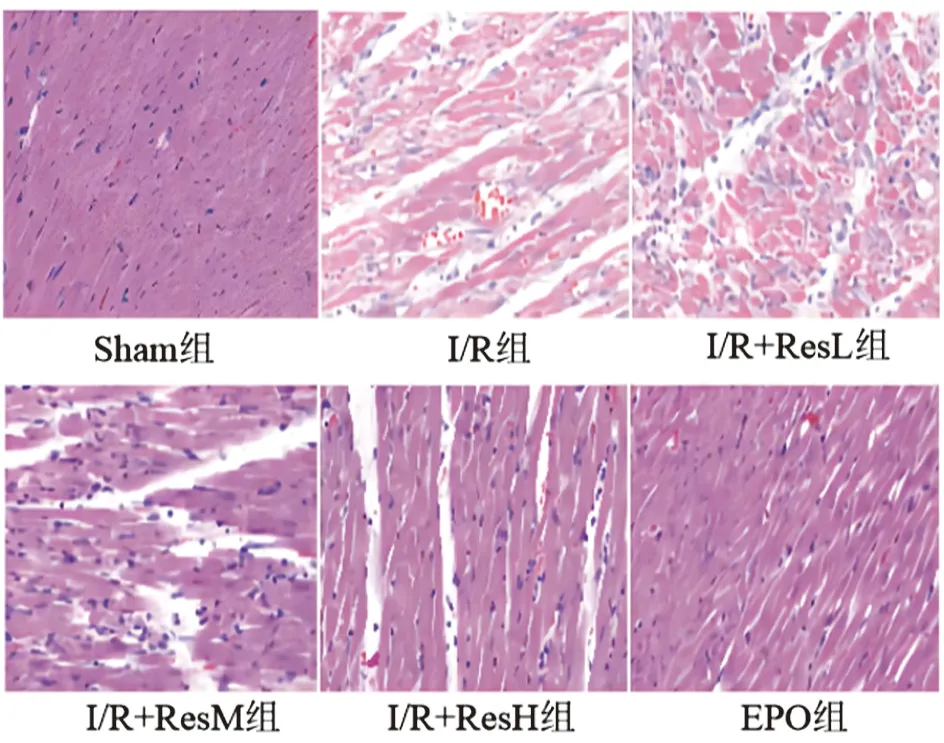
图2 各组大鼠心肌细胞HE染色
2.3 RES对大鼠铁死亡蛋白水平的影响与Sham组相比,I/R组与I/R+ResL组TFRl、IREB2以及FTH表达水平均明显上升(P<0.05);与I/R组相比,I/R+ResL组TFRl、IREB2以及FTH的蛋白表达水平无统计学差异,I/R+ResM组、I/R+ResH组与 EPO组蛋白表达水平均明显下降,存在统计学差异(P<0.05),且I/R+ResM组与I/R+ResH组间无统计学差异(图3)。

图3 各组大鼠心肌细胞中TFRl、IREB2与FTH的蛋白水平
2.4 大鼠缺血再灌注后血清LDH与CK-MB浓度的测定与Sham组行假手术大鼠相比,I/R组、I/R+ResL、I/R+ResM、I/R+ResH组和EPO组大鼠血清中CK-MB与LDH的水平均明显升高;同时I/R+ResL、I/R+ResM、I/R+ResH组和EPO组血清中CK-MB与LDH的水平均明显低于I/R组(P<0.05)(见表2)。

表2 各组大鼠血清LDH与CK-MB水平比较
2.5 各组大鼠心肌组织铁含量检测与Sham组相比,I/R组和I/R+ResM组心肌组织中铁含量明显升高,与I/R组相比,I/R+ResM组心肌组织中铁含量明显降低(见表3、图4)。

表3 各组大鼠心肌组织铁含量检测情况

图4 各组大鼠心肌细胞普鲁士蓝染色
2.6 Res对大鼠心肌细胞中TFRl、IREB2与FTH的mRNA水平影响采用RT-PCR技术观察铁相关基因转铁蛋白受体1(TFRl)、铁反应元件结合蛋白2(IREB2)以及铁蛋白重链(FTH)的mRNA表达水平的变化,与Sham组相比,I/R组和I/R+ResM组TFRl、IREB2以及FTH水平均有所上升;与I/R组相比,I/R+ResM组TFRl、IREB2以及FTH的mRNA表达水平均明显下降(图5)。

图5 各组大鼠心肌细胞中TFRl、IREB2与FTH的mRNA水平
2.7 Res对大鼠心肌细胞中ROS含量影响与Sham组相比,I/R组ROS荧光强度明显增强,与I/R组相比,I/R+ResM组ROS荧光强度明显降低(图6)。

图6 各组大鼠心肌细胞ROS含量
3 讨论
目前缺血性心脏病以及急性心肌梗死等一些疾病仍是临床心脏疾病患者死亡的主要原因,其主要病因多为冠状动脉狭窄或堵塞导致的心肌缺血[7],对其早期治疗方法主要为通过动脉搭桥、心脏外科体循环、心肺脑复苏以及器官移植等方法使心脏组织缺血后重新得到血液再灌注[8]。大量的临床研究表明,缺血再灌注可以通过恢复氧气与血液供给、进行细胞代谢来修复损伤结构、恢复组织与器官的功能,最终达到使患者病情好转的目的[9]。但另一些临床研究发现,缺血后再灌注同样会造成组织、器官的功能紊乱与结构损伤,甚至发生不可逆性损伤。缺血再灌注损伤的发生机制较为复杂,但大多涉及到活性氧突然大量增加,从而导致细胞膜磷脂的损伤、蛋白质的聚合、肽链的断裂以及细胞外基质中胶原纤维的胶原蛋白发生交联,使透明质酸降解,从而引起基质变得疏松,弹性下降[10]。在心肌缺血再灌注过程中,心肌梗死标记物CK-MB与LDH变化情况可作为心肌缺血再灌注模型建立的评价标准。本研究通过结扎大鼠冠状动脉左前降支后再灌注血液,心肌酶学变化结果表明,当缺血再灌注后大鼠心肌组织中CK-MB与LDH浓度均明显升高,提示心肌缺血再灌注模型制备成功。
白藜芦醇作为非黄酮类多酚有机化合物,能通过清除氧自由基发挥抗氧化及心血管保护作用[11]。在本研究中,经白藜芦醇干预后缺血再灌注后大鼠心肌组织中CK-MB与LDH浓度有所下降,这一过程一方面可能与白藜芦醇能通过影响缺血再灌注大鼠心肌组织中丙二醛的表达以及血红素加氧酶-1的水平发挥其抗氧化作用,从而保护心肌组织有关[12]。另一方面,白藜芦醇或许也能够通过抑制心肌细胞内Ca2+的浓度减弱应激反应,从而发挥保护作用[13]。
铁死亡是一种新型的铁离子依赖性细胞死亡方式,其一大特征是细胞内氧化堆积。有研究发现,铁和脂质过氧化物的水平与铁死亡具有密切联系,过量的铁会引起细胞损伤,并参加脂质过氧化物自由基的形成,从而引发细胞铁死亡[14]。这一过程可能是由于心肌缺血再灌注导致的氧化堆积促使细胞外的铁蛋白进入细胞内,同时抑制铁离子的正常代谢,造成细胞内铁含量蓄积升高,最终导致细胞内发生铁蛋白自噬[15],引发细胞释放大量的游离铁,增加细胞损伤,最终造成细胞铁死亡的发生。
为了探究白藜芦醇对心肌细胞损伤铁死亡的影响,本研究通过在大鼠缺血再灌注前应用白藜芦醇,发现与单纯I/R组相比,白藜芦醇的应用能显著抑制TFRl、IREB2与FTH的mRNA与蛋白水平的表达,结果表明抑制水平与剂量呈正相关,但当白藜芦醇浓度提升至1.5 mg/100 g后其可观测到平台期效应。此外细胞内铁离子含量被观测到显著降低,这一过程可能是由于对于存在大量铁离子的心肌细胞,白藜芦醇能够通过抑制心肌细胞铁摄取速度与效果、提升细胞内铁代谢效率及抑制铁蛋白自噬,从各种离子通道降低心肌细胞内聚集的大量铁离子,避免游离铁被释放造成损伤,从而避免引起大鼠心肌细胞铁死亡的发生。组织铁检测试剂盒与ROS荧光结果也说明了白藜芦醇能降低细胞内的铁含量。虽然应用白藜芦醇后心肌细胞内铁含量仍高于正常未损伤心肌细胞,但可以在一定程度上通过抑制铁死亡来减轻心肌缺血再灌注引起的损伤。
综上所述,本研究通过建立缺血再灌注大鼠模型,通过应用白藜芦醇发现白藜芦醇可以有效改善心肌细胞损伤后的铁离子相关基因TFRl、IREB2与FTH的表达,从而抑制心肌细胞铁摄取、提高铁代谢以及抑制铁蛋白自噬,改善心肌组织由于缺血再灌注导致的铁过量引发心肌细胞铁死亡造成的损伤,发挥保护心肌组织的作用。本研究为开展白藜芦醇的心肌保护作用提供了新的思路与研究证据。
