供体猪心在UW 液中的保存时间和温度对其组织结构的影响
2022-02-13王翔宇宋江平舒松仁任杰郑哲胡盛寿马艳
王翔宇,宋江平,舒松仁,任杰,郑哲,胡盛寿,马艳
心力衰竭被认为是现代社会的一种流行病,全球患病人数超过3 770 万[1],且随着社会老龄化的进程以及基于循证医学的治疗方案的实施,慢性心力衰竭的患病率仍在不断上升,许多患者进展到终末期心力衰竭,给全球经济造成巨大负担[2-4]。目前,心脏移植被认为是终末期心力衰竭患者的最佳选择,在心脏移植50 多年的历史中[5],心肌保护液的发明和改进对于扩大移植心脏供体池、提高心脏移植手术成功率和患者术后的远期存活率有重要意 义[6]。国际上常用的心肌保护液有HTK 液(histidine-tryptophan-ketoglutarate cardioplegia)、Celsior 液、UW 液(University of Wisconsin solution)。最近的一项Meta 分析表明,与Celsior 液相比,UW液保存可减少器官缺血性坏死;与HTK 液相比,用UW 液保存器官时,受体存活率更高[7]。在供体心脏的运输过程中,心肌保护液的温度和心脏的冷缺血时间是影响心脏结构和功能的重要因素。目前临床上静态低温(4℃)保存是器官体外保存的常用方法,主要是因为低温可以抑制细胞的生物化学活动,导致心脏对能量的需求降低[8],从而尽可能延长心脏可以耐受的冷缺血时间[9]。但目前供体心脏可耐受的冷缺血时间仍然是限制移植心脏供体池容量的重要因素,冷缺血时间超过4 h 会显著增加受体心脏移植后死亡率[10]。研究表明,亚常温保存(如21℃,结合特制的心脏保存液)[11]以及过冷保存(使用特制保存液和制冷系统,低于0℃时仍然不凝固)[12]可有效延长供体心脏可耐受的冷缺血时间;但尚未有研究比较UW 液在传统低温保存、亚常温保存及过冷保存条件下对供体心肌结构的影响。本研究试图通过病理染色的方式,探究UW 液的不同保存温度和外置时间对供体心脏结构的影响。
1 材料与方法
实验动物:中华小型猪18 头,8~17 月龄,体重26.50(25.80,27.65)kg,购自国家心血管病中心动物实验中心。
实验试剂及仪器:UW 液(ViaSpan,DuPont Pharmaceuticals,美国),全自动病理染色机(Thermo Fisher Scientific,美国),全自动数字玻片扫描系统(蔡司,德国)。
麻醉方法:参照Wei 等[13]发表的文献,通过肌内注射由阿托品(0.05 mg/kg)、舒泰(3 mg/kg)、甲苯噻嗪(1.5 mg/kg)组成的混合物进行麻醉。通过耳缘静脉放置22 G 静脉导管,给予乳酸林格液以维持血容量,必要时静脉注射异丙酚(2 mg/kg)。
供体猪心的获取:根据现行的中国心脏移植供体心脏的获取规范[14],在猪达到良好的麻醉状态后,由专业的心脏移植团队按照下述流程开展供体猪心获取:(1)消毒铺巾;(2)切皮:使用电刀切皮,并根据供体状态来补充血容量,必要时给予升压药物静脉注射;(3)锯胸骨:劈开胸骨后,将胸骨牵开器撑开,并在牵开器两侧各垫一块打开的无菌治疗巾,切开双侧胸膜;(4)阻断:先阻断上下腔静脉,再阻断升主动脉,然后立刻行肺静脉及下腔静脉切开减压;负压吸引温血水,冰屑包裹心脏降温;(5)灌注:用托马斯液灌注,监测并记录灌注压力,同时用手感知主动脉根部和左心室,在保证充分灌注的同时避免左心室高张力,灌注至心脏完全停跳并触摸柔软;(6)切取供体心脏:心脏灌停后,向心包腔添加无菌冰屑以降温;左手轻轻撩起心脏,以此离断下腔静脉和左右肺静脉;游离至左心房顶及左右肺动脉水平时,将心脏放回心包腔,用冰屑心脏包裹以降温;再游离弓近端和上腔静脉,分别离断后显露左右肺动脉,将肺动脉离断后沿组织间隙游离到左心房顶水平,最后将心脏大血管完整取下;(7)供体心脏检查:将供体心脏置于装满冰屑的容器,检查心脏有无损伤、结构异常及冠状动脉病变等,然后用UW 液灌注,此时也要密切关注主动脉根部压力情况,以保证左心室无异常充盈;(8)外科医生更换无菌手套后,用3 000 ml 冰生理盐水(0℃~4℃)冲洗心脏。
供体猪心在UW 液中的保存方法:在包装袋内注入500 ml 的UW 液,将获取的供体猪心分别放入包装袋中,然后整体放入设置成不同温度(21℃、4℃、-4℃)的冰箱中。根据存放的温度以及供体猪心的外置时间,将取下的猪心保存在9 种条件下,分别为21℃、3 h,2℃、6 h,21℃、9 h,4℃、3 h,4℃、6 h,4℃、9 h,-4℃、3 h,-4℃、6 h,-4℃、9 h,每种保存条件下保存2 个猪心。
猪心心脏组织取材:在相应的温度和时间下保存后,借鉴移植心脏标准化取材流程[15],对猪心进行组织取材:(1)心脏称重、拍照;(2)将心脏解剖为6 个部分:左心室前壁、左心室侧壁、左心室后壁、室间隔、右心室前壁、右心室后壁;(3)测量主动脉瓣周径、肺动脉瓣周径、左心室室壁厚度、右心室室壁厚度、室间隔厚度;(4)石蜡病理标本的制备:在左心室前壁取一块全层组织,并用10%福尔马林保存。
病理组织切片制备:上述心肌组织经酒精梯度脱水后,包埋于石蜡中,用轮转式石蜡切片机制作5 mm 厚的病理切片,置于载玻片上。
HE 染色及图像分析:将恒温摊片烤片机温度设置成68℃,再将载玻片在其上放置45 min,之后在全自动机中进行HE 染色。
统计学方法:采用 SPSS 23.0 统计软件进行统计分析,不符合正态分布的计量资料以中位数(P25,P75)表示。
2 结果
18 头中华小型猪及其心脏基本特征:本研究共纳入18 头中华小型猪,编号为P1-P18,各猪的UW 液保存条件、月龄、体重及心脏质量见表1。猪心脏解剖实物图见图1。

表1 18 头中华小型猪及其心脏基本特征
图1 编号P13 中华小型猪心脏解剖实物图
不同UW 液保存条件下中华小型猪心肌组织的HE 染色结果(图2):在21℃的UW 液中保存3 h 时,猪心心肌细胞即出现水肿(图2 黑色箭头),少量心肌细胞核溶解(即心肌细胞坏死,图2 蓝色箭头),并伴有少量炎症细胞浸润(图2 红色箭头),保存6 h时出现部分心肌细胞坏死,保存9 h 时发生大面积心肌细胞坏死。在4℃的UW 液中保存3 h 时,猪心心肌细胞出现少量炎症细胞浸润,保存6 h 时出现少量心肌纤维溶解(图2 黄色箭头),保存3 h 和6 h 时均未发现明显的心肌细胞水肿和坏死,但保存9 h 时出现明显的心肌细胞坏死。在-4℃的UW 液中保存3 h 时,猪心心肌细胞间的正常连接即被破坏,导致心肌细胞分离(图2 白色箭头),保存6 h 时出现明显的心肌细胞坏死,保存9 h 时心肌坏死面积增大。
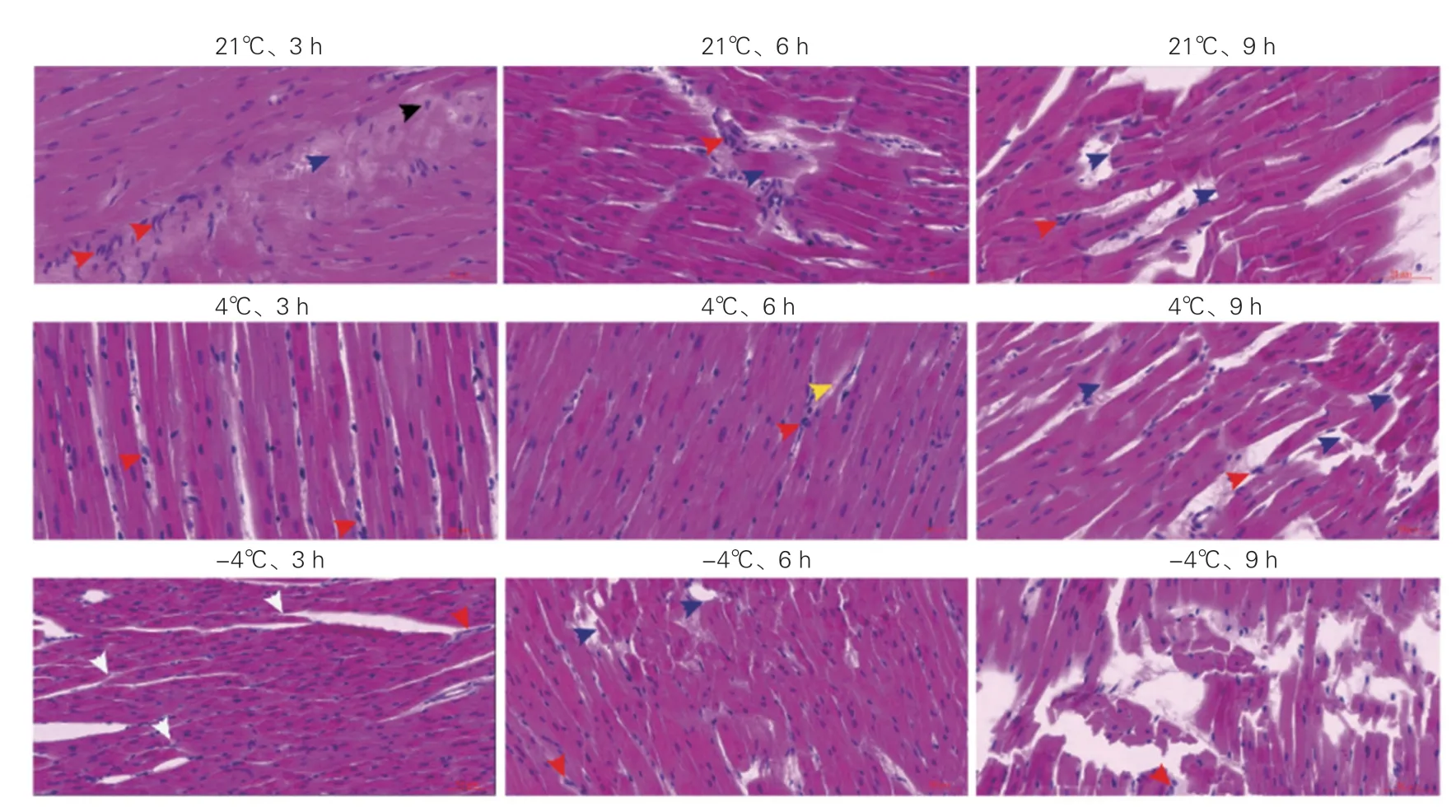
图2 不同UW 液保存条件下中华小型猪心肌组织的HE 染色图片(×40)
3 讨论
供体心脏在移植前的保存过程中的缺血性损伤是影响移植后心脏功能和受体存活时间的重要因素,而心肌保护液的温度以及供体心脏在保护液中的保存时间可影响缺血性损伤的程度[16]。
本实验通过用3 种不同温度的UW 液保存猪心,每种温度下分别保存3 h、6 h、9 h,然后对猪心进行组织取材及病理染色。HE 染色结果显示,在3种不同温度下,猪心在保存过程中的缺血性损伤均随着保存时间延长而加重,表现为心肌细胞水肿程度加深、心肌组织溶解和坏死面积变大。在21℃的UW 液中保存3 h 时,猪心心肌细胞即出现明显的水肿,而在4℃和-4℃的UW 液中保存3 h 时,猪心心肌细胞并未出现水肿。这可能与21℃下心肌细胞的代谢水平较高有关,据文献报道,温度每升高10℃,心肌细胞的代谢水平约上升为原来的两倍[17],心肌细胞内三磷酸腺苷消耗加快,导致细胞膜钠钾泵的功能无法维持,造成细胞水肿。在4℃的UW液中保存6 h 时,猪心心肌细胞已经出现坏死,保存9 h 时坏死更加明显。在-4℃的UW 液中保存 3 h 时,猪心心肌细胞间的距离已经增大,说明细胞之间的连接被破坏,这可能与低温诱导的细胞膜损害以及组织内冰晶的形成有关[18-19],而心肌细胞之间的分离将导致心肌细胞无法同时兴奋和收缩[20],极大地损害心脏功能。
本实验还发现,在3 种不同温度的UW 液中保存3 h 后,猪心心肌组织中即出现少量炎症细胞,但是炎症细胞数量并不多,且并未随保存时间的延长而明显增多,这可能与心脏离体后失去炎症细胞的来源有关。后续研究可以将切除后的供体猪心在体外保存后,用受体猪的血来灌注供体心脏,或者将供体猪心移植到受体猪体内,适当时间后再取心脏组织进行病理学研究,有助于更科学地评估不同体外保存条件对心肌炎症细胞以及缺血/再灌注损伤的影响。
本实验结果对临床供体心脏的保存有一定的指导意义。首先,由于在不同温度下保存的供体心脏的缺血性损伤均随着保存时间的延长而加重,所以在临床工作中应尽量缩短供体心脏的体外保存时间。其次,保存温度低于0℃会导致心肌组织内形成冰晶,进而损害供体心脏的结构和功能,故临床工作中应避免0℃以下保存供体心脏。由于保存温度升高会加快细胞代谢速率,进而缩短心脏可耐受的体外保存时间,故供体心脏在体外转运过程中应保存于0℃以上的合适低温范围内。
本实验证实,体外保存时间延长可加重供体心脏的缺血性损伤。21℃和-4℃的UW 液静态保存均不利于心肌组织和细胞结构的维持。在4℃的UW液中静态保存3 h 内,不会造成猪心明显的心肌细胞坏死,但保存超过6 h 时则会对心肌细胞产生明显的缺血性损害,故临床工作中应尽量缩短供体心脏的体外转运时间,并使之一直保存于0℃以上的合适低温范围内。
利益冲突:所有作者均声明不存在利益冲突
