泛耐药鲍曼不动杆菌生物被膜形成能力与同源性分析*
2022-02-13孟千琳凌保东
孟千琳,凌保东
(1.成都医学院结构特异性小分子药物研究四川省高校重点实验室,成都 610500;2.成都医学院药学院,成都 610500)
近年来,泛耐药鲍曼不动杆菌(extensively drug resistantAcinetobacterbaumannii,XDRAB)检出率呈逐年上升趋势,被称为“21世纪革兰阴性杆菌中的MRSA”[1],对全球公共卫生构成重大威胁。鲍曼不动杆菌的致病性与多种毒力因子有关,生物被膜作为重要的毒力因子,具有极强的黏附性、抗吞噬性、耐药性,有助于鲍曼不动杆菌在医院环境中的生存与转移[2]。相关分子流行病学研究表明[3],鲍曼不动杆菌流行菌株具有不同的多位点序列分型(multilocus sequence typing,MLST),鲍曼不动杆菌克隆的基因组主要分为3个国际克隆组:国际克隆Ⅰ (IC1)、国际克隆Ⅱ(IC2)和国际克隆Ⅲ(IC3),其中IC2是欧洲和亚洲的主要克隆系。有研究表明[4],亚洲国家的耐碳青霉烯类鲍曼不动杆菌以IC2的克隆复合体(CC92)为主。此外,肠杆细菌基因间重复序列聚合酶链反应(ERIC-PCR) 常用于研究从不同标本中收集的鲍曼不动杆菌菌株之间的关系,有助于确定鲍曼不动杆菌与流行性克隆的传播关系[5]。本研究通过MLST与ERIC-PCR对泛耐药鲍曼不动杆菌进行同源性分析,同时检测泛耐药鲍曼不动杆菌的生物被膜形成能力,进一步掌握院内鲍曼不动杆菌流行现状,以期为临床防控泛耐药鲍曼不动杆菌感染提供依据。
1 材料与方法
1.1材料
1.1.1菌株来源 37株XDRAB来自成都医学院第一附属医院2018年1月—2020年7月患者,痰液20份,灌洗液9份,导管4份,伤口分泌物、脓液、尿、脑脊液各1份,其中临床分布重症医学科15株,呼吸科重症监护病区11株,外科6株,内科5株。质控菌金黄色葡萄球菌ATCC29213、大肠埃希菌ATCC25922、铜绿假单胞菌ATCC27853、大肠埃希菌DH5α为本实验室保存。
1.1.2仪器与试剂 恒温培养箱(上海一恒科技有限公司)、生物安全柜(Thermo Fisher Scientific)、酶标仪(SpectraMa190)、96孔细胞培养板(科兹莫生物科技有限公司)。胰酪大豆胨液体培养基(TSB, 青岛海博生物技术有限公司,批号:20200815),结晶紫(成都金山化学试剂有限公司,批号:20170416)、磷酸盐缓冲液(PBS,上海生工生物工程有限公司,批号:20201228)、聚合酶链反应(PCR)引物和测序(北京擎科生物科技有限公司)、2×Taq Master Mix (Dye Plus,南京诺唯赞生物科技股份有限公司)。
1.2方法
1.2.1XDRAB药敏试验 参照美国临床实验室标准化协会(CLSI2020)标准,金黄色葡萄球菌ATCC29213、大肠埃希菌ATCC25922、铜绿假单胞菌ATCC27853为质控菌株,采用微量肉汤稀释法测定碳青霉烯类、β-内酰胺类、氨基苷类、喹诺酮类、多粘菌素类等16种抗菌药物的最低抑菌浓度(MIC)值。
1.2.2XDRAB生物被膜形成能力检测 菌液的制备:将细菌接种于LB固体培养板上,37 ℃,孵育16~20 h后,挑取单克隆于0.9%氯化钠溶液200 μL中,吹打混匀,取100 μL,使用酶标仪测定600 nm波长处吸光度(A值),用0.9%氯化钠溶液调整至A600值=0.1,即为麦氏0.5浓度,细菌含量达到1×108CFU·mL-1。结晶紫染色法(crystal violet staining,CVS):参照文献[6-7]的实验方法,并稍作调整,使用96孔细胞培养板,以大肠埃希菌DH5α为阴性对照组,菌株统一设置6个复孔,每孔加入A600值=0.1菌液20 μL和TSB培养基180 μL,37 ℃,孵育24 h。次日吸出培养基,用PBS 200 μL清洗3次,空气干燥20 min,0.1%结晶紫染色20 min,吸出结晶紫,重复PBS清洗3次,空气干燥20 min,加入95%乙醇溶解,酶标仪测定570 nm下A值。生物被膜形成能力判定标准为:①阴性:A模型对照≤A阴性对照;②弱阳性:A阴性对照
1.2.3MLST分型 鲍曼不动杆菌管家基因序列参照MLST数据库Oxford方案(https://pubmlst.org/organisms/acinetobacter-baumannii),包括7个管家基因,分别为:gltA、gyrB、gdhB、recA、cpn60、gpi和rpoD。PCR反应体系:2 × Taq Master Mix 7.5 μL,上、下游引物各0.5 μL,DNA模板1 μL,ddH2O 5.5 μL,共15 μL。PCR反应条件为:94 ℃预变性5 min,94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,共30次循环,72 ℃延伸5 min。扩增片段测序后与MLST数据库进行比对获得等位基因谱,按照gltA-gyrB-recA-cpn60-gpi-rpoD的排列顺序输入数据库中获得对应菌株的序列型(sequence type,ST)进行分析。
1.2.4ERIC-PCR分型 参照文献[8]合成引物,PCR反应体系:2 × Taq Master Mix 25 μL,上、下游引物各2 μL,DNA模板10 μL,ddH2O 11 μL,共50 μL。PCR反应条件为:94 ℃预变性5 min,94 ℃变性30 s,40 ℃退火1 min,72 ℃延伸1 min,共35次循环,72 ℃延伸10 min。使用Image Lab 5.0软件定量工具自动分析条带数量进行同源性分析,参照文献[9]比较菌株间相似性,以主条带位置和数量相同定义为同一基因型。
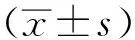
2 结果
2.1XDRAB对抗菌药物的耐药情况 37株XDRAB除对多粘菌素类、替加环素敏感外,其余抗菌药物均耐药,具体结果见表1。
2.2XDRAB培养24 h后生物被膜形成能力检测 细菌培养24 h后,使用结晶紫染色法对生物被膜形成进行定量检测,与阴性对照组DH5α比较,4株为强被膜形成菌株,7株为中被膜形成菌株,19株为弱被膜形成菌株,其余为阴性7株。
2.3MLST对XDRAB分型结果 经测序的37株XDRAB,按照ST分型和等位基因编号后结果显示,37株XDRAB分为3种ST序列型,其中34株XDRAB为ST208型,2株为ST195型,1株为ST368型。ST208型菌株主要分离于呼吸科重症监护病区(10/34)和重症医学科(14/34),分离标本主要来源于痰液(18/34)和灌洗液(8/34)。与全球序列数据库进行比对,37株XDRAB均属于国际克隆组IC2的克隆复合体(CC92),说明CC92为XDRAB感染流行的主要克隆复合体。
2.4ERIC-PCR对XDRAB扩增结果 37株XDRAB经ERIC-PCR扩增后,通过琼脂糖凝胶电泳,形成2条左右的碱基条带,条带长度为250~500 bp,通过分析,菌株被分为I型(22株),II型(15株),共2种类型,结果见图1。

M:DNA2000Marker;1-9,11,13,15-17,19,21-24为I型;其余为Ⅱ型。图1 部分XDRAB的ERIC-PCR图谱M:DNA2000Marker; 1-9,11,13,15-17,19,21-24 are type I; the other are type Ⅱ.Fig.1 ERIC-PCR of partial XDRAB strains
3 讨论
XDRAB生物被膜的形成使临床面临严峻挑战[10],生物被膜形成过程主要分为四个阶段:初始黏附、增殖、形成成熟生物被膜、生物被膜的分散再定植。生物被膜一旦形成,可通过渗透限制、营养限制、基因表达上调、免疫逃逸等耐药机制为鲍曼不动杆菌提供保护模式并增强对抗菌药物的抵抗力[11-12]。本研究中37株XDRAB经检测有30株具有生物被膜形成能力,81%以上XDRAB均会形成生物被膜,是导致医院慢性感染和难治性感染的反复发作的重要原因。
为避免XDRAB在院内感染继续扩散,选择有效的准确的菌株同源性分析方法至关重要。MLST作为分子流行病学和菌株种群遗传分析的通用方法[13],通过分析细菌7个管家基因的等位基因内部片段的DNA序列,清晰呈现每个分离株的序列类型。分离株的遗传相关性可以通过等位基因图谱之间的差异矩阵以树状图的形式直观呈现[14]。ERIC-PCR指纹图谱是最有效区分鲍曼不动杆菌的分子分型技术之一[15],包含重复序列(如:ERIC序列)的细菌基因组可通过该序列快速评估细菌分离株的克隆变异性。本研究采用MLST和ERIC-PCR两种国际通用分子分型技术对37株XDRAB进行同源性分析,MLST结果显示,ST208型为主要分型,其次为ST195和ST368,均属于CC92,该结果与KIM等[16]研究结果一致,此外,QU等[17]研究表明,ST208型已成为中国西部地区鲍曼不动杆菌感染暴发的主要序列型。ERIC-PCR结果显示,37株XDRAB分为Ⅰ型(22株)、Ⅱ型(15株),由于ERIC基因为保守序列,其扩增产物无法完全确定,可能会出现部分电泳条带缺失、模糊等不确定因素[18],因此,本实验选择采用两种分子分型技术对XDRAB进行同源性分析,以保证更全面地呈现XDRAB的流行病学趋势。
目前,关于XDRAB的流行病学与毒力因子相关性分析的研究很少。生物被膜作为重要的毒力因子[19],其形成的分子机制和基因主要包括Csu基因座(CsuAB/A/B/C/D/ E)参与菌毛合成,Pga基因座参与编码多聚-N-乙酰基葡糖胺(PNAG),OmpA参与编码外膜蛋白,Bap参与编码生物被膜相关蛋白[20]。相关研究表明[21],ST208携带主要生物被膜形成基因,其中97.7%存在Csu基因,ST195对Pga和OmpA基因阳性率高。由于本研究菌株ST分型主要以ST208为主,所以无法深入分析生物被膜形成能力与ST分型的相关性,对于XDRAB流行病学与毒力因子相关性分析,有待进一步研究。
综上所述,XDRAB导致的院内感染的治疗作为全球公共卫生的重大难题,亟待制定出可控治疗方案,本研究采用目前国际常用分子分型技术MLST与ERIC-PCR对XDRAB进行流行病学分析,针对ST208菌株需要严格注意感染路径,避免交叉感染,尽可能降低临床感染风险。
