浓香花生油脂体的提取工艺优化及品质分析
2022-02-12张丽霞魏松丽朱闪闪孙晓静
张丽霞,魏松丽,朱闪闪,孙 强,芦 鑫, 孙晓静,金 璐
(1.河南省农业科学院 农副产品加工研究中心,郑州 450002; 2.开封市质量技术监督检验测试中心,河南 开封 475004)
花生是我国主要的油料作物之一,也是国民食用油脂和蛋白质的重要来源。我国41%~47%的花生用于榨油[1],花生加工业存在产业链短、缺乏精深加工等问题[2]。随着国内对花生加工产品消费需求持续增长,加快花生产业转型升级的需求更加迫切。花生油脂体是花生中储存脂肪的重要细胞器,由磷脂、油体蛋白和中性脂组成[3],具有风味清香、乳化性好、稳定性佳等特点,在食品、化妆品、饲料及医药等行业有广阔的应用前景[4-5]。因此,进行花生油脂体相关研究对提高花生产业的科技水平具有现实意义。
浓郁、独特的烘烤香气是花生产品备受欢迎的重要原因之一,因而开发浓香花生油脂体对于提高油脂体的工业转化率和应用价值尤为必要,但目前国内相关研究报道较少。有研究[6]对比了烘箱烘烤、微波加热和红外辐射3种预处理方式对花生油脂体的增香效果,结果表明红外辐射预处理制备的花生油脂体香气强度最大,油脂体持水能力和乳化性显著增加。也有研究[7]对浓香花生油脂体的香气成分进行分析,筛选出了2-乙基-6-甲基吡嗪、N-甲基吡咯等10种特征风味物质。这些研究为浓香花生油脂体的开发利用奠定了基础,但未对制备工艺作进一步探讨,且缺乏对浓香花生油脂体品质的科学评价。酶法是提取花生油脂体的常用方法[8-9],将提取普通花生油脂体的最佳工艺参数应用于提取浓香花生油脂体,得率低,这可能与加热对花生细胞壁[10]及组成成分[11]的影响有关。Farah等[12]研究表明,焙烤对花生油脂体的外观、功能特性及蛋白膜有显著影响。因此,有必要对浓香花生油脂体的品质作进一步分析。
本文以红外辐射预处理的烘烤花生仁为原料,研究液料比、加酶量、酶解时间和酶解温度对浓香花生油脂体得率的影响,通过响应面设计优化提取工艺,并对所得浓香花生油脂体进行理化指标、氨基酸组成等品质分析,以期为花生油脂体的工业化应用提供理论依据。
1 材料与方法
1.1 试验材料
1.1.1 原料与试剂
花生仁,品种为豫花37,河南邦农种业有限公司提供。复合酶(纤维素酶、果胶酶与木聚糖酶比例为63∶24∶13)[13],自制;纤维素酶(酶活2.0×104U/g)、果胶酶(酶活3.0×104U/g)、木聚糖酶(酶活3.0×104U/g),购于庞博生物工程有限公司;磷酸氢二钠、磷酸二氢钠、盐酸等,为分析纯;去离子水,实验室自制。
1.1.2 仪器与设备
T-18-DS-25型数显高速分散机,德国艾卡有限公司;纳米粒度与固体表面Zeta电位分析仪,美国麦可奇有限公司;Hitachi 835-50氨基酸分析仪,日本日立公司;DXF-060型手提式中药粉碎机,广州市大祥电子机械设备有限公司;PL203型电子天平,梅特勒-托利多仪器(上海)有限公司;SHA-B型水浴恒温振荡器;DL-5-B型大容量低速离心机。
1.2 试验方法
1.2.1 浓香花生油脂体的提取工艺
将花生仁平铺一层置于140℃红外烘烤箱中烘烤30 min,取出冷却至室温后脱红衣,得到红外烘烤增香预处理花生[6-7],备用。称取红外烘烤增香预处理花生80 g,高速粉碎机粉碎后过0.15 mm(100目)筛,得到花生粉,备用。向花生粉中加入一定量去离子水,搅拌均匀后以12 000 r/min均质5 min,再加入适量复合酶,调节pH为5.5,并将其放入恒温水浴中酶解一定时间。酶解完成后取出,置于90 ℃恒温水浴中灭酶10 min,待其冷却至室温,于4 500 r/min 离心10 min,收集上层,即得新鲜浓香花生油脂体,冷冻干燥后得到干基浓香花生油脂体。
同时取等量未经红外烘烤增香预处理的花生仁,按照上述工艺制备花生油脂体,作为对照组。
1.2.2 花生油脂体得率的计算
花生油脂体的得率(Y)按式(1)计算。
(1)
式中:m为干基花生油脂体质量,g;M为红外烘烤增香预处理花生原料的质量,g。
1.2.3 理化指标测定
1.2.3.1 色泽
取20 mL新鲜浓香花生油脂体于培养皿中,置于装有照明系统的暗箱中,固定焦距和曝光度拍摄样品图像。采用Adobe Photoshop CS6软件对样品照片取色,每个样品取色3次,样品色泽由红值(R)、绿值(G)和蓝值(B)的平均值综合评定[14]。
1.2.3.2 平均粒径
取一定量新鲜浓香花生油脂体,用磷酸盐缓冲液(pH 7.2)稀释10倍后摇匀。采用纳米粒度与固体表面Zeta电位分析仪对样品稀释乳液进行测定,并以体积平均径(D(4,3))表示样品的平均粒径。测定条件:温度25 ℃,样品折光率1.33,散射光检测角度90°,扫描范围0.3 nm~3 500 μm。
1.2.4 氨基酸组成测定
按照GB 5009.124—2016进行氨基酸组成的测定。将新鲜浓香花生油脂体在110 ℃下用6 mol/L盐酸水解24 h后,用异硫氰酸苯酯衍生化处理;然后通过配备2.6 mm×150 mm离子交换柱的Hitachi 835-50氨基酸分析仪进行样品氨基酸组成的测定。
1.2.5 冻融稳定性测定
分别取等量3组新鲜浓香花生油脂体至具塞平底玻璃管中,在-20 ℃的超低温冰箱中储存24 h,后置于30 ℃的恒温水浴中解冻2 h,25℃常温静置1 h,记为1个冻融循环,测定样品乳清层高度和乳液总高度后,在-20 ℃继续冷冻24 h,重复以上操作2次,即为3个冻融循环。
根据每次测定的乳清层高度和乳液总高度,按照式(2)计算乳析指数(CI),其中第2、第3循环中乳清层高度为乳清层总高度。
(2)
式中:H1为乳清层高度,cm;H2为乳液总高度,cm。
1.2.6 数据处理
所有试验进行3次平行试验,分别采用Origin 8.5软件和Design-Expert V8.0.6软件对数据进行绘图和响应面分析。采用Duncan法进行组间差异显著性分析。
2 结果与分析
2.1 单因素试验
2.1.1 液料比对浓香花生油脂体得率的影响
在加酶量400 U/g、酶解温度60 ℃、酶解时间90 min条件下,考察液料比对浓香花生油脂体得率的影响,结果见图1。

注:不同字母表示差异显著,P<0.05。下同
由图1可知:浓香花生油脂体得率随液料比的增加而增大;当液料比为6∶1时,浓香花生油脂体得率最大((42.40±0.47)%),继续增加液料比,得率变化不显著(P>0.05)。这是因为液料比处于低水平时,反应体系黏度较大,不利于酶分子和底物的迁移和反应[15];而液料比较大时,导致酶和底物的浓度降低,酶解程度受到影响[16]。因此,选择6∶1为最适液料比。
2.1.2 加酶量对浓香花生油脂体得率的影响
在液料比6∶1、酶解温度60 ℃、酶解时间90 min条件下,考察加酶量对浓香花生油脂体得率的影响,结果见图2。

图2 加酶量对浓香花生油脂体得率的影响
由图2可知:随着加酶量的增加,浓香花生油脂体得率逐渐增大(P<0.05);在加酶量为400 U/g时,得率最大,继续增加加酶量,得率无明显增加(P>0.05)。这是因为底物浓度固定时,加酶量越大,体系反应速率越大,酶解越彻底[17],但当加酶量增加到一定程度后,酶与底物蛋白的结合达到饱和状态[18],酶解效率无显著变化。综合考虑,选取400 U/g为最适加酶量。
2.1.3 酶解时间对浓香花生油脂体得率的影响
在液料比6∶1、加酶量400 U/g、酶解温度60 ℃条件下,考察酶解时间对浓香花生油脂体得率的影响,结果见图3。

图3 酶解时间对浓香花生油脂体得率的影响
酶解时间的长短是影响酶解效果的关键因素之一[19]。由图3可知:随着酶解时间的延长,浓香花生油脂体得率整体呈上升趋势;在酶解时间从40 min延长到100 min的过程中,浓香花生油脂体得率呈快速上升趋势(P<0.05),并在100 min时达到最大值((44.75±0.32)%)。这是由于反应前期,酶与底物充分接触,反应速率较快;继续延长酶解时间,得率变化不大,此时酶解反应已趋于完全。综合考虑,选取100 min为最适酶解时间。
2.1.4 酶解温度对浓香花生油脂体得率的影响
在液料比6∶1、加酶量400 U/g、酶解时间100 min条件下,考察酶解温度对浓香花生油脂体得率的影响,结果见图4。
由图4可知:酶解温度在40~50 ℃范围内,浓香花生油脂体得率随酶解温度升高而显著增大(P<0.05);但当酶解温度高于50 ℃时,由于温度过高,部分酶空间结构改变,酶解效率大大降低,得率大幅下降(P<0.05)。温度对酶解反应的影响较复杂,一方面温度的升高能增加酶促反应的速率,另一方面温度过高又致使酶变性失活,反应速率下降[20]。因此,选择50 ℃为最适酶解温度。

图4 酶解温度对浓香花生油脂体得率的影响
2.2 响应面试验
2.2.1 响应面设计与结果
在单因素试验的基础上,根据Box-Behnken试验设计原理,以加酶量(A)、液料比(B)、酶解时间(C)和酶解温度(D)为自变量,以浓香花生油脂体得率(Y)为响应值,采用Design-Expert V8.0.6设计四因素三水平试验对浓香花生油脂体的提取工艺进行响应面优化。响应面试验因素与水平见表1,响应面试验设计及结果见表2。

表1 响应面试验因素与水平
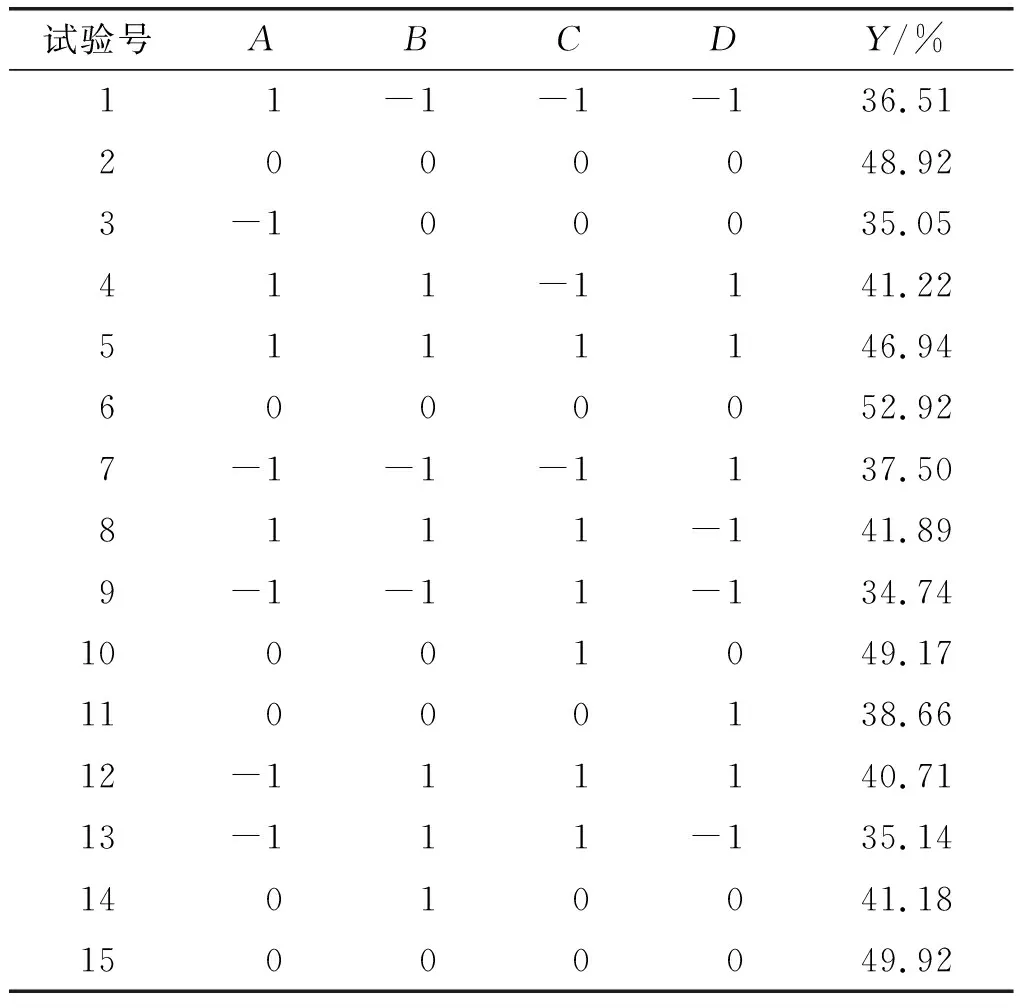
表2 响应面试验设计及结果

续表2
2.2.2 回归模型建立与方差分析
利用Design-Expert V8.0.6对试验结果进行多元回归拟合分析,建立浓香花生油脂体得率与加酶量、液料比、酶解时间和酶解温度的二次多项回归模型,该模型对应的二次多元回归方程为:Y=50.11+2.52A+1.47B+1.80C+1.61D+0.49AB+0.31AC-0.62AD-0.092BC-0.022BD+0.28CD-2.13A2-3.03B2-2.21C2-3.61D2。
对回归模型进行方差分析,结果如表3所示。

表3 方差分析

2.2.3 验证试验
通过Design-Expert V8.0.6软件对回归模型进行求解得到提取浓香花生油脂体的最佳工艺条件为加酶量463.21 U/g、液料比6.28∶1、酶解时间109.19 min、酶解温度50.93 ℃。考虑到试验的可操作性,将工艺条件调整为加酶量460 U/g、液料比6∶1、酶解时间110 min、酶解温度51 ℃,在此条件下进行3组平行验证试验,得到浓香花生油脂体的平均得率为50.89%,与预测值(51.67%)接近,表明该回归模型和最佳条件切实可靠,可以用来优化浓香花生油脂体的提取工艺。
2.3 浓香花生油脂体的品质
2.3.1 理化指标(见表4)
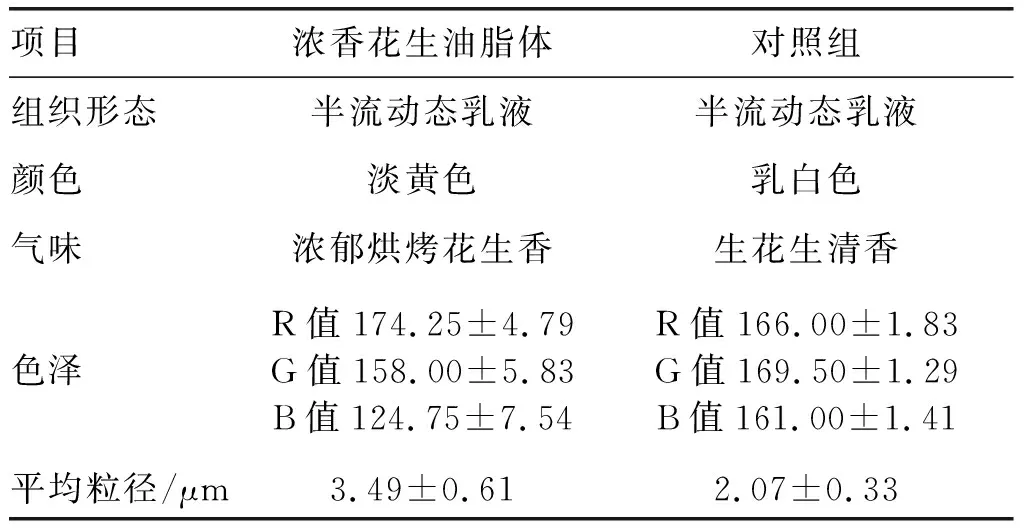
表4 浓香花生油脂体的理化指标
由表4可以看出:浓香花生油脂体呈半流动态乳液状,淡黄色,具有浓郁的烘烤花生香,相较于对照组油脂体特色明显;浓香花生油脂体的R值显著高于对照组,而G值和B值明显低于对照组,表明浓香花生油脂体呈现出更多的红色、更少的绿色和蓝色,该结果与油脂体颜色观测结果一致;浓香花生油脂体平均粒径稍大于对照组,原因可能是红外辐射预处理使浓香花生油脂体中的蛋白质油-水界面排布发生改变,界面张力增加,界面压减小,从而使部分油脂体发生絮凝和聚集[22-23],与Farah等[12]的研究结果一致。
2.3.2 氨基酸组成
浓香花生油脂体的氨基酸组成及含量测定结果见表5。
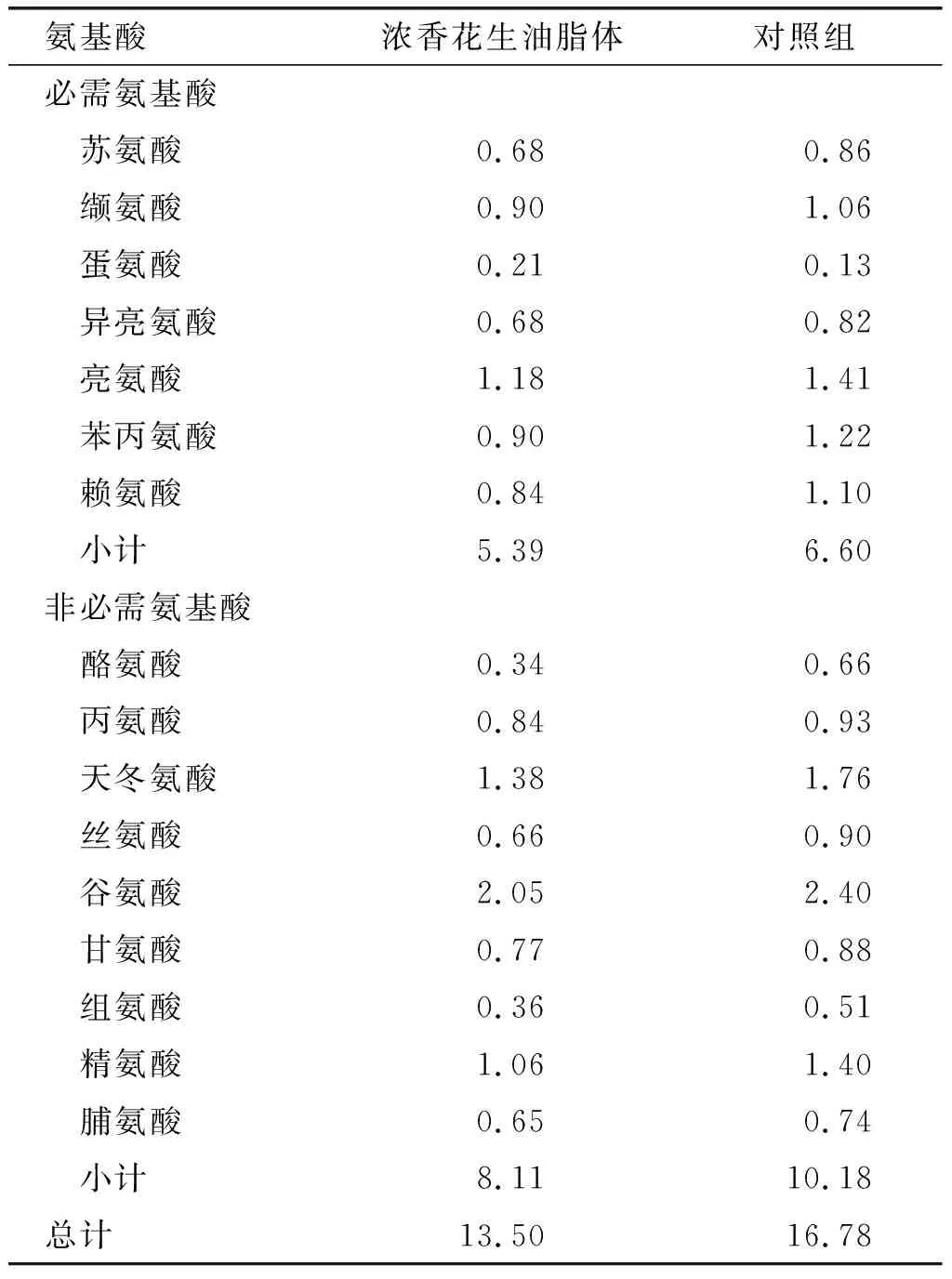
表5 浓香花生油脂体氨基酸组成及含量mg/100 g
由表5可知:浓香花生油脂体中氨基酸种类齐全,其中含量最多的3种必需氨基酸为亮氨酸(1.18 mg/100 g)、缬氨酸(0.90 mg/100 g)、苯丙氨酸(0.90 mg/100 g);含量最多的3种非必需氨基酸为谷氨酸(2.05 mg/100 g)、天冬氨酸(1.38 mg/100 g)、精氨酸(1.06 mg/100 g)。相较于对照组,浓香花生油脂体除蛋氨酸含量略高外,其他氨基酸含量均略低于对照组,这与浓香花生油脂体较高的预处理温度(140℃,30 min)有关。较长时间的高温处理可导致部分蛋白质变性,蛋白质溶解度降低[24-25],从而可能导致浓香花生油脂体中氨基酸含量降低。
2.3.3 冻融稳定性
通过乳析指数考察浓香花生油脂体的冻融稳定性,结果见图5。

注:同一样品不同小写字母表示差异显著。
乳析指数越小表明冻融稳定性越好。由图5可知:对照组花生油脂体3次冻融循环的乳析指数均大于35%,且每次冻融循环后油脂体的乳析指数均有所增高,表明对照组油脂体的冻融稳定性在3次冻融循环中逐步下降;而相较于对照组,浓香花生油脂体的乳析指数在第1和第2个冻融循环几乎为零,第3个冻融循环仅为(9.77±0.17)%,表明1~2个冻融循环对浓香花生油脂体的冻融稳定性影响不大,第3个冻融循环则能引起其冻融稳定性的轻微下降,说明浓香花生油脂体冻融稳定性良好。
3 结 论
在单因素试验的基础上,根据Box-Behnken试验设计原理对浓香花生油脂体的提取工艺进行了响应面优化。浓香花生油脂体的最佳提取工艺条件为液料比6∶1、加酶量460 U/g、酶解时间110 min、酶解温度51 ℃、pH 5.5,在此条件下浓香花生油脂体得率为50.89%。所制备的浓香花生油脂体呈半流动态乳液状,淡黄色,具有浓郁的烘烤花生香,平均粒径为(3.49±0.61)μm,氨基酸含量有所降低但种类齐全,冻融稳定性良好,工业应用价值较高。
