海洋装备防腐用镁合金牺牲阳极的研究进展
2022-02-12刘明耀江静华袁钰轩马爱斌
刘明耀,江静华,2,高 正,袁钰轩,马爱斌
(1.河海大学力学与材料学院,江苏 南京 211100;2.江苏吕泰合金有限公司,江苏 丹阳 212351)
引言
21世纪是我国大力发展蓝色经济、建设“海洋强国”的关键时期。海洋工程装备的安全运行是开发海洋资源、发展蓝色经济的技术基础。海洋环境十分复杂,对在海水中工作的设备而言是非常严酷的腐蚀环境。因此,海洋装备易于腐蚀,且运行维修和养护都较困难。牺牲阳极阴极保护法是预防大型金属结构腐蚀的有效方法,其具有易维护、无需外加电源等诸多优点,现代蓝色经济的发展促进了镁合金阳极在海洋装置防腐中的推广应用。我国有各类海洋石油钻采平台400余座,90%平台水下结构采取牺牲阳极进行腐蚀防护。常用的牺牲阳极材料主要有Zn基、Al基、Mg基三大类,其中Mg基阳极因具有电极电位负(纯Mg的标准电极电位为-2.37 V)、密度小、极化率低、活性较高、比强度和比刚度大等特点而备受关注。为提高镁合金牺牲阳极的保护性能,近年来常用的合金化元素有 Al,Zn,Mn 以及一些稀土元素[1-2]。本文基于现代海洋装备防腐对牺牲阳极的性能要求,概述了典型镁合金阳极材料的化学组成、性能特点及其影响因素,继而探讨了改善镁合金牺牲阳极的途径、新型牺牲阳极材料的发展和应用前景,旨在为海洋装备高效防腐用牺牲阳极材料的开发提供参考。
1 海洋防腐对牺牲阳极的性能要求
1.1 牺牲阳极的防腐原理与技术优势
牺牲阳极阴极保护法(简称牺牲阳极保护法),是利用电化学原理,在阳极材料被腐蚀消耗的同时,使阴极材料得到保护的方法。其应用于海洋装备的工作原理如图1所示。
牺牲阳极的保护原理,亦为原电池的工作原理。在电解质溶液(如:海水)中,采用某种电极电位比被保护金属更低的金属作为阳极,利用低电位金属的腐蚀电流作为高电位被保护金属的防腐电流。当不同的金属在海水等电解质溶液中组合在一起时,由于各自的电极电位不同,从而产生了电位差,形成了一个大电池。随着阳极金属的溶解,阳极上的电子不断流向阴极,电位高的阴极金属得到电子而受到保护。在阴极保护中,为使金属结构得到完全保护,可通过改变电流密度来达到所需要的保护电位。
牺牲阳极保护技术具有以下优点:安装及维持保养简单,费用低廉,无需外部电流,对环境污染小,腐蚀保护控制效果好。该方法可防止被保护金属溶入电解质(包括海水和其它介质),现已广泛用于海泥介质环境、输气管和输油管等管线工程及水利工程等。实际应用时,该保护法常与其它方法共同取用,称之为复合防腐。例如,可结合火焰喷涂、熔覆、电沉积、热浸和气相沉积等方法在被保护金属构件的表面生成不同类型的涂层,或者添加绿色有机-无机复合缓蚀剂,以进一步提高金属构件的防腐效果。随着海洋产业的迅猛发展和保护海洋环境的迫切需要,一些防止海洋腐蚀的涂层正朝着高性能和高环保的方向发展,最常见的有水性无机富锌涂料、无公害防锈涂料、低处理表面防锈涂料等[3]。这些防腐方法的联合使用,改善了海洋装置的实际防腐效果。
1.2 牺牲阳极的性能要求
采用牺牲阳极法对金属构件实施阴极保护时,牺牲阳极在电解质环境中与被保护的金属构件电连接,作为牺牲阳极的合金优先溶解,释放出的电流使金属构件阴极化到保护电位而实现保护。为达到这一目的,牺牲阳极材料须满足以下性能要求[4]:
(1)具有足够负(比阴极材料的电位要负)且稳定的开路电位和闭路电位,工作时自身的极化率小,即闭路(工作)电位应接近于开路电位,以保证有足够的驱动电压。
(2)具有大的理论电容量(即消耗单位质量牺牲阳极材料时按Faraday定律所能产生的电量)。
(3)具有高的电流效率(即实际电容量与理论电容量的百分比),以便达到长的使用寿命。
(4)表面溶解均匀,不产生局部腐蚀。腐蚀产物松软易脱落,且腐蚀产物无毒,对环境无害。
(5)自腐蚀率低,能保证工作效率。
(6)原材料来源充足,价格低廉,易于制备。
牺牲阳极材料的性能主要由其化学成分和组织结构决定,在严苛的海洋环境中,需根据服役要求选择合适的牺牲阳极材料。比如在海洋平台上使用的阳极材料有两种,当电位在-1.1~-1.3V的海洋平台上一般使用大吨位铝阳极,但海水深度超过1200 m时,海洋平台底部和钻杆部位电位达-1.3~-1.45 V时,铝阳极驱动电位已非常小而起不到保护作用,只能采用电位更负的镁阳极。国家标准GB/T 17731-2015规定了在海水、土壤等介质中工作的镁合金牺牲阳极材料的电化学性能要求[5]。
NACE RP0176-2003推荐了世界上部分重要海域的固定式海洋石油平台阴极保护的设计电流密度(如表1)[6]。其中,典型值针对的是海水中的平均状况,且远离江河入海口。依据典型设计斜率(阴极极化率)与维持电流密度进行设计,可避免过保护。对暴露在海水中的无防腐层构筑物,需先确定其设计寿命和海水电阻率,再明确阳极的消耗率,而后根据经验或现场实验数据,选取设计斜率及维持电流密度,通过公式计算确定出合适的阳极。

表1 固定式海洋石油平台阴极保护电流密度的设计[6]
2 镁合金牺牲阳极的类别与特点
由于镁合金具有较高的化学活性,自腐蚀性强,表面不会生成致密的保护膜,因此镁基阳极比铝基、锌基阳极的电流效率低得多,通常在50%左右。镁基阳极材料的突出优势在于密度小、理论电容量大、电位负、极化率低、对钢铁的驱动电压大(>0.6 V)。一般的纯镁阳极(纯度大于99.95%)由于电流效率很低(仅为30%左右),已被逐渐淘汰。由于杂质元素的加入会使镁合金的耐蚀性大幅降低,其中Fe,Ni,Cu等元素对其耐蚀性的降低尤为严重,故降低杂质元素是其性能提升的首选方法。但高纯镁的熔炼较为困难,因此工程中常采用合金化方法来制备高性能镁基阳极材料。
下面对几类典型镁合金阳极材料进行简要分析。
2.1 Mg‑Mn 系
Mg-Mn系牺牲阳极是常见的二元高电位合金,其中Mn元素在合金中可使第二相分布均匀,促进晶粒细化,提高其电化学性能。侯军才等[7]熔炼了系列低Mn含量的Mg-Mn合金,分析了Mn含量对其显微组织和电化学性能的影响规律,确定了Mn的合适加入量(0.08%~0.4%),并发现Mg-Mn牺牲阳极中的杂质元素会导致较大的溶质偏析和明显的晶粒尺寸差异,促使Mg-Mn阳极产生晶间腐蚀从而降低阳极的电流效率。
侯军才[8]研究还发现,由于高电位Mg-Mn阳极中Mn含量较低(仅为0.58%~1.10%),结晶过程中不会析出β相(Mn相),即Mg-Mn阳极的显微组织为单相α-Mg固溶体,故而Mg-Mn阳极的强度较低,但具有优异的塑性。经挤压变形后,其晶粒尺寸显著减小,使得阳极的开路电位显著升高。
向Mg-Mn阳极中添加Ca,Sr元素可改善其电化学性能。侯军才等[9]发现Mg-1%Mn合金中加入0.1%的Sr元素后,晶界处形成的Mg17Sr2弱阴极相可阻碍镁合金的晶间腐蚀,同时合金的晶粒也得到了细化,故其电流效率明显提高。Shamsudin等[10]研究发现含有较低Ca含量的Mg-Mn-0.35Ca阳极合金表面钝化程度较低,与开路电位(OCP)测试结果相吻合,表明了低Ca的存在足以引起钝化的不稳定性。Yamauchi等[11]向Mg-1%Mn中添加了0.5%Ca,得出Ca的存在能够细化晶粒提高电流效率,并可与Mg形成弱阴极相Mg2Ca,缓解合金的晶间腐蚀倾向。王登锋[12]在镁锰合金中加入少量Ca后进行热处理,发现固溶工艺参数对其电化学性能影响较大,其中Ca加入量约为0.6%的Mg-Mn合金经480℃/8 h的固溶处理后,腐蚀电位会上升15 mV左右,腐蚀速率则下降了60%左右。
2.2 Mg‑Al‑Zn阳极
Mg-Al-Zn-Mn阳极是最常见的镁合金阳极材料之一,其主要成分范围如表4所示[13]。典型合金有Mg-3Al-1Zn-Mn,Mg-6Al-3Zn-Mn,Mg-8Al-0.5Zn-0.2Mn等,其中性能最好、应用较广的为Mg-6Al-3Zn-Mn系合金。Mn在镁合金中能够降低杂质对Mg自腐蚀速度的影响,相当于“净化剂”的存在,比如微量的Mn可抵消杂质Fe的不良影响,减小镁的负差异效应,使该阳极材料具有驱动电压高、表面溶解均匀、电流效率高的特点,特别适合于在高电阻的介质中使用。但是,过量的Mn会导致镁合金耐蚀性和塑性的降低。同时加入Al和Zn元素,则Zn可降低镁的腐蚀速率,Al与Mg形成Mg17Al12强化相提高合金的强度。但为了获得良好的电化学性能,应严加控制Mg-Al-Zn-Mn系合金中的杂质含量。在相近的合金成分条件下,杂质较少的合金电流效率明显更高。
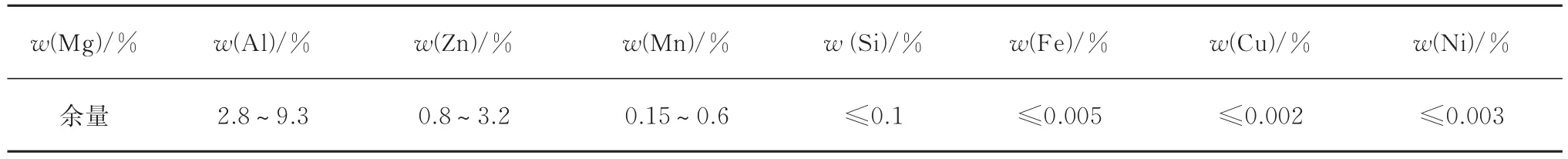
表2 常见Mg-Al-Zn-Mn合金牺牲阳极的化学成分[13]
Cain等[14]研究了镁合金牺牲阳极AZ31B-H24(Mg-3Al-1Zn)的阴极保护效果,由AZ31B-H24在0.6M NaCl和0.1M MgCl2中的恒电位极化可见,其具有很宽的保护电位范围,但在0.1M TRIS中未观察到实际阴极保护电位范围。AZ63镁合金的腐蚀行为由合金表面氧化膜、基体中第二相数量及腐蚀产物膜的特性共同决定。
徐桂英等[15]采用电偶腐蚀仪对比研究了AZ31,AZ63B和AZ91D三种镁合金在不同浓度NaCl溶液中的电偶腐蚀行为,发现AZ63B的电偶电流和电偶电位随时间变化表现较平稳,而AZ91D镁合金在0.1%NaCl溶液中的电偶电流和电偶电位出现了周期性的电化学振荡。相比之下,AZ63B最适合做阴极保护中的牺牲阳极材料,而AZ91D最不适用。
向镁合金中添加0.5%In元素[16],能够有效地提高AZ63镁合金的电化学性能。其归因于Mg-In固溶体中In元素的“溶解-再沉积”缓解了镁合金的电压滞后现象,同时提高了放电电流效率和放电活性。值得注意的是,当镁合金中In元素含量低于1.5%时,In元素能够加速镁合金的自腐蚀;但其含量达到2%时,由于第二相形成了致密网状结构,会因电流的屏蔽作用而降低合金的腐蚀速率。
2.3 新型高电位镁合金
镁合金牺牲阳极可按开路电位的高低,将之分为低电位和高电位Mg基牺牲阳极。其中,高电位镁合金广泛应用于电阻率较高的环境中金属构件的保护[17-18]。锌镁高电位镁合金牺牲阳极取代高锰镁合金牺牲阳极,可简化生产流程、节约能耗、减少污染物的排放,但其电流效率较低;最早纯镁作为高电位镁阳极使用,其后是电流效率较高的Mg-Mn系,但也仅仅达到50%左右,相关研究表明阳极的化学成分对阳极的电流效率和开路电位影响较大。高电位镁合金牺牲阳极主要特点为单位质量发生电量大、电位高,同时还具有比重小、电位较负、对Fe的驱动电压高、电流效率低等特点,特别适用于高电阻率介质中。镁合金牺牲阳极使用时,应注意避免与钢结构发生撞击。另外,国内现行的高电位镁合金牺牲阳极生产工艺是通过添加电解Mn或者MnCl2来使Mn的含量达到0.5%~1.3%(ASTM标准)。值得注意的是MnCl2易吸潮,而水蒸气遇到熔融态的Mg可能发生爆炸,十分危险。故研究一种新的低熔点金属来代替Mn是目前研究的突破点。美国标准ASTM843-1993(2003)和中国标准GB/T17731-2004均要求高电位镁合金牺牲阳极的电流效率高于50%,电位高于-1.77 V。
北京安泰科技股份有限公司开发了三种新型高电位镁合金牺牲阳极[19],分别为低锰阳极、锌-镁阳极、纯镁阳极。三种阳极的电化学性能均超过了现在流行的高锰阳极,其中锌-镁阳极的性能相对更优。赵世帮等[20]研究了高电位Mg-Mn牺牲阳极材料的组织结构、电化学性能及其自腐蚀机理,发现合金元素 Fe,Ni,Cu 使镁的腐蚀速度显著加大,Si与Mg形成Mg2Si以网状分布在晶界,Al与Mg形成Mg-Al,Mg2Al3和 Mg4Al3,对高电位镁阳极的电位、电流效率有很大的影响。因此,在生产中必须严格控制杂质含量。
2.4 其他镁合金牺牲阳极
王乃光等[21]发现Mg-A1-Pb阳极的腐蚀有一个潜伏期。Mg-Al-Pb腐蚀速率主要由腐蚀潜伏期决定,通常腐蚀潜伏期短则腐蚀速率高,腐蚀潜伏期长则腐蚀速率低;Mg-Al-Pb阳极的腐蚀速率并非由其开路电位值决定,开路电位值越低,腐蚀速率未必就越高。冯艳等[22]研究了Mg-Al-Pb-La合金阳极的放电性能,并与Mg-Al-Pb合金进行了比较。结果表明:前者在开路电位下表现出更强的耐蚀性以及更高的放电活性,镁合金阳极在不同介质中的氧化成膜特点和过程影响到其耐蚀性。在镁合金基体中加入0.55%的Zn和0.22%的Mn,可以缩短熔炼时间。Sinebryukhov等[23]采用氟盐溶液对 AZX911镁合金进行预处理,从而降低了阳极氧化涂层中的Ca含量,提高了镁合金的耐蚀性;磷酸盐和铵盐溶液阳极氧化也可提高其耐蚀性,具有牺牲防腐效果。Mg-9Al-2Sn合金是近年开发的一种力学性能、铸造性能及性价比较好的新型镁合金体系,缺点是耐蚀性较差,其作为阳极材料也正待开发。Cui等[24]采用浸泡试验、电化学测量和金相组织分析等方法,对比分析了不同晶粒尺寸的Mg-3Al-5Pb-1Ga-Y合金牺牲阳极的腐蚀行为和电化学性能,发现细晶组织具有更高的化学活性和更优的负放电电位。
3 海洋环境中镁合金牺牲阳极性能的影响因素
如图2所示,海洋腐蚀环境通常可分为5大区,即:海洋大气区、飞溅区、潮差区、全浸区和海泥区。造成金属材料在海水、海洋大气及海底泥土中发生腐蚀的因素,主要有化学因素(氯离子浓度等)、物理因素(温度等)、区域因素和生物因素[25]。镁合金等金属构件在海洋环境中的具体位置不同,对应的腐蚀机理和腐蚀类型也各不相同。
3.1 氯离子浓度
海水中主要的盐是氯化物盐,故Cl一的浓度是海水环境中对合金腐蚀的重要因素,Cl一能降低金属的氧化还原电位,同时能加速金属的腐蚀,此外Cl一还对腐蚀产物有影响。盐度还会对海水的导电率有影响,盐度越高则海水导电率越高,腐蚀反应越易进行,腐蚀就越严重;同时盐度增加又会降低海水的含氧量,从而降低腐蚀反应的发生速度。战广深[26]对 Mg-Al-Zn-Mn合金在 NaCl中与 A3钢、302不锈钢、紫铜的接触腐蚀行为(偶接)展开研究,结果表明Cl一浓度较高时,jgmq(阳极电偶电流密度)随浓度增大明显增大,阴极金属材料和阴阳极面积比不同在Cl一浓度高于0.010 mol/L时对jgmq有较大影响,jgmq与Ac/Aa(阴阳极面积比)成正比关系。电偶电势E随溶液中Cl一浓度增大向负向变化。毛玉坤[27]通过对Mg-1.1In合金在不同pH值的0.1 mol/L的NaCl溶液中进行开路电位测试、电化学阻抗测试、动电位极化曲线测试及浸泡失重测试,并用扫描电镜观察浸泡失重后的样品表面腐蚀形貌,发现Mg-1.1In合金随着溶液pH值的升高而耐蚀性变好。这是由于表面腐蚀产物能够在pH较高的溶液中稳定存在,提高腐蚀产物膜层的致密性。后又在不同浓度的NaCl溶液展开研究,发现Mg-1.1In合金随着溶液中NaCl浓度的升高,其耐蚀性先变差后变好。其原因为:高浓度时,一方面,当膜层表面离子浓度达到饱和后,膜层允许离子之间的转移的阻力增大,导致表面膜层临界浓度升高,减缓腐蚀;另一方面,合金的膜层致密度变高,膜层的保护性变好,腐蚀速率减慢。
3.2 温 度
温度的升高会使Mg合金更易氧化,带来更多的氧化物,从而降低阳极电位和电流效率。在模拟海洋环境中,李慧等[28]研究了温度对常用镁合金阳极材料MIC,AZ31和AZ63电化学行为的影响,发现在25℃至70℃人造海水介质中,这3种阳极的实际电容量和电流效率随温度的升高而小幅增加,极化曲线表现出活性溶解特征,局部腐蚀明显加剧,同时腐蚀产物抑制了阳极过程。刘婷[29]研究了不同介质(不只海水)温度对镁合金牺牲阳极电化学行为影响,最终通过实验发现改变介质温度对镁合金阳极电化学性能的影响并不显著。曾爱平等[30]考察了在淡水中温度20~80℃、电流密度0.015~1.20 mA/cm2的范围内,不同工作温度和电流密度下AZ63镁基合金牺牲阳极的电化学行为。其研究结果表明:在淡水中,工作温度上升对AZ63镁阳极电流效率和腐蚀形貌影响不大,工作电位稍有负移。
3.3 海水区域
与常规浅水相比,深水环境下,水的压力也随之增加,环境温度会降低(低于7℃),从而加速牺牲阳极的晶间腐蚀。与表层海洋环境相比,深水环境造成基体放电量大幅减少,电流效率降低,最终导致阳极钝化。由于海洋表层能得到大气中丰富的氧气以及海洋植物在光合作用下产生大量氧,因而海水含氧量在近表层最高,并随着水深增加而减小,只是在海底由于来自极地的高含氧水使其含氧量又有所升高,因此造成在浅海区域的腐蚀程度较重,而在深海区的腐蚀程度较轻。但是对于离岸较远、水深较深或涌浪较大的外海,水下焊接存在较大的危险;且受限于潜水员生理条件,一般难以焊接水下25 m以深处的牺牲阳极块。因此,水下25 m深处的钢制桩基础难以被牺牲阳极有效保护。
3.4 微生物
真实海洋环境中还含有大量的微生物。由于微生物生命活动或代谢产物所导致的腐蚀,称为微生物腐蚀(MIC)。具有腐蚀活性的微生物主要有硫酸盐还原菌(SRB)、硝酸盐还原菌(NRB)、铁氧化菌(IOB)、铁还原菌(IRB)和产酸菌(APB)等[31]。其主要通过参与Fe,S等元素的循环并改变金属表面的阴、阳极反应,影响腐蚀过程。金属的MIC往往伴随着生物膜的生成和发展过程,对腐蚀过程的影响很难预测和控制,其组成受环境中微小扰动(如温度、流量)的影响,生物膜的状态会造成材料腐蚀的较大差异,而生物膜的形成是一个非常复杂的生物和化学过程。MIC的控制在很大程度上是生物膜的控制,其控制理论大多以SRB为研究对象而提出,如经典的阴极去极化理论、浓差电池理论、代谢产物腐蚀理论等[32]。
方世杰[33]研究了 Cl-,Cu2+和 Fe2+浓度及其介质环境对SRB影响下铸态AZ91腐蚀行为的影响规律。结果表明:在含Cl-溶液中,生物膜起物理屏障作用,降低了AZ91对Cl-的腐蚀敏感性;在含Cu2+溶液中,SRB趋向于向金属表面生长,Cu2+对SRB起毒害作用,同时在金属表面形成Cu-Mg电偶腐蚀电池,促进镁合金的腐蚀,生物膜的形成具有降低镁合金腐蚀敏感性的作用;Fe2+浓度小于等于40 mg/L时,SRB生物膜延缓了镁合金腐蚀;当Fe2+浓度≥80 mg/L时,生物膜促进镁合金腐蚀。王蕾[34]通过研究两株典型真菌(黑曲霉菌和哈茨木霉菌)对AZ31B镁合金的腐蚀行为影响,发现含有哈茨木霉菌的样品溶液pH值比含有黑曲霉菌的样品溶液的pH值低,说明哈茨木霉菌代谢产生的有机酸的量比黑曲霉菌略大,因此对镁合金样品腐蚀影响更大。黑曲霉菌吸附在点蚀坑内,而哈茨木霉菌吸附在样品表面,充分说明了微生物腐蚀的复杂性。两株真菌的附着仅仅改变了镁合金的腐蚀速率,并未引起腐蚀机理的变化。
值得注意的是,近些年来,随着一些抗腐蚀微生物的发现以及有益细菌膜(beneficial bacterial biofilms,BBB)研究的开展,人们逐渐认识到微生物并不都会加速金属腐蚀,在某些条件下,也有可能减缓金属腐蚀,其抑制效率甚至远远好于某些防腐蚀涂层。Kan等[35]研究了人工海水中枯草芽孢杆菌生物膜的形成对AZ31B镁合金腐蚀的临时抑制作用,发现草芽孢杆菌的存在阻碍了电子的转移,显著抑制了其腐蚀进程。目前,相比使用杀菌剂等其它传统防腐技术,BBB被认为是一种最有前景、有效且环境友好的防腐技术。金属材料的多样性及其微观结构的复杂性,导致其在海洋环境中的MIC非常复杂,后续研究中还应充分发挥大数据与人工智能的优势,为MIC的预测与控制提供基础[36]。
4 改善镁合金牺牲阳极性能的途径
就镁合金而言,控制腐蚀速率的重要手段是调控化学成分和微观组织结构,合金元素的固溶度是决定镁合金性能的关键影响因素。为提高镁及其合金的耐蚀性,合金化处理、表面处理(如:化学转化处理、电镀、表面微弧氧化及有机涂层等防腐工艺)、减少合金杂质等方法被普遍采纳与应用。
4.1 表面处理
镁合金用作阳极材料时,既要保证其电负性较低,又要保证其自腐蚀较慢。由于镁的化学活性太强,自腐蚀速率很高,铸态镁合金往往需要经过表面处理才可实际应用。在镁或镁合金表面镀覆涂层也是比较困难的,因其极易被氧化生成氧化镁薄层;在施镀过程中,不可用pH<7的镀液,因其会发生强烈反应;夹杂、气孔等铸造缺陷,也是导致镀层缺陷的原因。就目前镁合金行业而言,表面处理是一大难题,故仍处于不断的研发、探索阶段。目前镁合金的表面处理方法主要有化学处理、阳极氧化、金属涂层、有机涂层等。
(1)化学转化工艺具有能耗少、设备简单、成本低的优点,故应用广泛。现在的研究主要集中在新型化学转化膜的开发,如:无Cr和P化学转化膜、稀土化学转化膜。
(2)镁合金阳极氧化膜比化学氧化膜厚且与基体结合紧密。其处理工艺比化学氧化处理复杂,当前研究主要集中在氧化液的改进与开发、氧化膜的组成、结构及其耐蚀性方面。
(3)金属涂层可采用电镀、化学镀或热喷涂等方法来获得。电镀层可选用Cu或Cu-Ni-Cr层,化学镀膜通常是Ni-P层。但是在镁合金表面电镀或化学镀是很困难的。热喷涂是将熔融状态的喷涂材料通过高速气流使其雾化喷射在零件表面并形成各种功能性涂层,从而提高表面性能,目前在镁合金方面的应用中还甚少。
(4)有机物涂层有多种,如油或油脂可短时间内防腐,油漆和蜡也是常用的有机物防蚀涂层。经过适当的预处理再涂覆有机物膜,可大幅度提高镁合金的耐蚀性,该方法的不足之处则在于涂层与基体的结合力比较差,涂层容易剥落。
(5)近年发展起来的微弧氧化(MAO)技术基本上克服了常见表面处理技术的缺陷,该工艺简单、环保、经济,对基体材料和工件形状适应性广。MAO膜层与基体结合力强,耐磨和耐蚀性好,综合性能优良,已成为目前公认的最有前途的镁合金表面处理方法[37]。
Yu等[38]在 Mg-9%Al-1%Zn(AZ91D)样品的一侧包覆Mg膜,在NaCl水溶液中形成电偶。Mg膜(牺牲阳极)对AZ91D基体具有阴极保护作用,这是因为Mg膜/AZ91D偶联的混合电位大于基体的腐蚀电位。Shang等[39]在镁合金AZ91表面电沉积了三乙醇胺(TEA)/氧化石墨烯(GO)复合镀层,并发现TEA/GO复合镀层在镁合金基体上分布均匀且复合镀层具有较低的腐蚀电流密度和较高的膜电阻。陈博等[40]发现涂敷了陶瓷涂层的试样能有效地阻止氯离子的进攻,与镁合金基体相比,其腐蚀电流密度减小了两个数量级,在溶液中的阻值也增加约一个半数量级,涂敷后镁合金的耐蚀性大幅度提高。
4.2 合金化处理
镁合金中的合金元素种类和含量决定着其各种性能。镁合金中的主要杂质元素为Fe,Ni,Cu,Co等。由于Fe,Mo和Nb等元素存在时,能形成第二纯金属相而没有相互的溶解,故而腐蚀会严重发生。有些元素则会与Mg形成Mg2X型(其中X=Si,Cu,Co,Ni)金属间化合物,从腐蚀的角度来看,形成Mg2X金属间化合物通常是非常不利的,因为Cu和Ni等金属的交换电流密度较大,所以会相应地增强阴极反应。对于Mg来说,最常用的合金元素为Al,在Cl-存在的环境下,Mg-Al合金会比纯镁的腐蚀电位提高约100 mVSCE。基于合金化可实现镁合金力学性能与耐蚀性之间的平衡。图3显示了合金元素的添加对纯Mg电化学性能的影响。
Yu等[42]采用双辊连铸技术成功研制出无毒、环保的Mg-Zn-In-Sn合金电极,并研究了少量Zn、In、Sn的加入对其耐蚀性的影响,发现该合金具有较高的开路电位和稳定的工作电流,腐蚀速度较慢,稳定性优于AZ91合金,并且易脱落腐蚀产物,可得到良好的保护效果。Yan等[43]针对镁牺牲阳极电流效率低的问题,开发了添加钆的镁牺牲阳极材料,并采用恒流法测定了其电化学性能,借助金相显微镜和能谱分析对其微观组织和成分进行了表征。结果表明:在镁牺牲阳极中加入钆可以细化镁牺牲阳极的晶粒尺寸,改变镁牺牲阳极的第二相分布,提高电流效率,降低镁牺牲阳极的电势;当钆添加量为0.1%时,电流效率最高可达65.32%,比未添加钆的镁阳极提高了10%。
对于各种元素加入镁合金后用于阳极材料时的性能还需大量的实验研究,尤其是在各种元素的添加含量方面,找到合适的元素种类及含量实现镁合金阳极的性能优化,仍是目前镁合金阳极材料研究热点之一。
4.3 制备工艺
镁合金制备工艺也是决定镁合金性能的一大因素。Zhao等[44]通过控制轧制变形过程中的压缩量得到不同孪晶数量的轧制态AZ31镁合金阳极材料,采用动电位极化扫描法、间歇放电法和电化学阻抗谱法研究了孪晶数量对轧制态AZ31镁阳极材料在3.5%NaCl溶液中电化学性能的影响。结果发现,孪晶能够使AZ31镁合金阳极材料具有更高电化学活性,在一定的范围内,随着孪晶数量增多,AZ31镁阳极材料电化学活性随之增大。Firdaus等[45]研究了热处理工艺对高电位镁阳极影响的腐蚀,发现在150℃下热处理后在冰盐水中冷却的HPMA样品显示出最低的腐蚀速率(21.87 MPY),阳极效率从48%(未热处理)提高到53%(在150℃下均质热处理);150℃保温后经冰盐水快速冷却表现出良好的牺牲阳极性能,具有较高的Eoc、较低的腐蚀速率、较高的阳极效率和较少的点蚀。凌赵华[46]以 Al-3.5Zn-0.02In-0.01Cd 合金作为牺牲阳极的内层材料,以Mg-6Al-3Zn-Mn合金作为牺牲阳极的外层材料,通过真空熔炼以及机械加工,制备出了4组内外层厚度比不同的镁包铝型复合牺牲阳极试样和2组普通牺牲阳极试样。通过实验分析发现,4组复合牺牲阳极试样的电化学性能均达到或者超过了相关牺牲阳极的国家标准。镁层和铝层的最佳厚度比为3:7。这种配比结构的复合牺牲阳极在初期具有足够负的工作电位,能尽快地对阴极结构起到良好的保护效果,等到外层镁合金阳极消耗完时,正好完成对被保护结构的阴极极化,从而降低了对牺牲阳极工作电位的要求,内层铝合金阳极便可对阴极结构进行有效地保护。意大利的Rossi等[47]研制了一种用于近海钢结构保护的复合牺牲阳极,内芯为铝合金(Al-Zn-In-Si-Mg-Ti),外层为厚15 mm的镁合金(Mg-Al-Zn-Mn)。在极化初期,利用镁合金较高的驱动电压所产生的大电流,使钢铁结构快速极化,进入被保护状态。待外层镁阳极全部溶解消耗后,被保护体达到稳定极化,此时构件因初期的极化大电流作用而使得表面形成保护性的钙镁类沉积物层,导致稳定极化所需的保护电流显著降低。而这时驱动电位较低的铝合金阳极开始工作,能在小电流下维持构件的稳定极化。
通过改善或创新制备工艺以使镁合金作为阳极材料获得更好的性能,这是镁合金阳极材料新的研究热点,需要进一步的深入探索。
5 结论与展望
利用镁合金牺牲阳极进行阴极保护,是防止重大金属装备腐蚀的一种有效方法。镁基牺牲阳极可用于保护淡水、海水介质中的机械设备、港口设施、船舰、近海钻井等,尤为适用于保护浸泡在海水中的钢结构件(如:轮船船体)及铝合金材料等。目前,我国国内镁阳极的市场正在逐步扩大,作为一种新的阳极材料,镁已开始应用于有特殊要求的海洋工程保护方面,但目前我国市场还亟需开发新型镁阳极、提高阳极的铸造挤压工艺水平。挤压镁牺牲阳极是一个有较大潜力可挖的产品,目前常用的镁牺牲阳极材料的基本成分已大体确定并标准化,但进一步开发高效、耐用、经济和环保型的镁牺牲阳极材料依然是今后发展的方向。
牺牲阳极防腐方法的核心问题是要开发出一种新的阳极,使其具有优良的性能,并要注重研发值得信赖的阳极制造工艺。扩展阳极的适用范围的问题在于阳极材料本身的特性,即在实际应用上限制因素较多。例如,纯镁阳极电流效率低,容易自腐蚀,寿命较短,几乎不用于海洋防腐工程。为此,需要添加合金元素以降低镁阳极的自腐蚀速率,提高其电流效率。此外,高温与高压含氧系统、气体-液体-固体三相共存系统、电阻变化大的系统等都需要采用不同材料的阳极材料。因此,寻找亲环境、高性能的牺牲阳极材料是目前主要研究方向之一。
注重研究开发复合阳极材料制作新工艺。例如,镁包锌、镁包铝、铝包锌及缓蚀剂包层金属等复合阳极材料使用了低温涂料和特殊工艺,在阳极材料表面附着特殊材料,内部金属元素可以通过膜表面实现交互作用。在阴极保护中,可使用外部合金的高驱动电位生成的大电流,使钢结构迅速极化,保证防护效果,减少阳极材料的消耗量。例如,发展镁-锌-镁复合材料,最大限度地利用镁阳极快速极化、锌阳极电流效率高的组合优势,将成为牺牲阳极材料新的发展方向之一。
