无溶剂无催化剂条件下Retro-Diels-Alder反应绿色高效合成β-烯胺酯衍生物
2022-02-12李伟强尹艳清王灼钰张宗琴
李伟强, 尹艳清, 万 娟, 王灼钰 张宗琴, 黄 超
(云南民族大学 化学与环境学院,云南 昆明 650503)
β-烯胺酯作为一种常见的药物合成高活性中间体,在制备各类含氮杂环类药物中发挥着举足轻重的作用[1-3].不仅如此,β-烯胺酯衍生物也是氨基醇、二胺类衍生物、β-氨基酸衍生物和其他含氮分子的中间体[4-5].因此,开发新型绿色高效合成β-烯胺酯分子的合成策略是近年来有机化学家关注的热点之一[6].
现如今,Mannich反应是合成β-烯胺酯的主流方法[7-9].令人遗憾的是,该反应大都具有条件苛刻、反应耗时长、试剂昂贵、污染严重和化学选择性差等不足[10-12].因此,开发一类绿色高效合成β-烯胺酯的策略仍是一个挑战.
文中报道了一种绿色高效合成β-烯胺酯的方法,即在无溶剂和无催化剂的条件下,仅通过调控反应温度,使Retro-Diels-Alder反应得以顺利激活,从而巧妙地构筑了β-烯胺酯化合物.
1 实验部分
1.1 实验试剂与仪器
实验所用溶剂类试剂乙酸乙酯、石油醚、四氢呋喃、N,N-二甲基甲酰胺、丙酮、甲苯等均为分析纯,产自天津市致远化学试剂有限公司或云南利妍科技有限公司;其他试剂如呋喃、乙炔二羧酸二乙酯、苯胺等均为化学纯或分析纯,购买于上海泰坦科技股份有限公司.
核磁共振仪:BRUKER ASCEND/AVANCE Ⅲ - 400 型超导核磁共振仪(以购买于百灵威科技有限公司的 CDCl3作溶剂, TMS 为内标),德国 BRUKER 公司;红外光谱仪: Nicolet iS10 型傅里叶变换红外光谱仪( KBr 压片),美国赛默飞世尔科技公司;显微熔点测定仪: X-5 LED 数字显示型显微熔点测定仪(温度未校正),北京泰克仪器有限公司;柱层析硅胶为200~300目,厂家为青岛海洋化工厂.
1.2 实验操作方法
Retro-Diels-Alder反应绿色高效合成β-烯胺酯衍生物的实验操作:氧杂冰片烯二乙酯1a(1.0 mmol)和胺类衍生物2a(2.0 mmol),无溶剂无催化剂置于 10.0 mL 反应试管中,密封反应试管并置于油浴恒温磁力搅拌器中 90 ℃ 反应.借助薄层色谱(TLC)监测反应进行情况.当底物反应完全后,将所得产物经柱层析纯化,减压旋蒸浓缩后得到目标产物.
1.3 反应条件的筛选
为了筛选得到该反应的最优条件,选择氧杂冰片烯二乙酯1a和无取代的苯胺2a作为模板反应,对反应的溶剂、温度、反应底物的摩尔比进行了筛选,发现在有溶剂存在产率反比无溶剂的产率低,因此,无溶剂为较优条件(表1序号5).实验中发现温度对该反应有明显的影响.在常温条件下,若要使底物完全转化,需要的时间为 5 d,且收率仅为62%.当温度逐渐升高后,反应时间出现了明显的缩短,收率获得了提高(表1序号7~9).当温度过高,副产物增多,收率出现了下降(表1序号10).最后,为进一步探究最佳反应条件,期望通过调整1a和2a的摩尔比来达到预期效果(表1序号11~14).最终1a的用量为 1.0 mmol,2a的用量为 2.0 mmol 使收率最高(表1序号5).进一步增加2a的使用量并不能使收率发生明显变化.
综上,通过筛选反应的溶剂、温度和反应物的摩尔比等条件,确定最佳反应条件为:无溶剂条件下,1.0 mmol 的氧杂冰片烯二乙酯1a和 2.0 mmol 的苯胺2a在 90 ℃ 下反应 6 h,以77%的收率获得目标β-烯胺酯化合物3a(表1序号5).此反应条件用于后续底物扩展工作.

图1 模板反应合成β-烯胺酯类化合物3a
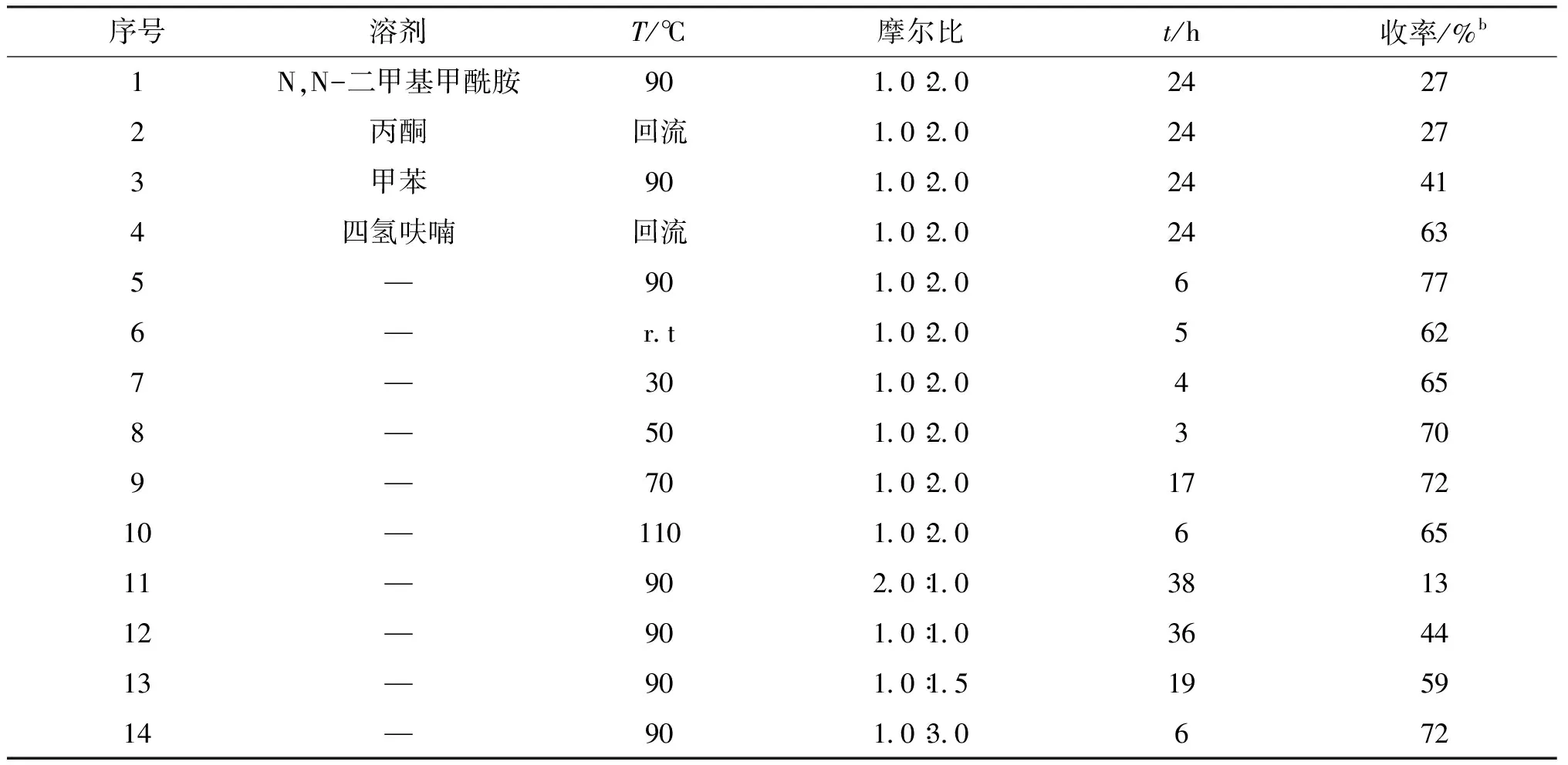
表1 化合物3a的最佳条件筛选a
2 结果与讨论
2.1 底物普适性的探讨
在上述最优反应条件下,针对不同种类的伯胺、仲胺衍生物的普适性进行了考察(表2).分别用不同取代基的苯胺2和其他胺类化合物2与氧杂冰片烯二乙酯1a发生Retro-Diels-Alder反应.运用该策略合成了10个β-烯胺酯化合物3.并对所有化合物的结构进行了系统的表征和分析.
首先讨论了不同种类取代基芳香胺对反应的影响.当苯胺对位被-Cl和-CF3这类的吸电子基团取代时,反应的收率出现了明显的降低(表2序号2,3).将对位-CF3取代反应时间延长至 72 h,中间体仍然大量未转换,最终收率仅为36%(表2序号3).随后,考察了苯胺对位和间位供电子基团取代时的情况.结果可见,反应能够以预期发生,并以较好的收率和较短的反应时间获得目标化合物(表2序号4,5).尤其是以对苯二胺为反应底物时,反应得以在 0.5 h 内迅速进行,并以66%的收率获得目标化合物(表2序号4).在探究苯胺衍生物后,我们还考察了脂肪族伯胺对反应的影响.令人遗憾的是,反应虽然能够进行,但所需时间较长且中间体仍然大量未转换,最终仅为20%左右(表2序号6、7).

图2 反应线路

表2 β-烯胺酯类化合物 底物普适性范围
最后,尝试采用杂环仲胺作为底物参与反应.令人惊喜的是,反应得以顺利且迅速的发生,并以良好至优的收率获得目标化合物(表2序号8~10).当以N-苯基哌嗪为反应原料时(表2序号8),通过控制反应时间,在反应 1 min 时淬灭反应获得了关键的Aza-Michael加成反应的中间产物4,进一步佐证了可能的反应机理.
2.2 可能的机理
基于以上底物普适性考察,对反应的机理进行了推测.在生成目标化合物3的过程中,氧杂冰片烯二乙酯1与苯胺2中的氨基孤对电子发生Aza-Michael加成反应生成中间体4.随后中间体4进行分子内电子转移发生Retro-Diels-Alder反应开环生成目标化合物β-烯胺酯3.

图3 可能的反应机理
2.3 化合物结构解析
化合物3aDiethyl 2-(phenylamino)maleate:收率 77%;黄色油状; IR(KBr)(νmax, cm-1) 3 279, 2 984,2 344,1 735,1 668,1 607,1 498,1 382,1 274,1 208,1 137,1 039,861,755, 693, 553 cm-1;1H NMR(400 MHz, CDCl3):δ9.68(1H, s), 7.30~7.25(2H, m), 7.11~7.07(1H, m), 6.92(2H, d,J=7.7 Hz), 5.38(1H, s), 4.22~4,13(4H, m), 1.30(3H, t,J=7.1 Hz), 1.09(3H, t,J=1.1 Hz);13C NMR(100 MHz, CDCl3):δ169.7, 164.5,148.5, 140.5, 129.2,124.3, 121.1, 93.9, 62.2, 60.1, 14.5, 13.7.HRMS(TOF ES+):m/zcalcd for C14H17NO4Na+[(M+Na)+], 286.105 0; found,286.105 5.
化合物3bDiethyl 2-((4-chlorophenyl)amino)maleate:收率 36%;黄色油状; IR(KBr)(νmax, cm-1) 3 450,2 986,2 331,1 736,1 668,1 619,1 496,1 379,1 276,1 209,1 137,1 092,1 040, 859, 819, 781, 551;1H NMR(400 MHz, CDCl3):δ9.61(1H, s), 7.24~7.20(2H, m), 6.85~6.81(2H, m), 5.42(1H, s), 4.21~4.13(4H, m), 1.27(3H, t,J=7.1 Hz), 1.12(3H, t,J=7.1 Hz);13C NMR(100 MHz,CDCl3):δ169.5,164.1,147.8,139.1,129.5,129.1.122.2,94.9,62.2,60.1,14.3,13.8.HRMS(TOF ES+):m/zcalcd for C14H17NO4ClNa+[(M+Na)+],320.066 0; found,320.066 3.
化合物3cDiethyl 2-((4-(trifluoromethyl)phenyl)amino)maleate:收率 36%;黄色油状; IR(KBr)(νmax, cm-1) 3 449,2 330,1 735,1 667,1 621,1 496,1 396,1 276,1 209,1 086,859, 819, 550;1H NMR(400 MHz, CDCl3):δ9.72(1H, s), 7.51(2H, d,J=8.5 Hz), 6.94(2H, d,J=8.4 Hz), 5.54(1H, s), 4.23~4.18(4H, m), 1.30(3H, t,J=7.1 Hz), 1.15(3H, t,J=7.2 Hz);13C NMR(100 MHz,CDCl3):δ169.3, 164.0, 146.9, 143.6, 120.1, 97.1, 62.4, 60.4, 14.3, 13.8; HRMS(TOF ES+):m/zcalcd for C15H16NO4F3Na+[(M+Na)+],354.092 4; found, 354.091 9.
化合物3dDiethyl 2-((4-aminophenyl)amino)maleate:收率 66%;黄色油状; IR(KBr)(νmax, cm-1) 3 447,2 330,1 731,1 659,1 612,1 519,1 394, 1 273,1 208,1 077, 818, 553;1H NMR(400 MHz, CDCl3):δ9.52(1H, s), 6.78~6.76(2H, m), 6.59~6.56(2H, m), 5.22(1H, s), 4.20~4.15(2H, m), 4.14~4.08(2H, m), 3.62~3.54(2H, m), 1.28(3H, t,J=7.2 Hz), 1.09(3H, t,J=7.1 Hz);13C NMR(100 MHz,CDCl3):δ170.0, 164.6, 150.0, 143.9, 131.8, 123.6, 115.6, 90.9, 61.9, 59.8, 14.5, 13.8. HRMS(TOF ES+):m/zcalcd for C14H18N2O4Na+[(M+Na)+], 354.092 4; found, 354.091 9.
化合物3eDiethyl 2-((3-methoxyphenyl)amino)maleate:收率 64%; 黄色油状; IR(KBr)(νmax, cm-1) 3 448,2 987,2 311,1 736,1 668,1 600,1 461,1 380,1 280,1 209, 1 133,1 046,858, 783, 688, 551;1H NMR(400 MHz, CDCl3):δ9.63(1H, s), 7.15(1H, t,J=8.0 Hz), 6.64~6.61(1H, m), 6.50~6.46(2H, m), 5.36(1H, s), 4.21~4.14(4H, m), 3.75(3H, s), 1.29(3H, t,J=7.1 Hz), 1.11(3H, t,J=7.1 Hz);13C NMR(100 MHz, CDCl3):δ169.6, 164.5,160.4,148.5, 141.7, 129.8, 113.4, 110.1, 106.8, 94.0, 62.2, 60.0, 55.03, 14.4, 13.8. HRMS(TOF ES+):m/zcalcd for C15H19NO5Na+[(M+Na)+], 316.115 5; found,316.115 2.
化合物3fDiethyl 2-(butylamino)maleate:收率 23%; 黄色油状; IR(KBr)(νmax, cm-1) 3 448, 2 329,1 733,1 658,1 613,1 458,1 269,1 204,1 076, 859, 550;1H NMR(400 MHz, CDCl3):δ8.06(1H, s), 5.00(1H, s), 4.32~4.24(2H, m),4.14~4.08(2H, m), 3.33~3.28(2H, m), 1.56~1.48(2H, m), 1.49~1.28(5H, m), 1.26~1.20(3H, m), 0.93~0.88(3H, m).13C NMR(100 MHz, CDCl3):δ169.4,162.9,151.4, 85.4, 60.9, 558.3, 43.7, 32.1, 18.9, 13.5, 13.1, 12.8. HRMS(TOF ES+):m/zcalcd for C12H21NO4Na+[(M+Na)+], 266.136 3; found, 266.136 7.
化合物3gDiethyl 2-(cyclopropylamino)maleate:收率 21%; 黄色油状; IR(KBr)(νmax, cm-1) 3 447,2 988,2 330, 1 738, 1 664, 1 609, 1 457, 1 357, 1 272, 1 206, 1 142,1 048,860,7 785, 623, 552;1H NMR(400 MHz, CDCl3):δ8.05(1H, s), 4.97(1H, s), 4.32~4.27(2H, m), 4.12~4.08(2H, m), 2.91~2.86(1H, m), 1.33(3H, t,J=7.1 Hz), 1.23(3H, t,J=7.1 Hz), 0.68~0.63(2H, m), 0.55~0.51(2H, m).13C NMR(100 MHz, CDCl3):δ170.1, 164.2, 153.5, 87.0, 61.9, 59.4, 26.7, 14.5, 14.2, 7.9; HRMS(TOF ES+):m/zcalcd for C11H17NO4Na+[(M+Na)+], 250.105 0; found,250.105 1.
化合物3hDiethyl 2-(4-phenylpiperazin-1-yl)maleate:收率 70%; 黄色油状; IR(KBr)(νmax, cm-1) 3 449,2 331,1 738,1 691,1 586,1 498,1 447,1 382,1 277,1 154,1 063, 858, 803, 755, 689, 548;1H NMR(400 MHz, CDCl3):δ7.30~7.26(2H, m), 6.92~6.89(3H, m), 4.83(1H, s), 4.40~4.39(2H, m), 4.14~4.09(2H, m), 3.34~3.32(4H, m), 3.24~3.22(4H, m), 1.39(3H, t,J=7.2 Hz), 1.24(3H, t,J=7.1 Hz);13C NMR(100 MHz, CDCl3):δ167.4, 165.6, 154.5, 150.7, 129.4, 120.8, 116.7, 87.5, 62.3, 59.6, 48.8, 47.1, 14.5, 14.0; HRMS(TOF ES+):m/zcalcd for C18H24N2O4Na+[(M+Na)+], 355.162 8; found, 355.162 6.
化合物3iDiethyl 2-(4-methylpiperazin-1-yl)maleate:收率 61%; 黄色油状; IR(KBr)(νmax, cm-1) 3 450, 2 980, 2 801, 2 331, 1 739, 1 693, 1 582, 1 450, 1 379, 1 285,1 201,1 159,1 049,1 007,801, 750, 552;1H NMR(400 MHz, CDCl3):δ4.67(1H, s), 4.31~4.26(2H, m), 4.02-3.97(2H, m), 3.09(3H, t,J=5.1 Hz), 2.37~2.35(4H, m), 2.21(3H, s), 1.27(3H, t,J=7.2 Hz), 1.13(3H, t,J=7.1 Hz);13C NMR(100 MHz, CDCl3):δ166.3, 164.4, 153.4, 85.8, 61.0, 58.2, 52.9, 45.8, 44.9, 13.3, 12.8; HRMS(TOF ES+):m/zcalcd for C13H22N2O4Na+[(M+Na)+],293.147 1; found,293.147 7.
化合物3jDiethyl 2-morpholinomaleate:收率 73%; 黄色油状; IR(KBr)(νmax, cm-1) 3 451, 2 980,2 330,1 739,1 694,1 585,1 444,1 380,1 276,1 158,1 113,1 041, 917, 861, 802, 748, 552;1H NMR(400 MHz, CDCl3):δ4.73(1H, s), 4.34~4.29(2H, m), 4.06~4.01(2H, m), 3.69~3.66(4H, m), 3.08(4H, t,J=4.9 Hz), 1.32~1.29(3H, m), 1.19~1.15(3H, m);13C NMR(100 MHz, CDCl3):δ166.2, 164.4, 153.7, 86.7, 64.9, 61.2, 58.5, 46.1, 13.4, 12.9; HRMS(TOF ES+):m/zcalcd for C12H19NO5Na+[(M+Na)+], 280.115 5; found,280.116 1.
化合物4Diethyl 2-(4-phenylpiperazin-1-yl)-7-oxabicyclo[2.2.1]hept-5-ene-2,3-dicarboxylate(4):收率: 83%, 黄色油状; IR(KBr)(νmax, cm-1) 3 447,2 333,1 731,1 597,1 452,1 263, 1 127, 1 136,1 060, 860, 755, 568 cm-1;1H NMR(400 MHz, CDCl3):δ7.27~7.23(2H, m), 6.91~6.83(3H, m), 6.59~6.57(1H, m), 6.25~6.23(1H, m), 5.31(1H, s), 5.24(1H, s), 4.23~4.09(4H, m), 3.42(1H, s), 3.08~2.93(8H, m), 1.32(3H, t,J=7.1 Hz), 1.27(3H, t,J=7.1 Hz).13C NMR(100 MHz, CDCl3):δ171.1, 169.9, 151.3, 140.7, 135.0, 129.2, 120.0, 116.2, 81.2, 80.2, 78.2, 61.2, 61.0, 53.3,50.2, 48.2, 14.6, 14.4;HRMS(TOF ES+):m/zcalcd for C22H28N2O5Na+[(M+Na)+], 423.189 0; found,423.188 5.
3 结语
综上,发展了一种经Retro-Diels-Alder反应,无溶剂、无催化剂,仅通过调控反应温度来实现绿色高效合成β-烯胺酯的方法.该反应具有良好的底物普适性,在无溶剂、无催化剂和常规加热等简单条件下展现出良好的官能团耐受性.具有环境友好和可持续发展性.因此,该方法为β-烯胺酯类化合物的合成提供了新的策略,作为一类重要的药物合成前体化合物,β-烯胺酯的绿色高效合成具有一定的应用价值,对于后续运用β-烯胺酯合成药物的研究,仍需进一步研究.
