锶含量对Ti-15Mo合金微弧氧化膜层及其磷灰石诱导能力的影响
2022-02-12刘元才徐铁伟张珊珊毕可晓伏淑霞曹磊梁森
刘元才,徐铁伟,张珊珊,毕可晓,伏淑霞,曹磊,梁森
锶含量对Ti-15Mo合金微弧氧化膜层及其磷灰石诱导能力的影响
刘元才,徐铁伟,张珊珊,毕可晓,伏淑霞,曹磊,梁森
(青岛理工大学 机械与汽车工程学院,山东 青岛 266525)
提高Ti-15Mo合金的生物相容性。通过电解液中Sr元素替代Ca元素,采用微弧氧化(MAO)与水热处理相结合的方法,在Ti-15Mo合金表面制备不同Sr含量的羟基磷灰石(HA)涂层。借助X射线衍射仪(XRD)和扫描电子显微镜(SEM)分析膜层的微观组织结构、相组成、接触角以及在模拟体液中的磷灰石诱导能力。电解液中的Sr含量会影响Ti-15Mo合金在恒流模式下MAO的电压,使得不同Sr含量样品的膜层微孔孔径与孔隙率随着Sr含量的增加先降低、后升高。水热处理后,膜层表面出现HA与Sr-HA相,样品表面Sr-HA的结晶度随着Sr含量的增加先增加、后降低。在30-Sr样品中,膜层表面Sr-HA的结晶度最好,Sr-HA晶柱分布均匀,呈现稳定的六棱柱形。此外,水热处理后的30-Sr样品,接触角达到10.5°,表现出优异的亲水性。模拟体液(SBF)浸泡实验结果显示,Sr离子的加入可以提高样品表面膜层的磷灰石诱导能力,尤其在30-Sr样品中,膜层表面的磷灰石沉积厚度达到58.87 μm。Sr离子的加入可以有效提高Ti-15Mo合金表面的磷灰石诱导能力,其中,在电解液中替代加入30%(质量分数)Sr离子时,膜层表面的磷灰石诱导能力最强,表现出良好的生物相容性。
微弧氧化;钛合金;掺锶;羟基磷灰石;生物相容性
生物植入材料中,常用的金属材料有不锈钢、钴基合金以及钛基合金。其中,钛及钛合金由于具有高比强度、低模量、良好的生物相容性以及高耐腐蚀性等优点,应用越来越广泛[1]。20世纪40年代初期,就已经有学者开始对钛及其合金在生物领域的应用展开研究[2]。随着对钛合金生物植入材料研究的不断深入,中高强度航空航天用α+β型Ti-6Al-4V合金进入到医用材料开发者的视野中,并广泛用于髋关节和膝关节的制造[3-4]。长期的临床研究表明,Ti-6Al-4V合金所释放出的钒、铝离子会对人体产生负面影响,极大地影响了其在生物领域中的进一步发展[5]。因此,一系列无钒、无铝的低模量新型β型钛合(如Ti-45Nb、Ti-29Nb-13Ta-4.6Zr、Ti-15Zr-7.5Mo、Ti- 15Mo等[6])不断地被开发出来。这类合金不仅避免了V、Al等有毒元素,且相比于α型和α+β型钛合金具有更接近人体硬组织的弹性模量,以及更高的强度和更好的生物相容性[7]。然而,钛及其合金表面的天然氧化物薄膜是生物惰性的,其诱导形成磷灰石的能力比较差[8]。因此,为了提高其表面的生物活性,在基体金属表面制备一层具有生物活性的钙磷涂层是一种比较有效的方法[9]。
在合金表面制备钙磷涂层常用的表面改性方法有等离子喷涂[10-11]、电沉积[12]、碱热处理[13-14]、微弧氧化[15-16]等。相较于其他改性方法,微弧氧化(Micro- arc oxidation,MAO)可以在金属表面原位生长出坚硬、致密和厚的氧化物膜层,这种膜层不仅具有优异的耐磨性[17]和耐蚀性,并且与基底之间的粘附强度也较高。此外,MAO还可以直接通过改变电解质的成分等来控制膜层中的化合物组成,这也是其他方法所不具备的[18-19]。
羟基磷灰石(Hydroxyapatite,HA)是人体骨和牙齿的主要无机成分,具有良好的生物活性和生物相容性,但是其受力学性能的制约,很难直接作为植入物植入体内,通常用作涂层材料[20]。通过MAO处理所得到的钙磷化合物是非晶相的,而将其转化为晶相的HA,则会进一步提高膜层的生物活性[21]。通过在高温高压下对膜层进行水热处理可以实现这一转换,提高HA的结晶度。陈柳珠等人[22]也已证实了水热处理后的MAO陶瓷膜层可以获得结晶度较高的HA。
为了进一步提高HA膜层的生物活性,在HA中加入Sr也是一种有效的办法。Sr是人体中一种重要的微量元素,是骨骼和牙齿的重要组成部分,并且具有促进骨形成、抑制骨吸收、促进成骨细胞增殖和抑制破骨细胞分化的作用[23]。有学者已经证明,相比于HA膜层,Sr-HA膜层在模拟体液中能够表现出较强的矿化能力,也能够显著提高骨髓间充质干细胞的粘附能力和细胞增殖率[24-25]。由于Sr元素的半径大于钙元素,在Sr离子取代HA中的钙离子后,掺有不同Sr含量的HA的晶体尺寸、晶格参数以及结晶度等是不同的,因此在不同的Sr含量下,Sr-HA膜层所表现出的物理性能以及生物活性等也有所不同[26-27]。目前,对于β型医用钛合金Sr-HA涂层的相结构和生物相容性的研究较少,寻找合适的掺Sr比例,对于提高β型医用钛合金HA涂层的生物相容性具有一定意义。
本工作在已有的医用Ti-15Mo合金研究基础上,采用MAO与水热处理相结合的方法,通过改变电解液中的Sr含量,在Ti-15Mo合金表面制备Sr-HA涂层。研究了膜层的显微组织结构、相组成、接触角以及在模拟体液中的矿化能力,探讨了不同Sr-HA涂层的磷灰石诱导能力,从而确定最佳的Ti-15Mo合金MAO膜的掺Sr工艺。
1 实验
实验基体材料选用经3次熔炼的β型Ti-15Mo合金,样品厚度为5 mm,直径为22 mm。将钛合金试样分别利用180#、400#、1200#的砂纸依次打磨,以除去表面的自然氧化膜,然后将试样在无水乙醇介质中进行超声波除油,使用去离子水清洗。MAO表面处理使用WHD-20型多功能双极性MAO电源,以恒电流直流脉冲方式进行。电流密度为9 A/dm2,频率为600 Hz,占空比为50%,氧化时间为55 min。电解液组成见表1。
表1 电解液组分及钙锶比
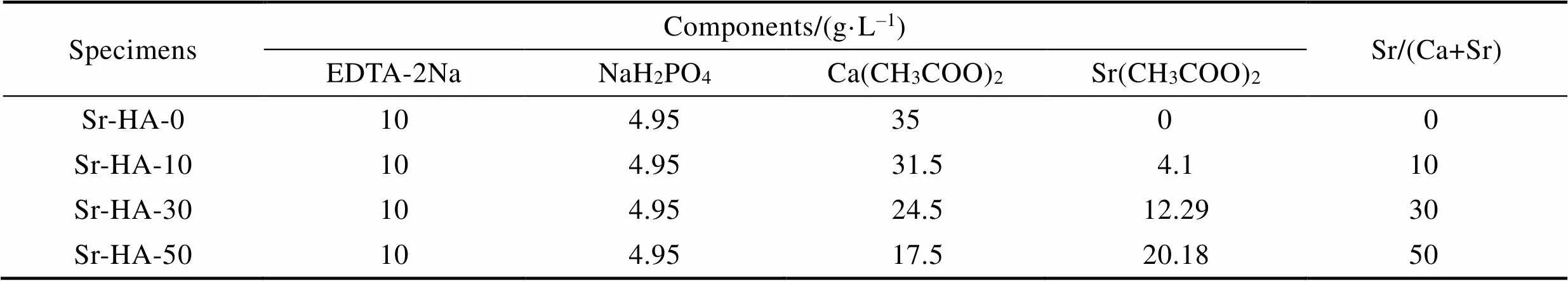
Tab.1 Electrolyte components and calcium strontium ratio
MAO完成后,使用去离子水冲洗干净,将试样放入高压反应釜中,以0.1 mol/L NaOH水溶液作为水热介质,pH为11~12,水热温度为190 ℃,保温10 h,水热完成后,用去离子水冲洗干净。采用模拟体液(Simulated body fluid,SBF)浸泡实验,测定样品的磷灰石诱导能力,SBF离子浓度见表2。将试样放入装有SBF的培养皿中,放入GHP-9050水隔式恒温培育箱中培养,设置恒定温度37 ℃,培养时间为18 d,每3天更换一次SBF,前3天使用紫外照射,避免污染。
表2 模拟体液离子浓度与人体血浆中的对比

Tab.2 Comparison of ion concentration in simulated body fluid and human plasma g/L
使用扫描电子显微镜(Scanning electron microscope,SEM)表征MAO、水热处理及SBF浸泡后样品的表面形貌。使用Ultima IV型X射线衍射仪(X-ray diffraction,XRD)分析MAO和水热处理后样品的相组成,扫描角度为20°~80°,扫描速度为2 (°)/min。采用接触角测量仪测定水热处理后样品的表面浸润性。
2 结果与讨论
2.1 掺Sr量对MAO膜层表面形貌、孔径和孔隙率的影响
不同掺Sr量电解液中MAO的时间与电压曲线如图1所示。在不同量的Sr代Ca元素电解液中,MAO的电压都随着氧化时间的增加而升高,且掺Sr量明显对MAO过程中的电压造成了影响。在0~15 min内,电压升高速度较快,随后变缓,逐步趋于稳定。其中50-Sr样品的终止电压最高,30-Sr样品的终止电压最低。
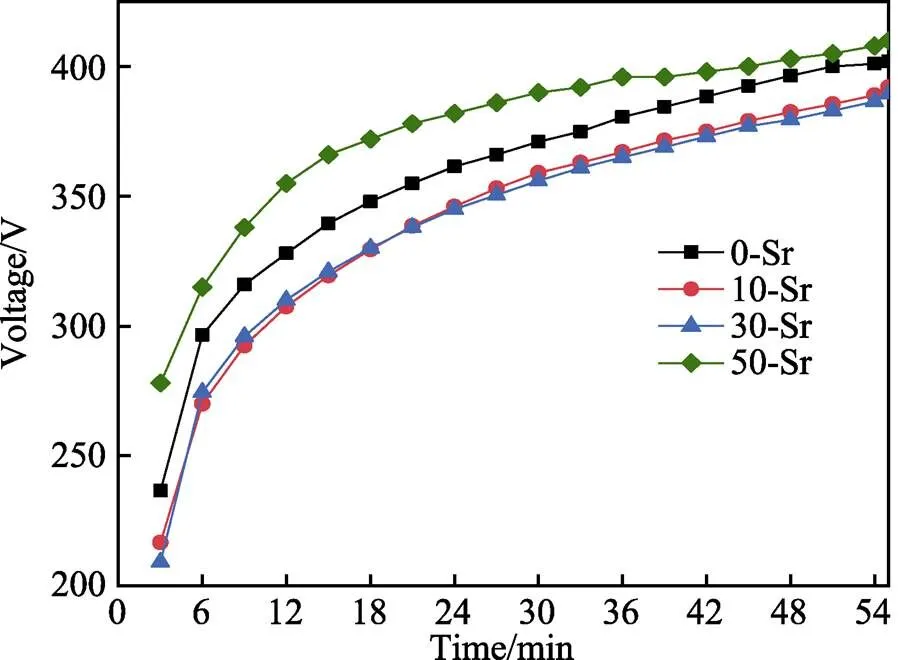
图1 不同掺Sr量电解液的MAO时间与电压曲线
Ti-15Mo合金在不同掺Sr量电解液中MAO后的表面SEM形貌及膜层中平均孔径和孔隙率的变化情况如图2所示。由图2a—d可以看出,电解液中掺Sr量对于膜层的表面形貌并没有太大的影响,样品表面均呈现MAO经典的“火山口”形貌,均匀地分布着许多微米级的微孔。通过Image-Pro Plus软件分析后发现,掺Sr量对膜层表面的孔隙率及平均孔径有略微影响,如图2e所示。50-Sr样品具有最大的孔径与孔隙率,30-Sr的最低。由图2可以发现,不同样品膜层中,微孔孔径、孔隙率与MAO过程中的电压有着相似的变化规律,即终止电压较高的膜层,微孔孔径与孔隙率也较高。根据以上结果可以确定,电解液中不同的Sr离子含量会使恒流模式下MAO过程中的电压发生变化。电压的增加实际上就是增大了MAO系统的反应能量,电场强度增大,使合金表面局部击穿变得更剧烈,从而使样品膜层中微孔孔径变大和孔隙率发生改变[28]。
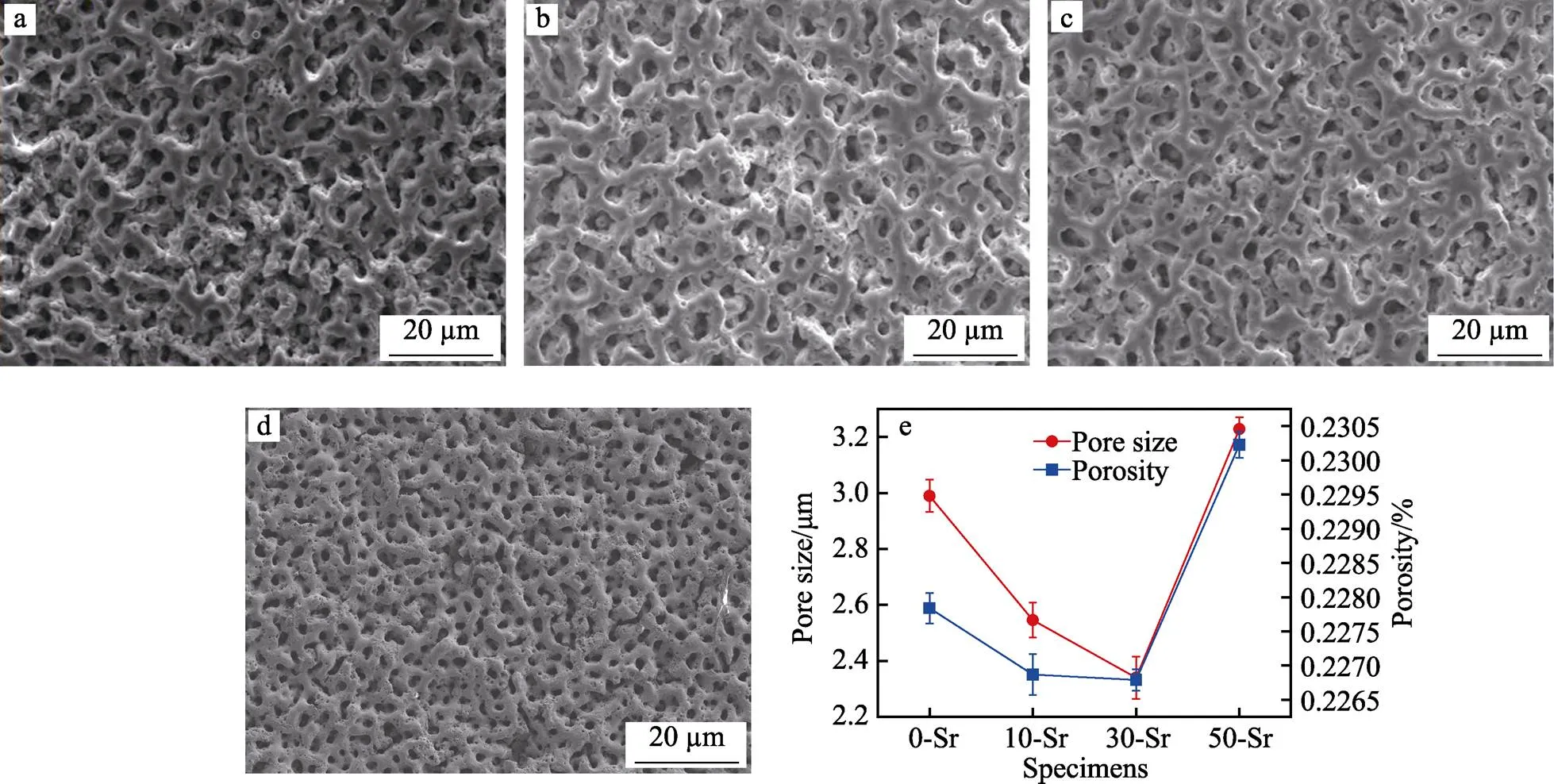
图2 不同掺Sr量电解液的Ti-15Mo合金MAO膜层表面形貌与孔径、孔隙率
2.2 掺Sr量对MAO和水热处理膜层相组成及表面形貌的影响
Ti-15Mo合金的显微组织和XRD图谱如图3所示。Ti-15Mo合金的显微组织中,β晶粒的晶界明显,晶界及交界处并未发现α相残留,且XRD图谱中只有β相峰的出现,这表明Ti-15Mo合金由单一的β相组成。具有单一β相的Ti-15Mo合金具有良好的塑性能力、低的弹性模量和高的断裂强度,能够满足用作承重生物材料的力学性能要求[29-30],作为一种新型的医用植入金属材料逐渐被关注。基于以上原因,本研究的基体材料选用完全固溶状态的单一β相Ti-15Mo合金。
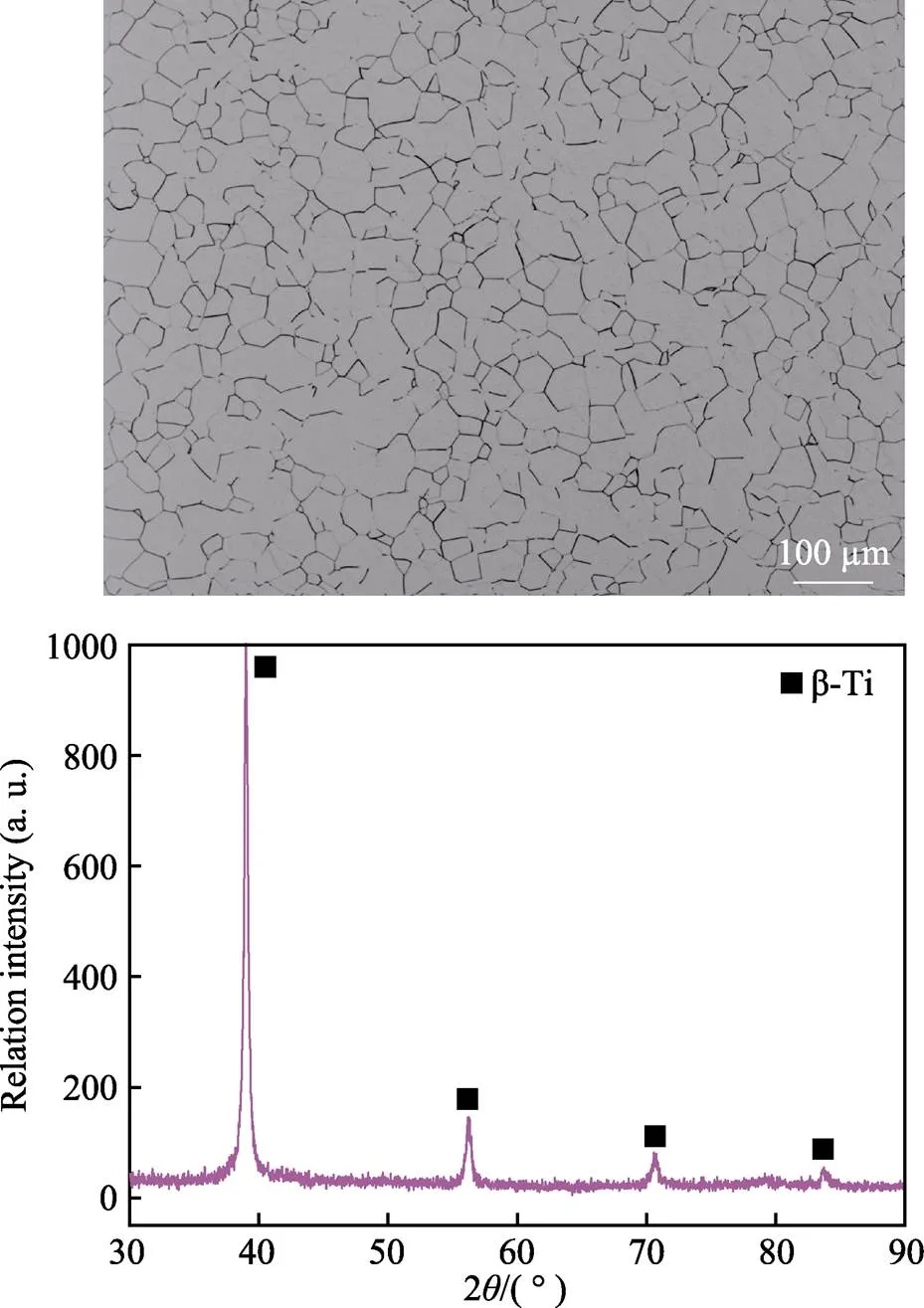
图3 Ti15-Mo合金的显微组织与XRD图谱
不同掺Sr量电解液的Ti-15Mo合金MAO膜层及水热处理后的XRD图谱见图4。由图4a可以看出,Ti-15Mo合金在经过MAO后,膜层表面主要由β-Ti、金红石、锐钛矿相组成,未见明显的HA相及掺锶HA相的Sr-HA衍射峰。MAO膜层经过水热处理后(如图4b所示),样品中除β-Ti、金红石、锐钛矿相之外,还有HA相及掺锶HA相Sr-HA衍射峰,而且Sr-HA的衍射峰强度随着掺Sr量的增加而增大。此外,随着掺Sr量的增加,Sr-HA衍射峰会略微向低角度偏移,如图4c所示。这由于Sr2+半径大于Ca2+,HA中的Ca位点被Sr2+取代后,会增加Ca10–xSr(PO4)6(OH)2的晶格常数,造成衍射峰左移[31]。同时这也表明了Sr2+取代并占据了HA中Ca2+的晶位。
不同掺Sr量水热处理后,Ti-15Mo合金MAO膜层的表面形貌如图5所示。可以看出,样品在经过水热处理后,膜层表面均有不同程度的HA(或Sr-HA)覆盖。0-Sr样品在经过水热处理后,HA覆盖率较低,结晶度较差(如图5a所示)。在掺入Sr离子后,Sr-HA的结晶度均有不同程度的提升,尤其是30-Sr样品(见图5c),膜层中Sr-HA的覆盖率明显上升,膜层表面能够全部被Sr-HA覆盖,基本看不出MAO后的“火山口”形貌。通过在高放大倍率(图5c右图)下观察发现,膜层全部由柱状晶体构成,并且分布比较均匀,呈现出稳定的六棱柱型。50-Sr样品(见图5d)中,相比于30-Sr样品,Sr-HA的覆盖率与结晶度都有所降低,且Sr-HA晶粒分布不均匀。
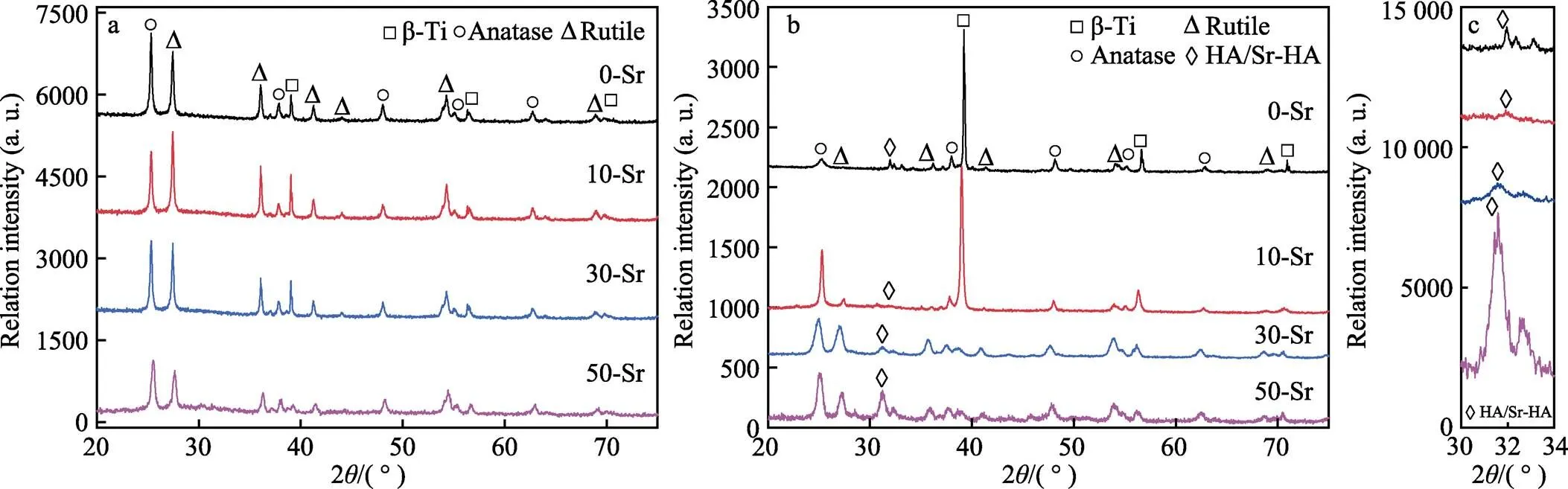
图4 不同掺Sr量电解液的Ti-15Mo合金MAO膜(a)及水热膜(b,c)的XRD图谱

图5 不同Sr含量Ti-15Mo合金水热处理后的表面形貌
综合图4和图5可以看出,经水热处理后的MAO膜层中,Sr离子成功取代部分钙离子,生成了Sr-HA。Sr离子的掺入可以提高水热处理后MAO膜层中Sr-HA的结晶度,但电解液中Sr离子的掺入量并不与Sr-HA的结晶度呈正比关系。掺Sr量在30%以下时,掺Sr量越高,结晶度越好。掺Sr量达到50%后,Sr-HA的结晶度又会有所下降,但还是会高于未掺Sr的样品。30-Sr与50-Sr样品中,Sr-HA所表现出的不同结晶度则取决于Sr2+取代Ca2+的方式,HA中Ca存在CaⅠ与CaⅡ两个不同的位点,CaⅠ与CaⅡ
位点分别占Ca总位点的40%与60%,其中CaⅡ是最稳定的位点,CaⅡ位点被Sr2+占据后,会引起更大的晶格畸变[32]。50-Sr样品中,由于Sr2+含量较高,被占据的CaⅡ位点相比于30-Sr有所增加,增加了Sr-HA晶格畸变,为了保持晶体结构,Sr-HA的生长遭到抑制,使Sr-HA的结晶度降低。
2.3 掺Sr量对水热处理后膜层表面接触角的影响
经过水热处理后,不同掺Sr量Ti-15Mo合金膜层的接触角如图6所示。结果表明,未经过任何处理的Ti-15Mo合金,基体接触角约为70.5°;经过水热处理后,各样品的接触角都大幅度降低。在各样品中,随着Sr含量的增加,膜层表面接触角先下降、后上升。其中30-Sr样品膜层的接触角最小,约为10.5°。当掺Sr量达到50%时,膜层的接触角略有上升,达到23.5°,但仍远小于未经过任何处理的基体合金。接触角越小,膜层的亲水性越好。这表明MAO与水热处理可以有效提高Ti-15Mo合金表面的亲水性,Sr离子的掺入也对合金表面亲水性的提升有积极影响,尤其是30-Sr样品,表现出优异的亲水性。MAO样品表面生成的多孔膜层增加了表面的粗糙度与比表面积,后续的水热处理又引进了大量的—OH亲水基团[33]。此外,水热处理后,膜层表面所生长的HA与Sr-HA晶体也进一步增加了样品表面的粗糙度与比表面积,使膜层的亲水性进一步提高。表面亲水性是植入材料生物相容性的重要影响参数之一,对于生物植入材料上的蛋白质吸附、血小板粘附、血液凝固以及细胞和细菌粘附等都会产生影响。已有研究证明,具有高亲水性的生物植入材料具有更好的生物相容性[31]。
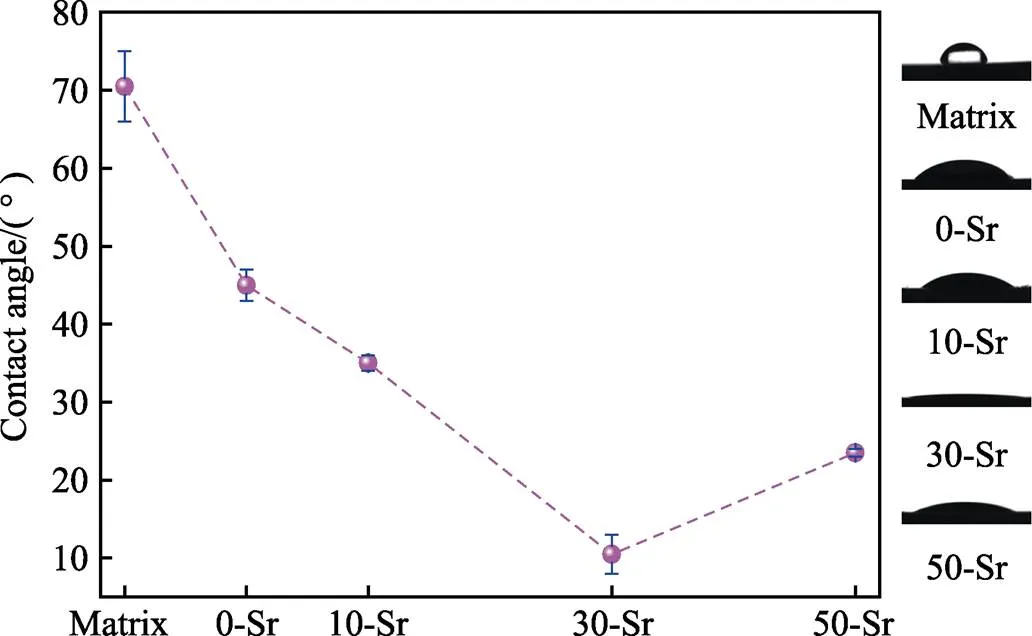
图6 不同Sr含量下Ti-15Mo合金水热处理后的接触角
2.4 掺Sr量对膜层磷灰石诱导能力的影响
不同掺Sr量下,经MAO与水热处理后的Ti-15Mo合金,在SBF中浸泡18 d后的表面形貌如图7所示。已有研究表明,生物活性材料在SBF浸泡实验中会使样品表面沉积磷灰石相,而材料表面的Ca2+、PO42–等离子以及—OH等活性基团会,对材料表面的磷灰石诱导能力产生一定影响[9,34]。由图7可知,在本实验中,所有样品在SBF中浸泡18 d后,表面均有明显的磷灰石沉积,通过高放大倍率图可以明显看出磷灰石所特有的纳米网状结构[35]。此外,经过MAO与水热处理的样品,其表面沉淀物远多于未经过任何处理的基体合金。在经过MAO与水热处理的样品中,Sr离子的掺入明显会提高样品表面的磷灰石沉积量,尤其是30-Sr与50-Sr样品,表现出优异的磷灰石诱导能力。
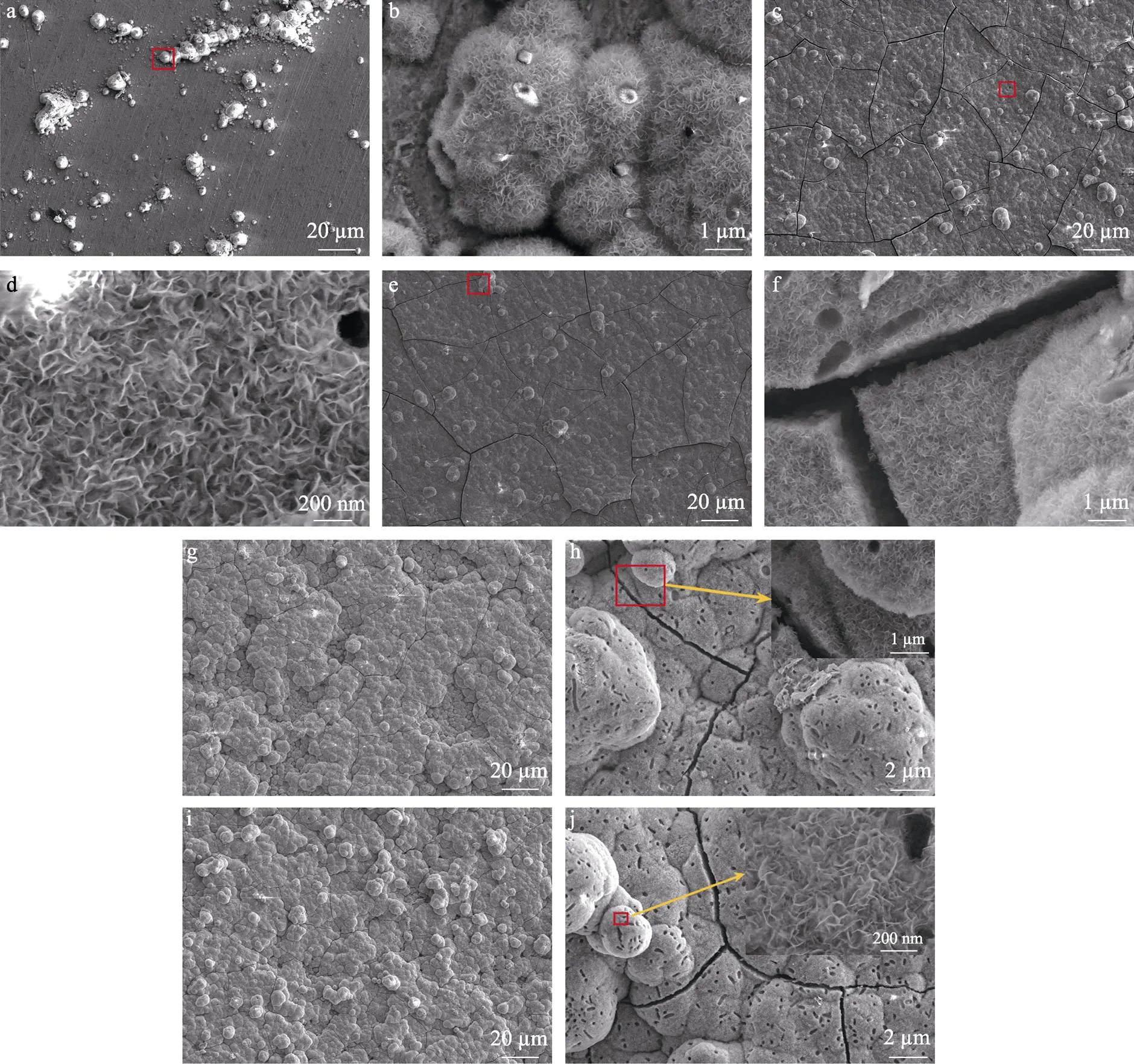
图7 样品在模拟体液中浸泡18 d后的表面形貌
样品在SBF中浸泡18 d后的截面形貌及钙磷元素分布如图8所示。可以看出,30-Sr与50-Sr样品中,磷灰石沉积层厚度要高于其他样品。30-Sr样品的磷灰石沉积量最多,磷灰石沉积层厚度达到58.87 μm,而50-Sr样品的磷灰石沉积层厚度略低于30-Sr,但仍能达到41 μm。此外,钙和磷元素也都均匀地分布在每一组样品中。样品表面膜层磷灰石越多,表明与人体的相容性越好。本实验表明,掺Sr量的增加可以大大提高Ti-15Mo合金诱导磷灰石的能力,尤其是在30-Sr样品中,膜层表现出优异的磷灰石诱导能力,具有良好的生物相容性。分析可知,SBF是Ca2+与PO42–的过饱和溶液,在样品进入SBF后,Sr-HA发生溶解,释放出大量的Ca2+与PO42–,增加了溶液中Ca2+与PO42–的过饱和度,为磷灰石形核生长提供了优异的离子条件。此外,Sr-HA和HA晶体相仿,与SBF中的Ca2+和PO42–有良好的相容性,对磷灰石形核生长起到很好的诱导作用,在富含Sr-HA晶体的部分会优先生长[20]。30-Sr样品在水热处理后,小接触角增加了膜层与SBF溶液的接触面积,而且其表面Sr-HA的结晶度高,使Sr-HA晶体均匀分布在膜层表面,为磷灰石提供了大量的形核位点,使Ca2+与PO42–能够迅速结合,并形核生长。
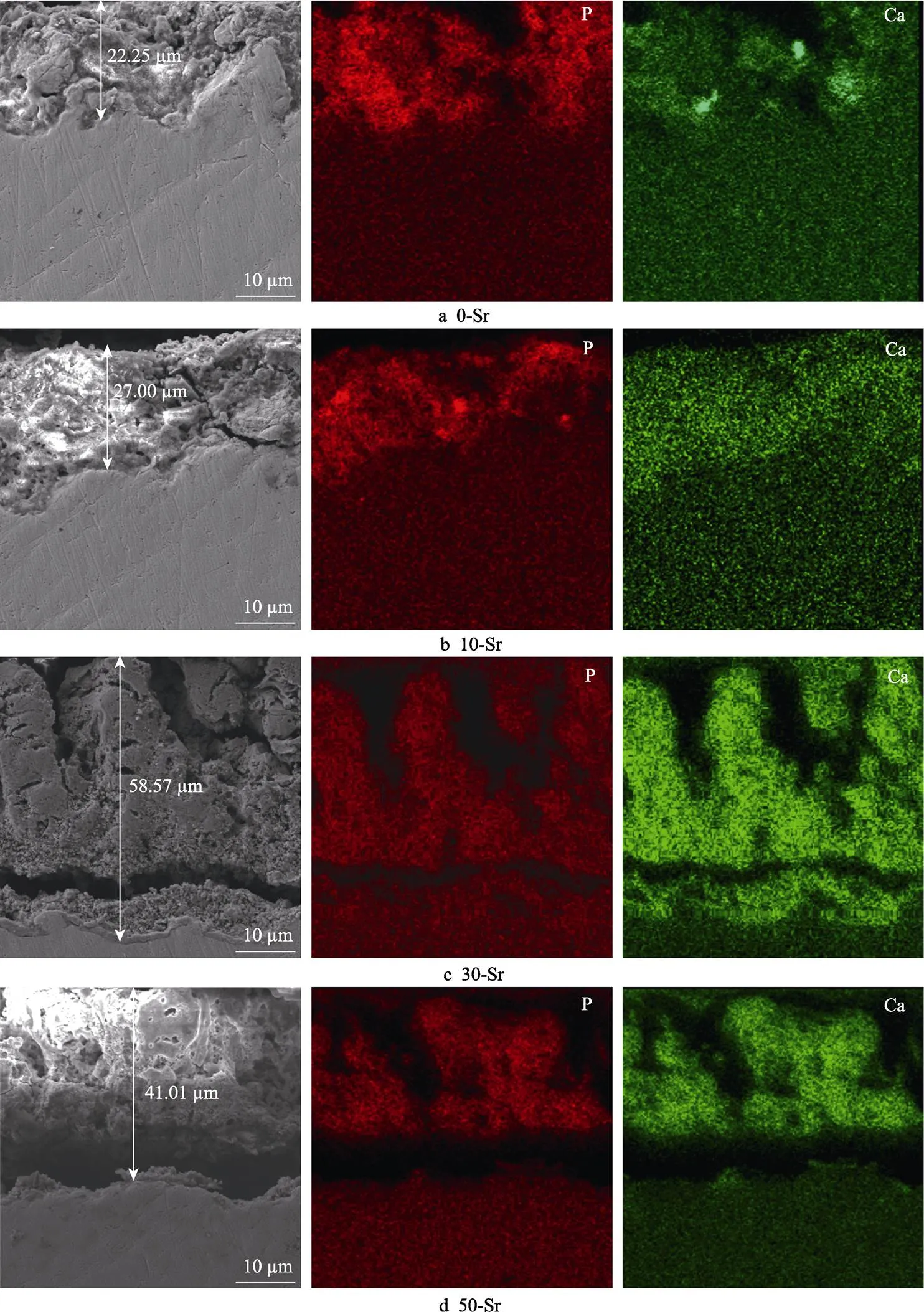
图8 样品在SBF中浸泡18 d后的截面形貌及钙磷分布(纵剖面)
3 结论
1)掺Sr量会影响Ti-15Mo合金在恒流模式下MAO的电压,导致不同Sr含量样品的膜层微孔孔径与孔隙率随着掺Sr量的增加先降低、后升高。
2)水热处理后,膜层表面出现HA与Sr-HA相。在30-Sr中,膜层表面Sr-HA的结晶度最好,Sr-HA晶柱分布均匀,呈现稳定的六棱柱形。经水热处理的30-Sr样品,接触角达到10.5°,表现出优异的亲水性。
3)SBF浸泡实验中,所有样品都表现出优异的磷灰石诱导能力。Sr离子的加入有效地提高了膜层的磷灰石诱导能力,30-Sr样品膜层中,磷灰石沉积厚度达到58.87 μm,表现出良好的生物相容性。
[1] CHEN Qi-zhi, THOUAS G A. Metallic Implant Biomaterials[J]. Materials Science and Engineering: Reports, 2015, 87: 1-57.
[2] 于振涛, 余森, 程军, 等. 新型医用钛合金材料的研发和应用现状[J]. 金属学报, 2017, 53(10): 1238-1264.
YU Zhen-tao, YU Sen, CHENG Jun, et al. Development and Application of Novel Biomedical Titanium Alloy Materials[J]. Acta Metallurgica Sinica, 2017, 53(10): 1238-1264.
[3] GEETHA M, SINGH A K, ASOKAMANI R, et al. Ti Based Biomaterials, the Ultimate Choice for Orthopaedic Implants—A Review[J]. Progress in Materials Science, 2009, 54(3): 397-425.
[4] BABILAS D, SŁUŻALSKA K, KRZĄKAŁA A, et al. Plasma Electrolytic Oxidation of a Ti-15Mo Alloy in Silicate Solutions[J]. Materials Letters, 2013, 100: 252- 256.
[5] DONATO T A G, DE ALMEIDA L H, NOGUEIRA R A, et al. Cytotoxicity Study of some Ti Alloys Used as Biomaterial[J]. Materials Science and Engineering: C, 2009, 29(4): 1365-1369.
[6] XU Tie-wei, ZHANG Shan-shan, CUI Ning, et al. Precipitation Behavior of Ti15Mo Alloy and Effects on Microstructure and Mechanical Performance[J]. Journal of Materials Engineering and Performance, 2019, 28(12): 7188-7197.
[7] 王运锋, 何蕾, 郭薇. 医用钛合金的研究及应用现状[J]. 钛工业进展, 2015, 32(1): 1-6.
WANG Yun-feng, HE Lei, GUO Wei. Research and Application of Medical Titanium Alloy[J]. Titanium Industry Progress, 2015, 32(1): 1-6.
[8] CHEN Jian-zhi, SHI Yu-long, WANG Lei, et al. Preparation and Properties of Hydroxyapatite-Containing Titania Coating by Micro-Arc Oxidation[J]. Materials Letters, 2006, 60(20): 2538-2543.
[9] LUO Rui, LIU Zhong-de, YAN Fei-xiang, et al. The Biocompatibility of Hydroxyapatite Film Deposition on Micro-Arc Oxidation Ti6Al4V Alloy[J]. Applied Surface Science, 2013, 266: 57-61.
[10] CAO Lei, ULLAH I, LI Na, et al. Plasma Spray of Biofunctional (Mg, Sr)-Substituted Hydroxyapatite Coatings for Titanium Alloy Implants[J]. Journal of Materials Science & Technology, 2019, 35(5): 719-726.
[11] KUMARI R, MAJUMDAR J D. Wear Behavior of Plasma Spray Deposited and Post Heat-Treated Hydroxyapatite (HA)-Based Composite Coating on Titanium Alloy (Ti-6Al-4V) Substrate[J]. Metallurgical and Materials Transactions A, 2018, 49(7): 3122-3132.
[12] 曾永香, 贺瑞, 裴锡波, 等. 电沉积制备氧化石墨烯-羟基磷灰石复合涂层[J]. 稀有金属材料与工程, 2016, 45(3): 727-731.
ZENG Yong-xiang, HE Rui, PEI Xi-bo, et al. Synthesis of Graphene Oxide/Hydroxyapatite Composite Coatings by Electrochemical Deposition[J]. Rare Metal Materials and Engineering, 2016, 45(3): 727-731.
[13] HSU H C, TSOU H K, HSU S K, et al. Effect of Water Aging on the Apatite Formation of a Low-Modulus Ti-7.5Mo Alloy Treated with Aqueous NaOH[J]. Journal of Materials Science, 2011, 46(5): 1369-1379.
[14] WANG Y Q, PAN L, TAO J, et al. Bioactive Porous Titania Formed by Two-Step Chemical Treatment of Titanium Substrates under High Intensity Ultrasonic Field[J]. Surface Engineering, 2011, 27(1): 46-50.
[15] LI Ya-da, WANG Wei-qiang, LIU Hui-ying, et al. Formation and in Vitro/in Vivo Performance of “Cortex-Like” Micro/Nano-Structured TiO2Coatings on Titanium by Micro-Arc Oxidation[J]. Materials Science and Engineering: C, 2018, 87: 90-103.
[16] ZHOU Rui, WEI Da-qing, CHENG Su, et al. The Structure and in Vitro Apatite Formation Ability of Porous Titanium Covered Bioactive Microarc Oxidized TiO2- Based Coatings Containing Si, Na and Ca[J]. Ceramics International, 2014, 40(1): 501-509.
[17] 刘元才, 孙启胜, 刘志远, 等. 氮化硼对TB8钛合金微弧氧化膜及其耐磨性的影响[J]. 青岛理工大学学报, 2020, 41(6): 102-107.
LIU Yuan-cai, SUN Qi-sheng, LIU Zhi-yuan, et al. Effect of Adding Boron Nitride on Micro Arc Oxidation Coatingsand Wear Resistance of the TB8 Titanium Alloy[J]. Journal of Qingdao University of Technology, 2020, 41(6): 102- 107.
[18] KAZEK-KĘSIK A, DERCZ G, KALEMBA I, et al. Surface Characterisation of Ti-15Mo Alloy Modified by a PEO Process in Various Suspensions[J]. Materials Science and Engineering: C, 2014, 39: 259-272.
[19] SIMKA W, KRZĄKAŁA A, KOROTIN D M, et al. Modification of a Ti-Mo Alloy Surface via Plasma Electrolytic Oxidation in a Solution Containing Calcium and Phosphorus[J]. Electrochimica Acta, 2013, 96: 180-190.
[20] 谭思民, 王帅星, 赵晴, 等. 水热时间对钛合金微弧氧化膜合成羟基磷灰石的影响[J]. 表面技术, 2014, 43(3): 20-24.
TAN Si-min, WANG Shuai-xing, ZHAO Qing, et al. Effects of Hydrothermal Time on Hydroxyapatite Synthesis of Microarc Oxidized Titanium[J]. Surface Technology, 2014, 43(3): 20-24.
[21] 全琳卡, 马凤仓, 刘平. 钛生物种植体表面羟基磷灰石生成技术发展现状[J]. 热加工工艺, 2010, 39(22): 106-110.
QUAN Lin-ka, MA Feng-cang, LIU Ping. Development Status of Hydroxyapatite Generation Technology of Titanium Bio-Implant[J]. Hot Working Technology, 2010, 39(22): 106-110.
[22] 陈柳珠, 李卫. 水热处理对钛表面羟基磷灰石合成的影响[J]. 稀有金属材料与工程, 2008, 37(3): 542-546.
CHEN Liu-zhu, LI Wei. Effect of Hydrothermal Synthesis Parameters on Hydroxyapatite Forming of Titanium Surface[J]. Rare Metal Materials and Engineering, 2008, 37(3): 542-546.
[23] 周游, 郭澍. 锶及羟基磷灰石在骨组织工程中的研究进展[J]. 中国美容整形外科杂志, 2018, 29(11): 686- 688, 706.
ZHOU You, GUO Shu. Research Progress of Strontium and Hydroxyapatite in Bone Tissue Engineering[J]. Chinese Journal of Aesthetic and Plastic Surgery, 2018, 29(11): 686-688, 706.
[24] LI Z Y, LAM W M, YANG C, et al. Chemical Composition, Crystal Size and Lattice Structural Changes after Incorporation of Strontium into Biomimetic Apatite[J]. Biomaterials, 2007, 28(7): 1452-1460.
[25] O’DONNELL M D, FREDHOLM Y, DE ROUFFIGNAC A, et al. Structural Analysis of a Series of Strontium- Substituted Apatites[J]. Acta Biomaterialia, 2008, 4(5): 1455-1464.
[26] LANDI E, TAMPIERI A, CELOTTI G, et al. Sr-Substituted Hydroxyapatites for Osteoporotic Bone Replacement[J]. Acta Biomaterialia, 2007, 3(6): 961-969.
[27] SCHMIDT R, GEBERT A, SCHUMACHER M, et al. Electrodeposition of Sr-Substituted Hydroxyapatite on Low Modulus Beta-Type Ti-45Nb and Effect on in Vitro Sr Release and Cell Response[J]. Materials Science and Engineering: C, 2020, 108: 110425.
[28] 陈柳珠, 李卫. 钛表面恒流微弧氧化及其能量规律[J]. 稀有金属材料与工程, 2008, 37(4): 682-685.
CHEN Liu-zhu, LI Wei. Invariable Current Mode Microarc Oxidation on Titanium Surface and Its Energy[J]. Rare Metal Materials and Engineering, 2008, 37(4): 682-685.
[29] 徐铁伟, 李金山, 张丰收, 等. 医用Ti-15Mo合金的再结晶动力学及时效响应研究[J]. 稀有金属材料与工程, 2017, 46(S1): 150-155.
XU Tie-wei, LI Jin-shan, ZHANG Feng-shou, et al. Recrystallization Dynamics and Aging-Treated Response of Ti-15Mo Medical Alloy[J]. Rare Metal Materials and Engineering, 2017, 46(S1): 150-155.
[30] XU T W, ZHANG S S, CUI N, et al. Microstructural and Textural Evolutions during Β → Α/ω Transformation in Biomedical Ti-15Mo Alloy and Its Effects on Mechanical Performance[J]. Journal of Materials Engineering and Performance, 2019, 28(11): 6969-6979.
[31] CHUNG C J, LONG Han-yun. Systematic Strontium Substitution in Hydroxyapatite Coatings on Titanium via Micro-Arc Treatment and Their Osteoblast/Osteoclast Responses[J]. Acta Biomaterialia, 2011, 7(11): 4081-4087.
[32] ZHAO Da-peng, SHI Wei, SHANG Peng, et al. Effects of Sr Incorporation on Surface Structure and Corrosion Resistance of Hydroxyapatite Coated Mg-4Zn Alloy for Biomedical Applications[J]. Transactions of Nonferrous Metals Society of China, 2018, 28(8): 1563-1570.
[33] 余森, 于振涛, 韩建业, 等. 多孔Ti3Zr2Sn3Mo25Nb钛合金表面活性次级微孔涂层的制备及其成骨性能[J]. 中国表面工程, 2012, 25(6): 101-106.
YU Sen, YU Zhen-tao, HAN Jian-ye, et al. Preparation and Osteogenesis of Active Secondary Microporous on the Porous Ti3Zr2Sn3Mo25Nb Titanium Alloy[J]. China Surface Engineering, 2012, 25(6): 101-106.
[34] MÜLLER L, MÜLLER F A. Preparation of SBF with Different HCO3–Content and Its Influence on the Composition of Biomimetic Apatites[J]. Acta Biomaterialia, 2006, 2(2): 181-189.
[35] 汤坚. 纯钛表面微弧氧化陶瓷涂层的水热调控及其生物活性[D]. 哈尔滨: 哈尔滨工业大学, 2020.
TANG Jian. Hydrothermal Modification and Bioactivity of Microarc Oxidation Ceramic Coating on Pure Titanium[D]. Harbin: Harbin Institute of Technology, 2020.
Effect of Strontium Content on Micro Arc Oxidation Coating and the Apatite Inducing Ability of Ti-15Mo Alloy
,,,,,
(School of Mechanical & Automotive Engineering, Qingdao University of Technology, Qingdao 266525, China)
This paper aims to improve the biocompatibility of Ti-15Mo alloy. Through micro arc oxidation (MAO) with Ca element replaced by Sr element in electrolyte and subsequent hydrothermal treatment, hydroxyapatite (HA) coatings are made on the surface of Ti-15Mo alloy. With the help of X-ray diffraction (XRD) and scanning electron microscope (SEM), this paper analyzes the microstructure, phase composition, contact angle and apatite inducing ability in the simulated body fluid of the coating. The results indicate that the MAO voltage under constant current mode is affected by the Sr concentration in the electrolyte and with the increase of Sr concentration, the scale and porosity of micro-pores of the coating with different Sr concentration first reduce and then increase. HA and Sr-HA phases had formed in the surface of Ti-15Mo alloy after MAO and hydrothermal treatment. Meanwhile, the Sr-HA crystallinity in the coating showed a rising trend with the increase of Sr concentration. The best Sr-HA crystallinity in coatings formed in the 30-Sr specimen, and the distribution of Sr-HA crystal columns with a stable hexagonal shape presented uniformly.In addition, the contact angle after hydrothermal treatment also presents excellent hydrophilicity, and the contact angle in 30-Sr specimen after hydrothermal treatment is 10.5°. Apatite induction ability of the coating of Ti-15Mo alloy in the simulated body fluid (SBF) has enhanced due to addition of Sr ions in the electrolyte during the MAO. The best apatite induction ability and biocompatibility of the coating appear in 30-Sr specimen, and its apatite deposition thickness is 58.87 μm. Apatite induction ability of Ti-15Mo alloy can be significantly improved by adding strontium ions in the electrolyte. When 30% Sr ions are added into the electrolyte, the apatite induction ability of the coating is the best and it also has good biocompatibility.
micro arc oxidation; titanium alloy; doped strontium; hydroxyapatite; biocompatibility
2021-03-20;
2021-05-26
LIU Yuan-cai (1998—), Male, Master's degree, Research focus: metal material processing and surface modification.
徐铁伟(1982—),男,博士,副教授, 主要研究方向为航空结构材料的相变理论及强韧化。
Corresponding author:XU Tie-wei (1982—), Male, Doctor, Associate professor, Research focus: phase transformation theory and strengthening of aviatic materials.
刘元才, 徐铁伟, 张珊珊, 等.锶含量对Ti-15Mo合金微弧氧化膜层及其磷灰石诱导能力的影响[J]. 表面技术, 2022, 51(1): 287-295.
TG146.2+3
A
1001-3660(2022)01-0287-9
10.16490/j.cnki.issn.1001-3660.2022.01.031
2021-03-20;
2021-05-26
山东省自然科学基金面上项目(ZR2020ME006);山东省重点研发计划项目(2018GGX102027)
Fund:General Program of Natural Science Foundation of Shandong Province (ZR2020ME006); Key Research and Development Program of Shandong Province (2018GGX102027)
刘元才(1998—),男,硕士研究生,主要研究方向为金属材料加工及表面改性。
LIU Yuan-cai, XU Tie-wei, ZHANG Shan-shan, et al. Effect of Strontium Content on Micro Arc Oxidation Coating and the Apatite Inducing Ability of Ti-15Mo Alloy[J]. Surface Technology, 2022, 51(1): 287-295.
