莲雾果实采后木质素合成相关MYB基因家族及其作用分析
2022-02-12匡凤元吴光斌陈发河
聂 珂,匡凤元,张 珅,吴光斌,陈发河
(集美大学食品与生物工程学院,福建 厦门 361000)
莲雾(Syzygium samarangense[Blume]Merrill&L.M.Perry)又名洋蒲桃、水蒲桃、爪蒲桃等,是桃金娘科蒲桃属乔本植物,起源于马来半岛、安达曼和尼科巴群岛[1],由我国台湾省最早引入种植[2]。莲雾果实营养丰富,药用价值高,具有保健功效,鲜食生津解渴,深受消费者的喜爱[3]。但由于莲雾果实采后生命活动旺盛,其果肉易发生絮状绵软等症状,使其食用品质发生劣变[4]。莲雾采后木质素代谢是造成果实絮状绵软症状发展的重要因素[5]。
MYB转录因子是植物中最大的一类转录因子家族,其N端含有一段约51~52个氨基酸组成的能够结合DNA的MYB结构域。相关研究发现,影响木质素生物合成的关键基因大多受到MYB转录因子的调控[6-7]。MYB转录因子参与植物的生长发育[8]、应激反应[9]、苯丙烷代谢[10]等多种过程。MYB基因在次生代谢中对木质素生物合成有重要作用。研究发现,棉花GhMYB43蛋白、红肉蜜柚CmMYB330蛋白和荷花NnMYB4蛋白对拟南芥木质素合成均起负调控作用[11-13]。采后莲雾果实中心絮状绵软的发展与木质素合成密切相关,目前对于莲雾果实的研究重点多集中于细胞壁代谢[14]和木质素代谢与果肉絮状绵软的生理机制方面[15],对于转录因子调控木质素代谢影响莲雾果实絮状绵软的机制尚不清楚。
本文对莲雾果实木质素合成相关的MYB转录因子家族进行生物信息学分析及表达研究,选择在莲雾果实中与MYB330、MYB4基因关系相近并具有显著性差异基因的MYB48克隆,考察拟南芥根、茎、叶处木质素合成关键酶基因的表达量差异,从分子水平上分析莲雾果实MYB家族的相关性质,并确定差异莲雾MYB基因对采后莲雾果实木质素合成的调控作用,为进一步探讨SsMYBs蛋白的功能和解析莲雾果实絮状绵软调控的分子机制提供基础。
1 材料与方法
1.1 材料与设备
1.1.1 材料与试剂
以当日抵达厦门市台湾水果集散中心的台湾“蜜风铃”莲雾果实为试材。
大肠杆菌(DH5α)和农杆菌(EHA105):购自唯地生物科技(上海)有限公司;PMD19-Simple载体:购自宝日医生物技术(北京)有限公司;PCAMBIA2301载体:购于北京鼎国昌盛生物技术有限公司;T4连接酶、限制性核酸内切酶KpnI/Hind III、克隆载体pMD19-T、DNA marker:购自TaKaRa。
RNA提取试剂盒(Omega Plant RNA Kit:R6827-01):Omega公司;反转录试剂盒(Prime-ScriptTMII 1st Strand cDNA Synthesis Kit:6210A):TaKaRa宝生物工程(大连)有限公司;DNA纯化回收试剂盒、质粒提取试剂盒:天根生化科技(北京)。
1.1.2 仪器与设备
DW-86L338(J)超低温冰箱:海尔生物医疗股份有限公司;LE204E型电子分析天平:梅特勒-托利多仪器(上海)有限公司;Sigma3K18型高速冷冻离心机:德国Sigma公司;WH-2型微型漩涡混合仪:上海沪西分析仪器厂有限公司;SW-CJ-ZD型超净工作台:苏州净化设备有限公司;SYG-1220型恒温水浴锅:美国精骐有限公司;MJ-78A型高压灭菌锅:施都凯仪器设备(上海)有限公司;A600型PCR扩增仪:杭州朗基科学仪器有限公司;Nanodrop 1000型微量蛋白核酸测定仪:赛默飞世尔科技公司;C150型凝胶成像系统:美国UVP公司;OSE-470型切胶仪:天根生化科技(北京)有限公司。
1.2 方法
1.2.1 莲雾果实MYB转录因子基因(MYB基因)家族成员的数据筛选
所采用数据源自本研究室前期测序得到的莲雾转录组数据库,已上传至NCBI(SRA数据库[16](https://www.ncbi.nlm.nih.gov/bioproject/PRJNA284092),在KEGG通路中选择苯丙烷类代谢通路(KO09422通路)。用“MYB”和词进行筛选,选择基因的功能注释为“预测其与木质素合成相关的MYB蛋白”的基因,应用ORF finder(https://www.ncbi.nlm.nih.gov/gorf/orfig.cgi)在线预测其开放阅读框,并推导出可编码蛋白序列。
1.2.2 莲雾MYB基因家族成员的生物信息学分析
利用Ex PASy的Prot Param和Prot Scale对SsMYBs蛋白进行基本理化性质和亲/疏水性分析;通过Net Phos 3.1 Server在线对SsMYBs蛋白的潜在磷酸化位点进行预测;通过NCBI served Domains数据库,在线分析MYB蛋白保守结构域;登录SignalP 5.0 Server查看SsMYBs蛋白的信号肽;利用Cell-PLoc 2.0对SsMYBs蛋白进行亚细胞定位预测,利用在线软件TMHMM Server v.2.0预测蛋白的跨膜结构。利用SOPMA在线数据库和SWISS-MODEL数据库分别进行SsMYBs蛋白的二级结构预测和三维结构的同源建模预测。
1.2.3 莲雾果实MYB基因家族成员的系统发育树构建
利用MEGA7.0软件对筛选得到的20个MYB基因进行多序列比对,选择邻近结合法(Neighbor-Joining,NJ)算法构建系统发育树,Pariwise Deletion处理缺失数据,P-distance模型,Bootstrap检测次数设为1 000;再利用NCBI的基本局部比对搜索工具(BLAST,https://www.ncbi.nlm.nih.gov/blast/)对莲雾MYB蛋白分别进行相似性比对,构建莲雾MYB基因家族与其他物种间的系统发育树。
1.2.4 SsMYBs基因总RNA的提取及cDNA的合成
选择贮藏期间差异表达的comp_46078序列。通过ORF finder(https://www.ncbi.nlm.nih.gov/orffinder/)在线预测该序列的开放阅读框,根据同源性分析将其命名为SsMYB48。用Omega试剂盒提取RNA,利用TaKaRa反转录试剂盒合成第1链cDNA,于-20℃保存备用。
1.2.5 SsMYB48基因的克隆及植物表达载体构建
以RNA反转录合成的cDNA为模板,利用Primer Premier 5.0软件设计全长引物,正向引物(F):5′-ATGACCCCTCAAGAAGAGA-3′,反向引物(R):5′-CCTTACCAGGAAGAGTAATGA-3′;PCR扩增莲雾SsMYB48序列全长,设置3个生物学重复和3次技术重复。PCR扩增后,将产物进行回收纯化,连接pMD19-T载体(TaKaRa),转入大肠杆菌DH5α感受态细胞,进行阳性克隆筛选,送测序进行验证,提交NCBI GenBank获得登录号。选择北京鼎国公司生产的植物过表达载体pCAMBIA2301,构建pCAMBIA2301-SsMYB48重组质粒。
1.2.6 SsMYB48基因的组织表达
构建pCAMBIA2301-SsMYB48重组载体,在拟南芥中进行过表达。分别取成熟的野生型和SsMYB48基因过表达拟南芥植株的根、茎和叶作为材料,选择AtIRX8作为内参基因,参考李针针[17]的引物设计(如表1所示),荧光定量PCR进行反应。每个样本设置3个生物学重复和3次技术重复。设定0 d的莲雾果实基因表达量为1.0(对照),其他均为处理组,根据2-△△Ct法计算相对表达量。
2 结果与分析
2.1 莲雾MYB基因家族成员的命名
选取合适的开放阅读框中的蛋白序列,通过美国国家生物技术信息中心(NCBI,https://www.ncbi.nlm.nih.gov)数据库中进行蛋白序列比对(Blastp),筛选出具有MYB或者MYB-like的蛋白序列,并根据同源性比对结果对SsMYBs基因家族成员进行命名,如表2所示,得到20个MYB基因。

表2 莲雾MYB基因家族成员的基因名称Table 2 Gene names of MYB gene family members in wax apple
2.2 莲雾MYB基因家族成员的基本理化性质及疏水性分析
如表3所示,该家族蛋白的氨基酸序列长度在91~591个氨基酸之间,蛋白质的相对分子质量介于9.98~64.91 kD,理论等电点(pI)介于4.92~9.73,其中SsMYB4、SsMYB5、SsMYB6、SsMYB39、SsMYB44、SsMYB77、SsMYB114、SsMYB308和SsMYB330蛋白呈碱性(pI>7),剩余基因成员呈酸性(pI<7)。SsMYBs蛋白的脂肪系数为41.81~94.29,不稳定指数为30.34~67.98,平均亲水指数为-0.672 9。除SsMYBs39为稳定性蛋白外,剩余蛋白成员表现为不稳定蛋白(不稳定指数>40),故SsMYBs蛋白为亲水性蛋白。

表3 莲雾MYB基因家族成员的基本理化性质分析Table 3 Analysis of basic physical and chemical properties of MYB family gene members in wax apple
如图1所示,图形的高峰值(正值)区域表示疏水区域,而负值的“低谷”区域是亲水区域,SsMYB1蛋白和SsMYB4蛋白的亲水区大于疏水区,说明SsMYB1蛋白和SsMYB4蛋白为亲水性蛋白;分析其余蛋白家族成员,发现有相似的结果,表明莲雾MYB蛋白家族均为亲水性蛋白。

图1 SsMYBs蛋白序列的亲/疏水性的预测分析Fig.1 Hydrophilic/hydrophobic prediction analysis of SsMYBs protein sequence
2.3 莲雾MYB基因家族成员的磷酸化位点分析
如图2所示,SsMYB1和SsMYB4中丝氨酸(S)磷酸化位点几乎分布在整条多肽链上,苏氨酸(T)和酪氨酸(Y)分布在多肽链的中后段。由表4可知:20个莲雾MYB蛋白氨基酸中,丝氨酸数目均为最高,其次是苏氨酸;在三者中,酪氨酸含量为最低;在莲雾SsMYBs蛋白中,SsMYB33蛋白具有的潜在磷酸化位点数最多,SsMYB114蛋白含有的潜在磷酸化位点数最少。
表4 莲雾MYB蛋白磷酸化位点分析Table 4 The phosphorylation site analysis of MYB proteins in wax apple 单位:个

图2 莲雾MYB蛋白磷酸化位点分析Fig.2 The phosphorylation site analysis of MYB proteins in wax apple
2.4 莲雾MYB基因家族成员的蛋白性质分析
20个SsMYBs均无信号肽,没有剪切位点,不属于分泌蛋白;亚细胞定位都定位于细胞核上;无明显跨膜区。SsMYB1的信号肽和跨膜区分析结果如图3所示。MYB基因主要作用于细胞核,不应该含有信号肽区域和跨膜结构,这与预测结果一致,符合基因与细胞核顺式元件相结合并发挥调控作用的特点。
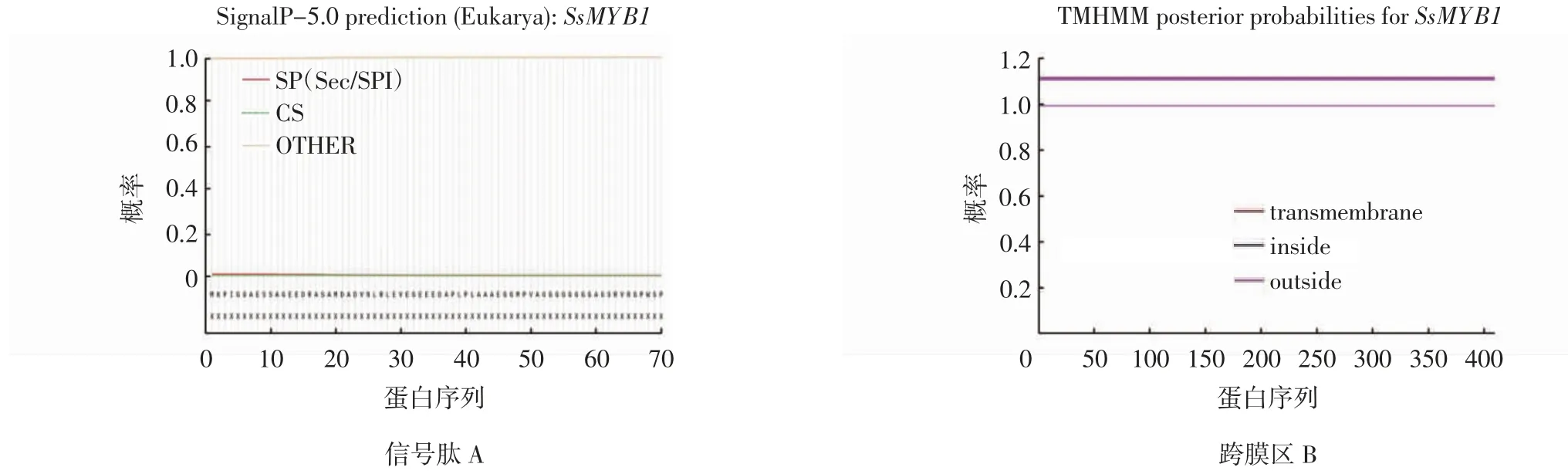
图3 SsMYB1信号肽分析及跨膜结构分析Fig.3 Analysis of signal peptide and transmembrane structure of SsMYB1
2.5 莲雾MYB基因家族成员的二级结构和三级结构预测
如表5所示,SsMYBs蛋白均由α-螺旋(Alpha helix)、β-转角(Beta turn)、延伸链(Extended strand)和随机卷曲(Random coil)4种构型组成,其所占比例分别为33.99%、6.47%、4.61%和54.92%。由以上分析可知,SsMYBs蛋白主要构型为α-螺旋和随机卷曲。

表5 SsMYBs的蛋白质二级结构对比分析Table 5 Comparative analysis of secondary structures of SsMYBs proteins
MYB蛋白的三级结构通常与其二级结构具有一定的联系,可以通过三级结构的结果来判断二级结构结果的正确性。如图4所示,在三级结构中,α-螺旋和无规卷曲是SsMYBs蛋白的主要结构元件,分布于整个蛋白质中,这与SOPMA预测SsMYBs蛋白质的二级结构结果一致。
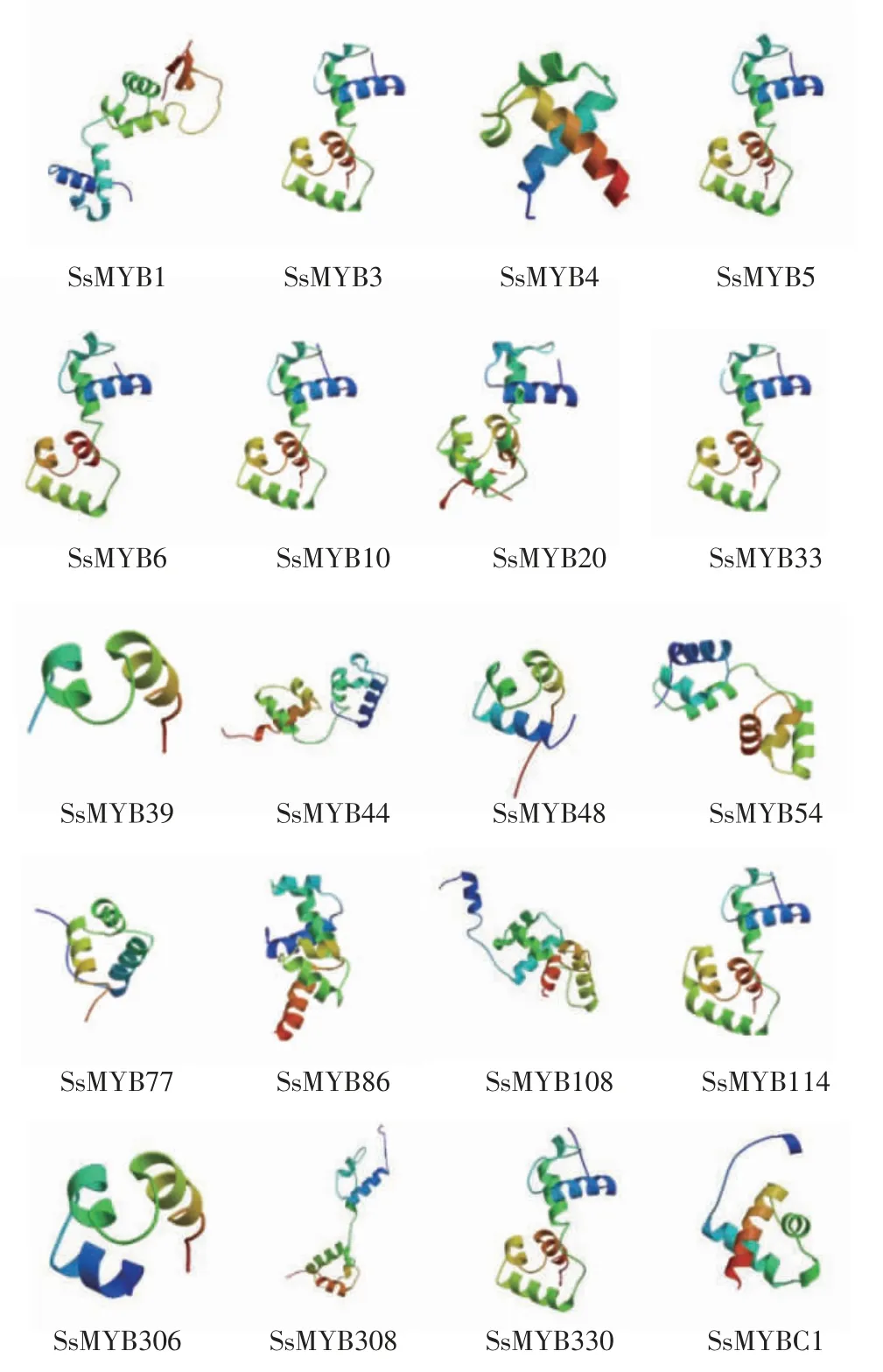
图4 莲雾MYB基因家族蛋白的三级结构分析Fig.4 Tertiary structure analysis of MYB gene family proteins in wax apple
2.6 莲雾MYB基因家族成员的多序列比对
如图5所示,根据序列同源性分析结果,莲雾MYB基因家族中可分为2个类群。其中SsMYB77与SsMYB44的同源性最高,为100%。SsMYB3、SsMYB10、SsMYB20与SsMYB86成员之间的相似性较高,SsMYB10、SsMYB20与SsMYB308之间的相似性较高;有研究表明MYB330与MYB4与木质素的合成有关[12-13],选择与SsMYB330和SsMYB4相似性较高的SsMYB48和SsMYB54的蛋白序列,在NCBI上进行BLAST比对,进一步研究莲雾MYB蛋白与其他物种MYBs蛋白之间的进化关系。
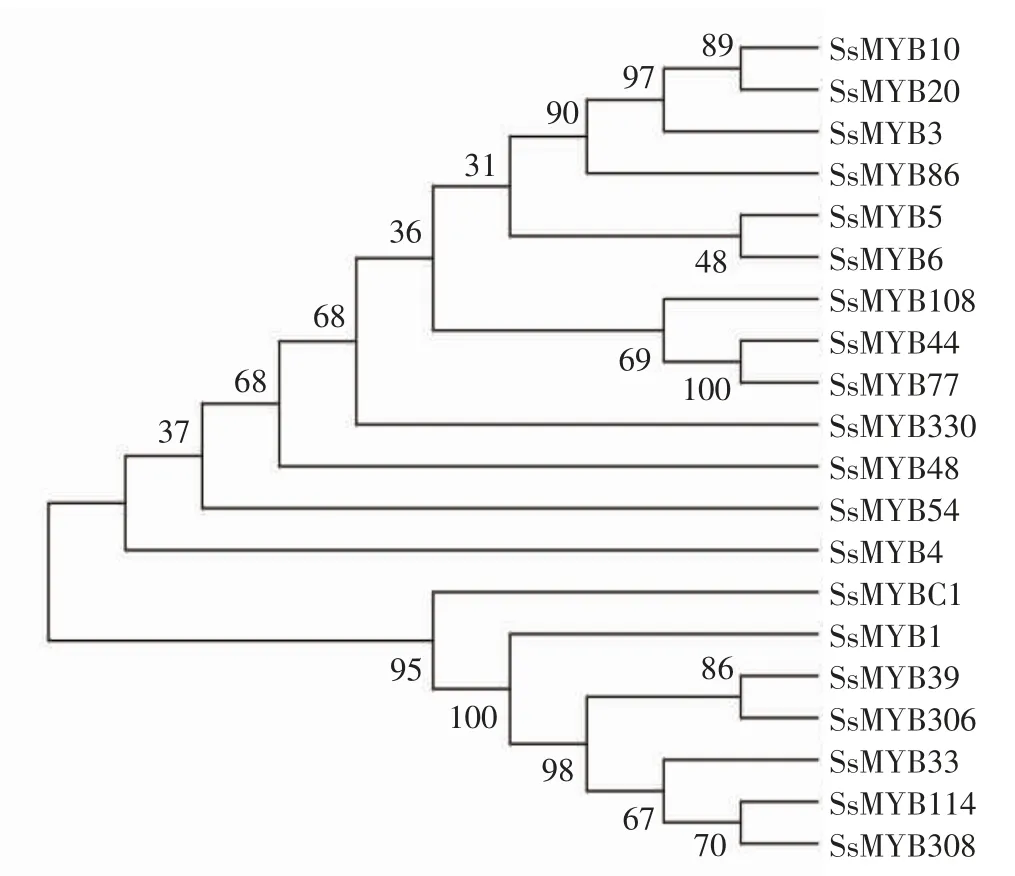
图5 SsMYBs的mRNA序列同源性分析结果Fig.5 Results of homology analysis of mRNA sequences of SsMYBs
2.7 莲雾MYB基因家族成员的系统发育树
如图6所示,利用4个莲雾MYB蛋白(SsMYB330、SsMYB4、SsMYB48和SsMYB54)与木豆(Cajanus cajan,CcaMYBs)、大麻(Cannabis sativa,CsMYBs)、番木瓜(Carica papaya,CpMYBs)、柑 橘(Citrus clementina,CcMYBs)、小果咖啡(Coffea arabica,CaMYBs)、榴莲(Durio zibethinus,DzMYBs)、巨桉(Eucalyptus grandis,EgrMYBs)、大 豆(Glycine max,GmMYBs)、野 大 豆(Glycine soja,GsMYBs)、树棉(Gossypium arboretum,GarMYBs)、南方棉(Gossypium austral,GaMYBs)、陆地棉(Gossypium hirsutum,GhMYBs)、木槿(Hibiscus syriacus,HsMYBs)、鼠尾草(Herrania umbratical,HuMYBs)、橡胶树(Hevea brasiliensis,HbMYBs)、麻风树(Jatropha curcas,JcMYBs)、核桃(Juglans regia,JrMYBs)、木薯(Manihot esculenta,MeMYBs)、杨梅(Morella rubra,MrMYBs)、开心果(Pistacia vera,PvMYBs)、银白杨(Populus alba,PaMYBs)、胡杨(Populus euphratica,PeMYBs)、毛果杨(Populus trichocarpa,PtMYBs)、石榴(Punica granatum,PgMYBs)、美洲栎(Quercus lobata,QlMYBs)、栓皮栎(Quercus suber,QsMYBs)、玫瑰木(Rhodamnia argentea,RaMYBs)、蓖麻(Ricinus communis,RcMYBs)、密花豆(Spatholobus suberectus,SsuMYBs)、番樱桃(Syzygium oleosum,ScMYBs)、可可树(Theobroma cacao,TcMYBs)、葡萄(Vitis vinifera,VvMYBs)、枣(Ziziphus jujuba,ZjMYBs)共33个物种的MYB蛋白构建系统发育树,发现4个莲雾MYB蛋白与番樱桃、玫瑰木和巨桉均在同一进化亚枝上,说明它们之间的同源性较高,故推测莲雾MYB基因与番樱桃、巨桉、玫瑰木的亲缘性较近,其可能是由于莲雾与番樱桃、巨桉、玫瑰木同属于桃金娘科和桃金娘目。

图6 莲雾MYB基因家族系统发生树Fig.6 Phylogenetic tree of MYB gene family in wax apple
2.8 SsMYB48基因的克隆及植物表达载体的构建
如图7所示,因MYB330和MYB4两个基因与木质素的合成有关[12-13],选择与SsMYB330和SsMYB4相似性较高的氨基酸序列且在莲雾转录组贮藏期间差异表达的SsMYB48基因进行克隆和表达。
如图7A所示,以莲雾cDNA为模板,得到的SsMYB48基因扩增产物条带大小在500~750 bp之间。测序结果与转录组数据库中序列一致,SsMYB48编码的氨基酸序列全长549 bp,编码182个氨基酸残基和一个终止密码子TAA(图8)。在NCBI上传序列comp_46078,获得登录号:MK204557.1。选择pCAMBIA2301植物表达载体,分子量大小为11 633 bp,插入目的基因后,pCAMBIA2301-SsMYB48重组质粒条带大小为12 182 bp,如图7B所示,电泳检测显示条带在蛋白marker 12 000 bp附近,与预期大小相似,且没有其他杂带,说明目的条带插入成功,且重组质粒质量良好。如图7C所示,用KpnI/Hind III对重组质粒进行双酶切验证,在蛋白Marker 12 000 bp附近及549 bp处分别出现预期的目的条带,表明植物表达载体构建成功。
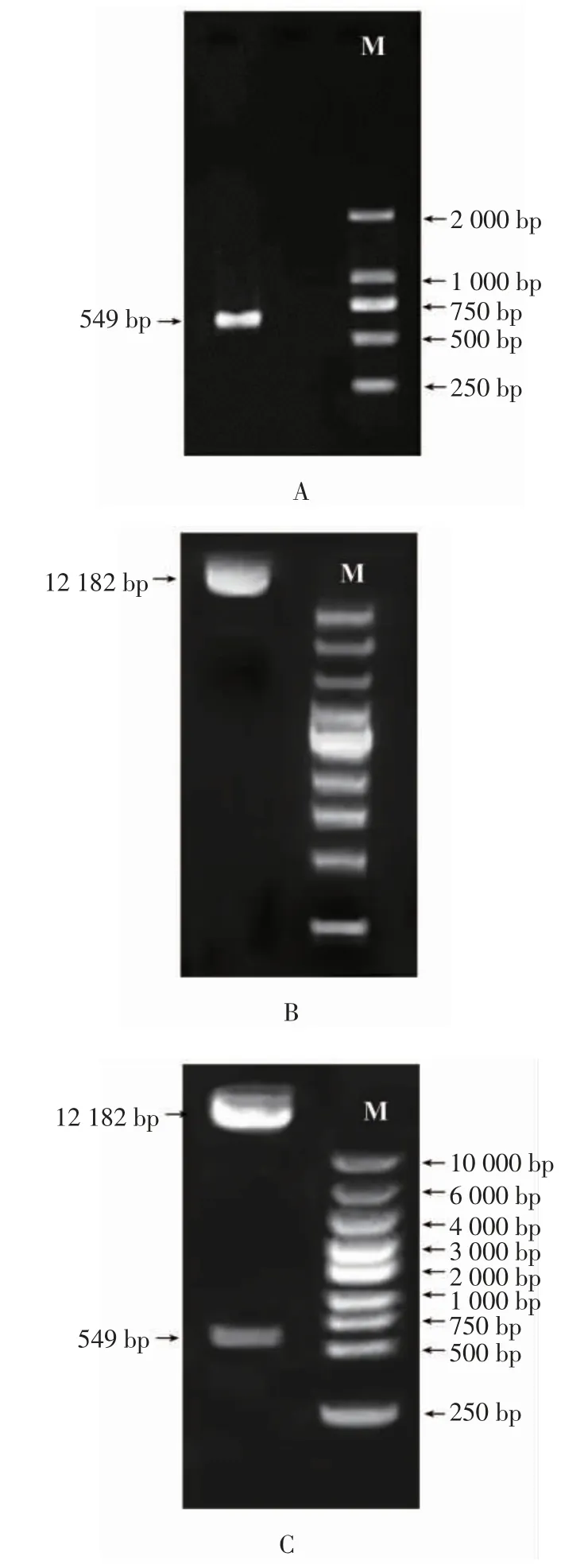
图7 SsMYB48基因克隆电泳图Fig.7 Electrophoresis results of SsMYB48 PCR products

图8 SsMYB48基因cDNA及推测的氨基酸序列Fig.8 Sequence of SsMYB48 cDNA and the deduced amino acids
2.9 SsMYB48在拟南芥上的组织表达
如图9所示,转SsMYB48基因的拟南芥根、茎和叶中木质素合成途径关键酶基因的表达量均较野生型拟南芥植株有所下降,在拟南芥各个组织中的表达丰度差异性较大。从基因表达趋势来看:SsMYB48基因在拟南芥的根、茎、叶中均有表达,且在茎、叶片中SsMYB48过表达型植株木质素合成关键酶基因的表达量较野生型植株明显下降。比较转SsMYB48基因型和野生型中木质素合成关键酶基因的相对表达量发现:在拟南芥的根中,木质素合成关键酶基因At4CL、AtF5H和AtPOD的差异较明显;在茎中,AtC4H、AtF5H、AtC3H和AtPOD的差异较明显;在叶片中,AtPAL、AtC4H、AtF5H、AtC3H和AtPOD的差异较明显;综合得在拟南芥的根、茎、叶中,木质素合成关键酶基因AtF5H和AtPOD受SsMYB48基因的影响较大。

图9 SsMYB48木质素合成关键酶基因在拟南芥不同组织中的表达分析Fig.9 Expression analysis of key enzyme genes of SsMYB48 lignin synthesis in different tissues of Arabidopsis thaliana
3 讨论与结论
莲雾果实采后果肉易发生絮状绵软症状,通过转录组分析发现莲雾果实絮状绵软症状的发生与木质素合成含量有关[16]。MYB基因作为目前在植物中研究发现的数量最大、功能最多样的基因之一[18],其表达物可参与调控植物次生代谢中的苯丙烷代谢[19]。目前在枇杷[20]、石榴[21]和柑橘[22]等果实中均克隆得到调控木质素合成的MYB蛋白。
本文利用莲雾转录组数据库筛选出20个与木质素合成相关的MYB基因,对其进行生物信息学分析。研究结果表明,MYB基因表达的MYB蛋白多为不稳定亲水性蛋白;具有多个潜在的磷酸化位点,均为非分泌蛋白,不含跨膜结构。MYB基因常在细胞核内与靶标基因的启动子区域结合,发挥其激活或抑制该基因表达的功能。因此,基因一般被定位于细胞核中,起着调控表达的作用[23]。Zhao等[24]对大豆GmMYBJ3进行氨基酸序列特征及亚细胞定位分析,发现GmMYBJ3定位在细胞核中。研究人员通过构建载体pCAMBIA1301-MYB10-GFP,侵染烟草细胞后,发现杏PaMYB10基因定位于细胞核中[25]。这与本文预测的SsMYBs蛋白的亚细胞定位于细胞核的结果一致。二级结构分析和三级结构建模预测表明:SsMYBs蛋白空间结构主要是由α-螺旋和随机卷曲组成,所占比例分别为34.30%和55.03%,符合一般MYB蛋白特征[26-27]。
系统进化树结果表明:相邻或较近进化关系上可能具有相同或相似的功能[28],多序列比对结果发现SsMYB77与SsMYB44的同源性最高,SsMYB3、SsMYB10、SsMYB20与SsMYB86成员之间的相似性较高,通过构建莲雾MYB与不同物种间的进化树,推测相似性较高的家族成员间功能可能存在相似性。分析发现:莲雾与番樱桃、巨桉、玫瑰木的亲缘性较高,属同一分支,其可能是由于莲雾与番樱桃、巨桉、玫瑰木同属于桃金娘科和桃金娘目。莲雾作为木本植物,它的基因组数据库非常大而且复杂,在短时间内难以对其进行全基因组测序,现在已知它与番樱桃、巨桉、玫瑰木的亲缘性很高;SsMYB48基因在拟南芥的根、茎、叶中的过表达对木质素合成均起抑制作用,在茎、叶中木质素合成关键酶基因的表达量较野生型植株明显下降,说明SsMYB48基因在拟南芥根中的表达水平较低,在茎、叶中表达水平较高;木质素合成关键酶基因AtF5H和AtPOD受SsMYB48基因的影响较大。以上结果表明,莲雾MYB基因对木质素的合成可能起抑制作用,在今后对莲雾MYB基因的进一步研究中,可以借助番樱桃、巨桉、玫瑰木的基因组作为莲雾基因分析的参考和验证基础。
