替普瑞酮对帕金森细胞模型中热休克蛋白表达的影响及其抗细胞凋亡机制
2022-02-12郭垠利刘承波
郭垠利,刘承波
1.贵州师范学院化学与材料学院,贵州贵阳550018;
2.江陵县人民医院检验科,湖北荆州434100
临床上替普瑞酮(geranylgeranylacetone,GGA)主要应用于胃肠道的溃疡疾病治疗中。在多个脑区的神经元中、肝脏组织细胞中、脑梗塞以及光损伤等造成的细胞损伤中,GGA通过诱导蛋白激酶C(protein kinase C,PKC)的表达而使热休克因子-1(heat shock factor 1,HSF-1)磷酸化,调节HSF-1的转录活性,使热休克蛋白(heat shock protein,HSP)70表达量升高,抑制ROS的生成功能,从而达到保护细胞损伤的作用[1-3]。Apoptozole(AP)是HSP70的抑制剂,通过抑制HSP70与APAF-1的相互作用,诱导含半胱氨酸的天冬氨酸蛋白水解酶caspase依懒性的凋亡反应[4]。APRILE等[5]研究发现,人类分子伴侣HSP70抑制帕金森病相关蛋白α-突触核蛋白的淀粉样蛋白原纤维的伸长,并且能够与错误折叠的蛋白相互作用,阻止聚集物的形成,协助错误折叠的α-突触核蛋白降解,该机制能够有效抑制神经退化性病变。
在生物机体内,细胞凋亡的各个通路间并不是独立的,而是存在相互调节的作用。该调节主要通过Bcl-2原癌基因的编码产物Bcl-2蛋白家族来实现。Bcl-2家族按其功能可分为抗凋亡的Bcl-2亚族和促凋亡的Bax亚族,而Bax是线粒体凋亡信号通路上游的关键调节因子[6]。HSP70能够依赖其所具有的分子伴侣的功能及ATPase的活性,通过caspase依赖或caspase非依赖的活动参与细胞凋亡信号通路的多个环节。有研究表明,诱导HSP70的过表达能够有效抑制促凋亡蛋白Bax从胞质向线粒体的转移,抑制线粒体释放促凋亡因子,从而调控线粒体的上游通路,进一步抑制凋亡执行蛋白caspase-3的诱导表达[7]。同时,DARLING等[8]的研究也表明,在神经元细胞中,内质网应激诱导的细胞凋亡同样依赖于Bax的传递。其通过抑制Bax蛋白抑制因子1(Bax inhibitor-1,BI-1)的表达,进一步抑制pro-caspase-12前体的堆积,诱导内质网应激的特异性蛋白酶caspase-12的切割活化,进一步启动凋亡执行因子caspase-3的表达,从而促使凋亡发生。
帕金森(Parkinson disease,PD)是一种中老年常见的神经系统退行性疾病,其主要临床表现为静止性震颤、步态不稳、运动迟缓等运动障碍,以及非运动症状如神经异常、嗅觉衰退、睡眠障碍疾病[9-10]。在65岁以上人群中,PD发病率约2%[11]。随着全球人口老龄化程度日益加剧,PD临床发病率呈逐年上升趋势。据有关组织机构预测,至2040年,全球PD患者人数将由2015年的620万急增至1 290万,不仅会严重影响患者生活质量,而且会给患者家庭以及社会带来沉重的经济负担[12-13]。在对PD的分子病理学研究中,通常通过1-甲基-4苯基-1,2,3,6-四氢吡啶(1-methyl-4-phenyl-1,2,3,6-te-trahydropyridine,MPTP)诱导构建PD的毒理学模型。MPTP作为一种具有神经毒性的物质,在大脑内转化为高毒性的1-甲基-4苯基吡啶离子MPP+,并在多巴胺能(dopaminergic,DA)神经元中聚集,从而诱导DA神经元的退行性病变[14]。MPP+是体外构建PD模型的常用药物,其被DA神经元转运蛋白摄取后,聚集在线粒体内,通过产生氧化应激反应,增加活性氧,抑制线粒体呼吸链复合物Ⅰ活性,阻断NADH氧化磷酸化系统,使三磷酸腺苷生成减少,最终导致黑质内DA神经元变性死亡。因此,本研究用MPP+作用于PC12细胞诱导PD细胞模型,通过研究GGA对MPP+药物诱导的PD细胞模型中HSP70蛋白的表达及细胞凋亡的影响,探讨其抗细胞凋亡机制及在PD患者脑中的神经保护作用。
1 材料与方法
1.1细胞 PC12细胞株(大鼠肾上腺髓质嗜铬瘤分化细胞株)购自中国科学院昆明动物研究所。
1.2主要试剂 RPMI1640培养基购自美国GIBCO;胎牛血清和马血清购自美国Hyclone公司;青霉素链霉素双抗、MTT购自北京索莱宝科技有限公司;BCA蛋白定量试剂盒购自美国Bio-RAD公司;小鼠抗Bax(sc-20067)、HSP70(sc-66048)、caspase-3(sc-56053)单抗及兔抗pro-caspase-12(sc-5627)多抗、鼠抗β-actin(sc-47778)单抗购自美国Santa Cruz Biotechnology公司;GGA购自日本卫材中国药业公司;MPP+、AP购自美国Sigma;HRP标记的Goat anti-Rabbit、Goat anti-Mouse购自美国KPL公司;其余试剂均为国产分析纯。
1.3细胞培养 用RPMI164培养基(含10%灭活供体马血清、5%灭活胎牛血清和1%双抗)于37℃,5%CO2培养箱培养PC12细胞,当细胞融合度达90%时,弃上清,加入新鲜的培养基,用移液器吹散细胞,平均分装至2个玻璃培养皿中。
1.4P D模型的建立及其细胞存活率检测 采用MTT法。用培养液悬浮对数生长期PC12细胞,调整细胞悬液浓度为5×105个/mL,加入细胞悬液,100μL/孔,设6个复孔;用0.3 mmol/L MPP+刺激贴壁的PC12细胞0、3、6、12和24 h,并根据刺激时长不同,分别将上述给药细胞设为0、3、6、12、24 h组,置37℃,5%CO2培养箱培养;加入MTT溶液,20μL/孔,继续培养4 h;终止培养,吸弃孔内培养液,加入二甲基亚砜,150μL/孔,置摇床低速震荡10 min,使结晶物充分溶解;酶标仪450 nm波长处检测各孔A值。
1.5P D模型的分组处理 为检测PD模型中凋亡标记分子蛋白Bax及pro-caspase-12的表达,将细胞模型分为2组:不给药的control组、0.3 mmol/L MPP+刺激6 h的给药组;为了检测GGA诱导HSP70表达抑制凋亡的作用,将PD模型细胞分为4组:PD模型构建成功的control组、0.2 mmol/L GGA给药组(GGA组)、1μmol/L HSP70抑制剂单独给药组(AP组)及0.2 mmol/L GGA与1μmol/L HSP70抑制剂联合用药组(GGA+AP组)。
1.6B a x、pro-caspase-12、caspase-3、H S P70蛋白表达的检测 采用Western blot法。用RIPA细胞裂解液裂解细胞,取10μg总蛋白,经10%SDS-PAGE分离后,电转至PVDF膜,加入10%脱脂奶4℃封闭过夜;分别加入鼠抗Bax、caspase-3和HSP70单抗及兔抗pro-caspase-12多抗,同时以鼠抗β-actin单抗作为内参(均1∶5 000稀释),37℃孵育1 h;抗原抗体结合后,以1×TPBS缓冲液洗涤3次,每次5 min,分别加入HRP标记的Goat anti-Mouse和Goat anti-Rabbit(均1∶10 000稀释),37℃孵育l h;用1×TPBS缓冲液洗涤5次,每次10 min,ECL显影检测蛋白表达情况。Image软件计算灰度值,目的蛋白与β-actin灰度值的比值即为目的蛋白相对表达量。
1.7统计学分析 用SPSS 22.0软件进行统计学分析,数据以均值±标准差(x±s)表示,两组间比较采用t检验;多组间比较采用单因素方差分析,事后多重比较采用LSD-t检验。检验水准α为0.05,以P<0.05为差异有统计学意义。
2 结果
2.1细胞存活率 MTT法检测结果表明,与0 h组相比,用0.3 mmol/L MPP+刺激PC12细胞3、6、12和24 h后细胞存活率均显著下降(t分别为6.659、8.647、11.24和12.31,P均<0.01)。见图1。表明PD模型构建成功。本文选择6 h组作为PD建模成功试验组。
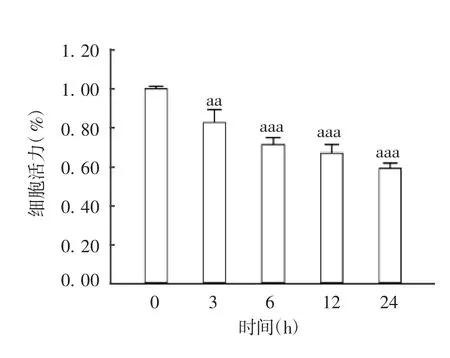
图1 MPP+刺激PC12细胞凋亡的检测Fig.1 MPP+stimulated apoptosis of PC12 cells
2.2P D模型中B a x、pro-caspase-12蛋白的表达 与control组相比,给药组Bax蛋白的表达(0.600 0±0.140 5)明显升高(t=4.272,P<0.05),内质网特异性的含半胱氨酸的pro-caspase-12蛋白的聚集(-0.365 2±0.046 02)显著下降,切割活化极显著上升(t=7.937,P<0.01)。见图2。2.3GG A和A P对P C12细胞中H S P70蛋白表达的影响 与control组相比,GGA组HSP70蛋白的表达明显升高(t=4.569,P<0.01),而AP组明显降低(t=2.855,P<0.05);GGA+AP组HSP70蛋白的表达较GGA组明显降低(t=4.085,P<0.01)。见图3和图4。2.4GG A和A P对P C12细胞中B a x、pro-caspase-12和caspase-3蛋白表达的影响 与control组相比,GGA组Bax蛋白的表达被明显抑制(t=2.370,P<0.05),而AP组明显升高(t=3.546,P<0.01);GGA组pro-caspase-12蛋白的表达明显升高(t=4.881,P<0.01),而AP组明显降低(t=3.142,P<0.05)。GGA+AP组pro-caspase-12蛋白的表达较GGA组明显降低(t=4.312,P<0.01)。GGA组caspase-3蛋白的表达较control组明显降低(t=3.458,P<0.01),而AP组明显升高(t=4.284,P<0.01)。GGA+AP组的Bax和caspase-3蛋白的表达与GGA组相比,差异无统计学意义(t=1.497,P>0.05)。见图5和图6。
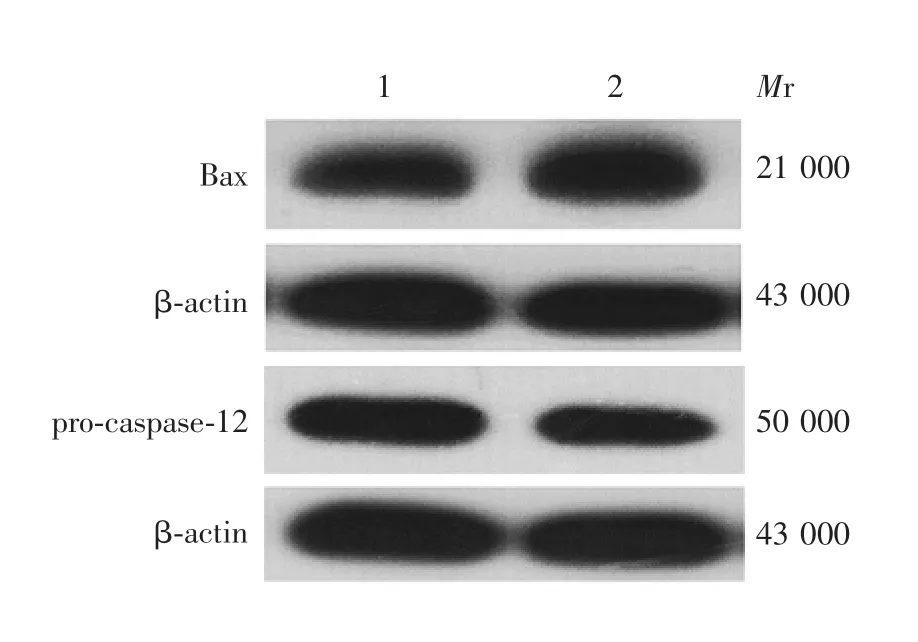
图2 PD模型中Bax、pro-caspase-12蛋白表达的Western blot检测Fig.2 Western blotting of Bax and pro-caspase-12 proteins expressed in PD cell model
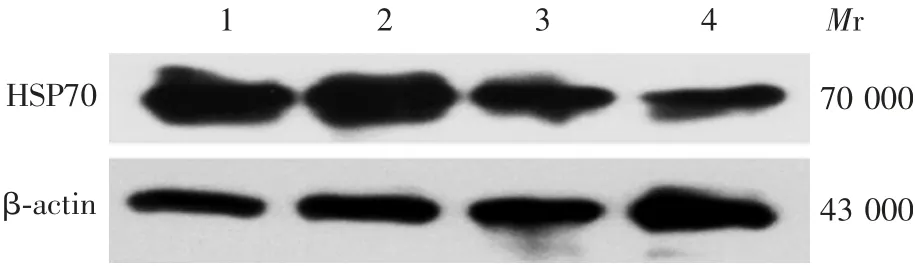
图3 GGA和AP对PC12细胞HSP70蛋白表达影响的Western blot检测Fig.3 Western blotting of effects of GGA and APon HSP70 expression in PC12 cells
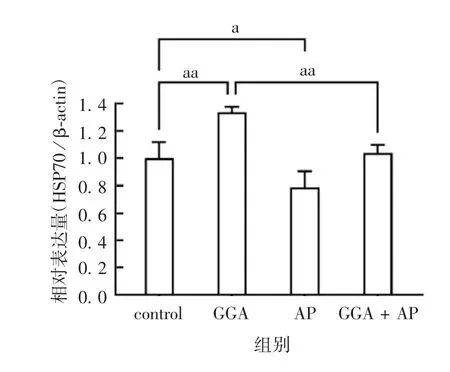
图4 GGA和AP对HSP70蛋白表达的影响Fig.4 Effects of GGA and APon HSP70 protein expression

图5 GGA和AP对Bax、pro-caspase-12和caspase-3蛋白表达影响的Western blot分析Fig.5 Western blotting of effects of GGA and AP on expressions of Bax,pro-caspase-12 and caspase-3
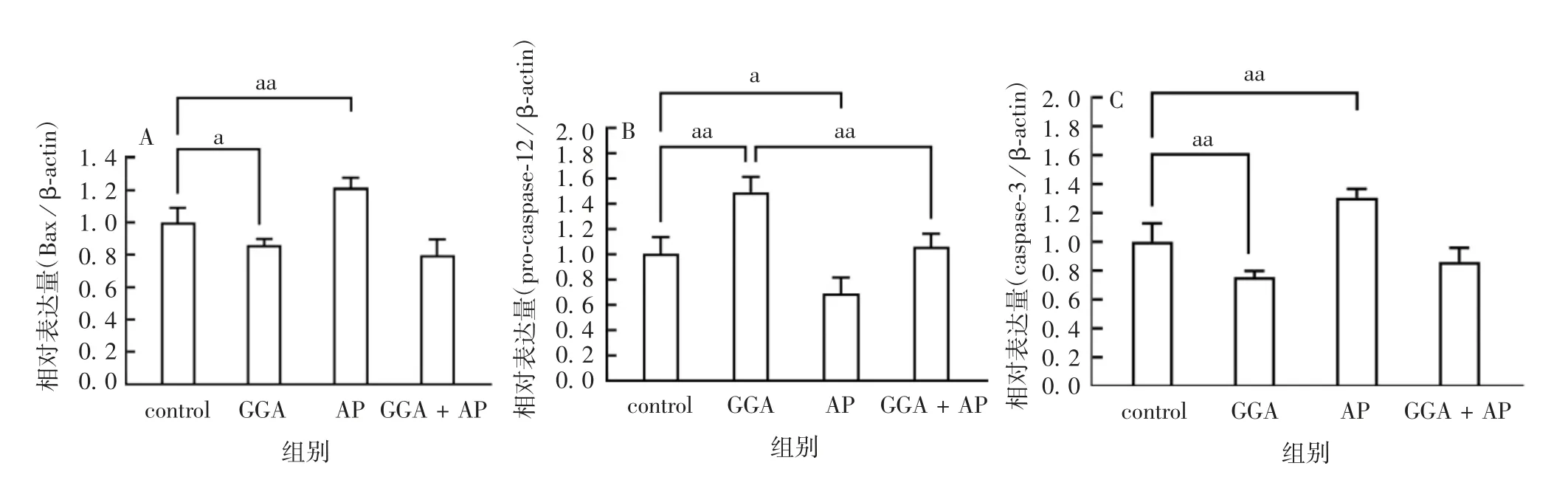
图6 GGA和AP对Bax(A)、pro-caspase-12(B)和caspase-3(C)蛋白表达的影响Fig.6 Effects of GGA and APon expressions of Bax(A),pro-caspase-12(B)and caspase-3(C)
3 讨论
PD是一种脑神经退化性疾病,其具体的发病机制目前尚不明确。研究结果显示,PD的发病机制可能与早期环境、氧化应激、遗传因素、线粒体功能障碍、年龄因素、免疫异常、细胞凋亡等诸多因素有关[15]。MPP+可通过抑制线粒体复合物Ⅰ的活性导致线粒体功能紊乱,并产生大量的ROS,进而产生氧化应激。而ROS是引起DA神经元凋亡的重要原因之一,本研究结果显示,MPP+刺激PC12细胞后,细胞启动促凋亡反应,促进定位于胞浆中的促凋亡分子Bax蛋白转移至线粒体膜上,在线粒体外膜插入形成通道,释放Ca2+,对Bax有协同作用并抑制pro-caspase-12的聚集,从而促进pro-caspase-12切割活化,进而导致PD中DA神经元凋亡[16]。
HSP70是细胞在缺氧、高热、创伤、感染等外界环境刺激下产生的一种高度保守的蛋白质,持续性的氧化应激反应能使细胞内HSP70蛋白表达量降低。有文献报道,可通过提高动物体内HSP70表达量,有效对抗因氧化应激造成的相关损伤[17]。GGA是一种主要用于治疗胃溃疡的萜类药物,同时也被认为是一种有效、低毒的HSP70诱导剂。目前在哺乳动物体内发现12种caspases,作为凋亡执行者的caspase-3则是神经元凋亡的重要标志物[18]。我们在研究中发现,GGA能显著升高PD模型中HSP70水平,降低促凋亡因子Bax和caspase-3水平,并诱导caspase-12前体pro-caspase-12的聚集,抑制凋亡蛋白caspase-12的切割活化。同时,AP刺激PD模型,抑制HSP70表达,促进促凋亡因子Bax、caspase-3蛋白的表达,并抑制pro-caspase-12聚集,诱导caspase-12切割活化。GGA通过诱导PD模型中HSP70过表达,降低促凋亡因子Bax和caspase-3表达,抑制pro-caspase-12切割活化,进而抑制caspase依赖的凋亡途径的激活。
本研究结果显示,预防性给予GGA能够调节凋亡相关基因和蛋白的表达,GGA对于MPP+药物诱导的PD模型中神经凋亡具有保护作用。但由于PD的发病机制较为复杂,仍需进一步深入探讨其可能的机制。GGA通过作用于药物靶点HSP70蛋白,调节Bax蛋白的表达,减少caspase-12释放,抑制caspase-3活性,从而减轻MPP+诱导的细胞凋亡。本研究为临床上治疗PD提供了新的思路,为将来彻底治愈PD提供了可能。
