利用慢病毒包装小窝蛋白-1过表达稳定细胞株的构建
2022-02-12刘杨许淑娟李琼毅刘翊忠
刘杨,许淑娟,李琼毅,刘翊忠
1.西北民族大学生物医学研究中心生物工程与技术国家民委重点实验室,甘肃兰州730030;
2.西北民族大学生命科学与工程学院,甘肃兰州730030
小窝结构(Caveolae)是位于细胞表面的穴样内陷结构,可介导多种生物大分子物质进入细胞内,其中小窝蛋白-1(Caveolin-1)是Caveolae最重要的组成蛋白,也是Caveolae发挥作用最重要的蛋白。Caveolin-1相对分子质量为21 000~24 000,广泛分布于上皮、内皮、成纤维及平滑肌细胞中,主要序列包括中央高度保守的疏水区及两侧可变的N-端和C-端区域[1]。
Caveolin-1是内吞途径的重要蛋白,在病毒感染宿主细胞早期发挥重要的促进作用。另外,该蛋白还可参与多种细胞活动,包括细胞周期调节、胆固醇转运排出及血管生成等[2-5],Caveolin-1的脚手架结构域(Caveolin scaffolding domain,CSD)与一些细胞膜上的信号分子也存在相互作用,调控细胞的信号转导及细胞的增殖、凋亡、转化和癌变等过程[6]。近年来,随着病毒感染宿主细胞研究机制的不断深入,多项研究提示,Caveolin-1与病毒感染细胞密切相关;其可促进大部分病毒如猿猴空泡病毒40、人冠状病毒及口蹄疫病毒等感染宿主细胞[7-10];同时对少量病毒如人类免疫缺陷病毒的感染过程又发挥抑制作用[11-12]。
本实验从BHK-21细胞中扩增Caveolin-1基因,经双酶切、连接、转化等过程构建重组质粒pTRIPCav1;将其及对照质粒pTRIP-EGFP分别转染至HEK-293T细胞中,收集慢病毒并感染BHK-21细胞,构建Caveolin-1过表达稳定细胞株BHK-Cav1及过表达绿色荧光蛋白(enhanced green fluorescent protei,EGFP)的对照细胞株BHK-EGFP,并对两种细胞株的稳定性、过表达特性和细胞活力进行检测。
1 材料与方法
1.1细胞及质粒 仓鼠肾细胞BHK-21及人胚胎肾细胞HEK-293T均由西北民族大学生物医学研究中心提供;E.coliBL21(DE3)感受态细胞、载体pTRIPCMV及质粒pTRIP-EGFP均由西北民族大学生物工程与技术国家民委重点实验室提供;载体pMD18-T购自宝生物工程(大连)有限公司。
1.2主要试剂及仪器 TRIzol®Reagent试剂盒及LipofectamineTM2000 Reagent购自美国Invitrogen公司;Proliferation细胞活力检测试剂盒购自美国Gromega公司;质粒提取试剂盒及胶回收试剂盒购自北京全式金生物技术有限公司;TIANScript M-MLV及TaqDNA聚合酶均购自天根生化科技(北京)有限公司;BamHⅠ、XbaⅠ限制性内切酶及T4 DNA连接酶均购自宝生物工程(大连)有限公司;ECL显色试剂盒购自美国PerkinElmer公司;聚凝胺(Polybrene)、嘌呤霉素(Puromycin)及兔抗Caveolin-1单克隆抗体均购自上海碧云天生物技术有限公司;兔抗GAPDH抗体购自英国Abcam公司;荧光标记的山羊抗兔抗体购自美国Jackson ImmunoResearch公司;4′,6-二脒基-2-苯基吲哚(DAPI)染料购自美国Sigma公司;新生牛血清(NBS)、胎牛血清(FBS)及DMEM培养基购自兰州民海生物工程有限公司;PCR仪购自德国Biometra公司;凝胶成像系统购自美国GE公司;酶标仪购自美国Thermo Fisher公司;生物荧光倒置显微镜购自日本Olympns公司。
1.3Caveolin-1基因的扩增 根据GenBank中登录的Caveolin-1基因序列(NM_GU075958.1)应用Primer5软件设计引物。上游引物:5′-GCTCTAGAATGTCTGGGGGCAAATACGTGGACTC-3′,下游引物:5′-CGGGATCCTCATATCTCTTTCTGCGTGCTGATGC-3′,扩增片段大小为537 bp。引物由北京擎科新业生物技术有限公司合成。取对数生长期的BHK-21细胞,按TRIzol®Reagent试剂盒说明书提取细胞RNA,反转录合成cDNA,以其为模板,PCR扩增Caveolin-1基因。反应体系为:LA Taq 0.5μL,dNTP 8.0μL,10×PCR BufferⅡ5.0μL,cDNA 5.0μL,Caveolin-1-F 1.0μL,Caveolin-1-R 1.0μL,DEPC H2O 29.5μL。反应条件为:94℃预变性5 min;94℃30 s,65.6℃45 s,72℃1 min;72℃再延伸10 min。PCR产物经1%琼脂糖凝胶电泳鉴定后,用胶回收试剂盒说回收目的条带。
1.4pMD18T-Cav1克隆质粒的构建 将PCR产物与载体pMD18-T于22℃用T4 DNA连接酶连接过夜,构建克隆质粒,将其转化至E.coliBL21(DE3)感受态细胞中,均匀涂布于含0.005 mg/mL Amp的琼脂平板上,于37℃孵育箱中倒置培养过夜;挑取单个菌落,接种于含0.005 mg/mL Amp的LB培养基中培养12 h,用质粒提取试剂盒提取克隆质粒,将其命名为pMD18T-Cav1。
1.5pTRIP-Cav1重组表达质粒的构建 将pMD-18TCav1及pTRIP-CMV载体于37℃水浴中分别用XbaⅠ和BamHⅠ双酶切2 h,回收的目的片段与载体片段于16℃用T4 DNA连接酶连接过夜,构建重组质粒。按1.4项进行转化及提取质粒。重组质粒进行双酶切鉴定,阳性质粒送生工生物工程(上海)股份有限公司测序。将鉴定正确的重组表达质粒命名为pTRIP-Cav1。
1.6B H K-C a v1及B H K-EG F P细胞株的构建
1.6.1携带Caveolin-1及EGFP目的基因慢病毒的包装构建 取对数生长期的HEK-293T细胞,接种于6孔板中,37℃培养24 h;待细胞密度达80%时,按LipofectamineTM2000 Reagent说明书分别将0.75μg的pTRIP-Cav1及对照质粒pTRIP-EGFP转染至HEK-293T细胞中,置37℃恒温培养箱内培养10 h,更换为含10%NBS的DMEM培养基继续培养48 h,收集含慢病毒的上清。
1.6.2慢病毒感染及BHK-Cav1和BHK-EGFP细胞株筛选 将对数生长期的BHK-21细胞接种至96孔板中37℃培养24 h;待细胞密度达80%时,弃去含10%NBS的DMEM培养基,分别加入1.6.1项构建的慢病毒混合液[500μL慢病毒上清+500μL DMEM(含20%FBS)+8μL Polybrene][13],混均后加入96孔板中,200μL/孔,转导12 h;更换为含10%FBS的DMEM细胞培养液,用10μg/mL Puromycin对阳性细胞筛选14 d,期间不断去除未转导成功的死细胞,余下的活细胞即为转导成功的细胞。最终获得过表达Caveolin-1细胞株BHK-Cav1及过表达EGFP的细胞株BHK-EGFP。均培养7代。
1.7B H K-C a v1和B H K-EG F P细胞株稳定性验证
1.7.1BHK-EGFP细胞中EGFP表达的检测 取培养过程中第10(P10)、20(P20)及30代(P30)BHK-EGFP细胞,以BHK-21细胞为对照,荧光显微镜下观察蛋白表达。
1.7.2BHK-Cav1细胞中Caveolin-1蛋白表达及基因mRNA水平的检测
1.7.2.1Western blot 取培养过程中P10、P20及P30 BHK-Cav1细胞,以BHK-21细胞为对照。细胞用RIPA裂解,产物经12%SDS-PAGE分离后,转印至PVDF膜上,用0.25 g/L脱脂奶粉于室温封闭1 h;加入兔抗Caveolin-1抗体(1∶1 000稀释),室温孵育2 h;PBST洗涤5次,每次5 min,加入HRP标记的山羊抗兔抗体(1∶5 000稀释),室温孵育1 h;PBST洗涤5次,ECL显色。
1.7.2.2qRT-PCRCaveolin-1基因上游引物:5′-AACCAGAAGGGACACACAG-3′,下游引物:5′-AAGGAGAGAATGGCAAAGT-3′,产物大小为151 bp。按1.7.2.1项收集各生长代次的BHK-Cav1细胞,以BHK-21细胞为对照。提取各组细胞RNA,反转录合成cDNA,以其为模板,进行qRT-PCR扩增。反应条件为:95℃预变性3 min;95℃15 s,60℃15 s,72℃20 s,共40个循环。记录CT值。
1.8B H K-C a v1、B H K-EG F P及B H K-21细胞中Caveolin-1过表达的检测
1.8.1Westernblot及qRT-PCR法 检测BHK-EGFP及BHK-Cav1细胞中Caveolin-1蛋白表达及基因mRNA水平,方法同1.7.2项。
1.8.2免疫荧光法 将P10 BHK-Cav1及P10 BHK-21细胞分别接种至24孔培养板中,培养24 h,待细胞融合度达40%~50%时,PBS洗涤3次,弃去PBS,加入70%乙醇,4℃过夜;次日吸去乙醇,PBS洗涤3次,加入兔抗Caveolin-1抗体(1∶200稀释),37℃孵育1 h;100 r/min摇床上PBS洗涤4次,每次5 min,加入荧光标记的山羊抗兔抗体(1∶200稀释),37℃孵育1 h;PBS洗涤4次,加入细胞核染料DAPI,室温孵育5 min;蒸馏水洗涤10 min,荧光封固剂固定,静置10 min后观察荧光。
1.9B H K-C a v1及B H K-EG F P细胞活力的检测 分别将对数生长期BHK-21、BHK-EGFP和BHK-Cav1细胞接种至96孔板中传代培养至P10代,待细胞贴壁后的0、24及48 h时,用Proliferation细胞活力检测试剂盒进行检测,重复3次。以BHK-21的细胞活力记为100%,比较3组细胞的相对活力变化。
1.10统计学分析 应用GraphPad Prism 5.0软件进行统计学分析。实验数据以均数±标准差(x±s)表示,独立样本间比较采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1Caveolin-1基因扩增产物的鉴定 目的基因PCR产物经1%琼脂糖凝胶电泳分析,可见537 bp的特异性条带,大小与预期一致,见图1。

图1 Caveolin-1基因PCR产物电泳图Fig.1 Electrophoretic profile of PCR product of Caveolin-1 gene
2.2重组表达质粒的鉴定 重组表达质粒pTRIPCav1的双酶切产物经1%琼脂糖凝胶电泳分析,可见537 bp的目的基因片段,大小与预期一致,见图2。测序结果表明重组质粒基因序列正确。

图2 重组表达质粒pTRIP-Cav1的双酶切(XbaⅠ/BamHⅠ)鉴定Fig.2 Restriction map of recombinant plasmid pTRIP-Cav1(XbaⅠ/BamHⅠ)
2.3 B H K-C a v1及B H K-EG F P细胞株的稳定性
2.3.1BHK-EGFP细胞中EGFP的表达 与BHK-21细胞比较,P10、P20及P30 BHK-EGFP细胞荧光明显,见图3。表明EGFP可稳定表达,BHK-EGFP细胞株构建成功。2.3.2BHK-Cav1细胞中Caveolin-1蛋白表达及mRNA水平 与BHK-21细胞比较,P10、P20及P30 BHK-Cav1细胞中Caveolin-1蛋白表达水平增加;基因RNA水平显著增加(t分别为5.103、7.545和5.243,P均<0.01)。同时Caveolin-1蛋白表达及基因RNA水平不随细胞代次的增长而改变,具有较好的稳定性。见图4和图5。

图3 各组细胞的荧光显微镜观察(×20)Fig.3 Fluorescence microscopy of cells in various groups(×20)
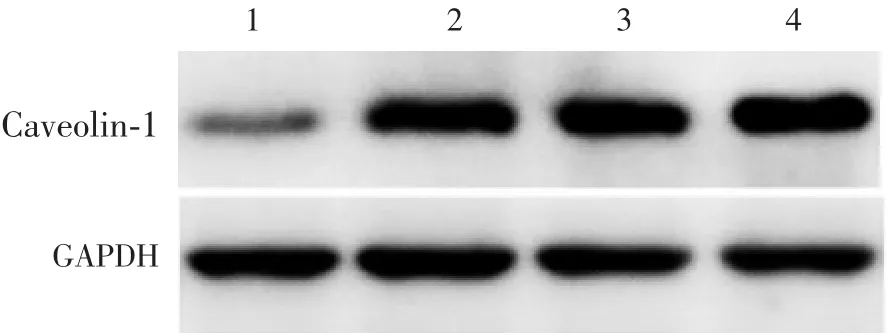
图4 各组细胞中Caveolin-1蛋白表达的Western blot分析Fig.4 Western blotting of Caveolin-1 protein expressed in various groups

图5 各组细胞中Caveolin-1基因mRNA相对水平Fig.5 Relative mRNA levels of Caveolin-1 in various groups
2.4C a v eolin-1过表达B H K-C a v1及B H K-EG F P细胞中C a v eolin-1检测结果 与BHK-EGFP和BHK-21细胞比较,BHK-Cav1细胞中Caveolin-1蛋白表达水平增加;基因mRNA水平显著升高(t=6.081,P<0.01)。见图6和图7。

图6 各组细胞中Caveolin-1蛋白表达的Western blot分析Fig.6 Western blotting of Caveolin-1 protein expressed in cells of various groups
2.5C a v eolin-1过表达B H K-C a v1细胞中C a v eolin-1荧光观察 结果显示,与BHK-21细胞比较,BHKCav1细胞中Caveolin-1散发的红光明显增强,见图8。表明BHK-Cav1细胞构建成功。

图8 免疫荧光检测各组细胞中Caveolin-1的表达(×40)Fig.8 IFA of expression of Caveolin-1 in cells of various groups(×40)
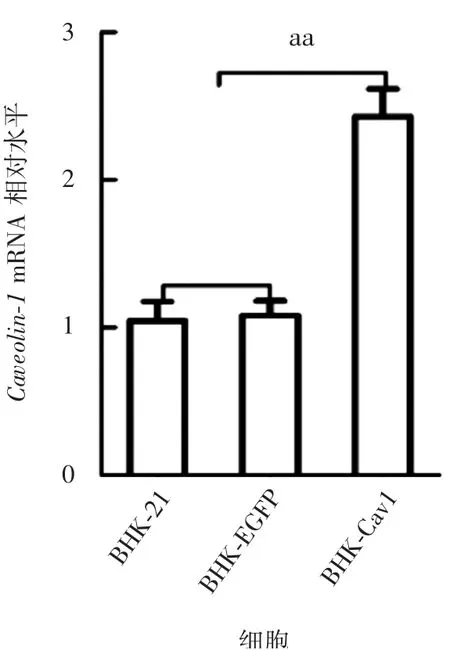
注:aa表示P<0.01。
2.6B H K-EG F P及B H K-C a v1细胞的活力 结果显示,与同时间培养的BHK-21细胞比较,BHK-EGFP及BHK-Cav1细胞在0、24及48 h的细胞活力差异无统计学意义(t分别为32.33、33.94和41.00,P均>0.05),见图9。表明构建的BHK-Cav1和BHKEGFP细胞的活力与BHK-21细胞无显著性差异。

图9 不同时间各组细胞的活力Fig.9 Determination of cell vitalities in various groups at different time
3 讨论
根据相关文献报道,Caveolin-1在一些人源细胞中表达量较低,但在数种鼠源细胞中均可稳定表达,且在不同代次的仓鼠肾细胞BHK-21中均可稳定表达[6-7]。因此,本实验选择从BHK-21细胞中扩增Caveolin-1基因为目的片段,构建pTRIP-Cav1重组表达质粒及BHK-Cav1细胞株。
本研究在预实验中筛选了慢病毒上清与含FBS的DMEM培养基的不同配比,选取BHK-21细胞不病变的最大慢病毒上清含量,即按1∶1体积比配置慢病毒上清与含20%FBS的DMEM的转导混合液,对BHK-21细胞进行感染。本文以BHK-21细胞为对照,对BHK-Cav1及BHK-EGFP细胞株中蛋白表达的稳定性,Caveolin-1过表达及细胞活力进行检测,结果提示,BHK-Cav1细胞可稳定过表达Caveolin-1,BHK-EGFP可稳定过表达EGFP,且两种细胞活力良好,证明稳定细胞株构建成功。
本实验成功构建了pTRIP-Cav1重组表达质粒和BHK-Cav1稳定细胞株,同时验证了细胞株具有可稳定过表达的特性,并保证了细胞株的活力;使稳定过表达Caveolin-1的BHK-Cav1细胞和稳定过表达无关蛋白EGFP的BHK-EGFP细胞更有应用价值。本实验为下一步研究病毒通过Caveolin依赖型内吞途径感染BHK-21细胞奠定了基础。
