血清Treg在原发性胃癌患者中的表达水平及对腹腔镜辅助D2根治术预后的影响
2022-02-11何薇陈莉马婷
何薇,陈莉,马婷
【提要】目的 观察血清调节性T细胞(Treg)水平在原发性胃癌患者中的表达及对腹腔镜辅助D2根治术治疗预后的影响。方法 回顾性分析昆明医科大学第二附属医院2016年1月至2018年1月收治的116例胃癌患者的临床资料,患者均行腹腔镜辅助D2根治术治疗,设计基线资料调查表,记录研究所需资料,检测血清Treg水平,随访17~36个月,评估患者预后,比较预后不良组与预后良好组基线资料、血清Treg水平,采用COX回归分析检验血清Treg水平对预后不良的影响,并分析血清Treg水平对预后不良的预测效能。结果 116例胃癌患者中途均无失访或意外事件死亡,其中有45例预后不良,有71例预后良好;初步比较预后不良组与预后良好组基线资料后,建立COX回归模型,经COX回归分析检验结果显示,血清Treg、CD4+CD25+表达上调是胃癌患者预后不良的风险因素(OR>1,P<0.05);CD4+表达上调是胃癌患者预后不良的保护因素(OR<1,P<0.05);绘制受试者工作曲线(ROC)发现,血清Treg、CD4+、CD4+CD25+水平用于预测胃癌患者预后不良风险的曲线下面积(AUC)均>0.80,均有一定预测价值。结论 原发性胃癌患者血清Treg水平呈现表达上调,血清Treg、CD4+、CD4+CD25+表达与患者预后不良发生有关,并可作为预测因子。
原发性胃癌早期症状不明显,部分患者仅有轻微消化道症状,缺乏特异性,患者可忽视自身病情,导致就诊时胃癌已进入进展期[1]。对于进展期胃癌,临床主张对患者实施手术治疗,腹腔镜辅助D2根治术是微创术式,较传统开腹手术有一定优势,造成切口小,术中出血少,利于减少术后并发症[2]。且相关研究报道,腹腔镜辅助D2根治术与传统开腹手术疗效相近,可完整切除肿瘤病灶[3]。但该研究观察时间尚短,未能评估胃癌患者预后不良情况,结论有一定局限性。国内研究证实,胃癌患者行腹腔镜辅助D2根治术治疗后,短期内仍有一定预后不良风险[4]。探讨预后不良的有效预测因子尤为必要。调节性T细胞(regulatory T cell,Treg)被证实在肿瘤免疫耐受中发挥重要作用,参与肿瘤增殖、转移[5]。推测Treg也可能与胃癌患者术后复发转移有关,但对于Treg能否用于预测胃癌患者预后尚有待进一步探讨。基于此,本研究进一步观察血清Treg水平在原发性胃癌患者中的表达及对腹腔镜辅助D2根治术治疗预后的影响。
1 资料与方法
1.1 一般资料
回顾性分析医院2016年1月至2018年1月收治的116例胃癌患者的临床资料,年龄48~66岁,平均(55.84±7.08)岁;男73例,女43例;发病部位:胃窦部77例,胃体部26例,其他部位13例;有慢性胃炎史16例;TNM病理分期[6]:Ⅰ期39例,Ⅱ期63例,Ⅲa期14例;浸润深度:原位癌62例,肿瘤侵犯黏膜层或黏膜下层54例;分化程度:低分化32例,中分化53例,高分化31例;合并淋巴结转移25例。本研究符合伦理学有关规定。
1.2 入选标准
1.2.1 纳入标准 ①符合胃癌诊断标准[7],经手术标本病理学检查结果评估确诊,并证实为腺癌;②满足腹腔镜手术指征:术前经胃镜检查、CT检查等,可见患者肿瘤直径<10 cm,浸润深度在T2以内;③术前检测患者心肺功能良好;④美国麻醉医师协会(American Society of Anesthesiologists,ASA)[8]分级Ⅰ~Ⅱ级。
1.2.2 排除标准 ①术前接受放化疗治疗的患者;②患有其他恶性肿瘤的患者;③身体质量指数(body mass index,BMI)≥25 kg/m2;④合并自身免疫性疾病的患者;⑤合并肿瘤远处转移的患者;⑥有腹腔镜禁忌症的患者:为胃恶性间质瘤、淋巴瘤的患者,术中肿瘤发生破裂,有血性腹腔积液、腹部疝的患者。
1.3 血清Treg水平检测方法
于入院时,抽取患者空腹静脉血2 mL,以3 000 r/min的速度、10 cm的离心半径离心10 min,取血清,采用BD FASCanto流式细胞仪检测Treg水平、CD4+水平、CD4+CD25+水平。
1.4 观察指标
1.4.1 收集资料 设计基线资料调查表,记录研究所需资料,包括年龄、性别、发病部位、确诊至手术时间、慢性胃炎史、TNM病理分期、病灶数目、病灶最大直径、浸润深度、分化程度、淋巴结转移情况、手术时间。其中TNM病理分期、病灶数目、病灶最大直径、浸润深度、分化程度、淋巴结转移情况经手术标本病理学检查结果评估。
1.4.2 腹腔镜辅助D2根治术治疗预后评估 均由同一组经验丰富的医护人员对患者实施腹腔镜辅助D2根治术治疗,并于术中行淋巴结清扫。术后7 d行CT复查,见肿瘤完整切除,无残留病灶。出院后对患者进行跟踪随访,根据WHO[9]制定的有关标准评估患者预后,患者每3个月复查1次,初步行CT检查,对存在可疑病灶患者行进一步的穿刺活检,若患者保留胃基础生理功能,术后无病灶复发或转移情况,则判定为预后良好。若患者胃基础生理功能基本丧失,或术后有病灶复发或转移,或病死,则判定为预后不良。将患者分为预后不良组与预后良好组。
1.5 统计学方法

2 结果
2.1 不同预后原发性胃癌患者生存情况
116 例原发性胃癌患者中位随访时间为 27个月(四分位数间距18.85~36),Kaplan-Meier 生存分析显示,预后不良组生存率低于预后良好组(P=0.014)。见图1。
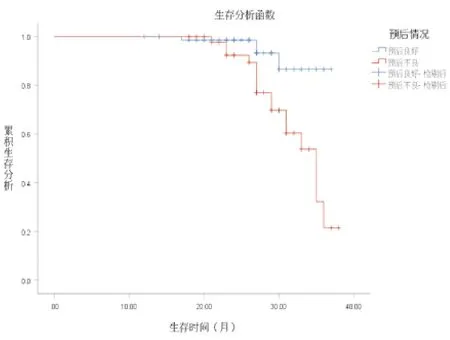
图1 不同预后原发性胃癌患者生存情况
2.2 预后不良组与预后良好组基线资料、Treg水平比较
116例胃癌患者中途均无失访或意外事件死亡,其中有45例(38.79%)预后不良,有71例(61.21%)预后良好;两组在浸润深度、分化程度、淋巴结转移、Treg(%)、CD4+(%)、CD4+CD25+(%),比较差异均有统计学意义((P<0.05),其中具体表现为预后不良组在肿瘤侵犯黏膜层或黏膜下层、低分化、合并淋巴结转移占比、CD4+CD25+(%)均高于预后良好组,而预后良好组的CD4+水平高于预后不良组;两组年龄、性别、发病部位、确诊至手术时间、慢性胃炎史、TNM病理分期、病灶数目、病灶最大直径、手术时间比较,差异无统计学意义(P>0.05)。见表1。

表1 预后不良组与预后良好组基线资料、Treg水平比较
2.3 COX回归分析检验各主要指标对预后不良的影响
将初步基线资料比较结果显示差异有统计学意义的浸润深度、分化程度、淋巴结转移情况、血清Treg、CD4+、CD4+CD25+水平纳入作为自变量并说明,变量赋值见表2,将患者预后作为因变量(预后不良=“1”,预后良好=“0”);建立COX回归模型,结果显示血清Treg、CD4+CD25+是胃癌患者预后不良的影响因素(OR>1,P<0.05)。见表3。

表2 自变量赋值情况

表3 COX回归分析检验各主要指标对预后不良的影响
2.4 血清Treg、CD4+、CD4+CD25+水平预测预后不良的ROC结果
将血清Treg、CD4+、CD4+CD25+水平作为检验变量,将患者预后作为状态变量(预后不良=“1”,预后良好=“0”),绘制ROC(图2)发现,血清Treg、CD4+、CD4+CD25+水平用于预测胃癌患者预后不良风险的AUC分别为:0.834、0.821、0.813,均>0.80,均有一定预测价值,cut-off值分别取5.635%、31.080%、1.645%时可获得最佳预测效能,各检验变量对应的cut-off值、特异度、敏感度等相关参数详见表4。

图2 血清Treg水平预测预后不良的ROC曲线图
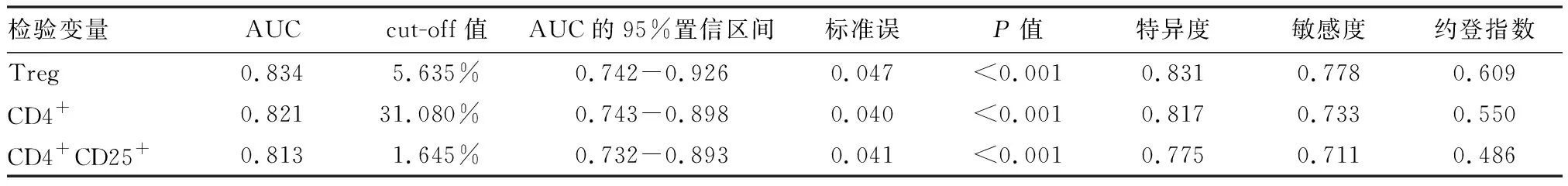
表4 血清Treg水平预测预后不良的ROC检验结果
3 讨论
尽管手术方式不断改进,胃癌患者受创降低、术后并发症减少,但患者预后风险仍未能得到有效控制[10]。术后复发转移患者往往需再行手术或放化疗治疗,可增加患者医疗费用,影响胃生理功能,并有较高致死率[11]。
蒋大平等[12]研究结果显示,胃癌患者行根治术后3年内生存率仅有67.00%,说明患者3年内预后不良风险可达33.00%以上。本研究结果显示,随访17~36个月,116例胃癌患者中途均无失访或意外事件死亡,其中有45例预后不良,占比达38.79%,高于上述研究结果,主要因本研究将复发、转移及胃基础生理功能丧失均纳入预后不良范畴。由此得出,胃癌患者行腹腔镜辅助D2根治术治疗后,存在较高预后不良风险。既往临床将胃癌患者肿瘤分期、淋巴结转移情况、浸润深度及肿瘤标志物水平用于评估患者预后,但相关指标用于预测的特异度和敏感度尚不理想,临床仍待持续探讨新的指标,为治疗方案的改进提供多方面的意见[13-14]。
Treg细胞作为抑制免疫的主要效应因子,有关Treg在肿瘤中的作用一直是临床研究的热点,目前相关研究已证实Terg与癌症患者病情进展及治疗获益均有关[15]。本研究进一步观察Treg对胃癌患者预后的影响,初步比较预后不良组与预后良好组基线资料后,建立COX回归模型,经回归分析检验结果显示,血清Treg、CD4+CD25+表达上调是胃癌患者预后不良的风险因素;CD4+表达上调是胃癌患者预后不良的保护因素。分析相关机制在于:Treg细胞可促使免疫抑制发生,并抑制自然杀伤细胞的细胞毒作用,当Treg细胞表达上调时,多种抑制性细胞因子分泌增加,如白细胞介素-10、转化生长因子-β等,使患者机体处于免疫抑制状态,且自然杀伤细胞对肿瘤细胞的杀伤作用较弱,肿瘤细胞易发生免疫逃逸[16-17]。术前血清Treg高水平的胃癌患者,可能有微小转移癌灶,且癌细胞不宜被机体免疫系统识别攻击,术后有较高的复发转移、病死风险,再行相关治疗可严重影响患者胃生理功能,造成预后不良[18]。动物试验证实,CD4+CD25+在维持机体内环境稳定、抗肿瘤免疫中发挥重要作用,被证实可影响机体对早期原发肿瘤的反应状态,与肿瘤耐受也有关[19]。在机体CD4+CD25+表达上调时,具有免疫抑制功能的Tr细胞在肿瘤组织局部及外周血聚集,抑制肿瘤特异效应性T淋巴细胞,使肿瘤抗原免疫应答受抑制,实体肿瘤细胞逃避免疫系统攻击,导致癌变不能被机体有效清除,原发肿瘤易生长、增殖、侵袭,存在肿瘤细胞种植及转移,患者行手术治疗后,复发转移风险高[20-21]。CD4+细胞具有多种功能,分为Th1和Th2两个亚型,分别可介导体液免疫应答和细胞免疫应答,可正向调节肿瘤免疫应答[22]。此外,相关研究证实,CD4+还可对肿瘤细胞发挥直接杀伤作用,可通过上调组织相容性抗原表达,促使肿瘤细胞被识别和清除,介导对肿瘤的杀伤作用,并可抑制肿瘤血管生成[23-24]。在CD4+表达上调时,机体体液免疫及细胞免疫较活跃,机体对肿瘤细胞的杀伤能力增强,肿瘤血管不易生成[25]。因此患者行手术治疗的获益较好,术后预后不良风险较轻。
绘制ROC发现,血清Treg、CD4+、CD4+CD25+水平用于预测胃癌患者预后不良风险的AUC均>0.80,均有一定预测价值,说明血清Treg、CD4+、CD4+CD25+水平在胃癌患者预后不良风险预测中有一定应用价值。针对此情况,临床可对术前Treg、CD4+CD25+高水平、CD4+低水平的胃癌患者实施免疫治疗或接种肿瘤疫苗治疗,并可对预后不良高风险患者实施放化疗治疗。但Terg细胞不是影响肿瘤预后的唯一因素,肿瘤的发展及转归涉及到复杂的机制,本研究因纳入资料较少,结论尚有局限,未来还应纳入观察糖类抗原125、糖类抗原199、B淋巴细胞等指标水平,进一步分析胃癌患者预后不良风险,对患者实施合理治疗。
综上所述,原发性胃癌患者血清Treg水平呈现表达上调,血清Treg、CD4+、CD4+CD25+表达与患者预后不良发生有关,并可作为预测因子。
