敲除KDM4B通过减少上皮间质转化抑制结肠癌转移与侵袭
2022-02-11杜恒余洁简辉张红英吴安定
杜恒,余洁,简辉,张红英,吴安定
【提要】目的 构建KDM4B敲除的人结肠癌HCT116和SW260细胞,研究KDM4B对结肠癌细胞迁移与侵袭的影响并探讨其机制。方法 利用免疫组化染色,检测临床组织样本KDM4B的表达量;利用CRISPR/Cas9技术,通过慢病毒侵染HCT116与SW260细胞,构建 KDM4B敲除细胞系;利用细胞划痕实验及transwell小室实验评价KDM4B敲除细胞与野生型细胞迁移及侵袭能力的差异;利用Western blotting检测EMT标志蛋白E-cadherin、 N-cadherin和Vimentin的表达情况。结果 免疫组化表明结肠癌组织中KDM4B显著高表达;通过Western blotting成功验证了KDM4B敲除结肠癌细胞系; 敲除KDM4B显著抑制HCT116及SW260细胞的迁移与侵袭; 敲除KDM4B显著上调HCT116及SW260细胞中E-cadherin的表达,显著下调N-cadherin和Vimentin的表达。结论 KDM4B能够通过介导EMT促进结肠癌细胞HCT116和SW260的迁移与侵袭,将其敲除可以显著减弱这种作用。
癌症是威胁人类健康的重要疾病之一,其发生与发展与肿瘤细胞内基因的异常表达有十分密切的关系[1]。组蛋白的甲基化与去甲基化是表观遗传调控的主要调节形式之一,并在基因功能的调控中发挥重要的作用,组蛋白甲基化状态的失衡已被证实与癌症存在极为密切的关联[2-3]。组蛋白赖氨酸去甲基化酶4B(KDM4B)是调节组蛋白甲基化状态的一种关键酶,已有研究证实其在肿瘤细胞中高表达,并对肿瘤的侵袭与转移起到促进作用[4-7]。
上皮间质转化(epithelial-mesenchymal transformation, EMT)是肿瘤细胞发生迁移与侵袭的重要环节,其与组蛋白甲基化状态的失衡具有一定的关系[8-9]。我国是结肠癌的高发国家之一,近年来新发病例有上升趋势[10]。因此,本文通过CRISPR/Cas9基因编辑技术对结肠癌细胞中的KDM4B进行敲除,研究其与上皮间质转化和转移侵袭之间的关系。
1 材料与方法
1.1 实验材料
临床组织样本由黄冈市中心医院提供;人胚胎肾HEK293T、人结肠癌细胞HCT116及SW260购自中国典型培养物保藏中心;免疫组化DAB试剂盒购自Dako Danmark A/S 公司;DMEM培养基、胎牛血清、胰酶购自Gibco公司;LB培养基购自Merck公司;T4 PNK、T4 ligase购自碧云天生物技术有限公司;DH5α感受态购于金沙生物科技有限公司;LentiCRISPR v2、pMD2.G、psPAX2质粒购自Addgene公司;PEI、puromycin、polybrene、ampicillin购自Sigma-Aldrich公司;质粒抽提试剂盒购自天根生化科技有限公司;JMJD2B、E-cadherin、 N-cadherin、Vimentin、β-actin抗体购自CST公司;HRP偶联二抗购自SouthernBiotech公司;Transwell小室购于Corning公司。
1.2 免疫组化染色
取4%多聚甲醛固定的组织样本,经乙醇梯度脱水,二甲苯透明后,用石蜡进行包埋并切片,经二甲苯脱蜡,乙醇梯度水化后,进行抗原修复及一抗孵育,随后进行HRP二抗孵育,加入DAB工作液进行显色,并用苏木精复染,在100倍视野下进行拍照,结果使用Image J软件进行光密度分析。
1.3 引物设计与合成
通过Crispick网站设计人源KDM4B sgRNA引物,其正义序列为CACCGCTTTGTCTCCCCGATCTACG,反义序列为AAACCGTAGATCGGGGAGACAAAGC,由生工生物工程股份有限公司进行合成。
1.4 CRISPR基因敲除
将引物磷酸化后与酶切的LentiCRISPR v2载体进行连接,然后使用DH5α感受态进行转化,使用含0.1% ampicillin的LB平板培养基筛选单克隆菌落,扩增单克隆后抽提质粒并测序,使用PEI将质粒与psPAX2、pMD2.G包装质粒混合转染至HEK293T细胞中,次日收集病毒液。使用收集得到的病毒液侵染HCT116及SW260细胞,利用puromycin进行筛选,4日后取存活的细胞进行敲除验证。
1.5 细胞划痕实验
将野生型及KDM4B敲除的HCT116及SW260细胞按每孔1.0×106个接种至6孔板,待细胞贴壁且密度达到90%时进行划痕并拍照后放入培养箱继续培养,分别与第24 h及48 h取出并在100倍视野下拍照,使用ImageJ软件分析划痕区域面积。
1.6 Transwell小室侵袭实验
将matrigel基质胶用预冷的无血清培养基稀释8倍后铺于transwell小室上层,待凝固后加入含1×104个细胞的细胞悬液,下层加入含10%胎牛血清的DMEM培养基。培养24 h后取出小室并擦除上层底部的细胞,4%多聚甲醛固定后使用0.5%结晶紫染色,随机取5个视野在200倍视野下进行拍照计数。
1.7 蛋白免疫印迹分析
收集细胞提取总蛋白并煮沸变性,使用BCA法进行蛋白定量,按每孔40 μg蛋白进行上样,使用5%浓缩胶及10%分离胶按100 V进行SDS-PAGE电泳,400 mA湿转1 h至PVDF膜, 5%脱脂牛奶进行封闭1 h,TBST洗膜后加入对应一抗,4 ℃孵育过夜,TBST洗膜后加入二抗孵育1 h,TBST洗膜后使用化学发光试剂盒,于凝胶成像系统上进行曝光,使用image J软件进行灰度分析。
1.8 统计学分析

2 结果
2.1 KDM4B在肿瘤组织中显著高表达
使用免疫组化法对3例结肠癌患者的正常组织及肿瘤组织切片进行染色,结果显示肿瘤组织的KDM4B表达量显著高于正常肠道组织,表明KDM4B在肿瘤组织中显著高表达。
2.2 KDM4B基因敲除结果的验证
使用Western blotting法从蛋白水平检测KDM4B基因的翻译情况,结果显示使用CRISPR/Cas9基因敲除后的细胞不表达JMJD2B(即KDM4B)蛋白,而野生型及转染空载质粒的细胞JMJD2B蛋白高表达,提示KDM4B基因被成功敲除。
2.3 敲除KDM4B抑制人结肠癌细胞HCT116及SW260的迁移
细胞划痕实验显示,野生型HCT116及SW260细胞在24 h后,划痕发生明显愈合,48 h后划痕基本消失,而KDM4B基因敲除的细胞划痕愈合缓慢,48 h后仍然存在明显的划痕,24 h及48 h的划痕面积与野生型细胞存在显著性差异。说明敲除KDM4B基因后能够显著抑制人结肠癌HCT116及SW260细胞的迁移。抑制人结肠癌HCT116及SW260细胞的迁移。
2.4 敲除KDM4B抑制人结肠癌细胞HCT116及SW260的侵袭
通过transwell小室侵袭实验,观察到敲除KDM4B后,HCT116及SW260细胞的侵袭数量显著低于野生型细胞,证明了KDM4B基因的敲除能够显著抑制人结肠癌HCT116及SW260细胞的侵袭。
2.5 敲除KDM4B调控人结肠癌细胞HCT116及SW260中上皮间质转化相关蛋白的表达
利用Western blotting实验检测了野生型HCT116及SW260及KDM4B敲除细胞中上皮间质转化相关蛋白E-cadherin、 N-cadherin和Vimentin的表达情况。结果显示,与野生型细胞相比,KDM4B敲除的细胞中E-cadherin蛋白的表达量显著增高,而N-cadherin和Vimentin蛋白的表达量则显著降低。
3 讨论
组蛋白的甲基化与去甲基化是细胞表观基因组学调控的一类重要生物过程,在肿瘤的发生发展过程中发挥关键的作用[11-14]。组蛋白的甲基化长期以来被认为是不可逆的,直至组蛋白赖氨酸残基去甲基化酶家族(KDMs)被发现,才揭开了新的研究序幕[15]。近年来,KDMs家族成员KDM4B被发现在乳腺癌、卵巢癌、胃癌、结直肠癌等恶性肿瘤中存在高表达,并且促进肿瘤细胞的增殖与发展,其作用机制包括调控Wnt、Hippo、NF-κB等信号通路,促进肿瘤细胞葡萄糖代谢等[16-19]。
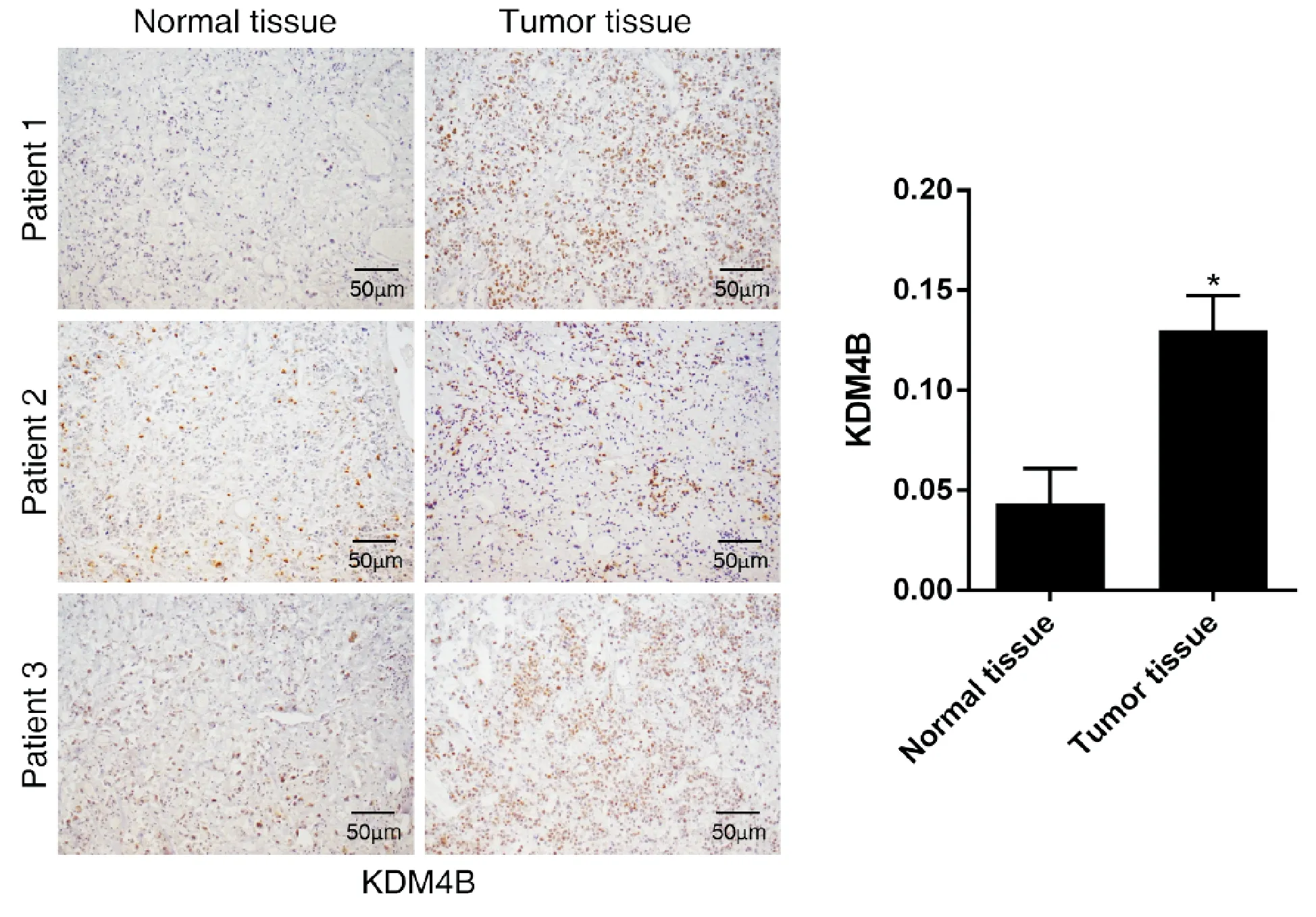
图1 KDM4B在结肠癌组织中显著高表达(100×, *P<0.05)
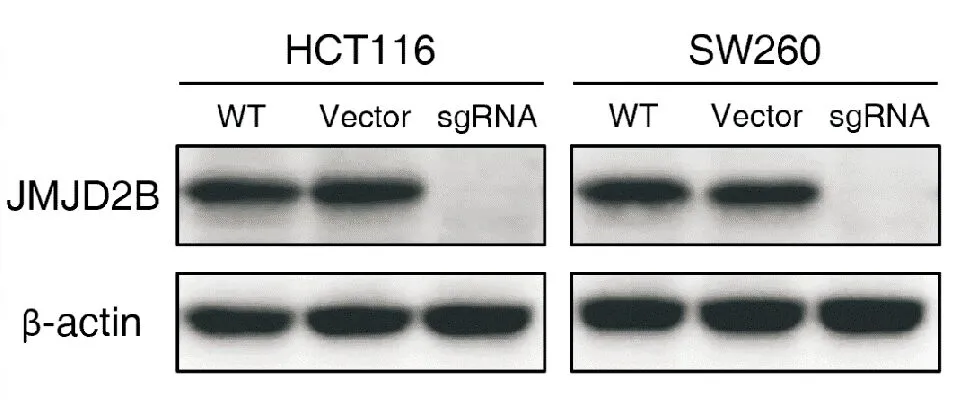
图2 KDM4B基因敲除结果的验证
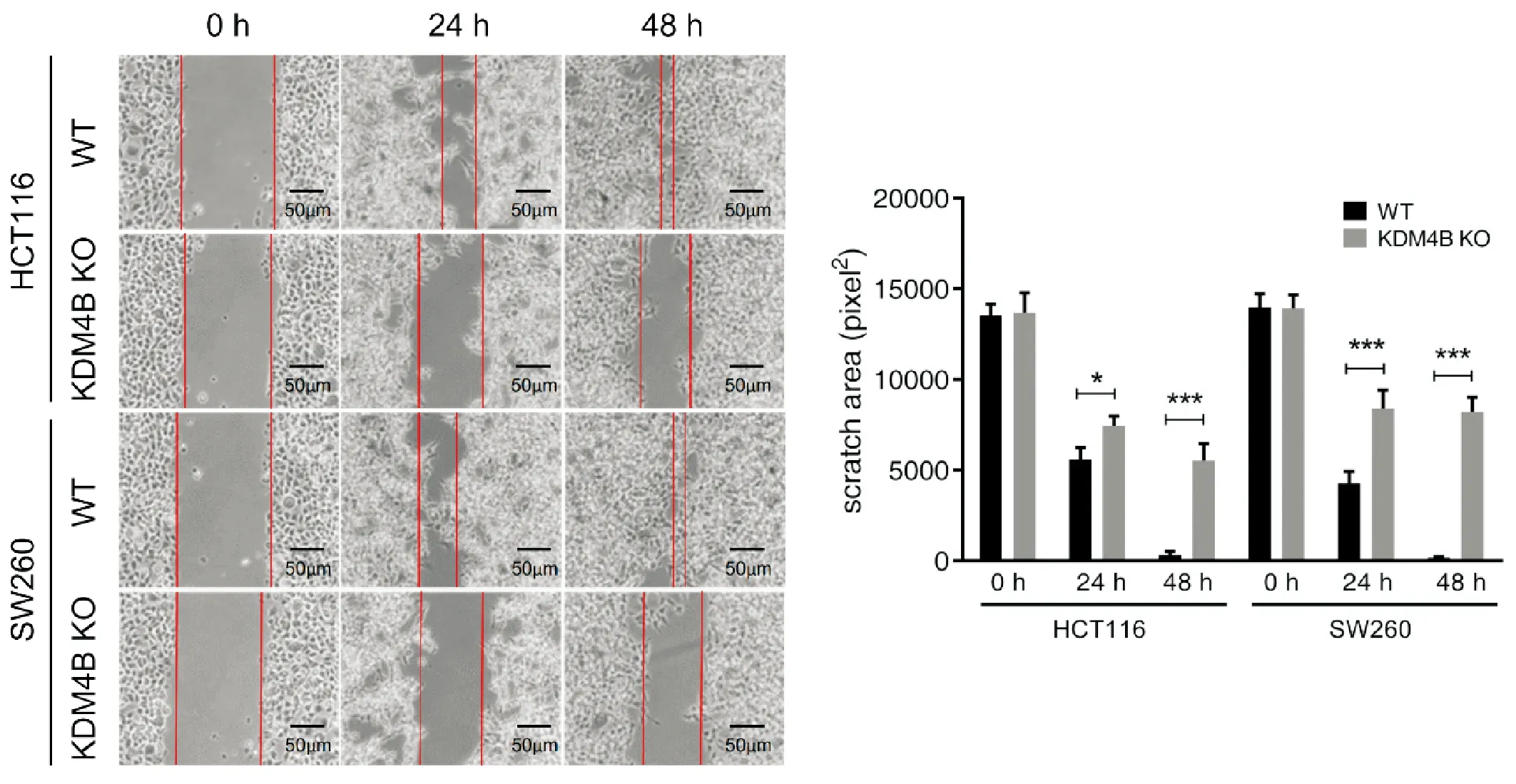
图3 敲除KDM4B抑制人结肠癌细胞HCT116及SW260的迁移(100×, *P<0.05,**P<0.01,***P<0.001)
KDM4B高表达被证实能够促进乳腺癌细胞的迁移与侵袭[20],但是在结肠癌细胞中是否具有类似的作用仍不清楚。KDM4B被证实在结直肠癌细胞中高表达[21],因此猜测是否结肠癌的迁移与侵袭是否与KDM4B有关,敲除KDM4B是否能够抑制迁移与侵袭。CRISPR/Cas9基因编辑技术是近些年发展起来的一项新兴技术,具有强大的基因编辑功能,本文通过使用该技术成功地在人结肠癌HCT116及SW260细胞中敲除了KDM4B基因。通过细胞划痕和transwell小室侵袭实验,我们发现野生型的结肠癌细胞表现出了较强的迁移侵袭能力,而将KDM4B敲除后,这种迁移与侵袭能力得到了明显的抑制,说明结肠癌细胞的迁移与侵袭与KDM4B的表达正相关。
上皮细胞间质转化(EMT)通常发生在特定的病理条件下,上皮细胞朝向间质细胞发生转化[22-23]。钙粘蛋白(cadherin)和Vimentin是上皮细胞间质转化的两类标志物,正常组织中的E-cadherin存在广泛表达,而N-cadherin的表达在除心肌、平滑肌、睾丸等组织中很难检测到,但在肿瘤细胞中,E-cadherin的表达通常降低,而N-cadherin表现为增高,这种现象被称为“钙粘蛋白开关”[24-25]。这种现象在两种野生型结肠癌细胞中得到证实,即E-cadherin低表达,N-cadherin高表达。而在KMD4B敲除的两种结肠癌细胞中,这种现象得到了逆转,趋向于正常组织中的表达形式。说明了KDM4B在介导EMT中存在重要的作用,并且敲除KDM4B可以减少EMT。

图4 敲除KDM4B抑制人结肠癌细胞HCT116及SW260的侵袭(200×, *P<0.05,**P<0.01)
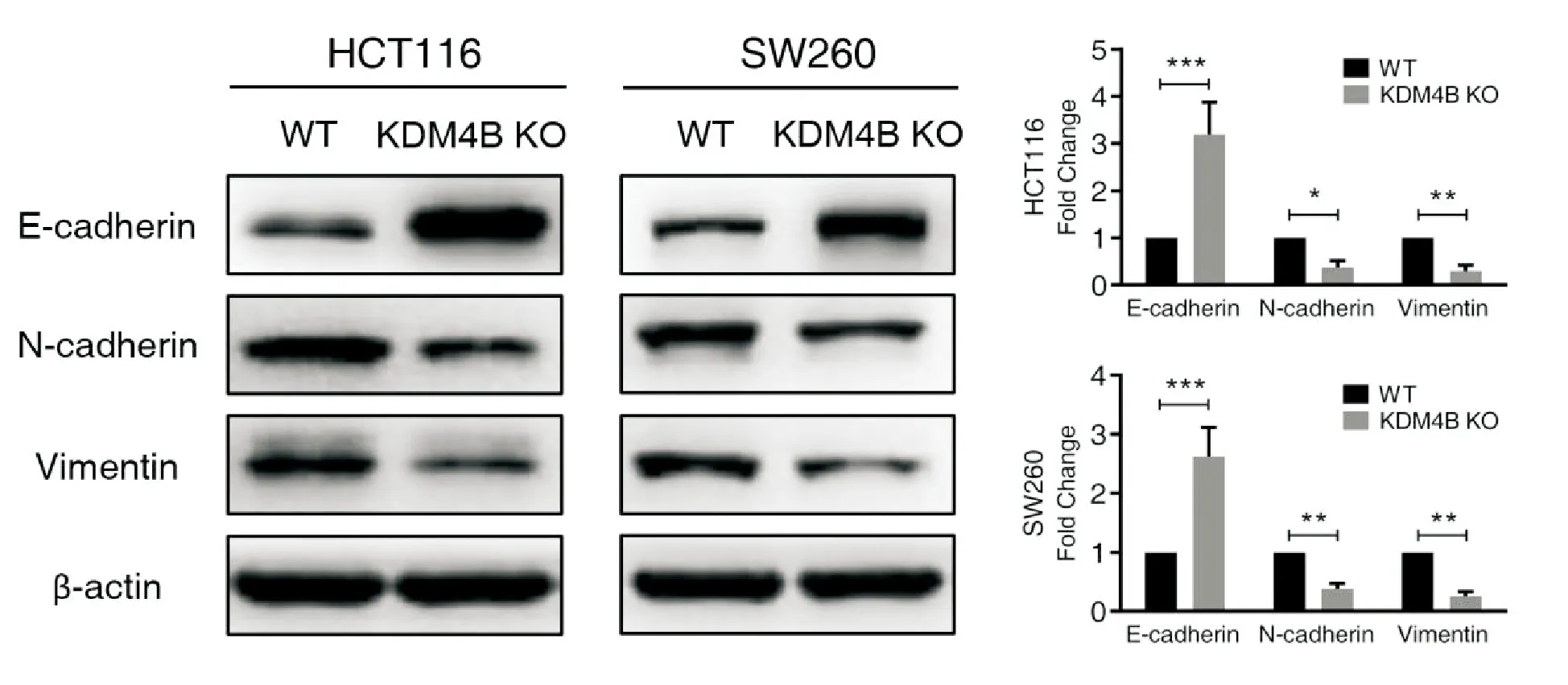
图5 敲除KDM4B调控人结肠癌细胞HCT116及SW260中上皮间质转化相关蛋白的表达(*P<0.05,**P<0.01,***P<0.001)
综上,KDM4B能够通过介导EMT促进结肠癌细胞HCT116和SW260的迁移与侵袭,将KDM4B敲除可以显著减弱这种作用,KDM4B或许可以作为结肠癌治疗的一个新靶点。
