慢性萎缩性胃炎患者白光内镜下特征改变及其与胃泌素-17、糖类抗原724的相关性分析
2022-02-11李文伦王利丽李艳慧
李文伦,王利丽,李艳慧
【提要】目的 探究慢性萎缩性胃炎(CAG)患者白光内镜下特征改变及其与胃泌素-17(G-17)、糖类抗原724(CA724)的相关性。方法 选取2018年5月~2021年5月我院收治的CAG患者92例为研究对象,另选取同期92例慢性非萎缩性胃炎(CNAG)患者作为对照组,分析两组患者的临床资料。通过多因素Logistic回归分析影响CAG发病的相关因素,建立列线图风险预测模型,并进行模型评价。分析不同特征患者的G-17和CA724水平。结果 A型患者52例(56.52%),B型患者40例(43.48%)。与A型相比,B型患者的诊断符合率更高(P<0.05),肠上皮化生(IM)、异型增生(ATP)患者比例更高(P<0.05)。多因素Logistic回归分析结果显示,幽门螺旋杆菌(H.pylori)感染、家族史、高密度脂蛋白(HDL-C)水平降低、G-17水平升高、CA724水平升高、乙醛脱氢酶1(ALDH1)水平升高均为CAG发病的独立危险因素(P<0.05)。列线图预测模型预测CAG发病概率为65.00%。经受试者工作特征曲线(ROC)分析,列线图模型预测CAG发病的曲线下面积(AUC)为0.858(95%CI: 0.805~0.911),灵敏度为0.865,特异度为0.695,表明模型的区分度尚可。该模型的内部数据验证结果显示,预测情况与实际情况具有良好的一致性。与A型相比,B型患者血清G-17和CA724水平均更高(P<0.05)。结论 CAG内镜下特征包括A型和B型。B型IM、ATP患者比例更高。H.pylori感染、家族史、HDL-C水平降低、G-17水平升高、CA724水平升高、ALDH1水平升高均为CAG发病的独立危险因素。B型患者血清G-17和CA724水平均更高。不同类型CAG患者血清G-17和CA724水平有一定差异,临床上应重视患者血清G-17和CA724水平的检测。
慢性萎缩性胃炎[1-3](Chronic atrophic gastritis, CAG)在胃病较常见,是一种慢性疾病,当胃黏膜受到损害时,黏膜发生病理性改变,如黏膜固有腺体萎缩和肌层增厚。临床上患者多以恶心、呕吐、腹痛等症状为主。该病多与患者的生活作息、饮食结构、压力过大等因素相关,且病程长,早期无明显症状,易被忽视[4]。近年来,在我国,慢性胃炎患者的发病概率呈上升趋势,其中CAG约占24%[5]。诊断CAG的常用方法包括胃镜检查和组织病理学诊断。在胃镜下,患者黏膜形态以皱襞变平、红白相间、血管暴露等状态为主。CAG是一种癌前状态,若未控制及时,随着病情进展很可能发生癌变[6],因此,早发现、早治疗可以有效降低CAG癌变风险,改善患者预后。
胃泌素-17[7](Gastrin-17, G-17)由胃窦和十二指肠G细胞分泌合成,是一种内分泌激素,其生理功能主要是维持胃酸分泌、调节消化道功能,以保持正常的细胞代谢及消化道结构,并促进肠胃运动,其是反映胃黏膜功能的重要指标。糖类抗原724[8](Carbohydrate antigen 724, CA724)是一种与胃癌相关的肿瘤标志物,对胃癌具有较高的灵敏度和特异度。而CAG作为胃癌癌前病变,CA724也是其临床诊断的指标之一。因此,本研究选取92例CAG患者作为研究对象,探讨CAG患者白光内镜下特征改变及其与G-17和CA724的相关性,现报告如下。
1 资料与方法
1.1 一般资料
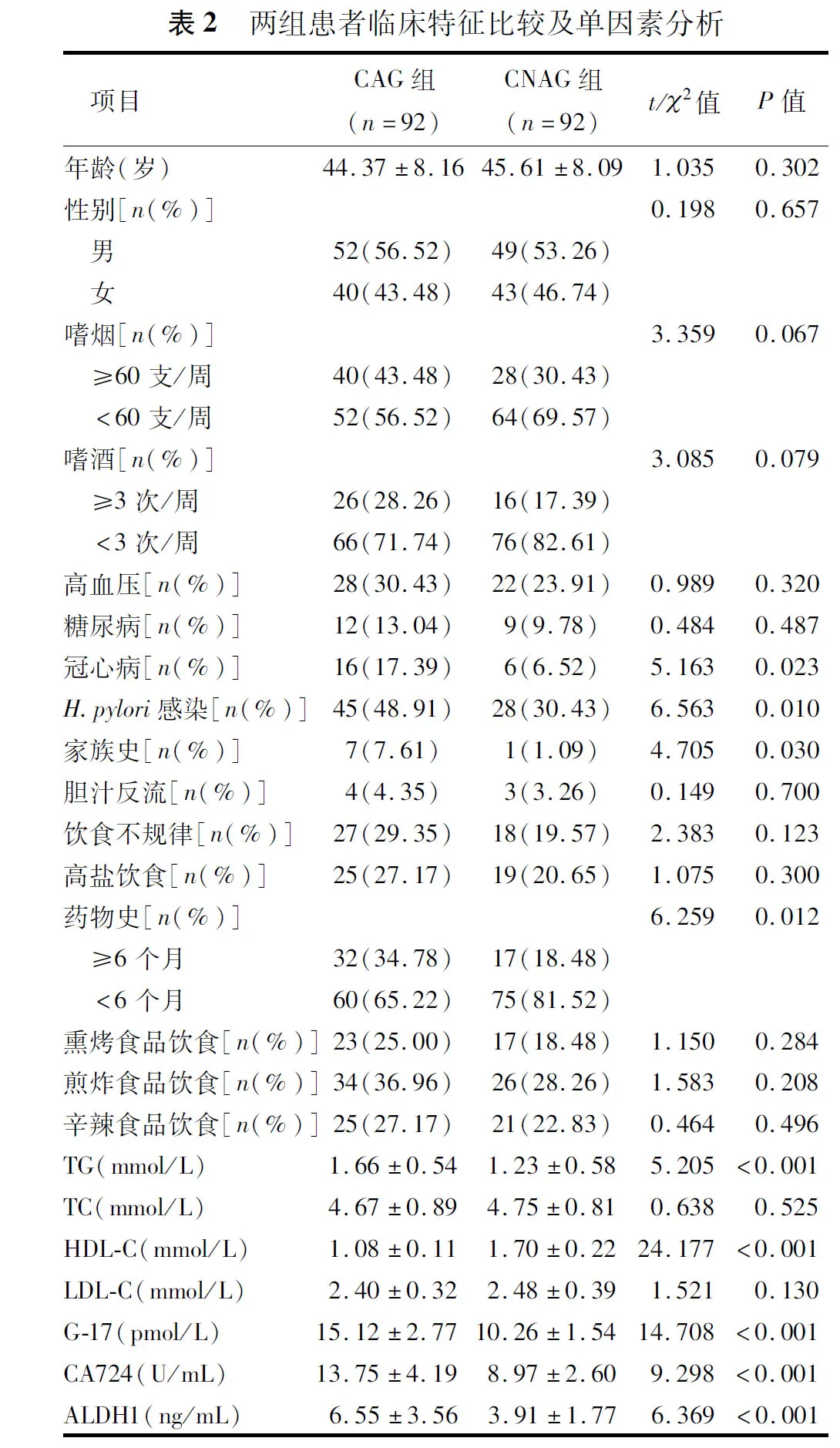
选取92例于2018年5月~2021年5月我院收治的胃镜、组织病理诊断的CAG患者为研究对象(CAG组),分析其临床资料,其中男52例,女40例,年龄22~70岁,平均(44.37±8.16)岁。选取同期我院收治的92例慢性非萎缩性胃炎(Chronic non-atrophic gastritis, CNAG)患者作为对照组(CNAG组),其中男49例,女43例,年龄25~65岁,平均(45.61±8.09)岁。本研究经我院伦理委员会审批,患者或家属均知情同意且签署知情同意书。
纳入标准:(1)CAG以及CNAG组患者均符合诊断标准[9];(2)临床资料完整者;(3)愿意配合临床观察者。排除标准:(1)患有严重消化道疾病;(2)恶性肿瘤患者;(3)妊娠、哺乳等特殊阶段;(4)患有其他严重疾病。
1.2 研究方法
1.2.1 一般资料收集
确定研究对象后,对患者均进行临床特征的收集,包括年龄、性别、嗜烟、嗜酒、高血压、糖尿病、冠心病、幽门螺旋杆菌(Helicobacterpylori,H.pylori)感染、家族史、胆汁反流、饮食不规律、高盐饮食、药物史、熏烤食品饮食、煎炸食品饮食、辛辣食品饮食、甘油三酯(Triglyceride, TG)、总胆固醇(Total cholesterol, TC)、低密度脂蛋白(Low density lipoprotein cholesterol, LDL-C)、高密度脂蛋白(High density lipoprotein cholesterol, HDL-C)、胃泌素17(Gastrin 17, G-17)、糖类抗原724(Carbohydrate antigen 724, CA724)、乙醛脱氢酶1(aldehyde dehydrogenase 1, ALDH1)以及白光内镜下特征改变[8]。
1.2.2 检查方法
胃镜检查:术前,禁食6~8 h,利多卡因胶浆(口服,10 mL),以麻醉润滑。
病理检查:胃镜下,从胃体、胃窦、胃角中取4~6块组织黏膜,采用10%甲醛固定或石蜡包埋。
H.pylori感染:采用改良Giemsa染色及快速尿素酶试剂法检测标本,颜色不变、浅红色、深红色分别表示为Hp阴性、弱阳性、强阳性。
采集患者清晨空腹静脉血3 mL,进行血清分离后,将其保存在-20 ℃的环境中待测。采用ELISA法检测G-17和ALDH1水平,ALDH1试剂盒购自美国RayBiotech公司,G-17试剂盒购自芬兰Biohit公司。采用电化学发光法测定血清CA724水平,试剂盒由罗氏公司提供。应用全自动生化分析仪(贝克曼库尔特AU5800)检测TG、TC、LDL-C、HDL-C。
1.3 统计学处理

2 结果
2.1 CAG患者白光内镜下特征改变及诊断符合率
根据CAG内镜下特征将患者分为A型(52例,56.52%)和B型(40例,43.48%)。A型黏膜形态:红白相间,白居多,皱襞变平或消失,血管充分暴露;B型黏膜形态:结节状或颗粒状。不同CAG患者病理检查结果比较,与A型相比,B型患者的诊断符合率更高(P<0.05),IM、ATP患者比例更高(P<0.05),见表1和图1。
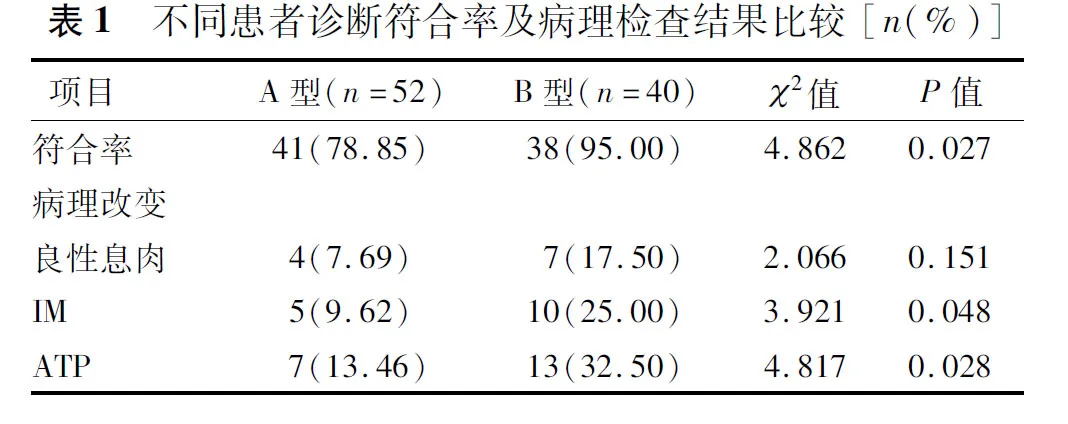
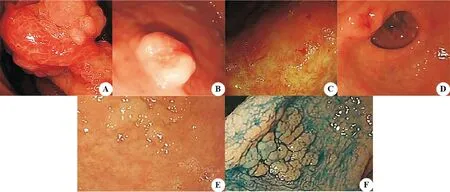
图1 内镜下病灶形态特征 A:颜色呈不规则分布;B:颜色、形状不规则;C:表面发红,自发性出血;D:边缘毛刺,自发性出血;E:边界不清晰;F:4%靛胭脂染色后边界清晰
2.2 两组患者的临床资料比较
与CNAG组相比,CAG组冠心病、H.pylori感染、家族史、药物史(6个月的患者比例更高(P<0.05),TG、G-17、CA724、ALDH1水平更高(P<0.05),HDL-C水平更低(P<0.05)。两组其余指标的差异均无统计学意义(P>0.05),见表2。
2.3 多因素Logistic回归分析
以CAG发病为因变量,以表2中两组差异具有统计学意义的指标(P<0.05)为自变量,进行多因素Logistic回归分析,结果显示,H.pylori感染、家族史、HDL-C水平降低、G-17水平升高、CA724水平升高、ALDH1水平升高均为CAG发病的独立危险因素(P<0.05),见表3。
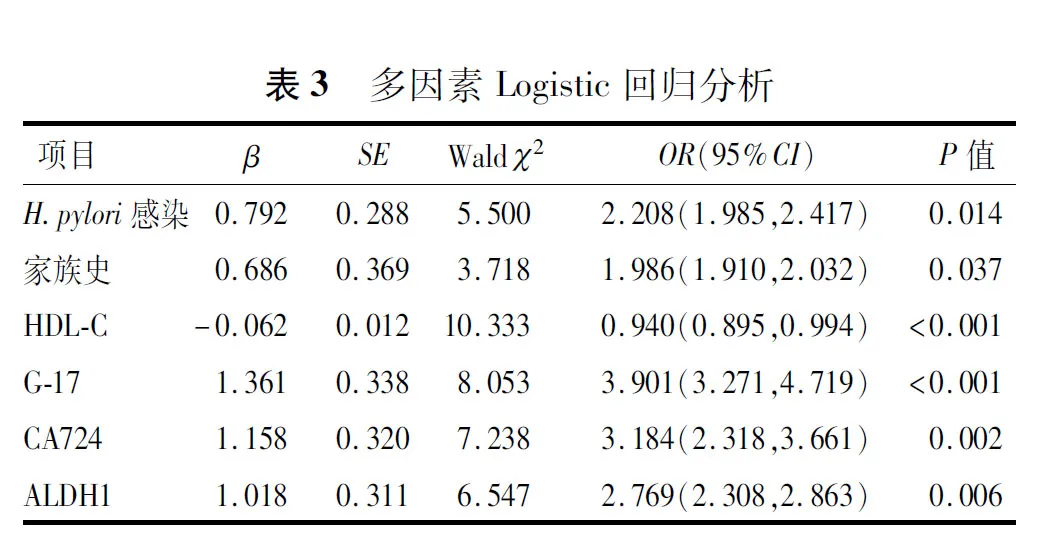
2.4 建立列线图预测模型
基于影响CAG发病的独立危险因素建立列线图预测模型。模型中H.pylori感染(38分)、家族史(22分)、HDL-C<1.40 mmol/L(80分)、G-17>12.70 pmol/L(72分)、CA724>11.40 U/mL(60分)、ALDH1>5.20 ng/mL(50分),总分322分,见图2。
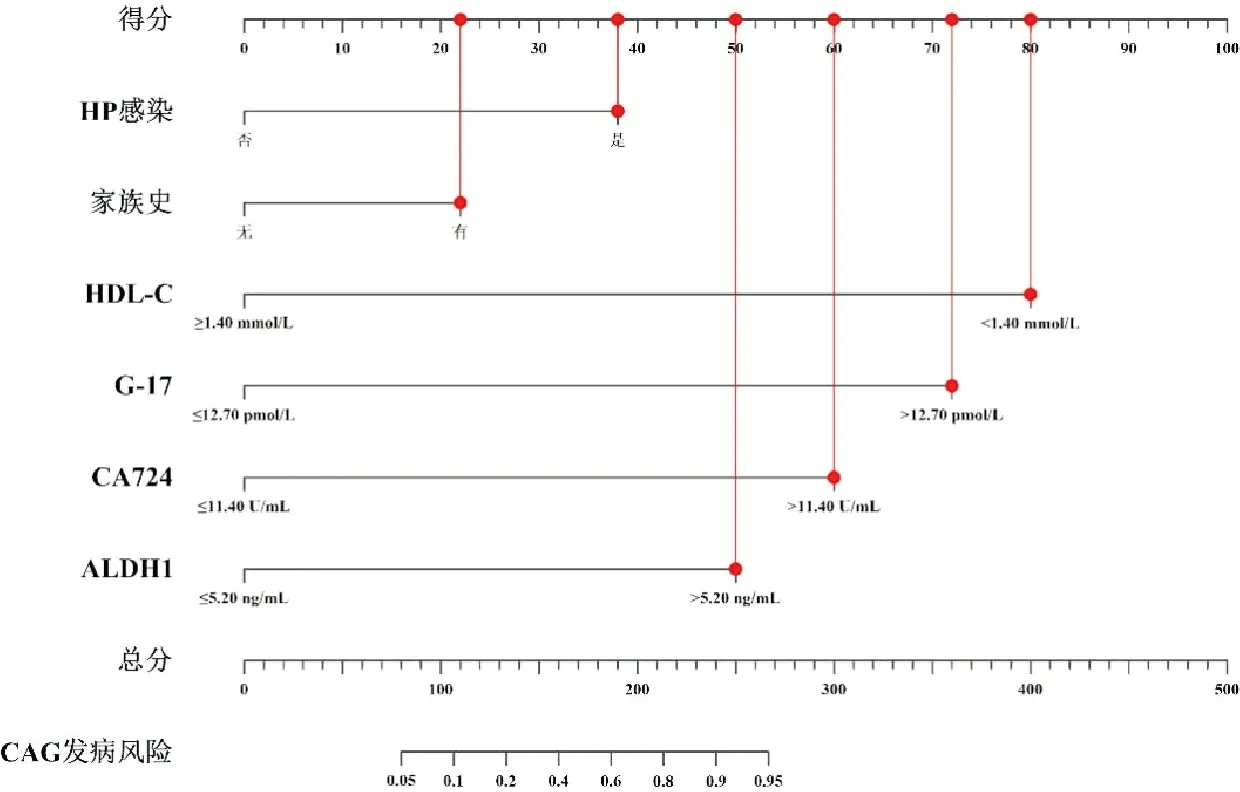
图2 CAG发病的列线图预测模型
2.5 模型评价
经ROC分析,列线图模型预测CAG发病的AUC为0.858(95%CI: 0.805~0.911,P<0.01),灵敏度为0.865,特异度为0.695,见图3A。该模型的内部数据验证结果显示,校准图中标准曲线与预测曲线贴合较好,表明预测情况与实际情况具有良好的一致性,见图3B。
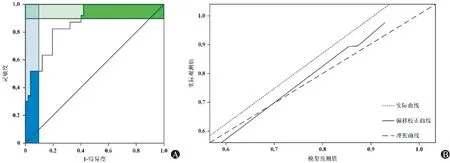
图3 列线图预测模型的ROC曲线(A)和内部验证校准图(B)
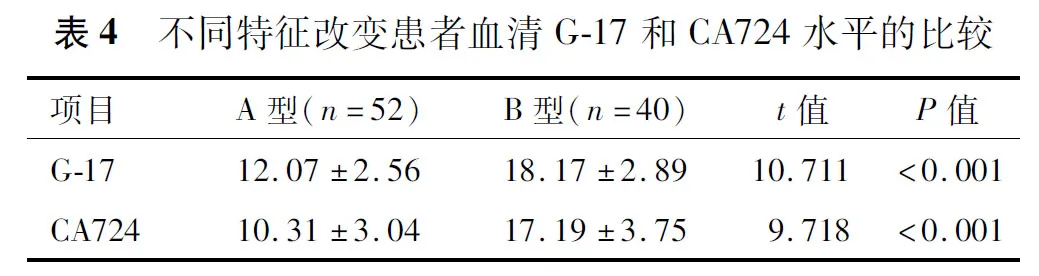
2.6 白光内镜下不同特征改变患者血清G-17和CA724水平的比较
与A型相比,B型患者血清G-17和CA724水平均更高(P<0.05),见表4。
3 讨论
临床上,慢性胃炎可分为CNAG和CAG两类,其中CAG是一种较常见却易被忽视的疾病,该病进展隐匿,大多无明显症状或临床表现为食欲减退、上腹部不适等消化不良症状[10-12];与CNAG相比,CAG更严重。Correa模型[13-14]显示胃癌的发生发展过程,即正常胃黏膜→慢性非萎缩性胃炎→CAG→IM→ATP→GC。在胃黏膜萎缩后期,患者多伴有IM与ATP,若不及时干预,严重时可发展成为胃癌,因而CAG已成为胃癌癌前病变之一[15]。随着胃镜技术逐渐发展成熟,通过胃镜诊断CAG可显示出不同特征以及病理改变。本研究显示,CAG内镜下特征包括A型52例和B型40例。与A型相比,B型患者的诊断符合率更高,IM以及ATP患者比例更高。这可能是由于B型患者的取样标本多在结节状或颗粒状黏膜处,而该处较易诊断为CAG并易发生IM、ATP等病理改变,因此与A型相比,B型的诊断符合率以及IM、ATP检出率均更高。
CAG是一种癌前状态,通过各种基因的差异性表达,可发展为胃癌。因此,对于CAG,早期预防至关重要。国内外相关研究表明[16-18],CAG发病可能与长期不规律、不健康的饮食习惯、心理因素、H.pylori感染以及家族史等因素有关。本研究结果表明,H.pylori感染、家族史、HDL-C水平降低、G-17水平升高、CA724水平升高以及ALDH1水平升高均为CAG发病的独立危险因素。(1)H.pylori是一种主要存在于胃黏膜中的革兰氏阴性菌[19]。大量研究表明[20],H.pylori感染是CAG发病最主要的原因。同时H.pylori感染与CAG患者病理改变相关[21]。H.pylori感染可引起慢性胃炎反应,而慢性胃炎长期发生,则会严重影响患者胃黏膜结构、胃腺体等,出现IM、ATP等病理改变,甚至发生胃癌。(2)范尧夫等人[22]的研究表明,胃癌家族史为胃癌前病变的危险因素之一,具体影响机制还有待于从基因水平以及宏观环境等因素的相互作用进一步明确。(3)研究表明[23],HDL-C升高是CAG的保护因素。这可能是由于HDL-C在正常胃黏膜到胃癌的发展各阶段中发挥着作用,能够抑制CAG向胃癌发展。(4)G-17水平常用于癌前病变以及胃癌筛查,G-17可激活混合谱系激酶3,使金属基质蛋白酶活化,细胞外基质降解,从而促进肿瘤侵润和转移[24]。同时H.pylori感染也会使得G-17水平上升[25]。(5)CA724是一种肿瘤标志物,对胃癌具有较高灵敏度和特异度。而CAG作为癌前病变,CA724也可作为CAG的诊断指标。(6)对于导致或加速胃癌的进程,ALDH1具有一定的作用机制,可促进肿瘤侵润和转移,但具体机制有待进一步明确。
经ROC分析,预测CAG发病的列线图模型的区分度尚可。该模型的内部数据验证结果显示,预测情况与实际情况具有良好的一致性,表明模型的准确度较高。与A型相比,B型患者血清G-17和CA724水平均更高。这可能与B型患者IM、ATP检出率较高相关。
综上所述,CAG内镜下特征包括A型和B型。B型IM、ATP患者比例更高、血清G-17和CA724水平更高。H.pylori感染、家族史、HDL-C水平降低、G-17水平升高、CA724水平升高、ALDH1水平升高均为CAG发病的独立危险因素。不同类型CAG患者血清G-17和CA724水平有一定差异,临床上应重视患者血清G-17和CA724水平的检测。
