RET原癌基因与肿瘤相关性研究的进展现状
2022-02-11肖金平李程曹云娣孙志坚康平兰晓梅
肖金平, 李程, 曹云娣, 孙志坚, 康平, 兰晓梅
浙江科途医学科技有限公司,浙江湖州313000
RET原癌基因位于人体10 号染色体上,其可通过不同的剪切方式对3‘端进行剪切,形成RET9、RET43 和 RET51 等受体酪氨酸激酶,构成单跨膜酪氨酸激酶受体蛋白RET 家族。RET 蛋白在正常的神经元、交感神经、副交感神经节、甲状腺C 细胞、肾上腺髓细胞、泌尿生殖道细胞、睾丸生殖细胞均有表达。RET蛋白活化后通过激活RAS、MAPK、ERK、PI3K、AKT 等下游的信号通路,调控细胞增殖、迁移和分化。RET蛋白在器官生成和机体神经(包括自主神经系统、肠道等)的发育过程中起关键作用,且人体正常的精子产生和肾脏发育均需要RET蛋白的参与。
RET基因致癌突变类型包括点突变、基因融合、重排和拷贝数变化等,在甲状腺癌中常见为RET 体细胞变异,肺腺癌中为RET 融合,乳腺癌中同时存在RET 拷贝数变化、点突变和重排。该基因突变具有泛癌种致癌的特性,因此,本文综述了RET基因突变的癌症相关性研究、精准化检测及靶向药物的开发,以期为实现跨癌种精准诊疗,提高肿瘤患者的生存率提供一定的理论依据。
1 RET原癌基因的生物学特性及功能
1985年,Frank-raue等[1]首次在重组DNA 中发现了RET原癌基因,进一步分析发现RET基因定位于10 号染色体上,含21 个外显子,全长60 kb,至少有4 个转录产物。RET基因属于钙粘蛋白超家族成员,所编码的RET 蛋白是一种存在于细胞膜上的单跨膜酪氨酸激酶受体,是细胞生长和分化传导信号的细胞表面分子[1-2]。RET酪氨酸蛋白复合物含有胞外受体结合区、富含半胱氨酸的跨膜区和胞内结合区,其中胞内结合区可以主动或被动磷酸化,启动下游信号通路。RET 酪氨酸受体的配体为胶质细胞源神经营养因子(glial cell line-derived neurotrophic factor,GDNF)家族成员,主要包括 4 种,分别为 GDNF、neurturin、artimin 和persephin[1-4],不同受体与不同的因子结合亲和力和功能存在差异,从而激活RET 信号调节通路如Ras/MAPK、PI3-K、PLCγ 等,用于调节神经元生长、分化、存活等生物学效应[5]。
RET 蛋白参与的信号通路有PI3K、RAS 和STAT。细胞存活、增殖、迁移和分化的主要途径一条是PI3K-AKT-mTOR,另一条是RAS-RAFMEK-ERK(图1)。RET蛋白通过与可溶性胶质细胞源神经营养因子家族配体蛋白结合,从而被激活[6-7],并可能编码出具有异常活动的RET 蛋白,其可能传递异常信号并影响细胞生长、生存、侵袭、转移等过程。当RET基因突变或者重排时,会促使肿瘤的发生。
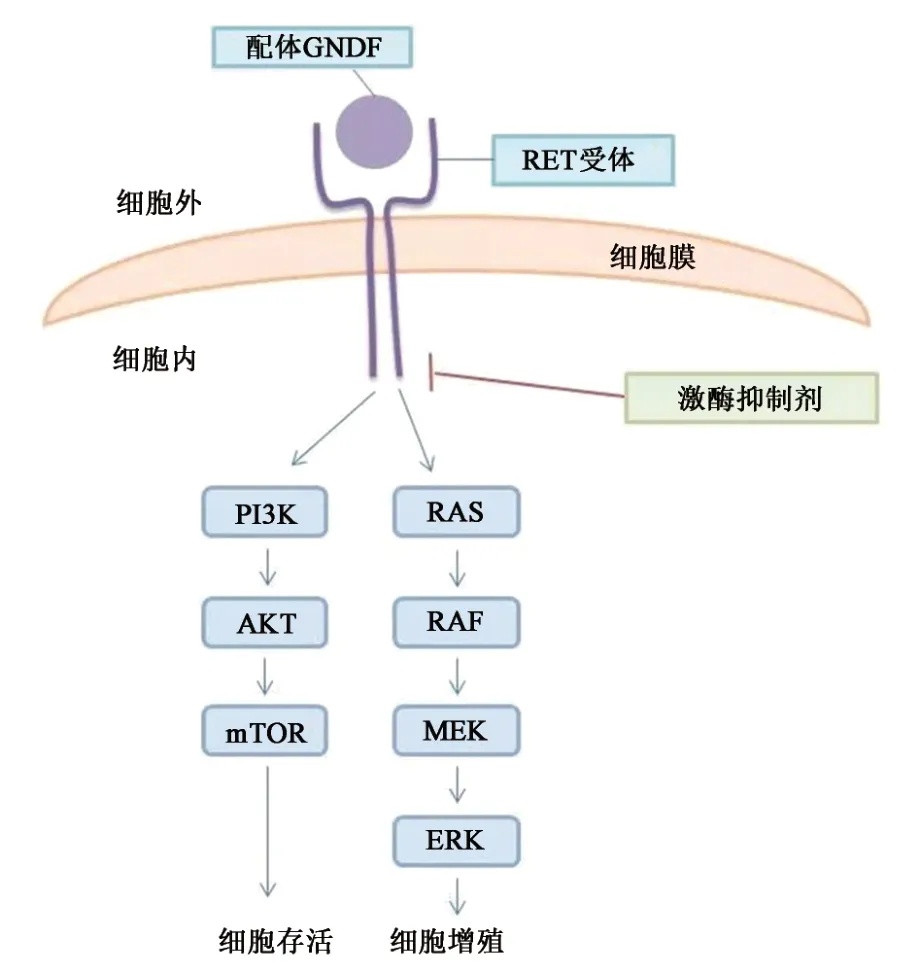
图1 RET基因的信号通路图Fig.1 Signal pathway diagram of RET gene
2 RET原癌基因突变与癌症的相关性
2.1 主要突变类型与机制
RET基因主要通过突变、过度表达等方式影响多种肿瘤的发生、发展及转移。同时当染色体重排导致RET基因中间断裂后,RET基因3‘端激酶结构域会与不同的基因发生融合,形成驱动肿瘤增殖的融合基因。
2.2 RET重排与甲状腺癌的关系
甲状腺癌最主要的发病原因是电离辐射,RET基因与甲状腺疾病密切相关,包括甲状腺乳头状癌(papillary thyroid carcinoma,PTC)[8]和甲状腺髓样癌(medullary thyroid carcinoma,MTC)[9]。在散发性乳头状甲状腺癌中,RET基因重排率为20%~40%,目前最常见的有NCOA4-RET 和CCDC6-RET 融合基因,同时RET基因的点突变也是甲状腺癌的发病原因,65%~80%的甲状腺髓样癌体细胞存在RET基因突变。研究表明,甲状腺癌和RET癌基因的活化密切相关,其中ERT/PCT 癌基因显示阳性的患者,年龄越小肿瘤发展程度越轻,肿瘤体积越小,细胞繁殖生长能力越弱,对药物敏感预后能力也越强[9]。
有研究表明,舒尼替尼治疗乳头状甲状腺癌效果显著,RET 酪氨酸激酶抑制剂凡德他尼和卡博替尼治疗甲状腺髓样癌效果明显[10-12]。2019年,美国食品药品监督管理局(Food and Drug Administration,FDA)授予了 Selpercatinib 孤儿药资格认证,其可用于治疗RET 融合阳性非小细胞肺癌(nonsmall-cell lung cancer,NSCLC)、RET 融合阳性和RET 突变甲状腺癌,包括低分化甲状腺癌、未分化或间变性甲状腺癌、MTC、局部晚期或转移性滤泡或乳头状甲状腺癌[13]。研究表明,19例RET 融合阳性甲状腺癌患者接受其他治疗后,总缓解率为79%,87%的应答患者缓解持续时间超过6个月;8例仅接受Selpercatinib 治疗的患者,总缓解率为100%,75%的应答患者缓解持续时间超过 6 个月[14]。2020 年 9 月,美国 FDA 授予 RET抑制剂Pralsetinib 优先审查资格,其是一种RET靶向疗法,可用于治疗晚期或转移性RET 突变型甲状腺髓样癌和RET融合阳性甲状腺癌患者。
2.3 RET基因融合与肺癌的关系
肺癌是发病率和死亡率均较高的恶性肿瘤,严重威胁人们的生命安全,肺癌的发生除了与EGFR、KRAS、BRAF、ALK、ROS1等常见基因相关外,还存在RET原癌基因融合的情况。KIF5B-RET是肺小细胞癌中最常见的RET融合基因。非小细胞肺癌形成肺恶性肿瘤主要是通过KIF5BRET、CCDC6-RET、NCOA4-RET、TRIM33-RET基因诱导癌蛋白产生及引起类似于ALK基因突变致癌的信号传导通路激活,进而导致细胞癌变(图2),其中KIF5B-RET 是最常见的融合形式,约占90%。
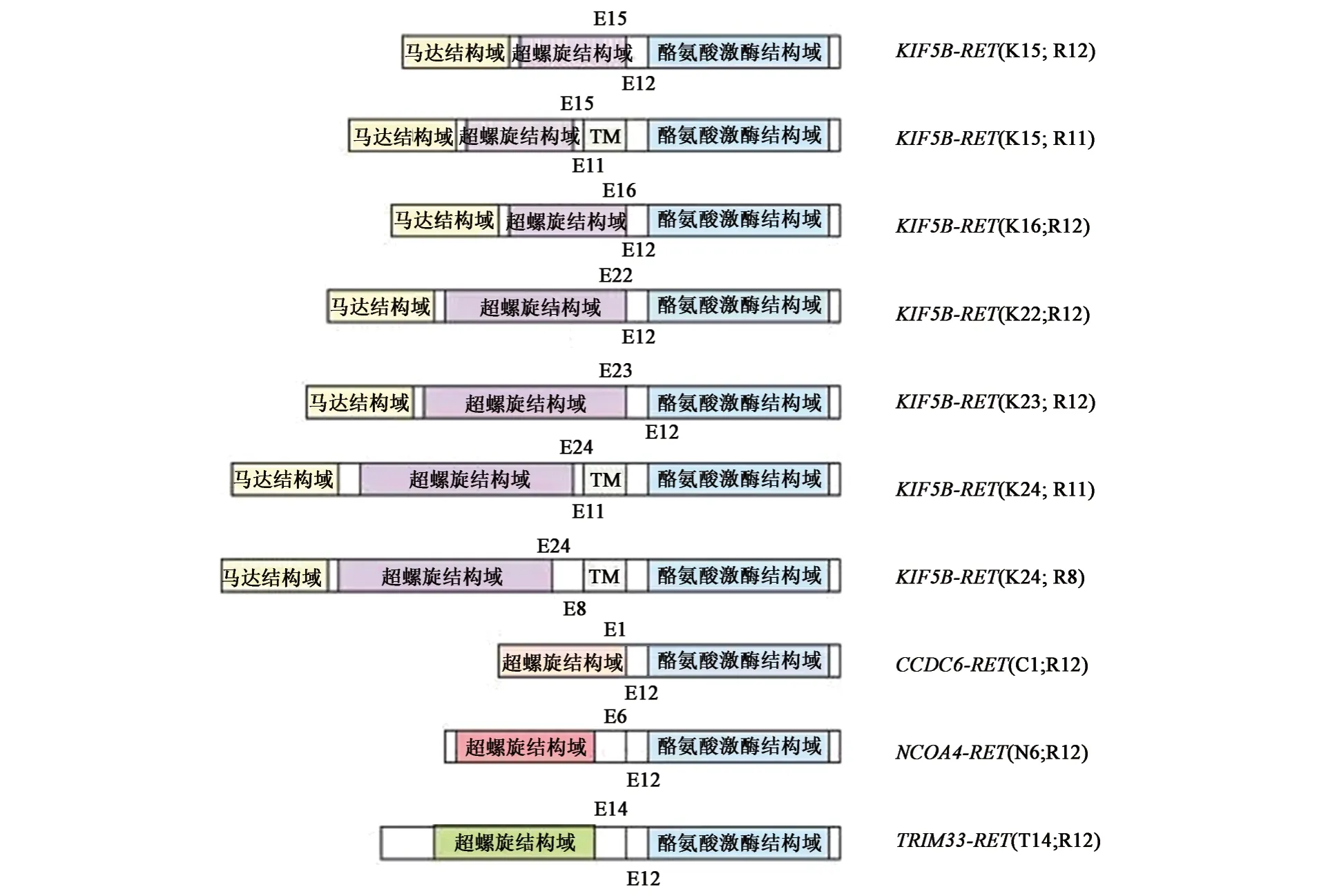
图2 非小细胞肺癌中RET基因的融合形式Fig.2 The fusion form of the RET gene in non-small cell lung cancer
2012 年有研究者首次在非小细胞肺癌中发现了RET融合基因,发生率为1%~2%[15]。Cong等[16]通过数据库检索对13 篇文章进行了分析,共纳入 8 859 个病例,其中,169 例检测出RET融合基因,阳性检出率为1.91%;存在KIF5B-RET 有121 例,且女性高于男性;同时,研究发现,RET融合基因与STNNB1、MAP2K1、EGFR、TP53、MET及SETD2等基因变异共存[17-18]。
有研究表明,RET基因融合可能是导致EGFR-TIKs(包 括 一 代 EGFR-TIKS[19]、三 代 EGFRTIKS[20)]获得耐药性的作用机制之一。Selpercatinib 在39 例先前未接受过治疗(初治)RET 融合阳性非小细胞肺癌成人患者中的临床试验结果显示,总缓解率为84%,58%的应答患者缓解持续时间≥6 个月[21]。Pralsetinib 治疗 87 例 RET 融合阳性非小细胞肺癌患者的总缓解率为50%,75%的应答患者持续缓解时间≥6个月[22]。
2.4 RET基因表达与乳腺癌的关系
乳腺癌是全世界女性发病率最高的恶性肿瘤,侵袭性乳腺癌中有30%~70%表达RET蛋白,且其表达与ER 阳性乳腺癌密切相关[23]。RET 通过PI3K 途径诱导乳腺癌的发生,主要存在于ER阳性的患者中,雌激素和RET 蛋白之间形成相互促进的特殊机制,ER阳性的乳腺癌中RET蛋白的含量较高。RET抑制剂可抑制乳腺癌的原发灶生长及转移能力,降低蛋白活性,RET抑制剂可作为乳腺癌靶向药物[24];同时不同的肿瘤中RET基因的突变频率存在明显差异,其中甲状腺肿瘤的RET基因突变频率最高[23](表1)。

表1 不同肿瘤的RET基因突变频率Table 1 RET gene mutation frequency in different tumors
3 RET基因的检测技术
RET基因为低频突变基因,且可与多个不同基因在不同的断裂点发生融合突变,检测的样本一般来源于石蜡组织样本、新鲜组织样本和血液等,且应用不同组织来源建立的肿瘤类器官中同样存在RET基因的突变。RET基因常用的检测方法有免疫组织化学(immunohistochemistry,IHC)、荧光原位杂交(fluorescence in situ hybridization,FISH)、RT-PCR 以及下一代测序(next generation sequencing,NGS),以上的检测技术均存在优缺点(表1),因此选择适合的检测方法尤为重要。
3.1 IHC
IHC 的优点是经济快捷、适合大样本筛选,但免疫组化的结果判断标准尚未统一,检测准确性不高。研究表明RT-PCR 和FISH 检测RET-fuison基因结果相同,但与IHC 检测的结果匹配度不佳[25-26]。
3.2 FISH
FISH 能将探针直观地定位于具体染色体臂上,检测出相应探针在基因组中不具有任何表型的同源序列,灵敏度较高[27]。但检测费用较高,检测结果需要专业的人员进行分析,主观性强,检测时间长。研究表明FISH 检测技术无法提供RET融合伴侣的信息,且目前FISH 阳性阈值尚无标准,RET 分离信号值为10%~20%,导致检测结果难以判读[28]。
3.3 RT-PCR
RT-PCR 特异性、敏感度和自动化程度均较高,且仪器设备较常见,因此,RET 筛查研究多使用RT-PCR。RT-PCR 仅能检测已知的位点,无法检测新的或未知位点,在处理样本过程中RNA 易降解,从而影响检测结果[29]。
3.4 NGS
近年来,随着测序技术的研究和发展,NGS广泛运用于临床。NGS是对传统Sanger测序一次革命性的改变,其具有高通量、操作简单,可大规模筛选基因等优点,同时准确度较高,能够提高基因检测的检出率。
IHC、FISH、RT-PCR、NGS 各种检测技术检测RET原癌基因有各自的优缺点,具体见表2。
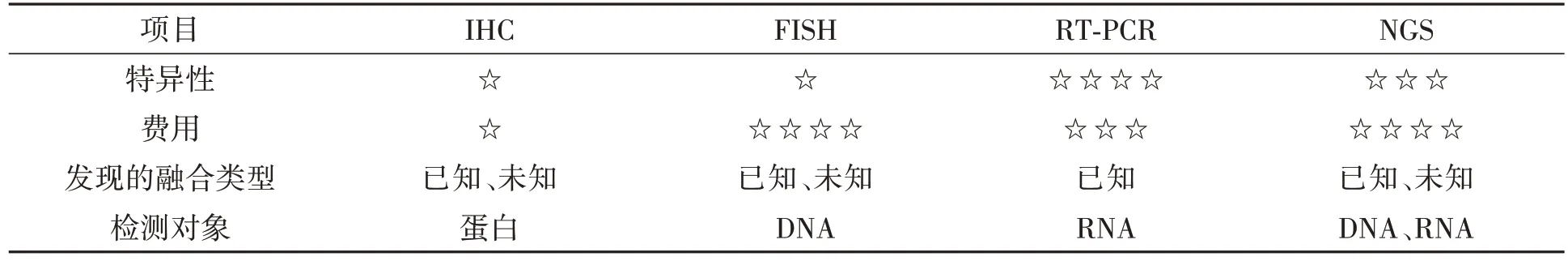
表2 IHC、FISH、RT-PCR和NGS检测RET原癌基因的优缺点比较Table 2 Advantages and disadvantages of IHC,FISH,RT-PCR and NGS detection of RET proto-oncogene
4 针对RET基因的靶向治疗
目前已批准上市或仍在研发阶段的RET 靶向抑制剂有多靶点药物、RET激酸抑制剂、高选择性RET抑制剂等。
4.1 多靶点药物
早期用于治疗具有RET基因融合突变的非小细胞肺癌患者的靶向药物,主要以多靶点药物为主,如凡德他尼(vandetanib)、卡博替尼(carbozantinib)或舒尼替尼(sunitinib)等酪氨酸激酶抑制剂。但临床实践表明以上药物对RET融合基因的选择性不强,药物的有效性相对较差。一项关于RET 融合非小细胞肺癌的Ⅱ期临床试验中,19 例患者服用凡德他尼治疗后的客观有效率为47%,疾病控制率为90%,无进展生存期为4.7个月[30]。
4.2 RET激酶抑制剂
礼来公司开发的selpercatinib 为首个被批准用于治疗携带RET基因变异患者的靶向药,其为RET 激酶抑制剂,对 KIF5B-RET、CCDC6-RET、ERT V804L/M 和M918T 耐药较为敏感,对多种RET 阳性的患者均具有较高的敏感性,在提高药效的同时可明显降低药物的不良反应。临床试验表明未服用凡德他尼和卡博替尼的76 例RET突变型甲状腺髓样癌患者经过selpercatinib 的治疗后,客观缓解率(overall response rate,ORR)为59%,26 例已采用药物治疗后的RET 阳性患者再经selpercatinib 治疗后的有效反应率为62%,且经selpercatinib 治疗后部分机体反应符合实体瘤的疗效评价(response evaluation criteriain solid tumors,RECIST)标准[31]。
4.3 高选择性RET抑制剂
由基石药业和Blueprint Medicines 合作开发的Pralsetinib 属于高选择性RET 抑制剂,对于KIF5B-RET、CCDC6-RET 融合及 RET V804E/L/M和Y806C/H/N 较为敏感。Pralsetinib 被设计成一种有效的、高选择性的RET 突变抑制剂,常用于治疗非小细胞肺癌、甲状腺癌和其他实体瘤[32]。在一项Ⅰ/Ⅱ期临床试验中,既往接受过治疗的RET 阳性甲状腺癌晚期患者服用BLU-677 的ORR 达到60%,90%的患者缓解持续时间达到18个月,在既往未接受过系统治疗的患者中,疾病控制率为74%,98%的患者的肿瘤均缩小[33]。Pralsetinib 对KIF5B-RET 自磷酸化的抑制作用是RXDX-105 的 20 倍 以上 ,表明 Pralsetinib 具 有 优先活性。
综上所述,靶向治疗与传统的化疗、放疗相比,具有特异性强、疗效显著、不良反应少等优点,可以减少对正常组织的损伤,提高患者的生存质量。
5 展望
随着全球癌症病例的逐年增加,肿瘤的治疗从传统的手术、化疗和放疗,发展为靶向治疗。肿瘤的精准化、个性化治疗作为其临床用药的必要诊断程序,市场前景广阔。目前RET 抑制剂在肿瘤治疗的领域中取得了一定的成就,但其疗效和安全性仍需进一步验证,其中NGS 技术是目前运用最广泛和最稳定的技术。随着检测技术的不断更新、发展,以及更安全、疗效更好的RET 抑制剂药物的出现,未来可为肿瘤患者提供更高质量的服务,不断提高患者的生存率和生活质量。
