冷等离子体对果蔬冷库微生物群落的影响
2022-02-11曹建康赵玉梅仲崇山刘彧希
方 琼,曹建康, ,赵玉梅,仲崇山,刘彧希
(1.中国农业大学食品科学与营养工程学院,北京100083;2.中国农业大学信息与电气工程学院,北京 100083)
果蔬冷库是指利用降温设施来维持物品所需的适宜湿度和低温环境的一种贮藏设施,主要用来存放水果和蔬菜等农产品,在一定时间内确保其品质[1-2]。我国是果蔬生产和消费大国[3],冷库在果蔬的冷链流通过程中起到至关重要的作用[4]。低温虽然可抑制大多数微生物的生长繁殖,但却无法做到有效杀灭微生物。因此冷藏环境中的病原微生物仍会使果蔬在贮藏期间及解除低温后发生病害。产品腐烂变质或产生真菌毒素[5],不仅会造成经济损失[6],还可能威胁人类的生命健康[7]。因此,了解果蔬冷库环境中的微生物组成,采取合适的杀菌手段对冷库中的微生物群落结构进行干预,是保障果蔬冷库整体保鲜水平和贮藏质量的一项重要工作。
近几年,冷等离子体技术作为一种非热消毒杀菌技术已逐渐应用于食品行业[8-9]。冷等离子体(cold plasma, CP)处理产生的活性基团和离子能在较短时间内有效抑制包括细菌、酵母、霉菌甚至是真菌孢子在内的多种微生物的生长并导致其死亡,且其安全无残留,在食品中有良好的应用前景[10-12]。研究表明,冷等离子体对果蔬、肉类、水产品及谷物等食品表面的金黄色葡萄球菌、大肠杆菌[13]、沙门氏菌、单增李斯特菌、黄曲霉菌[14]、青霉菌、白色念珠菌[15]等食源性致病菌均有良好的杀灭效果。现有的以冷等离子体及果蔬为研究对象的相关研究主要以杀菌方式和杀菌效果为主[11],冷等离子体干预果蔬冷库微生物群落效果的系统研究还未见报道。
本研究选取了0 ℃果蔬冷库,采用冷等离子体技术对冷库环境进行杀菌处理,通过高通量测序,鉴定了冷等离子体处理前后冷库环境空气中细菌群落和真菌群落的主要组成及结构变化,并构建了微生物共生网络,为提高冷库整体保鲜技术水平提供思路和理论依据。
1 材料与方法
1.1 材料与仪器
营养琼脂、马铃薯葡萄糖琼脂培养基(PDA)北京奥博星生物技术有限公司;0.22 μm微孔滤膜生工生物工程(上海)股份有限公司;无菌拭子 比克曼生物科技有限公司;DNA提取试剂盒(PowerSoil DNA Isolation Kit) 美国MoBio Laboratories;Agencourt AMPure XP核酸纯化试剂盒 美国Beckman Coulter公司。
SPX-250B-Z型生化培养箱 上海博迅实业有限公司医疗设备厂;DW-HL398型超低温冷冻储存箱 中科美菱低温科技股份有限公司;TD1198-03型便携式臭氧气体检测报警仪 北京天地首和科技发展有限公司;NanoDrop 2000型分光光度计 美国Thermo Fisher Scientific;DYY-7C型电泳仪 北京市六一仪器厂;MiSeq PE300高通量测序平台美国Illumina公司;WTR-33型等离子保鲜设备 购于唐山衡生空气净化器设备有限公司,该设备尺寸为:446 mm×116 mm×320 mm,内含介质阻挡放电等离子体发生装置和气体循环风扇,额定功率为150 W,额定臭氧产生速率为2.50 g/h,可设1%~99%浓度,工作时间可设1~60 min,按小时循环工作。
1.2 实验方法
1.2.1 冷等离子体处理 将WTR-33等离子保鲜设备悬挂于3 m×2 m×2 m的0 ℃果蔬冷库中,高度为1.60 m。设置臭氧发生浓度为10%,工作时间为每小时10 min。设备开始工作后,设置5个高度与采样点一致、按梅花布点的测量点,使用臭氧检测仪检测冷库中臭氧浓度,绘制臭氧浓度随时间变化的曲线图。
1.2.2 微生物浓度检测 WTR-33等离子保鲜设备循环工作前及工作30 d后,采用自然沉降法[16]对果蔬冷库中的微生物进行采样,设置5个采样点,每个点4块平板,包括2块真菌培养基和2块细菌培养基。真菌培养基为沙氏培养基,细菌培养基为营养琼脂培养基。取样时将培养基平板打开静置10 min,使空气微生物小颗粒沉降到培养基表面。采样完成后,盖上盖子,将培养皿倒置于恒温培养箱中培养,细菌于37 ℃下培养48 h;真菌于28 ℃下培养72 h。培养结束后,对培养皿进行菌落计数,根据奥氏公式计算空气微生物浓度(CFU/m3)。
菌落计数后,按照如下公式计算出受检环境空气中的微生物浓度[17]:
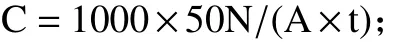
式中:C—空气中微生物浓度(CFU/m3);A—平板面积(cm2);N—培养皿菌落数(个);t—暴露时间(min)。
1.2.3 微生物样品采集 采集等离子体处理前及处理30 d后冷库空气环境中的微生物。取样容器为直径5 cm的0.22 μm有机系微孔滤膜,抽滤1 h,收集空气微颗粒,将吸附微颗粒的过滤膜装入无菌铝箔内,密封在-80 ℃储存。冷等离子体处理前和处理30 d后的冷库空气微生物样品分别编号为ES0和ES1。
1.2.4 基因组DNA提取和PCR扩增 使用MO BIO PowerSoil®DNA Isolation Kit对样品基因组DNA进行提取,并利用1%琼脂糖凝胶电泳检测DNA的完整性,利用NanoDrop 2000分光光度计检测DNA的浓度和纯度。
细菌的16S rDNA 扩增引物为V3+V4 区通用引 物338F(5‘-ACTCCTACGGGAGGCAGCAG-3‘)和806R(5‘-GGACTACHVGGGTWTCTAAT-3‘),真菌扩增引物为ITS1F(5‘-CTTGGTCATTTAGAGGA AGTA-3‘)和ITS2R(5‘-GCTGCGTTCTTCATCGATG C-3‘)[18]。
PCR扩增体系25 μL:DNA样品30 ng,2×Taq Plus Master Mix 12.5 μL,牛血清白蛋白(bovine serum albumin,BSA) 3 μL,5 μmol/L Forward Primer 1 μL,5 μmol/L Reverse Primer 1 μL,加ddH2O至25 μL。细菌PCR扩增条件:94 ℃预变性5 min,30次循环(94 ℃变性30 s,50 ℃退火30 s,72 ℃延伸60 s),最后72 ℃延伸7 min。真菌PCR扩增条件:94 ℃预变性5 min,34次循环(94 ℃变性30 s,50 ℃退火30 s,72 ℃延伸60 s),最后72 ℃延伸7 min。
PCR 产物经1%琼脂糖凝胶电泳检测后,用Agencourt AMPure XP核酸纯化试剂盒纯化,构建文库,利用Illumina MiSeq PE300平台进行测序。
1.3 数据统计与分析
原始数据下机后,结果以Fastq格式存储。利用Trimmomatic (Version 0.36)、Pear (Version 0.9.6)对Fastq数据进行质控。利用Flash (Version 1.20)、Pear根据PE的overlap关系对两端序列进行拼接(merge)处理,得到Fasta序列。根据已知数据库用UCHIME方法比对去除Fasta序列的嵌合体,对于未知数据库使用自比对(denovo)方法进行去除,同时去除不合要求的短序列。下机数据(Raw PE),在去除barcode和primer并拼接后得到raw tags,raw tags经进一步去除嵌合体、短序列后得到优质序列clean tags。用Qiime软件(Version 1.8.0 http://qiime.org/)计算相关指数,使用R软件(Version 2.15.3)绘制物种多样性曲线。使用VSEARCH (Version 2.7.1 https://github.com/torognes/vsearch) 对有效数据进行97%的相似度聚类[19],采用UPARSE聚类法将序列相似性大于97%的clean tags定为一个OTU(operational taxonomy unit)[20]。基于OTU聚类分析结果及代表序列,进一步进行多样性分析和差异分析等。分析数据库包括:SILVA (Release 128 http://www.arb-silva.de)、UNITE (Release 8.2 http://unite.ut.ee/index.php) 的真菌数据库、NCBI Nucleotide(https://www.ncbi.nlm.nih.gov/) 数据库和BLAST(2.6.0+ http://blast.ncbi.nlm.nih.gov)。本研究使用R语言工具及其igraph包,psych包,选取所有样本绝对丰度前20的属水平结果进行相互关联性分析,并以对应的门作为legend,过滤掉P值大于0.05的或相关值|R|<0.6的结果,使用Cytoscape 3.80进行绘图。
所有处理组至少含有4次生物学重复。用Microsoft Office Excel 2019对数据进行统计并算标准误差。数据结果以平均值±标准偏差(standard deviation, SD)表示。用OriginPro 2018作图。用IBM SPSS Statistics 25.0软件对数据进行方差分析(ANOVA),采用配对T检验(Student‘s T test)和Turkey test进行显著性分析,P<0.05时代表差异显著,P<0.01时代表差异极显著。
2 结果与分析
2.1 冷等离子体处理时果蔬冷库中臭氧浓度变化
臭氧是冷等离子体中的主要活性氧成分,其可以诱导氧化损伤从而发挥抗菌作用[21]。由图1可知,等离子体设备按小时循环工作时,冷库中臭氧浓度先急剧上升至10 μL/L后缓慢下降,周期循环波动。
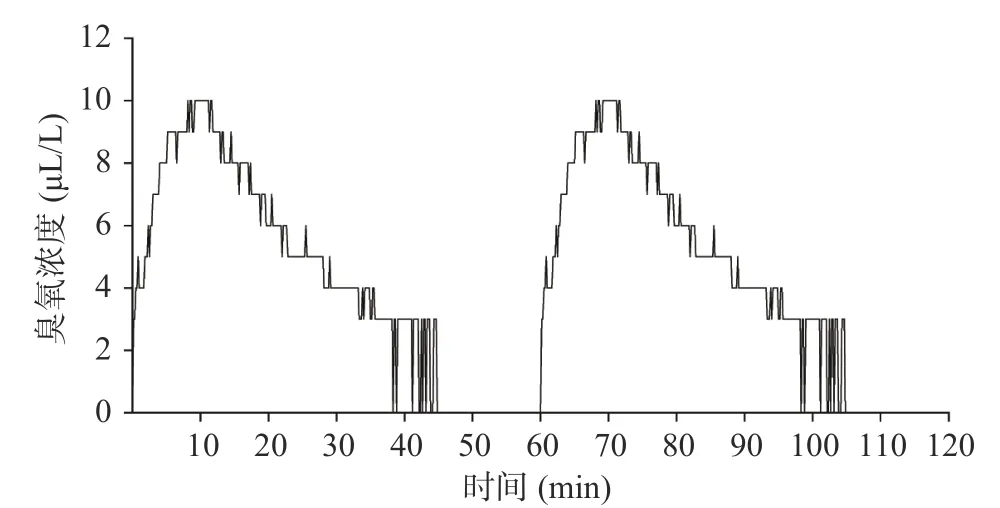
图1 果蔬冷库中臭氧浓度变化曲线Fig.1 Changes of ozone concentration in cold storage over time
2.2 冷等离子体处理对果蔬冷库微生物数量的影响
冷等离子体处理前后冷库空气中微生物数量变化如图2所示。冷等离子体处理后细菌浓度由137 CFU/m3降低到了11 CFU/m3,真菌浓度由343 CFU/m3降低到了33 CFU/m3,表明冷等离子体对冷库空气中的微生物具有良好的杀灭效果。真菌对于等离子体的抗性高于细菌,可能是因其细胞壁厚度、成分等不同[22]。
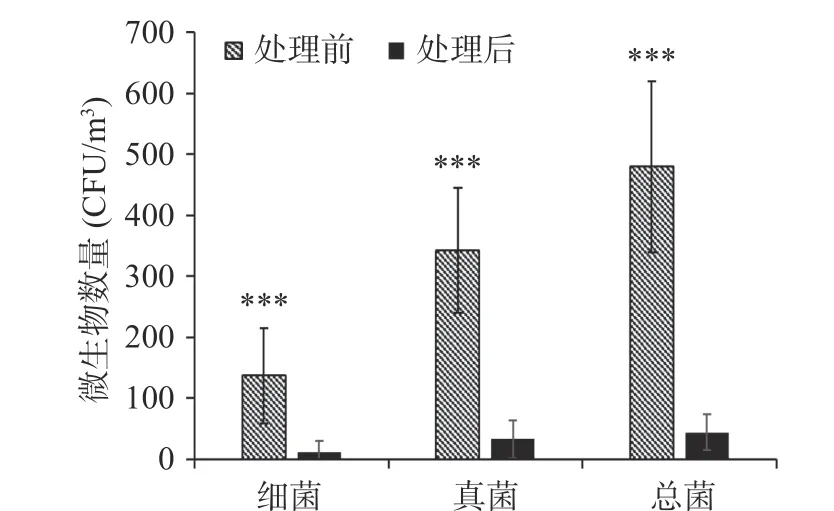
图2 冷等离子体处理前后果蔬冷库微生物数量变化Fig.2 Microorganism concentration in cold storage before and after cold plasma treatment
2.3 冷等离子体处理对果蔬冷库微生物多样性的影响
所有样品的覆盖率(Coverage)均达到0.9999(表1),说明样品中有未被测出的序列的概率较低,测序数量已饱和,能够真正反映冷库空气中微生物菌群结构及组成多样性的情况。

表1 果蔬冷库空气样品高通量测序质量Table 1 Quality of high-throughput sequencing of air samples in cold storage
细菌和真菌群落的α-多样性指数箱线图分别如图3 和图4所示。PD whole tree表示谱系多样性,是兼顾考虑了物种丰度以及进化距离的多样性指数,是基于系统发育树来计算的一种多样性指数,其数值越大,表示群落多样性越高[23]。Chao 1是物种丰富度指数,对稀有物种敏感,代表物种种类数目的丰富度[24]。Shannon指数和Simpson指数与物种丰富度和均匀度呈正相关,Shannon指数对物种丰富度更敏感,Simpson指数对物种均匀度更敏感[25]。
冷等离子体处理后,果蔬冷库空气中细菌群落的PD whole tree指数、Chao 1指数和Shannon指数均显著降低(P<0.05),Simpson指数有所降低但差异不显著(P>0.05)(图3);真菌群落的PD whole tree指数和Chao 1指数变化不明显,但是Shannon指数和Simpson指数极显著降低(P<0.001)(图4)。总体而言,冷等离子体处理显著降低了果蔬冷库空气中微生物的α多样性,且处理前后,真菌的多样性均高于细菌,说明真菌群落结构更复杂。
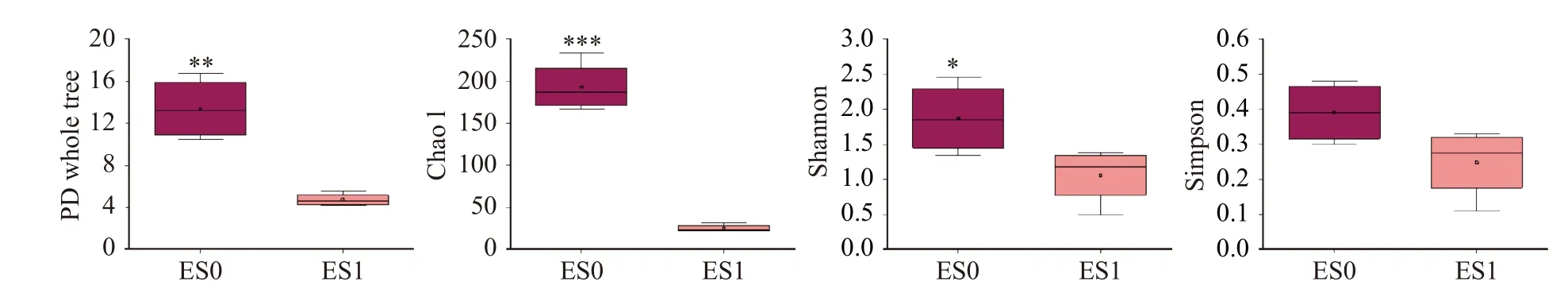
图3 细菌群落α多样性指数箱线图Fig.3 Boxplot of α diversity index of bacterial community
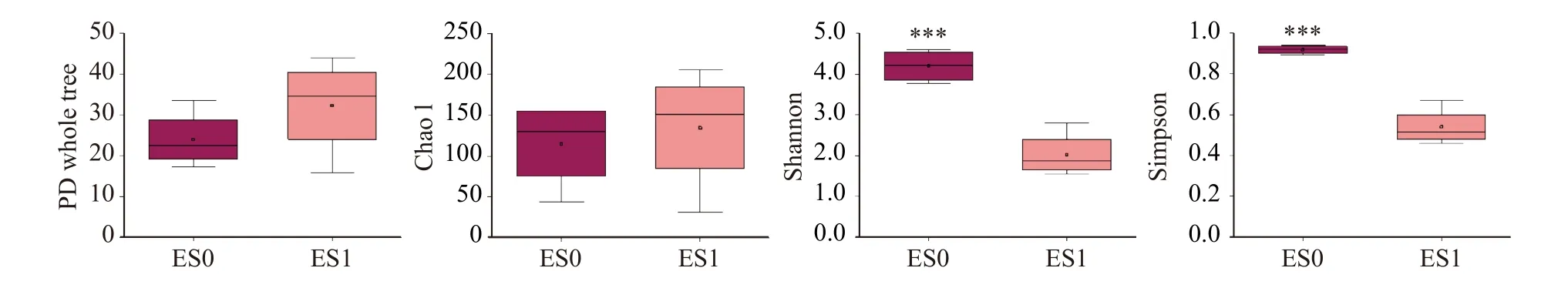
图4 真菌群落α多样性指数箱线图Fig.4 Boxplot of α diversity index of fungal community
为了进一步分析冷等离子体处理前后果蔬冷库空气中微生物群落组成的差异性,基于OTU图谱,采用加权UniFrac矩阵法计算细菌群落和真菌群落的β-多样性,进行基于Bray-Curtis距离的主坐标分析(principal co-ordinates analysis,PCoA)和多元方差分析(permutational multivariate analysis of variance,PERMANOVA)。PCoA分析可以直观显示不同样品中微生物群落结构上的相似性及差异性,不同样品间的距离越小,则两个样品之间的微生物群落结构差异性越小[26]。如图5所示,PC1(48.05%,57.28%)能够很好的区分冷等离子体处理前后的样品,处理前后的样品点之间距离有明显分离。与处理前相比,冷等离子体处理后冷库空气中的细菌群落结构和真菌群落结构都发生了显著的变化,结合α多样性分析的结果,表明冷等离子体处理能够显著降低冷库空气中的微生物多样性。
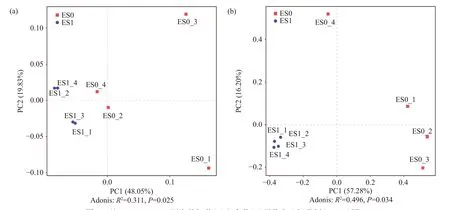
图5 基于Bray-Curtis距离的细菌(a)和真菌(b)群落主坐标分析(PCoA)图Fig.5 Principal coordinate analysis (PCoA) plots based on the Bray-Curtis distance for bacterial (a) and fungal (b)communities in samples
2.4 冷等离子体处理对果蔬冷库环境中微生物群落组成的影响
为明确冷等离子体处理前后的果蔬冷库空气环境中的主要微生物组成,根据物种注释结果,选取每个样本或分组中在门和属水平上相对丰度大于1%的物种,生成了物种相对丰度柱形累加图(图6和图7)。

图6 冷等离子体处理前后冷库环境中细菌门水平(a)和属水平(b)的群落组成Fig.6 Bacterial community composition at the level of phylum (a) and genus (b) in cold storage environment before and after cold plasma treatment
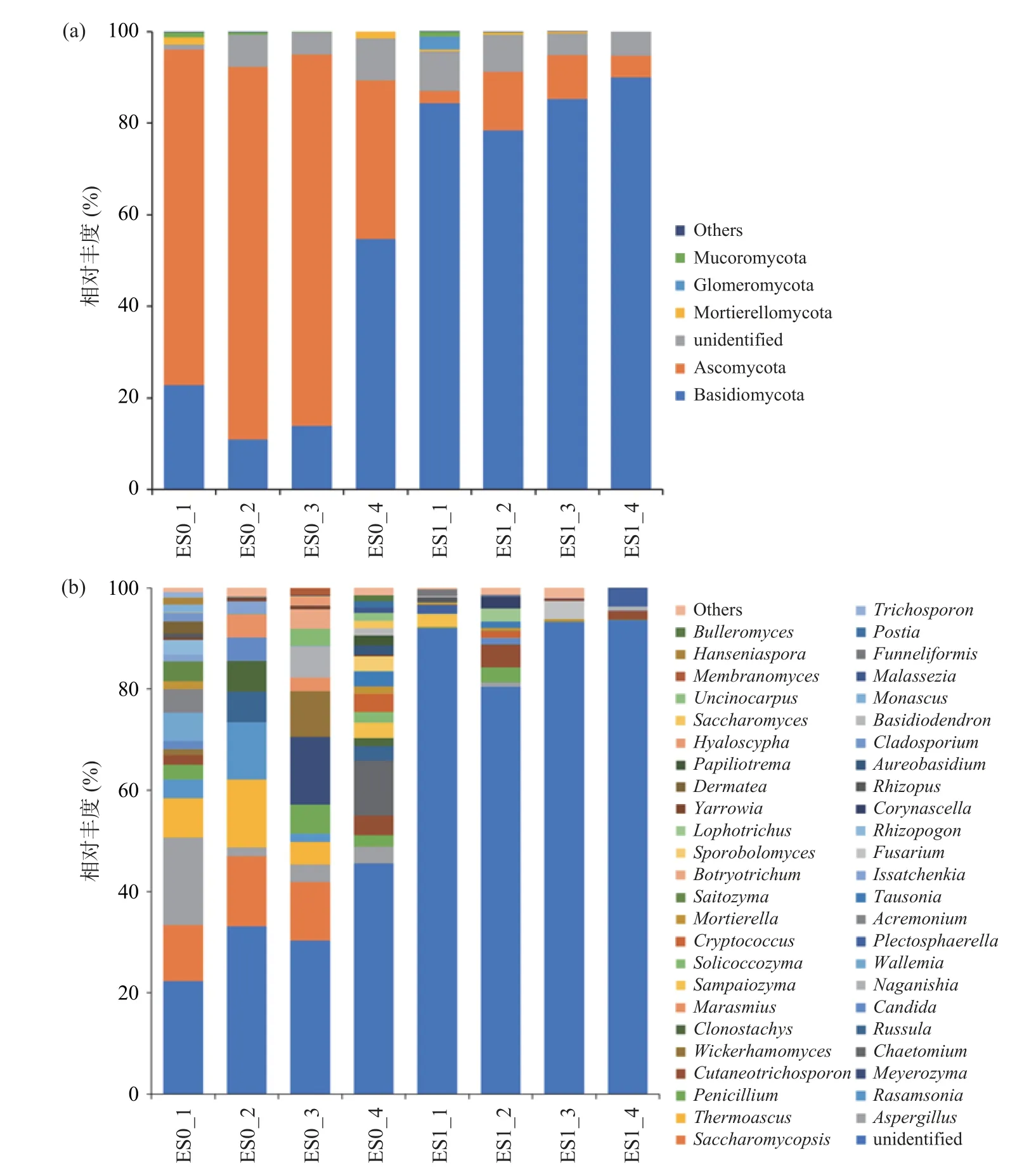
图7 冷等离子体处理前后果蔬冷库环境中真菌门水平(a)和属水平(b)的群落组成Fig.7 Fungal community composition at the level of phylum (a) and genus (b) in cold storage environment before and after cold plasma treatment
如图6所示,在门水平上,冷等离子体处理前后,细菌群落组成中均主要是厚壁菌门(Firmicutes)(83.87%,88.36%)占绝对优势,其次是变形菌门(Proteobacteria)(9.32%,8.78%)。冷等离子体处理后,蓝细菌门(Cyanobacteria)相对丰度由处理前的3.02%降为0。厚壁菌门属于革兰氏阳性菌[27],细胞壁由一层较厚(10~50 nm)的含胞壁酸的肽聚糖构成。变形菌门属于革兰氏阴性菌[28],细胞壁中不含磷壁酸,肽聚糖含量低,较疏松。变形菌门是细菌中最大的一门,包括很多病原菌,如大肠杆菌、沙门氏菌、霍乱弧菌、幽门螺杆菌等著名的种类。蓝细菌门也是一类革兰氏染色阴性菌,与水环境关系密切,可引起淡水水体水华爆发或水质恶化等环境问题[29]。有研究表明,通常等离子体对革兰氏阴性菌的灭活效果要优于革兰氏阳性菌,且细胞壁的厚度与杀灭时间呈正相关[30]。本研究中冷等离子体处理后,变形菌门和蓝细菌门相对丰度下降,而厚壁菌门相对丰度随之有所上升与以上研究结论相符。
在细菌群落属水平上,冷等离子体处理前后均是厚壁菌门的芽孢杆菌属(Bacillus)(78.09%,86.43%)占据优势地位,这与Ye等[5]对冰箱里微生物多样性的研究结果一致,该研究发现不同冰箱里芽孢杆菌属(Bacillus)均为主要优势菌属,相对丰度最高可达85.80%;其次是变形菌门的从毛单孢菌属(Comamonas)(2.22%,2.10%)。冷等离子体处理后,未确定菌属的细菌(unidentified)相对丰度由处理前的4.09%降为0.22%,变形菌门的醋酸杆菌属(Acetobacter)和未培养细菌(uncultured bacterium)分别由处理前的1.42%和1.27%降为0,变形菌门的Acidibacter和不动杆菌属(Acinetobacter)均有所升高,分别由处理前的0.77%和0.54%变为1.94%和1.16%。以上结果表明等离子体对冷库空气中的芽孢杆菌属细菌作用不明显,而对醋酸杆菌属和未培养细菌有明显的灭活作用。Acidibacter和不动杆菌属的升高可能是因为其他菌属的丰度降低而导致其相对丰度相应升高。醋酸杆菌属是一类有较强氧化能力、可使果蔬腐败变质的革兰氏阳性细菌[31],未培养细菌大都是革兰氏阴性的致病菌[29],冷等离子体处理可使这两类细菌相对丰度显著下降,表明其在果蔬采后贮藏保鲜中有良好的应用潜力。
如图7所示,在门水平上,冷等离子体处理前,真菌群落组成中占据优势的是子囊菌门(Ascomycota)(84.50%)和担子菌门(Basidiomycota)(25.59%)。担子菌门真菌种类繁多,可食用与药用的较多,部分可引起植物病害与木材腐烂[32]。子囊菌门真菌可营腐生、寄生和共生,腐生的子囊菌可引起食品腐烂霉变,寄生的子囊菌常引起植物病害[33]。冷等离子体处理后,子囊菌门相对丰度下降为7.46%,担子菌门随之成为主要优势菌门(67.61%)。其中,处理前后未确认分类的真菌均相对较多(unidentified)(5.48%,6.68%)。
在真菌群落属水平上,冷等离子体处理前占据优势地位的是未确定菌属的真菌(unidentified)(32.82%)、复膜孢酵母属(Saccharomycopsis)(9.11%)、曲霉属(Aspergillus)(6.45%)、嗜热子囊菌属(Thermoascus)(6.43%)和Rasamsonia(4.16%)等。冷等离子体处理后,其他优势菌属相对丰度下降,而未确定菌属的真菌仍占据优势地位,且相对丰度随之变为89.80%。表明在真菌群落方面,对冷等离子体敏感的菌属较多。担子菌门的威克汉姆酵母属(Wickerhamomyces)、红菇属(Russula)和小皮伞属(Marasmius)在冷等离子体的作用下相对丰度降为0。子囊菌门的复膜孢酵母属(Saccharomycopsis)、曲霉属(Aspergillus)、嗜热子囊菌属(Thermoascus)、Rasamsonia、青霉菌属(Penicillium)和螺旋聚孢霉属(Clonostachys)也在冷等离子体的作用下大幅度降低。相对丰度变化较大的复膜孢酵母属、曲霉属和嗜热子囊菌属真菌多用于现代发酵工业[34],于果蔬贮藏保鲜有害无益;Rasamsonia是可引起人类侵染性感染、威胁生命的真菌[35];青霉菌属可引起果蔬腐烂霉变及产生毒素[36]。这些真菌属相对丰度的显著降低,表明冷等离子体处理可以一定程度上杀灭冷库环境中植物病原菌及人类致病菌。
2.5 微生物共生网络构建
通过spearman检验方法[37],分别选取细菌和真菌所有样本绝对丰度前20的属水平结果进行相互关联性分析,并以对应的门作为legend,计算所得结果过滤掉P值大于0.05的或相关值|R|<0.6的进行绘图,分别构建了细菌与真菌的共生网络(图8)。不同颜色的节点代表不同的所属门,节点大小代表分类学丰度,红线代表正相关,线的粗细代表相关性的强度,线粗表示相关性较强。

图8 果蔬冷库环境中细菌(a)和真菌(b)共生网络Fig.8 Co-occurrence network of bacteria (a) and fungi (b) in cold storage environment
如图8所示,细菌属共生网络图包含12个节点和11条边,真菌属共生网络图包含10个节点和12条边。可以发现,果蔬冷库微生物之间存在较为紧密的联系,并且都是正相关关系,说明不同的类群之间可能生态位较为相似或彼此之间存在互利共生的关系[38]。细菌属共生网络中连通度较高的主要类群为厚壁菌门和拟杆菌门。水栖菌属(Enhydrobacter)仅与普氏厌氧球菌属(Anaerococcus_provencensis)存在强烈的正相关关系(P<0.01),与之类似的还有葡萄球菌属(Staphylococcus)和拟杆菌属(Bacteroides)。Sedimentibacter不仅与Proteiniborus和未培养细菌(uncultured bacterium)存在强烈的正相关关系,还与醋酸杆菌属(Acetobacter)和Candidatus_Actinomarina存在较强的正相关关系,表明其对果蔬冷库细菌群落结构起着重要作用,且物种间多存在着互利共生关系。真菌属共生网络中只包含两个门类群,其中子囊菌门连通度较高。由真菌属共生网络的节点大小可以明显发现果蔬冷库中真菌类群的丰度显著高于细菌类群。螺旋聚孢霉(Clonostachys)和毛壳菌属(Chaetomium)分别仅与红菇属(Russula)和Sampaiozyma存在正相关关系(P<0.01)。复膜孢酵母属(Saccharomycopsis)、嗜热子囊菌属(Thermoascus)、Rasamsonia和威克汉姆酵母属(Wickerhamomyces)相互之间存在强烈的正相关关系(P<0.01),且连通度均较高,表明这4个菌属呈共生关系,在果蔬冷库真菌群落结构中起着关键作用。
3 结论
通过对冷等离子体处理前后的0 ℃果蔬冷库空气中微生物数量及微生物群落多样性的研究,发现冷等离子体处理后,冷库空气中细菌、真菌数量与群落多样性均显著降低,说明冷等离子体可以应用于果蔬冷库中杀菌消毒,但其对冷库中贮藏期果蔬的影响还有待系统研究。处理前后,真菌群落多样性均高于细菌群落多样性,可能是冷库环境更适合真菌生长或真菌菌群的竞争优势大于细菌菌群。门水平上,冷库空气中的优势细菌为厚壁菌门,优势真菌为子囊菌门(处理前)和担子菌门(处理后)。属水平上,芽孢杆菌属细菌和未确定菌属的真菌始终占据优势地位。群落组成结构的研究表明,冷等离子体处理可有效杀灭醋酸杆菌属和未培养细菌等细菌,复膜孢酵母属、曲霉属、嗜热子囊菌属、Rasamsonia和青霉菌属等真菌,为后续开发冷等离子体广谱抑菌新技术提供了理论基础。网络分析表明,细菌中Sedimentibacter与其他物种存在强烈的相关性,真菌中复膜孢酵母属、嗜热子囊菌属、Rasamsonia和威克汉姆酵母属相互之间存在强烈的相关性,且均为正相关关系。冷库中微生物群落之间的协同关系可能对抑菌剂开发时的应用范围研究有一定的启发。本研究中存在很多未能确定分类的菌属,在微生物分类学意义上还有待深入研究。
