胃癌患者组织中EMT相关蛋白、TGF-β1 mRNA相对表达水平与淋巴结转移的相关性分析*
2022-02-11谢贞兰邢益祥袁小庆
谢贞兰,邢益祥,李 佳,袁小庆,赵 铁
安徽省铜陵市人民医院病理科,安徽铜陵 244009
胃癌在恶性肿瘤中病死率居第2位,多数病死患者合并肿瘤转移[1]。部分胃癌患者早期即可发生淋巴结转移,但有关淋巴结转移的分子及生物学机制尚未明确。既往研究证实,淋巴结转移与肿瘤分化程度、浸润深度等病理特征有关,胃癌组织病理学检查可用于评估胃癌患者淋巴结转移风险[2]。但仅通过肿瘤分化程度、浸润深度评估淋巴结转移风险仍有一定误诊率,还需结合其他手段进一步确诊淋巴结转移,包括影像学检查、内镜检查、病理学检查等[3-4]。在胃癌患者中,胃癌组织中相关因子表达水平已被作为淋巴结转移的辅助诊断手段,但目前已发现的相关分子标志物仍较少,需持续探讨新的分子标志物[5]。研究指出,上皮间质转化(EMT)相关蛋白参与上皮-间质-上皮转化过程,与肿瘤细胞黏附连接丢失相关,可增强肿瘤细胞转移能力[6]。转化生长因子(TGF)-β1可调节细胞增殖、分化,也可影响肿瘤细胞转移[7]。推测二者均与肿瘤患者淋巴结转移有关,但目前有关二者在胃癌组织中的表达及与胃癌患者淋巴结转移的关系尚无较多研究报道。基于此,本研究观察胃癌患者组织中EMT相关蛋白、TGF-β1 mRNA相对表达水平与淋巴结转移的相关性,现报道如下。
1 资料与方法
1.1一般资料 回顾性分析本院2016年1月至2020年11月收治的51例胃癌合并淋巴结转移患者的资料,纳入淋巴结转移组,回顾性分析本院同期收治的51例胃癌未合并淋巴结转移患者的资料,纳入无淋巴结转移组。纳入标准:(1)符合《胃癌规范化诊疗指南(试行)》[8];(2)经病理学检查确诊,胃癌组织学类型均为腺癌;(3)临床资料及病理资料均完整。排除标准:(1)合并胃溃疡;(2)合并其他部位原发肿瘤;(3)合并肾间质、肝、肺纤维化;(4)合并脾功能亢进;(5)合并糖尿病;(6)合并高尿酸血症;(7)合并心血管疾病;(8)合并哮喘。本研究的设计符合伦理学有关规定,经本院医学伦理委员会审核并批准。
1.2方法
1.2.1收集基线资料 回顾性分析患者入院时基线资料,详细记录本研究所需资料,包括年龄、性别、肿瘤最大径、发病部位、病程、肿瘤分化程度、TNM分期[9]、脉管内癌栓,其中肿瘤最大径、发病部位、肿瘤分化程度、TNM分期、脉管内癌栓均根据手术结果及手术标本病理学检查结果评估。
1.2.2EMT相关蛋白检测 取手术标本进行EMT相关蛋白检测,EMT相关蛋白包括E-钙黏蛋白(E-cadherin)、波形蛋白(Vimentin)、β-链蛋白(β-catenin)等,选取E-cadherin、Vimentin、β-catenin进行评估。试剂盒均由南京凯基生物技术发展有限公司提供。将组织剪碎后充分研磨,采用全蛋白提取试剂盒提取蛋白,采用聚丙烯酰胺凝胶电泳技术分离蛋白质,将蛋白质转移至聚偏二氟乙烯膜上。用5%脱脂奶粉37 ℃封闭1 h,TBST洗涤3次(每次5 min),加入稀释兔抗人E-cadherin、Vimentin、β-catenin单克隆抗体[赛默飞世尔(中国)有限公司],4 ℃孵育过夜,TBST洗涤3次(每次5 min),加入辣根过氧化物酶标记山羊抗兔抗体[赛默飞世尔(中国)有限公司],室温下反应1 h,TBST洗涤3次(每次5 min)。采用增强化学发光试剂盒对组织进行增强化学发光,反应体系严格按照说明书进行。采用以色列DNR公司Micro Chemi型化学发光凝胶成像系统观察、拍照。采用Quantity One软件分析蛋白条带,计算吸光度(A)值,以检测A值/内参照磷酸甘油醛脱氧酶A值作为EMT相关蛋白相对表达水平。
1.2.3TGF-β1 mRNA相对表达水平检测 取手术标本进行TGF-β1 mRNA相对表达水平检测,试剂盒均由上海研生生化试剂有限公司提供。碾碎组织,加入裂解液,采用总RNA试剂盒提取RNA,操作按照试剂盒说明书进行。提取RNA后,检测纯度,通过紫外分光光度法检测A值,波长取260和280 nm,满足A260/A280>1.80为合格。取1 μL RNA,采用反转录试剂盒进行反转录。采用荧光定量试剂盒对TGF-β1 mRNA相对表达水平进行定量检测,探针由美国Bioserch-MC公司合成,探针序列为5′-FAM-CGG ACC TTG TG-CAA CTC TCC ACC TCC-TAMRA-3′,反应体系严格按照说明书进行,检测方法为实时荧光定量PCR,采用2-ΔΔCt方法计算TGF-β1 mRNA相对表达水平。
1.2.4相关性评估 记录经手术标本病理学检查结果确诊患者淋巴结转移情况。采用回归分析检验患者肿瘤分化程度、TNM分期、脉管内癌栓、EMT相关蛋白、TGF-β1 mRNA相对表达水平与淋巴结转移的关系,并分析患者胃癌组织中EMT相关蛋白、TGF-β1 mRNA相对表达水平对淋巴结转移的预测效能。

2 结 果
2.1淋巴结转移组和无淋巴结转移组基线资料比较 淋巴结转移组不同肿瘤分化程度、TNM分期、脉管内癌栓的患者例数与无淋巴结转移组比较,差异均有统计学意义(P<0.05);淋巴结转移组E-cadherin相对表达水平低于无淋巴结转移组,Vimentin、β-catenin及TGF-β1 mRNA相对表达水平高于无淋巴结转移组(P<0.05);两组年龄、性别、肿瘤最大径、发病部位、病程比较,差异无统计学意义(P>0.05)。见表1。

表1 淋巴结转移组和无淋巴结转移组基线资料比较
2.2回归分析检验患者各主要指标或变量与淋巴结转移的关系 将初步基线资料比较结果显示差异有统计学意义的肿瘤分化程度、TNM分期、脉管内癌栓、E-cadherin、Vimentin、β-catenin及TGF-β1 mRNA相对表达水平作为自变量并说明,见表2,将淋巴结转移情况作为因变量(1=淋巴结转移,0=无淋巴结转移),经回归分析检验结果显示,胃癌患者肿瘤分化情况、病理分期、脉管内癌栓情况、胃癌组织内E-cadherin相对表达水平、Vimentin、β-catenin及TGF-β1 mRNA相对表达水平均与患者淋巴结转移有关(P<0.05);肿瘤低分化,TNM分期Ⅲ~Ⅳ期,有脉管内癌栓,胃癌组织中Vimentin、β-catenin及TGF-β1 mRNA相对表达水平升高均是淋巴结转移的风险因子(OR>1,P<0.05);胃癌组织中E-cadherin相对表达水平升高是淋巴结转移的保护因子(OR<1,P<0.05)。见表3。

表2 自变量赋值情况
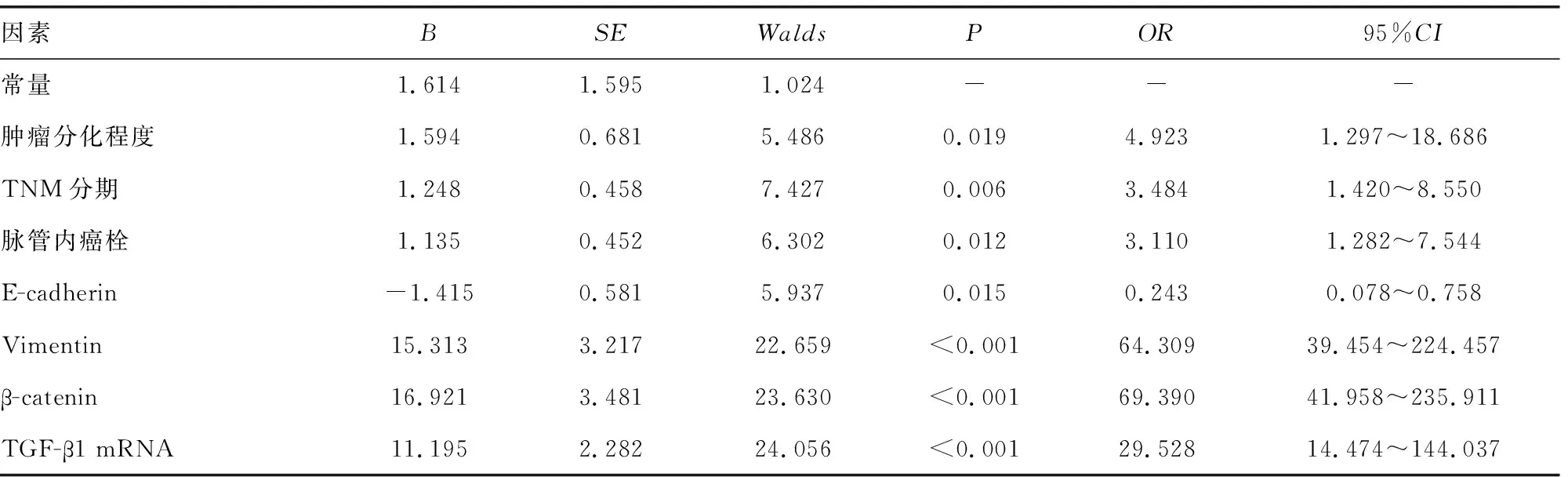
表3 回归分析检验患者肿瘤分化程度、TNM分期、脉管内癌栓、胃癌组织中EMT相关蛋白、TGF-β1 mRNA相对表达水平与淋巴结转移的关系
2.3胃癌组织中EMT相关蛋白、TGF-β1 mRNA相对表达水平预测淋巴结转移风险的ROC曲线分析结果 胃癌组织中E-cadherin、Vimentin、β-catenin、TGF-β1 mRNA相对表达水平用于预测淋巴结转移的AUC分别为0.863、0.833、0.831、0.838,AUC均>0.800,均有一定预测效能;最佳截断值分别取0.555、0.565、0.515、0.865时可以获得最佳预测效能,见表4、图1。

表4 胃癌组织中EMT相关蛋白、TGF-β1 mRNA相对表达水平预测淋巴结转移的效能比较

图1 胃癌组织中EMT相关蛋白、TGF-β1 mRNA相对表达水平预测淋巴结转移的ROC曲线图
3 讨 论
胃癌淋巴结转移是一个复杂的过程,涉及多步骤,包括肿瘤细胞恶变、侵袭、浸润等。患者出现淋巴结转移后,行手术及放化疗的难度增加,治疗后患者仍有较高的复发及转移风险,且短期生存情况不理想[10]。因此,及时预测、诊断淋巴结转移,并实施针对性治疗尤为必要。
有研究指出,胃癌患者肿瘤分化程度、临床分期、脉管内癌栓等病理特征均与淋巴结转移相关[11-12]。本研究初步比较发生与未发生淋巴结转移患者的资料后行Logistic回归分析结果显示,胃癌患者肿瘤低分化,TNM分期Ⅲ~Ⅳ期,有脉管内癌栓,胃癌组织中E-cadherin相对表达水平降低,Vimentin、β-catenin及TGF-β1 mRNA相对表达水平升高均与患者淋巴结转移有关,可能是胃癌患者淋巴结转移的风险因子。说明除病理特征外,胃癌组织中EMT相关蛋白、TGF-β1 mRNA相对表达水平也与淋巴结转移密切相关,胃癌患者若Vimentin、β-catenin及TGF-β1 mRNA相对表达水平升高可能提示淋巴结转移高风险。既往临床常采用肿瘤分化程度、TNM分期、脉管内癌栓评估淋巴结转移风险[13-16]。肿瘤分化程度可反馈癌细胞与其起源细胞的结构差异,分化程度越低的患者,肿瘤恶性程度越高,侵袭及浸润风险高,易累及淋巴结[13]。TNM分期可反馈肿瘤侵袭程度,分期Ⅲ~Ⅳ期患者的肿瘤侵袭程度较高,可侵袭黏膜下层,黏膜下层有丰富淋巴管及毛细血管,肿瘤可随淋巴管及毛细血管转移至淋巴结[14]。脉管内癌栓被作为多种肿瘤淋巴结转移的独立危险因素,存在脉管内癌栓的胃癌患者,胃壁淋巴管网受癌细胞侵犯,易发生淋巴结转移[15-16]。但上述特征仍难以准确反馈患者淋巴结转移情况,还可在此基础上结合淋巴结转移可能的风险因子,作为辅助预测与诊断的手段。
EMT是肿瘤转移重要机制之一,表现为肿瘤上皮细胞受细胞外因子刺激后,失去极性,转化为间质细胞,迁移和运动能力增强,因此肿瘤易发生转移[17]。EMT相关蛋白中,E-cadherin在胃癌患者中呈表达降低,主要原因在于胃癌发病后,黏附分子及基因表达改变,启动子胞嘧啶-磷酸-鸟嘌呤基序岛区过度甲基化,活性氧化物、TGF-β、凋亡信号传导途径基因升高,造成E-cadherin失活。而E-cadherin具有维持细胞和细胞间连接的作用,若E-cadherin表达降低,可使肿瘤细胞间黏附作用降低或丧失,肿瘤细胞易从原发灶脱落分离,转移到局部淋巴结,最终造成淋巴结转移[18]。Vimentin具有多种功能,其表达升高时可降低细胞表面E-cadherin水平,抑制E-cadherin促进细胞黏附作用,加速肿瘤从原发病灶处脱落[19]。此外,Vimentin表达升高可激活C-src原癌基因,C-src可进一步使限速酶己糖激酶磷酸化,为肿瘤细胞提供充足能量,为肿瘤转移提供有利条件,因此,肿瘤发生淋巴结转移的风险较高。而β-catenin则能与E-cadherin共同作用,形成复合物,发挥稳定E-cadherin结构、促进肿瘤细胞黏附的作用。当β-catenin表达升高时,复合物形成出现异常,肿瘤细胞难以紧密黏附,因此更易发生转移[20]。此外,β-catenin表达升高时,可影响β-catenin/TCF信号途径,促进细胞外基质蛋白表达,造成肿瘤细胞过度增殖,淋巴结转移风险高。TGF-β1 mRNA表达升高可反馈为肿瘤细胞中TGF-β1功能增强。TGF-β1是重要组织修复因子,具有调节细胞增殖、分化的功能。在胃癌患者中,TGF-β1可抑制免疫细胞,促使肿瘤发生免疫逃逸。此外,TGF-β1还可通过升高LMO1基因表达,促进肿瘤细胞发生EMT改变,并可促进血管内皮生长因子表达,诱导肿瘤血管生成,从而增加肿瘤侵袭、转移能力,导致淋巴结转移风险增加[21]。
结合回归分析结果与各项主要指标增加淋巴结转移风险的机制,推测胃癌患者组织中EMT相关蛋白、TGF-β1 mRNA相对表达水平对淋巴结转移有一定预测甚至诊断效能。绘制ROC曲线发现,胃癌组织中E-cadherin、Vimentin、β-catenin、TGF-β1 mRNA相对表达水平用于预测淋巴结转移的AUC均>0.800,均有一定预测效能,证实推测成立。临床可结合患者病理特征与胃癌组织EMT相关蛋白、TGF-β1 mRNA相对表达水平,预测患者淋巴结转移风险,若淋巴结转移风险较高,可于根治术中实施淋巴结清扫,并于术后实施强化放化疗,以预防肿瘤复发及转移。但因本研究未能探讨癌胚抗原、糖类抗原125、糖类抗原199等血清肿瘤标志物水平,结论尚有局限,还应在未来增加上述指标进行研究,全面分析与胃癌患者淋巴结转移相关的多种指标,进一步提高对胃癌患者淋巴结转移的预测与诊断特异度及灵敏度,对指导治疗具有积极意义。
综上所述,胃癌患者组织中EMT相关蛋白、TGF-β1 mRNA相对表达水平与淋巴结转移密切相关,癌组织中E-cadherin相对表达水平降低,Vimentin、β-catenin及TGF-β1 mRNA相对表达水平升高可增加淋巴结转移风险,且上述指标均可用于预测患者淋巴结转移,为淋巴结清扫术及术后强化放化疗的实施提供参考。
