PTA术后的维持性血液透析患者血清生物标志物水平变化对肺动脉压影响的研究
2022-02-11刘伊芳施文剑欧阳沙西
陈 娟,刘伊芳,施文剑,陈 钰,欧阳沙西
湖南师范大学附属第一医院/湖南省人民医院肾内科,湖南长沙 410000
近年来,肺动脉高压(PH)成为慢性肾脏病(CKD)患者的新威胁之一。据统计,CKD患者中PH的发病率为30%~50%[1-2]。与CKD 1~5期患者相比,在接受透析的终末期肾病(ESRD)患者中,合并PH的患者死亡风险更高[3]。PH的病因尚未完全阐明,肺血流量增加和肺血管阻力增加是PH发生的两个主要机制[4]。内皮细胞和平滑肌细胞是两种重要的细胞类型,在PH的病理生理学中起着重要作用。内皮细胞可以通过释放内皮素-1(ET-1)和一氧化氮(NO)等生物活性物质来调节平滑肌细胞的功能[5],NO等血管扩张剂的产生受损,以及ET-1等血管收缩剂的过度表达,增加肺血管阻力,促进血管重塑,导致肺动脉压(PAP)升高[6-8]。有研究报道,透析年限的延长、贫血、钙磷代谢紊乱、炎症状态等为PH发生的独立危险因素[9-11]。本研究以本院收治的动静脉内瘘(AVF)闭塞的维持性血液透析(MHD)患者为研究对象,探讨血清ET-1和NO等血清生物标志物对MHD患者PAP的影响,以期为防治PH的研究提供新思路。
1 资料与方法
1.1一般资料 选取2019年9月至2021年3月本院收治的50例AVF闭塞的MHD患者作为研究对象并进行分析,其中40例患者自愿行经腔内血管成形术(PTA),37例PTA成功,3例失败。PTA成功的37例设为PTA组,PTA失败3例与其余10例患者(共13例)转为隧道式中心静脉导管(CVC)术,设为CVC组。纳入标准[12]:(1)年龄≥18岁;(2)符合血液透析相关适应证;(3)自体AVF为唯一血管通路;(4)目标PTA术前自体AVF建立≥60 d;(5)AVF闭塞性病变以AVF无震颤,杂音消失,肱动脉血流量<250 mL/min为标准;(6)临床资料完善,依从性强,按要求定期随访。排除标准[13]:(1)射血分数<50%的左心收缩功能受损;(2)中度至重度左心瓣膜疾病(包括二尖瓣、主动脉瓣的狭窄和关闭不全);(3)心脏瓣膜置换史或心脏和(或)肺移植史;(4)患晚期实质性肺部疾病或慢性血栓栓塞性肺动脉高压;(5)合并恶性肿瘤、房颤、下肢静脉血栓;(6)随访期间更改血管通路、透析方式或肾移植;(7)原发病或并发结缔组织疾病;(8)患肝硬化、门脉高压症及睡眠呼吸低通气综合征;(9)不能完成随访。本研究经本院伦理委员会批准通过,所有患者知情并同意。
1.2方法
1.2.1临床资料收集 收集并记录患者的年龄、性别、身高、体质量指数、收缩压、舒张压、心率、MHD时间、吸烟史、钙(Ca)、ET-1、血红蛋白(Hb)、低密度脂蛋白(LDL)、NO2+NO3、磷(P)、甲状旁腺素(PTH)、三酰甘油(TG)、清蛋白(ALB)、B型钠尿肽(BNP)、C反应蛋白(CRP)等指标。
1.2.2血清ET-1和NO水平检测 入组测试者在早晨7:00抽取静脉血4 mL,乙二胺四乙酸(EDTA)抗凝,静置30 min后以速度4 000 r/min离心10 min,离心完成后收集上清液。采用酶联免疫吸附试验(ELISA)法检测患者血清ET-1水平。ELISA试剂盒由上海茁彩生物科技有限公司提供(货号:ZC-34232),严格按照试剂盒说明书进行操作。采用亚硝酸盐还原酶比色法检测患者血清NO水平。因NO本身半衰期极短,血液中的NO主要由血管内皮细胞、血管平滑肌细胞、血小板、巨噬细胞等产生亚硝酸盐(NO2+NO3),通过其水平可以间接了解NO水平。样品的处理过程:取出50 μL标本,以12 000 r/min的转速离心5 min,离心结束后取上清液。将标准品亚硝酸钠稀释到60 μL。随后定容、取样、温育、比色,最后在波长540 nm的分光光度计中进行测量,按照标准品曲线计算NO2+NO3水平。
1.2.3手术方法 患者取平卧位,内瘘侧肢体外旋外展,应用Logiqe超声诊断仪(美国GE Healthcare公司)及S7直线型探头(频率8~12 MHz)探查,确定狭窄部位,超声引导下以距离狭窄部位5 cm以上的内瘘血管为穿刺点顺向或逆向穿刺,置入血管鞘后,超声引导下置入导丝,导丝尖端越过狭窄处后将合适大小的球囊(直径为狭窄部位血管邻近正常血管内径的1.1倍,一般为4~7 mm)置入狭窄部位,压力泵逐渐加压至狭窄血管完全打开,重复3~4次后拔出血管鞘,压迫止血15~20 min。PTA成功的判定标准[14]:PTA治疗后残余血管狭窄<30%定义为技术成功;术后成功使用AVF血液透析1次,透析过程中血流量>200 mL/min定义为临床成功。PTA由同一组医师实施。

2 结 果
2.1患者一般资料比较 两组患者在年龄、性别、MHD时间、是否吸烟、体质量指数、收缩压、舒张压、心率、ALB、BNP、Ca、CRP、ET-1、Hb、LDL、NO2+NO3、P、PTH、TG一般资料比较差异无统计学意义(P>0.05),见表1。

表1 PTA组和CVC组一般资料的比较结果或n/n)

组别n收缩压(mm Hg)舒张压(mm Hg)心率(次/分)ALB(g/L)BNP(ng/mL)PTA组37147.73±20.4183.51±17.4576.59±21.4436.05±12.0314 124.04±4 725.45CVC组13148.25±21.7784.55±18.4475.89±23.4535.89±11.7813 978.23±4 718.44t/χ20.0990.2490.1340.0580.153P0.9210.8040.8940.9540.879

组别nCa(mmol/L)CRP(mg/L)ET-1(pg/mL)Hb(g/L)LDL(mmol/L)PTA组372.21±0.8215.64±4.8896.24±31.6398.03±30.451.77±0.62CVC组132.34±0.7815.89±5.45116.72±41.3197.54±28.451.74±0.58t/χ20.7940.2080.4650.1080.215P0.4300.8360.6430.9140.830
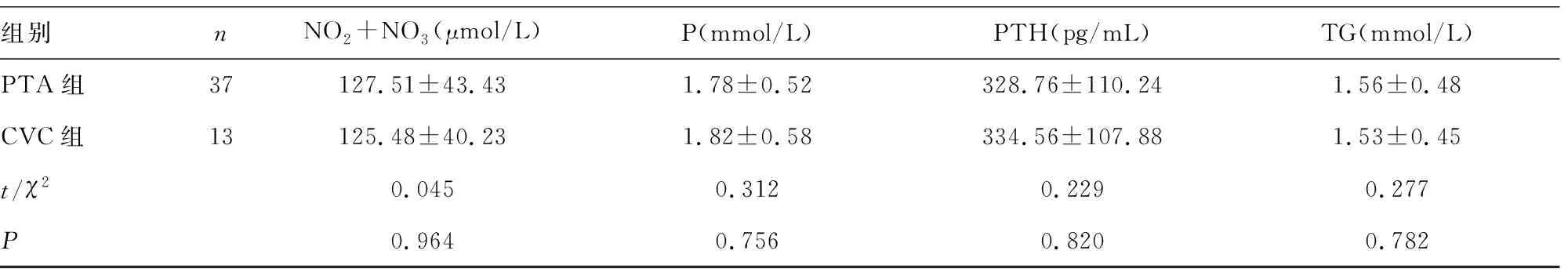
组别nNO2+NO3(μmol/L)P(mmol/L)PTH(pg/mL)TG(mmol/L)PTA组37127.51±43.431.78±0.52328.76±110.241.56±0.48CVC组13125.48±40.231.82±0.58334.56±107.881.53±0.45t/χ20.0450.3120.2290.277P0.9640.7560.8200.782
2.2PTA组与CVC组手术前后PH发生率的对比结果 PTA组术前PH发生率为59.50%,与术前相比,PTA组术后24 h PH发生率明显提高(P<0.05),但术后1个月两组差异无统计学意义(P>0.05);CVC组术前PH发生率为61.50%,与术前相比,CVC组术后24 h和术后1个月的PH发生率差异均无统计学意义(P>0.05),见图1。

图1 PTA组与CVC组PH发生率对比图
2.3关于PAP、ET-1和NO2+NO3水平在PTA组手术前后的比较 PTA组中,术后24 h PAP和ET-1水平明显高于术前和术后1个月(P<0.05),术后24 h的NO2+NO3水平明显低于术前和术后1个月(P<0.05),见表2。
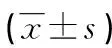
表2 PTA组PAP、ET-1、NO2+NO3水平术前、术后比较
2.4ET-1、NO2+NO3和MHD时间等因素与PAP的相关性分析 经Spearman相关分析发现,在PTA组中,Hb、NO2+NO3与PAP呈负相关(r=-0.684、-0.633,P<0.05),CRP、ET-1、P、MHD时间与PAP呈正相关(r=0.622、0.589、0.547、0.541,P<0.05),见表3。

表3 各因素与PAP的Spearman相关性分析结果
2.5Logistic回归分析 以PAP为因变量,将单因素中差异有统计学意义的因素纳入为自变量到多因素Logistic回归分析中,分析发现低水平Hb和高水平CRP是PTA组患者发生PH的独立危险因素(P<0.05),见表4。

表4 PTA组患者发生PH的多因素Logistic回归分析
2.6ROC曲线分析 使用ROC曲线评价Hb和CRP预测PTA组发生PH的价值。Hb预测PTA组发生PH的最佳截断值为119.5 g/L,AUC为0.692(95%CI:0.130~0.485,P<0.05)。CRP预测PTA组发生PH的最佳截断值为9.715 mg/L,AUC为0.594(95%CI:0.400~0.788,P<0.05)。Hb和CRP联合检测预测PTA组发生PH的AUC为0.712(95%CI:0.641~0.726,P<0.05)。见图2。

注:A为应用Hb预测PTA组发生PH的ROC曲线;B为应用CRP预测PTA组发生PH的ROC曲线;C为应用Hb和CRP联合预测PTA组发生PH的ROC曲线。
3 讨 论
PH是一种进行性、致命性的疾病,最终可导致右心衰竭。研究报道,长期接受MHD治疗的患者由于AVF的使用致使其心输出量提高,回心血量骤增,从而导致肺血管阻力增加,因此容易引发PH[15]。CKD患者发生 PH的机制尚未完全明确,有以下几个可能的病理生理机制:内皮功能受损、血清NO的生物学功能下降、血清ET-1水平升高、与AVF有关或无关的心排出量增大和容量负荷过多[16-18]。其中肺血管内皮功能障碍在PH的发展过程中起着关键作用,特征是NO等血管扩张剂的产生受损,以及ET-1等血管收缩剂的过度表达,增加肺血管阻力,促进血管重塑,导致PAP升高[6-7]。
既往研究显示,PH在CKD患者中有30%~50%的发病率[1-2]。本研究中,37例PTA组患者术前PH的发生率为59.50%,术后24 h PH的发生率增至81.80%,在随访1个月后PH发生率为62.10%。在13例CVC组患者中,术前PH的发生率为61.50%,而术后24 h及术后1个月的发生率均较PTA组降低。比较PTA组患者术前、术后的ET-1、NO等血液学指标,结果显示PTA组患者术后24 h的PAP、ET-1水平明显高于术前和术后1个月,而NO水平明显低于术前和术后1个月。说明PTA组患者术后24 h血清中ET-1水平的增加和NO水平的减少是导致术后PAP增高的主要因素。血清ET-1和NO参与PH的发生和发展过程,其原因可能为血清ET-1水平的增加及NO水平的减少增加肺血管阻力,促进血管重塑,最终导致PAP升高。而术后1个月,PTA组患者的PAP、ET-1、NO水平与术前比较差异无统计学意义(P>0.05),提示在PTA开通闭塞AVF的短时间内,血清ET-1和NO水平的改变可以影响PAP。
近年来,有研究证实CKD患者体内普遍存在的持续微炎症状态是导致心血管疾病的主要原因[19]。经Spearman相关性分析发现,MHD时间、P、CRP、ET-1水平与PAP呈正相关,而Hb、血清NO水平与PAP呈负相关。因此,本研究结果表明PH的发生可能与炎症状态、贫血、CKD矿物质和骨代谢异常及内皮功能障碍等因素有关,这与以往研究结果一致[20]。贫血使机体缺氧,长期缺氧可导致肺血管内皮细胞功能紊乱,肺血管收缩,血管平滑肌细胞增生,肺血管阻力增加,PAP升高[11]。同时,缺氧引起交感神经系统兴奋,心率加快,心输出量增加,肺血流量增加,如超出肺循环的代偿能力则引起PAP升高[21]。
Logistic回归分析结果表明,低水平Hb和高水平CRP是PTA组患者发生PH的独立危险因素,但是ET-1和NO水平不是其发生PH的独立危险因素,说明血清ET-1和NO水平虽然可能是影响PAP的因素,但由于血液中成分众多,ET-1和NO并不是改变PAP的独立危险因素。ROC曲线分析结果表明,当Hb为119.5 g/L及CRP为9.715 mg/L时对PTA术后MHD患者发生PH的预测效能最高。另外,Hb和CRP二者联合检测对预测PTA术后MHD患者发生PH的AUC大于二者单项检测,提示二者联合检测对预测PTA术后MHD患者PH的发生具有重要的意义。
CKD患者发生PH可导致其心脏结构的变化,逐渐引起左心室舒张及收缩功能异常。MHD时间、P、CRP、ET-1、Hb、NO水平与PAP存在显著相关性,且Hb和CRP联合检测对预测PTA术后MHD患者发生PH有一定的临床意义。但本研究为单中心前瞻性研究,样本量较小,随访时间较短,混杂因素较多,且未做药物干预试验,关于纠正贫血、抗炎等治疗能否改善PTA术后MHD患者发生PH的风险未做进一步研究。因此,还需要更多样本量和更严谨的设计来进一步证实。
