血清IL-31、IL-33水平与中晚期子宫内膜癌患者新辅助化疗效果的关系*
2022-02-11何宏月任小苗
何宏月,任小苗
西安市人民医院妇产科,陕西西安 710000
子宫内膜癌因早期临床症状不明显,且发病隐匿,多数患者在确诊时已进展至中晚期,治疗难度增加,即便是符合新辅助化疗适应证,也仍有部分患者会出现化疗无效的情况[1]。因此,早期准确预测中晚期子宫内膜癌患者新辅助化疗无效风险尤为关键。研究发现,人附睾分泌蛋白E4和糖类抗原(CA125)等均可用于诊断子宫内膜癌,但需要注意的是,该研究仅仅针对诊断[2]。白细胞介素-31(IL-31)主要由CD4+T细胞产生,能够促使机体中血管内皮因子呈过表达状态[3]。此外,有研究证实,IL-31的表达与上皮性卵巢癌的发生及发展密切相关[4]。白细胞介素-33(IL-33)可经ST2受体传导,诱发新生血管生成[5]。有文献指出,IL-33在胃癌组织中呈过表达状态,且与胃癌患者的预后有关[6]。结合上述IL-31、IL-33在肿瘤疾病中的表达特点,推测血清IL-31、IL-33异常表达可能与子宫内膜癌患者新辅助化疗效果有关,但尚未被证实。基于此,本研究主要分析血清IL-31、IL-33与子宫内膜癌患者新辅助化疗效果的关系。现报道如下。
1 资料与方法
1.1一般资料 本研究内容经西安市人民医院医学伦理委员会批准同意实施,且患者及其家属均知晓并签署知情同意书。选取2017年1月至2020年1月于本院接受新辅助化疗的123例中晚期子宫内膜癌患者作为研究对象。纳入标准:(1)经诊断性刮宫病理检查确诊为中晚期子宫内膜癌。(2)接受新辅助化疗。(3)Ⅱ~Ⅳ期。(4)符合新辅助化疗适应证[7](①Ⅱ~Ⅳ期患者;②经影像学或腹腔镜下探查初步评估难以实现满意的肿瘤细胞减灭术的Ⅳ期患者;③合并严重内科疾病,或体能状态差,不能耐受侵袭性手术者)。排除标准:(1)合并心、肝、肾等器官功能不全或衰竭;(2)合并其他恶性肿瘤;(3)合并严重传染性疾病或感染性疾病;(4)合并免疫系统疾病;(5)存在其他子宫内膜癌的高危因素(如肥胖、高血压、糖尿病、多囊卵巢等);(6)既往有放化疗史。123例子宫内膜癌患者年龄59~66岁;绝经年龄45~50岁;分化程度:低分化37例,中分化53例,高分化33例。
1.2方法
1.2.1新辅助化疗方法 全部患者均接受AP方案(阿霉素+顺铂化疗),每3周为1个化疗周期,均化疗3个周期。
1.2.2化疗效果评价及分组方法 全部患者均于化疗3个周期后观察至少1个月,根据文献[8]评估疗效,完全缓解为所有患者病变部位完全消失,维持时间>1个月;部分缓解为病变部位最大横径与最大直径相乘的缩小程度≥50%,维持时间>1个月;疾病稳定为病变部位最大横径与最大直径相乘的缩小程度<50%,维持时间>1个月;疾病进展为出现新病灶或病变部位最大横径与最大直径相乘的增大程度≥25%。临床缓解率=[(完全缓解人数+部分缓解人数)/总人数]×100%。将完全缓解、部分缓解患者纳入缓解组,疾病稳定、疾病进展患者纳入无效组。
1.2.3一般资料收集方法 采用医院自制基线资料调查量表调查两组患者的一般资料,Cronbach′s α系数为0.86,重测效度为0.88,包括年龄、妊娠次数(>3次、≤3次)、分娩次数(>2次、≤2次)、初始月经来潮年龄(≤13岁、>13岁)、绝经年龄。
依据穿刺活检结果,并结合《临床肿瘤学》[9]明确肿瘤分布形态(弥漫型、局限型),淋巴结转移(有、无),病理类型(腺癌、鳞癌、其他),肌层浸润程度(Ⅰa、Ⅰb、Ⅰc),分化程度(低分化、中分化、高分化),病理分期(Ⅱ期、Ⅲ期、Ⅳ期)。
1.2.4实验室指标检测方法 分别于两组患者接受新辅助化疗当天早晨抽取患者空腹外周静脉血5 mL,使用TD5A自动脱盖离心机(长沙英泰仪器有限公司)取血清。缺氧诱导因子1α(HIF-1α):以5 000 r/min的速度离心10 min后取血清,经酶联免疫吸附试验(ELISA)检测。血管内皮生长因子(VEGF):以3 000 r/min的速度离心15 min后取血清,经ELISA检测。IL-31、IL-33:以2 500 r/min的速度离心10 min后取血清,经ELISA检测。ELISA试剂盒均由合肥莱尔生物科技有限公司提供。
1.3统计学处理 采用SPSS24.0软件进行数据处理及统计分析,全部计量资料均经Shapiro-Wilk正态性检验,偏态分布的计量资料以M(P25,P75)表示,组间比较采用Mann-WhitneyU检验;计数资料用频数或百分比表示,组间比较采用χ2检验,等级资料采用秩和检验。偏态分布变量间的相关性采用双变量Spearman直线相关性分析。采用Logistic回归分析各指标与子宫内膜癌化疗无效的关系。绘制受试者工作特征(ROC)曲线,评估主要指标预测子宫内膜癌患者化疗无效风险的价值,以曲线下面积(AUC)评价,AUC≤0.500为无预测价值,0.500
2 结 果
2.1新辅助化疗效果 123例中晚期子宫内膜癌患者经新辅助化疗3个周期后,缓解组89例(72.36%)中完全缓解6例,部分缓解83例;无效组34例(27.64%)中疾病稳定24例,疾病进展10例。
2.2无效组与缓解组基线资料、实验室指标水平比较 两组年龄、妊娠次数、分娩次数、初始月经来潮年龄、绝经年龄、肿瘤分布形态、淋巴结转移、病理类型、肌层浸润程度、分化程度、病理分期比较,差异均无统计学意义(P>0.05);无效组血清HIF-1α、VEGF、IL-31、IL-33水平均高于缓解组(P<0.05)。见表1。
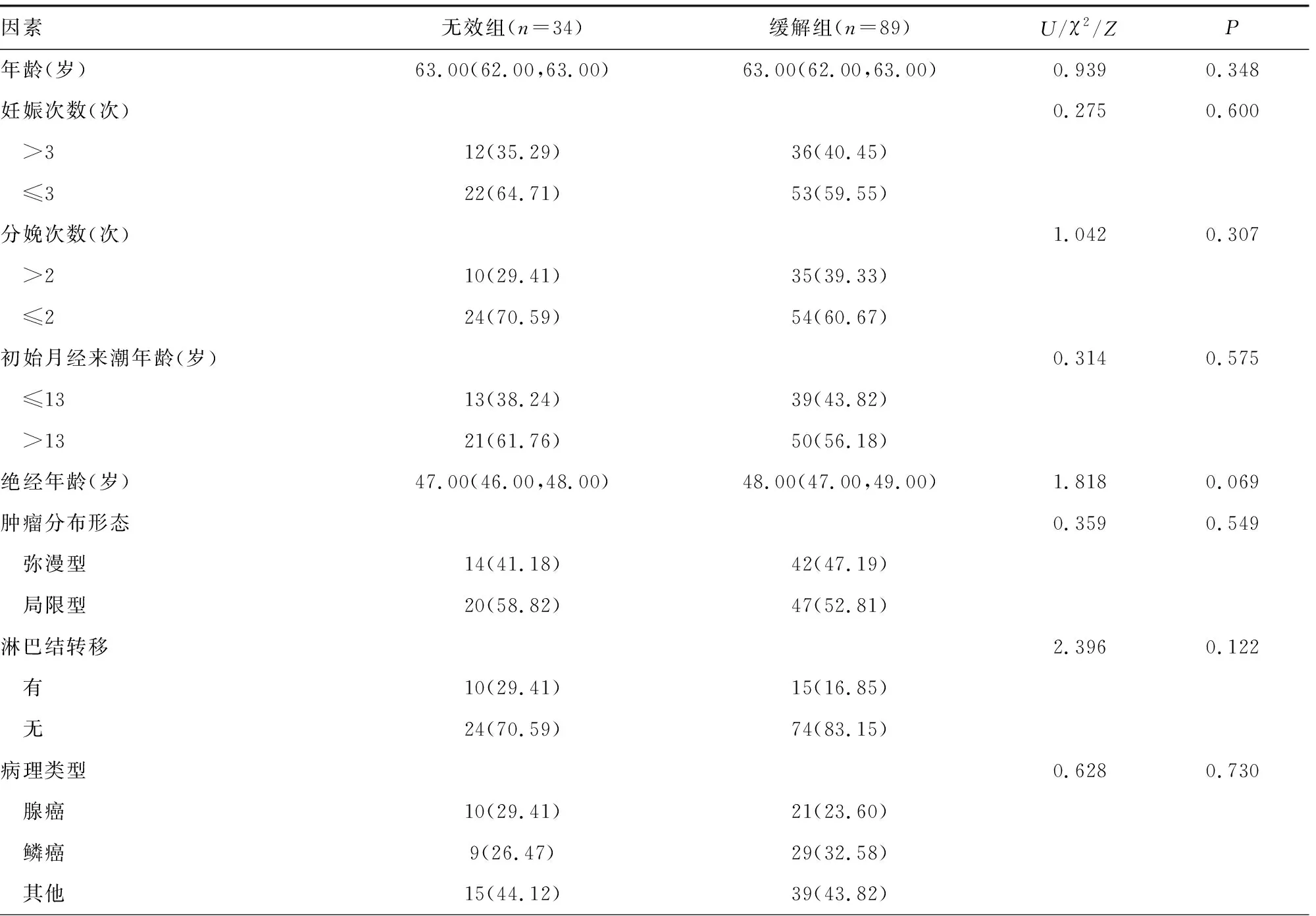
表1 无效组与缓解组基线资料、实验室指标水平比较[M(P25,P75)/n(%)]

续表1 无效组与缓解组基线资料、实验室指标水平比较[M(P25,P75)/n(%)]
2.3各指标与中晚期子宫内膜癌患者化疗无效关系的Logistic回归分析 将中晚期子宫内膜癌患者化疗前血清HIF-1α、VEGF、IL-31、IL-33水平分别作为协变量,化疗效果作为因变量(1=无效,0=缓解),经二元回归分析后将2.2中全部资料纳入,建立多元Logistic回归模型,结果显示,化疗前血清HIF-1α、VEGF、IL-31、IL-33与中晚期子宫内膜癌患者化疗无效有关,HIF-1α、VEGF、IL-31、IL-33过表达可能是中晚期子宫内膜癌患者化疗无效的风险因子(OR>1,P<0.05)。见表2。

表2 各指标与中晚期子宫内膜癌患者化疗无效关系的Logistic回归分析
2.4各项指标预测中晚期子宫内膜癌患者化疗无效风险的效能分析 将中晚期子宫内膜癌患者化疗前血清HIF-1α、VEGF、IL-31、IL-33水平分别作为检验变量,化疗效果作为状态变量(1=无效,0=缓解),绘制ROC曲线,结果显示,化疗前血清HIF-1α、VEGF、IL-31、IL-33水平分别预测中晚期子宫内膜癌患者化疗无效风险的AUC均>0.800,预测价值均较理想,见图1。依据ROC曲线得出,化疗前血清HIF-1α、VEGF、IL-31、IL-33的最佳截断值分别为51.410 ng/L、233.597 pg/mL、170.991 pg/mL、108.163 pg/mL。见表3。

图1 各项指标预测中晚期子宫内膜癌患者化疗无效风险的ROC曲线图
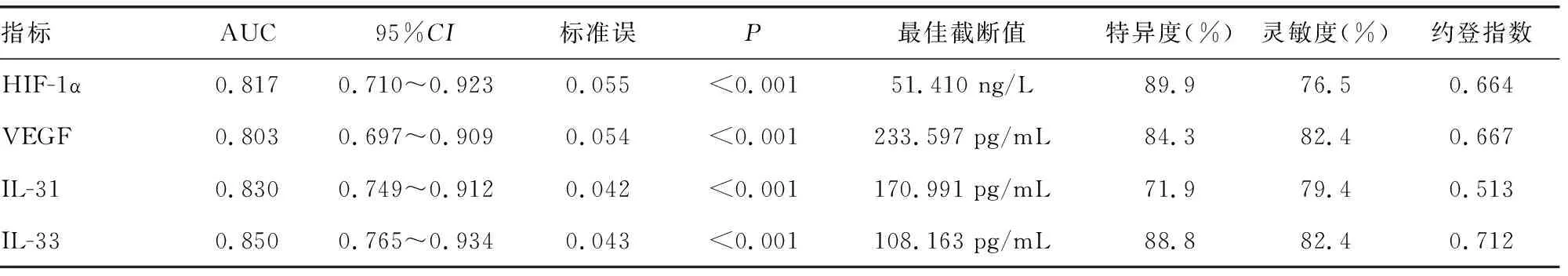
表3 各项指标预测中晚期子宫内膜癌患者化疗无效风险的效能分析结果
2.5中晚期子宫内膜癌患者化疗前血清IL-31水平与IL-33水平间的相关性分析 双变量Spearman直线相关性分析结果显示,中晚期子宫内膜癌患者化疗前血清IL-31水平与IL-33水平呈正相关(r=0.338,P=0.005)。见图2。

图2 中晚期子宫内膜癌患者化疗前血清IL-31水平与IL-33水平的相关性散点图
3 讨 论
作为一种上皮性恶性肿瘤,子宫内膜癌不仅是女性生殖系统常见的肿瘤,也是导致女性病死排名第3位的妇科恶性肿瘤。新辅助化疗是现阶段子宫内膜癌主要的治疗手段之一,但疾病早期因缺少特异性的表现及体征,易出现误诊、漏诊情况,多数患者确诊时已错失最佳治疗时机,可能对化疗的反应不佳,存在较高的化疗无效风险[10]。
VANDENPUT等[11]研究指出,子宫内膜浆液性癌Ⅳ期患者经新辅助化疗3个周期后仍有30%左右的患者化疗无效。本研究结果显示,123例中晚期子宫内膜癌患者,经新辅助化疗3个周期后,化疗无效34例,无效率为27.64%,其中疾病稳定24例,疾病进展10例,与上述研究相近,表明部分中晚期子宫内膜癌患者在接受新辅助化疗后仍有无效风险。因此,本研究着重分析可能与中晚期子宫内膜癌患者新辅助化疗无效有关的因子。有研究指出,缺氧、血管新生在肿瘤发生、发展中起着关键性作用,而HIF-1α、VEGF是常见缺氧诱导因子、血管内皮生长因子[12-13]。且本研究也证实,中晚期子宫内膜癌患者新辅助化疗无效组HIF-1α和VEGF水平高于缓解组。分析二者参与中晚期子宫内膜癌新辅助化疗无效的可能机制为:HIF-1α能够稳定肿瘤细胞的能量代谢,增加肿瘤细胞的侵袭性,提高远处转移风险,继而增加化疗无效风险[14]。而VEGF能够激活蛋白酶,使细胞外基质减少,更利于新生血管的生成,进而促进肿瘤细胞发生转移,影响化疗效果[15]。
白细胞介素是白细胞或免疫细胞间相互作用的淋巴因子,已被证实能够与血细胞生长因子相互协调、相互作用,共同参与机体多种生理及病理功能的调节[16]。IL-31、IL-33是白细胞介素家族中的主要成员,已被诸多研究证实其不仅与免疫调节有关,还可进一步引发并加重机体炎性反应,增加组织、细胞的受损程度,为肿瘤细胞的浸润及侵袭创造条件,不利于预后[17-18]。本研究结果显示,无效组血清IL-31、IL-33水平均高于缓解组,初步推测血清IL-31、IL-33异常表达可能与中晚期子宫内膜癌患者新辅助化疗效果有关。且以上推测均在进一步的回归分析中被证实,表明中晚期子宫内膜癌患者新辅助化疗实施前血清IL-31、IL-33异常表达不仅与化疗效果有关,还可能是化疗无效的风险因子。分析可能的原因如下:IL-31可通过辅助性T细胞2(Th2细胞)进一步加重患者体内炎性反应,使体内VEGF呈过表达状态;此外,IL-31还能直接刺激肿瘤细胞,使其释放大量VEGF,促进大量新生血管生成[19]。而研究证实,肿瘤组织处大量新生血管的生成可提高血管通透性,使血管内皮细胞大量产生及血管内物质发生渗漏,继而可影响肿瘤细胞的凋亡机制[20]。因此,当中晚期子宫内膜癌患者体内IL-31呈过表达状态时,不利于肿瘤细胞的凋亡,可进一步影响新辅助化疗效果,导致化疗无效。IL-33能够增加血管通透性,使血管收缩,不利于肿瘤细胞凋亡;同时,IL-33还能在病灶处募集大量炎症因子,进一步加重体内炎性反应程度,增加肿瘤细胞转移风险[21]。此外,有研究显示,IL-33在结直肠癌组织中呈过表达状态,可通过改变肿瘤组织内微环境,诱导肿瘤血管新生,进而启动肿瘤细胞的转移机制[22]。因此,当中晚期子宫内膜癌患者体内IL-33呈过表达时提示肿瘤存在转移风险,这将影响新辅助化疗的效果,进一步导致化疗无效。
本研究对各项指标预测中晚期子宫内膜癌患者化疗无效风险绘制了ROC曲线,结果显示,化疗前血清HIF-1α、VEGF、IL-31、IL-33水平分别预测中晚期子宫内膜癌患者化疗无效风险的AUC均>0.800,预测价值较理想。上述结果证实,新辅助化疗前血清IL-31、IL-33水平不仅是中晚期子宫内膜癌患者新辅助化疗无效的风险因子,还可作为患者化疗前预测化疗无效风险的关键标志物。但需要注意的是,血清HIF-1α、VEGF的定量检测技术日益增多,且各种检测技术之间仍存在着差异,在应用价值方面仍有局限。因此,未来临床若早期监测到中晚期子宫内膜癌患者新辅助化疗前血清IL-31、IL-33水平有异常,可在治疗原发病的同时实施合理干预,如对患者实施消炎、抗感染治疗,以改善患者血清IL-31、IL-33水平,可能对提高患者整体化疗效果有积极意义。此外,本研究对中晚期子宫内膜癌患者化疗前血清IL-31水平与IL-33水平的相关性分析结果显示,二者间呈正相关,说明中晚期子宫内膜癌患者化疗前血清IL-31水平与IL-33水平可能存在一定联系,二者可能相互影响、相互作用,共同参与了中晚期子宫内膜癌患者新辅助化疗无效的发生,这可能与二者均是炎症相关因子有关,其中某一指标水平改变均可能影响另一指标的变化。但由于对IL-31、IL-33之间关系的研究较少,尚不能根据本研究结果推断上述指标之间在疾病中的具体关系,仍需要在未来增加样本量、延长观察时间并查阅大量文献加以验证。
综上所述,血清HIF-1α、VEGF、IL-31、IL-33水平与中晚期子宫内膜癌患者新辅助化疗无效有关,可能是患者化疗无效的风险因子,对预测患者新辅助化疗无效风险有一定价值。
