福建省部分马铃薯产区晚疫病菌群体结构研究
2022-02-10李本金王荣波刘裴清邓丽霞石茗月李慧斌陈庆河
李本金 王荣波 刘裴清 邓丽霞 石茗月 李慧斌 陈庆河



摘要
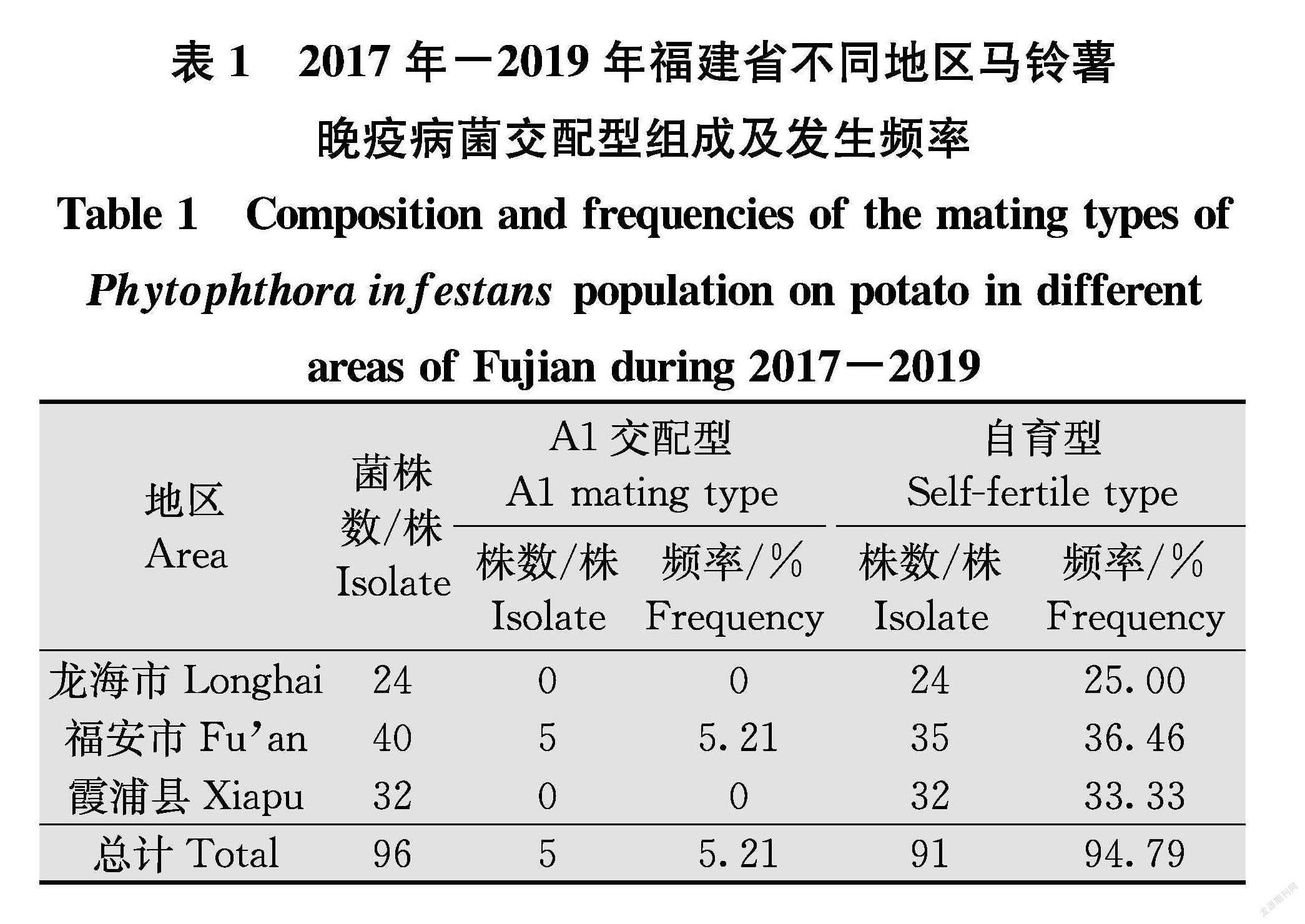
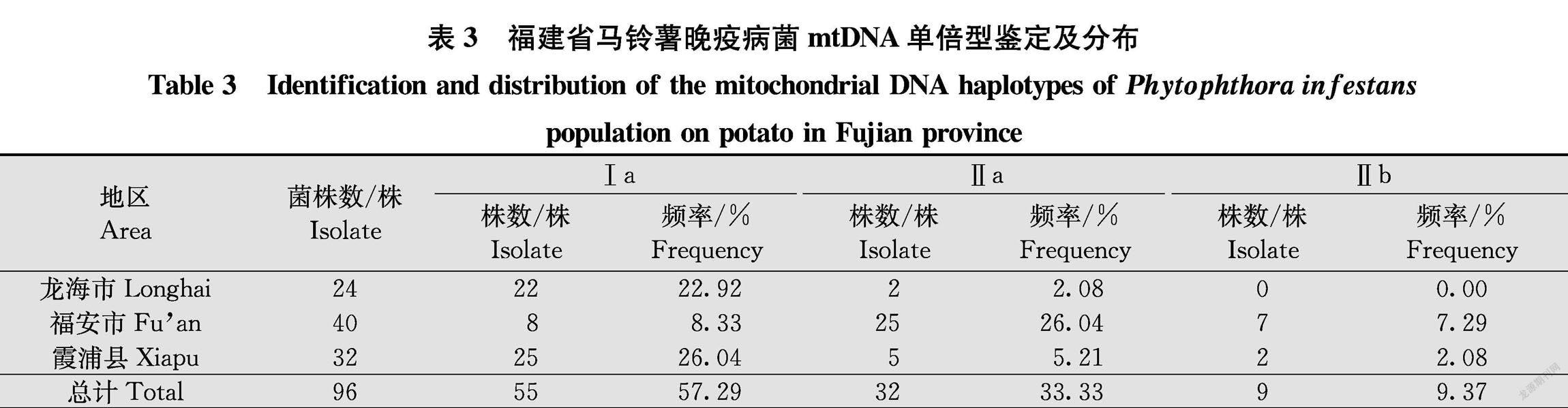
為明确福建省部分马铃薯产区晚疫病菌群体结构,2017年-2019年在龙海市、福安市、霞浦县共分离获得96株马铃薯晚疫病菌。采用对峙培养法、鉴别寄主法和PCRRFLP法对这些菌株的交配型、生理小种及线粒体DNA (mtDNA)单倍型进行分析。交配型测定结果显示,除了福建省福安市有5株(5.21%)为A1交配型外,其余91株(94.79%)均为自育型,未发现A2交配型及A1A2型菌株。从96个菌株中检测出16个生理小种类型,龙海市和福安市的优势生理小种均是可克服11个显性抗病单基因的1.2.3.4.5.6.7.8.9.10.11,霞浦县的优势生理小种为1.2.3.4.5.6.7.8.10。供试菌株均至少含有6个毒性基因。mtDNA单倍型共检测出3种类型,其中55个菌株(龙海市22株、福安市8株、霞浦县25株)为Ⅰa型,占57.29%,32个菌株(龙海市2株、福安市25株、霞浦县5株)为Ⅱa型,占33.33%,9个菌株(福安市7株、霞浦县2株)为Ⅱb型,占9.37%。研究结果表明,福建省马铃薯晚疫病菌群体遗传多样性日趋复杂。
关键词
马铃薯晚疫病菌;交配型;生理小种;mtDNA单倍型
中图分类号:
S435.32
文献标识码:A
DOI:10.16688/j.zwbh.2020645
Population structure of Phytophthora infestans isolates collected from a part of potato producing areas in Fujian province
LI Benjin1,WANG Rongbo1,LIU Peiqing1,DENG Lixia1,SHI Mingyue1,LI Huibin1,CHEN Qinghe1,2*
(1. Fujian Key Laboratory for Monitoring and Integrated Management of Crop Pests, Institute of
Plant Protection, Fujian Academy of Agricultural Sciences, Fuzhou350013, China; 2. Key
Laboratory of Green Prevention and Control of Tropical Plant Diseases and Pests, Ministry of
Education, College of Plant Protection, Hainan University, Haikou570228, China)
Abstract
To clarify the population structure of Phytophthora infestans in a part of potato producing areas in Fujian province, a total of 96 P.infestans isolates were collected from Longhai city, Fu’an city and Xiapu county of Fujian province from 2017 to 2019, and the mating type, physiological race and mitochondrial DNA haplotype were identified based on plate confrontation culture, host identification and PCRRFLP. The results showed that 91 out of the 96 P. infestans isolates were selffertile, accounting for 94.79%; five isolates collected from Fu’an belonged to A1 mating type, accounting for 5.21%, while A2 mating type and A1A2 type were not detected in this study. A total of 16 different physiological races were detected. The race 1.2.3.4.5.6.7.8.9.10.11 was the dominant species in Longhai and Fu’an cities, and the race 1.2.3.4.5.6.7.8.10 was the dominant species in Xiapu county. All of the isolates contained at least six virulence genes. Three mtDNA haplotypes (Ⅰa, Ⅱa andⅡb) were detected in this study, among which,Ⅰa type included 55 isolates (22 isolates in Longhai city, 8 isolates in Fu’an city and 25 isolates in Xiapu county), accounting for 57.29%, Ⅱa type included 32 isolates (2 isolates in Longhai city, 25 isolates in Fu’an city and 5 isolates in Xiapu county), accounting for 33.33%, andⅡb type included 9 isolates (7 isolates in Fu’an city and 2 isolates in Xiapu county), accounting for 9.37%. The results indicated that the composition of P.infestans populations was getting more and more complex in Fujian province.
Key words
Phytophthora infestans;mating type;physiological race;mitochondrial DNA haplotype
马铃薯是继水稻、小麦、玉米之后的世界第四大粮食作物,我国已成马铃薯生产和消费第一大国,近年来种植面积更是呈现逐年增加的趋势。由致病疫霉Phytophthora infestans引起的晚疫病是马铃薯生产上的一种毁灭性病害,一般年份减产10%~20%,严重时减产50%以上,甚至绝收[1]。该病在世界各马铃薯主产区均有发生和流行,我国每年因晚疫病造成的经济损失高达20亿美元[2]。
马铃薯晚疫病菌群体结构的组成与变异直接影响着病害的发生与流行,了解晚疫病菌群体特征及变异特点是控制晚疫病危害的必要前提。交配型是马铃薯晚疫病菌重要的群体结构特征之一,晚疫病菌存在A1、A2两种交配型,两者可通过异宗配合进行有性生殖产生卵孢子,而自育型菌株单独培养便可产生卵孢子。卵孢子的抗逆性强,能在土壤中越冬并成为翌年初侵染源,而且在有性生殖过程中会发生基因重组,有可能会产生致病力更强的后代群体。生理小种是晚疫病菌遗传多样性的重要表现型,1953年,Black等[3]提出了马铃薯晚疫病菌生理小种命名后,各国学者相继报道了马铃薯晚疫病菌生理小种组成,且发现小种类型不断趋于复杂化,复合小种类型已占主导地位。近年来,能克服11个主效抗性基因的超级小种在各省普遍出现,甚至已成为优势小种[4-7]。线粒体DNA单倍型因其结构简单,进化速度快,且为单亲遗传,已被广泛用于马铃薯晚疫病菌的遗传多样性分析[8]。Griffith等利用 PCRRFLP方法将线粒体单倍型分为Ⅰa,Ⅰb,Ⅱa,Ⅱb 4种类型[9]。国内学者研究发现这4种单倍型在我国不同地区的分布情况不尽相同[5,10]。
近年来,随着种薯的频繁调运,病原菌传播速度加快,马铃薯晚疫病所造成的危害日趋严重,对马铃薯产业持续稳定发展构成巨大威胁。因此,及时监测马铃薯晚疫病菌群体特征及动态变化对该病害综合治理具有重要的意义。近几年对福建省晚疫病菌群体结构的系统研究鲜有报道。本研究对福建省部分马铃薯主栽区晚疫病菌的交配型、生理小种及线粒体DNA单倍型进行分析,旨在明确马铃薯晚疫病菌群体结构组成及分布,从而为抗病品种选育和马铃薯晚疫病的有效防控提供科学依据。
1材料与方法
1.1材料
供试菌株:2017年-2019年在福建省龙海市、福安市、霞浦县马铃薯主产区采集具有典型晚疫病症状的病叶,按郑小波[11]的方法进行病原菌分离纯化,共获得96株马铃薯晚疫病菌。
标准菌株:测定晚疫病菌交配型的A1、A2标准菌株由美国康奈尔大学Fry W E博士惠赠。
鉴别寄主:从黑龙江省农业科学院引入一套完整的马铃薯晚疫病菌生理小种鉴别寄主,由11个含主效抗病单基因(R1~R11)的抗病品种和1个无抗病基因的感病品种(r)组成,均为无菌保存的试管苗。
1.2交配型测定
采用对峙培养方法测定各菌株的交配型。将待测菌株与A1、A2交配型标准菌株分别接种至黑麦培养基上, 在18~20℃黑暗条件下培养10~15 d后,在新鲜菌落边缘打取直径7 mm菌饼,转移至新鲜黑麦培养基上,待测菌株与标准菌株以2.5 cm的间距对峙培养,另设待测菌株单独培养,在18~20℃黑暗条件下培养15~20 d后,在显微镜下观察各待测菌株与标准菌株对峙培养的菌落交界处及单独培养的菌落是否产生卵孢子。若待测菌株仅与A1标准菌株产生卵孢子则为A2交配型,仅与A2标准菌株产生卵孢子则为A1交配型,与A1、A2标准菌株均产生卵孢子,但单独培养未发现卵孢子为A1A2型,单独培养即能产生卵孢子的为自育型。
1.3生理小种测定
1.3.1孢子悬浮液的制备
晚疫病菌菌株在黑麦培养基上18~20℃黑暗培养1~2周后,移至经表面消毒的不含主效抗病基因的新鲜薯片(‘费尔瑞它’)上,使其产生孢子囊并恢复致病力。7~10 d后,从薯片上刮下菌丝至装有灭菌水的离心管中,振荡洗下孢子囊,过滤后用血球计数板计数,将悬浮液中的孢子囊数调至约5×104个/mL,4℃冰箱内静置2~3 h,低温刺激游动孢子释放后用于接种。
1.3.2鉴别寄主的种植
鉴别寄主(试管苗)在MS培养基上培养20 d左右,移栽至以蛭石为基质的花盆中,浇以MS营养液,在温室18~25℃条件下生长6~8周后备用。
1.3.3人工接种鉴定生理小种
采用离体叶片接种法鉴定晚疫病菌生理小种。取鉴别寄主植株中部复叶的小叶片(生育期基本一致),用灭菌水将叶面冲洗干净,阴干后背面朝上放置在装有无菌的1.5%水琼脂培养基的培养皿内,用微量移液器吸取20 μL游动孢子悬浮液接种于叶脉侧面,每个菌株接种1套鉴别寄主,每个鉴别寄主接种4片叶片,每处理3次重复。接种后于18~20℃黑暗培养过夜,第2天将叶片翻转,置于18~20℃光照培养箱中(L∥D=16 h∥8 h)进 行保湿(湿度不低于95%)培养,第7~10 天观察接种部位是否出现症状。接种部位形成病斑并产生菌丝和孢子囊的即为感病型,接种部位无症状或只有坏死斑但无孢子囊产生的即为抗病型。每个菌株至少使4片叶中的3片叶发病,才称其具有毒力,否则要继续进行重复试验。
1.3.4生理小种的确定
根据马铃薯与晚疫病菌的互作关系符合基因对基因学说,确定菌株对所有鉴别寄主的抗病/感病情况后,根据Black等[3]提出的马铃薯晚疫病菌生理小种国际命名方案, 確定生理小种类型。根据晚疫病菌在 12个鉴别寄主上引起的反应,相应地命名为小种 0;1;2;……及小种1.2.3.4.5.6.7.8.9.10.11。所有小种都能侵染不具任何抗病基因的感病品种(r)。
1.4mtDNA单倍型分析
1.4.1基因组DNA提取
供试晚疫病菌菌丝体培养和收集参考连延浩等的方法[12]。采用植物DNA提取试剂盒提取菌丝基因组DNA,紫外分光光度计检测DNA的浓度和纯度,并用TE缓冲液稀释至50 ng/μL待用。
1.4.2引物的选择
参照Griffith等[9]的方法选择2对引物(F2: 5′TTCCCTTTGTCCTCTACCGAT 3′、R2: 5′TTACG GCGGTTTAGCA CATACA 3′; F4: 5′TGGTCATCCAGAGGTTTATGTT 3′、 R4: 5′CCGATACCGATACCAGCACCAA3′) 进行PCR扩增,引物由生工生物工程(上海)股份有限公司合成,产物分别为P2、P4,片段长度分别为1 070 bp和964 bp。
1.4.3PCR扩增
以晚疫病菌DNA为模板,分别用F2/R2 和F4/R4进行PCR扩增。反应体系为25 μL: 10×PCR buffer (Mg2+free) 2.5 μL,25 mmol/L MgC12 2.0 μL,2.5 mmol/L的dNTPs 2.0 μL,5 U/μL的Taq DNA聚合酶0.2 μL,10 μmol/L的上、下游引物各1.0 μL,DNA 模板1.0 μL,用无菌超纯水补足25 μL。PCR扩增程序为:94℃预变性90 s;94℃变性40 s,55℃退火60 s,72℃延伸90 s,40个循环;72℃延伸90 s。扩增结束后取5.0 μL PCR产物用含0.5 μg/mL EB的2.0%琼脂糖凝胶电泳检测,在凝胶成像系统上观察结果并拍照。
1.4.4mtDNA单倍型分析
PCR扩增产物P2和P4分别用限制性内切酶MspⅠ和EcoRⅠ酶切。酶切体系20 μL: 10×PCR Buffer 2.0 μL,BSA 0.2 μL,MspⅠ或EcoRⅠ 0.5 μL,产物P2或P4 15 μL,用无菌超纯水补足20 μL。37℃水浴消化过夜。酶切产物经琼脂糖凝胶电泳检测后,再根据P2产物经MspⅠ酶切和P4产物经EcoRⅠ酶切后的 结果对晚疫病菌线粒体 DNA单倍型进行分析。被测样本的P2产物被 MspⅠ酶切后,Ⅰa mtDNA单倍型可产生350、720 bp 2个片段,Ⅰb mtDNA单倍型可产生79、350、641 bp 3个片段,Ⅱa mtDNA单倍型可产生147、203、720 bp 3个片段,Ⅱb mtDNA单倍型可产生350、720 bp 2个片段;被测样本的P4产物被EcoRⅠ酶切后,Ⅰa mtDNA单倍型可产生209、361、394 bp 3个片段,Ⅰb mtDNA单倍型可产生209、361、394 bp 3个片段,Ⅱa mtDNA单倍型可产生361、603 bp 2个片段,Ⅱb mtDNA单倍型可产生361、603 bp 2个片段。
2结果与分析
2.1马铃薯晚疫病菌的交配型组成、发生频率及地理分布
对采自福建省的96株马铃薯晚疫病菌进行交配型测定,结果(表1)显示,龙海市24株、福安市40株中的35株、霞浦县32株为自育型菌株,即不需交配即能产生卵孢子,占供试菌株94.79%,福安市有5株为A1交配型,占供试菌株5.21%,供试群体中未发现A2交配型和A1A2型菌株。
2.2马铃薯晚疫病菌毒性基因鉴定及生理小种组成分析
利用 11个含主效抗病单基因及 1个不含抗病基因的一套鉴别寄主,采用离体叶片接种法测定马铃薯晚疫病菌的生理小种,结果(图1)显示:福建省部分产区晚疫病菌可以克服11个已知的抗性基因R1~R11,但晚疫病菌群体对各个抗性基因的毒性频率存在差异,对R6、R8的毒性频率均为100%,其次为R4、R1、R7、R10,毒性频率分别为98.96%、97.92%、97.92%、96.88%,对R2、R3、R5的毒性频率也较高,分别为88.54%、88.54%、82.29%,对 R9、R11的毒性频率较低,分别为39.58%、36.46%。
从表2可以看出,96个菌株中共检测出16个生理小种类型,每种类型含有6~11个毒性基因,其中龙海市以生理小种1.2.3.4.5.6.7.8.9.10.11发生最普遍,出现频率为8.33%, 其次为1.3.4.5.6.7.8.10和1.2.3.4.6.7.8.10,出现频率均为4.12%;福安市以生理小种1.2.3.4.5.6.7.8.9.10.11 发生最普遍,出现频率为12.50%,其次为1.3.4.5.6.7.8.10 和1.2.4.5.6.7.8.10,出现频率分别为7.29%和6.25%;霞浦县以生理小种1.2.3.4.5.6.7.8.10 发生最普遍,出现频率为16.67%,其次为1.2.3.4.5.6.7.8.9.10.11和1.2.3.4.6.7.8.10,出现频率均为5.21%;其他小种的出现频率在1.04%~3.13%。该结果表明福建省部分马铃薯产区晚疫病菌不仅生理小种组成复杂,而且其毒性基因构成也相当复杂。
2.3马铃薯晚疫病菌mtDNA单倍型分析
2.3.1马铃薯晚疫病菌mt DNA的PCR扩增
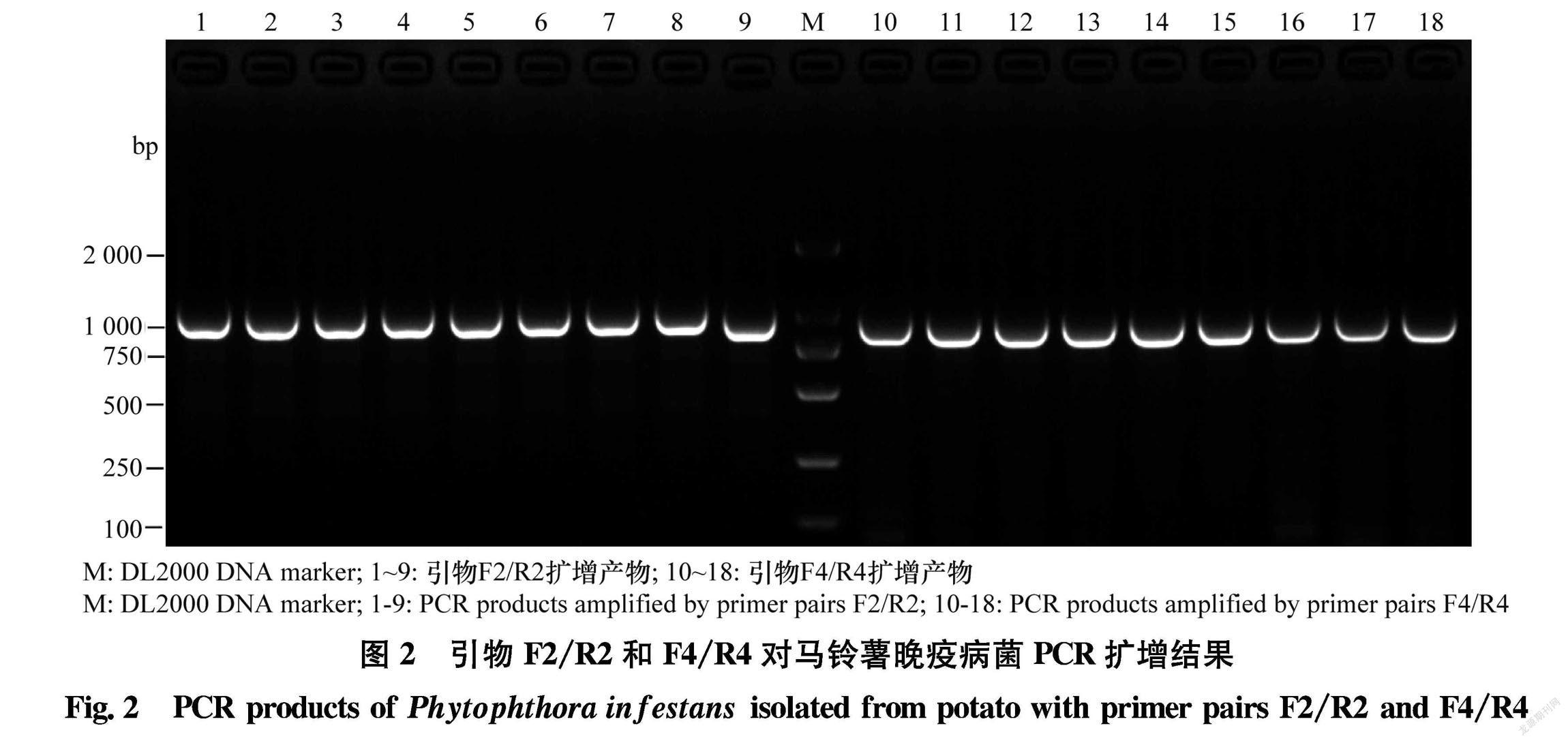
使用F2/R2和F4/R4 2对引物分别对96株马铃薯晚疫病菌基因组DNA进行PCR扩增,扩增结果(图2)显示,P2产物为1 070 bp,P4产物为964 bp。
2.3.2马铃薯晚疫病菌mtDNA单倍型分析
所测的96株晚疫病菌中,共发现Ⅰa、Ⅱa、Ⅱb 3种mt DNA单倍型(部分结果见图3),其中龙海市,Ⅰa型22株(占总株数22.92%,下同),Ⅱa型2株(2.08%),福安市,Ⅰa型8株(8.33%),Ⅱa型25株(26.04%),Ⅱb型7株(7.29%),霞浦縣,Ⅰa型25株(26.04%),Ⅱa型5株(5.21%),Ⅱb型2株(2.08%)。在所有菌株中均未检测到Ⅰb单倍型(表3)。龙海市和霞浦县优势mtDNA单倍型均为Ⅰa型,而福安市则为Ⅱa型。
3讨论
20 世纪80 年代后在英国、美国、日本、德国、荷兰、匈牙利、俄罗斯、瑞士、挪威等国检测到少量晚疫病菌自育型菌株[10]。中国自20世纪60 年代发现自育型晚疫病菌株后[13],四川、内蒙古、甘肃等省也陆续发现了自育型菌株[14- 18]。2001年-2007年福建省11个县市187株晚疫病菌交配型鉴定结果显示,仅在2006年发现1株自育型菌株[19]。本研究测定了2017年-2019年采自福建省龙海市、福安市、霞浦县的96株晚疫病菌交配型,结果显示,除了来自福安市5个菌株为A1交配型外,其余91株均为自育型,可见福建省晚疫病菌群体结构发生了很大变化。该结果与方治国[20] 2011年采自福建省218株晚疫病菌鉴定结果全部为自育型菌株相似。
本试验从2017年-2019年采自福建省的96个菌株中测定出16个生理小种类型, 每种类型含有6~11个毒性基因,全谱型小种1.2.3.4.5.6.7.8.9.10.11 已成为福安市和龙海市的优势小种类型。与李本金等[19] 2008年报道的福建省马铃薯晚疫病菌生理小种检测结果相比,此次检测到毒性基因组合更加复杂,“超级生理小种”频繁出现并成为优势小种,这种趋势与国内外相关报道[4,21- 23] 结果一致,其原因可能与福建省大面积栽培含有主效抗病基因的马铃薯品种、各地频繁的引种调种以及大量出现马铃薯晚疫病菌自育型菌株有关。福建省马铃薯晚疫病菌生理小种组成的复杂性给育种工作带来很大难度,因此在挖掘新的抗原和选育抗性品种的同时,应选择无病种薯,并且密切关注晚疫病菌生理小种变化情况。
国外对晚疫病菌群体mtDNA单倍型多态性的研究认为,Ⅰb类型代表晚疫病菌在第二次全球迁移之前形成的“旧”群体,Ⅰa、Ⅱa、Ⅱb 3种类型代表晚疫病菌在第二次全球迁移之后形成的“新”群体[24- 25]。 本文发现2017年后福建马铃薯晚疫病菌mtDNA单倍型发生明显变化,由之前报道 的Ⅰb、Ⅱa和Ⅱb型[26]演变成了Ⅰa、Ⅱa、Ⅱb型,且Ⅱb为优势 mtDNA单倍型演变成了Ⅰa或Ⅱa为优势mtDNA单倍型, 其原因可能与福建省每年都从北方和周边主产区调入大量的种薯有关,在调入种薯的同时,不同线粒体单倍型的晚疫病菌也跟随着种薯被带进福建不同产区。本研究未检测 到Ⅰb 单倍型,该结果与福建、云南、青海、黑龙江等省[8,10,12,27]的报道一致,说明被检测地区的马铃薯晚疫病菌均为“新”群体,从而导致马铃薯晚疫病菌遗传结构更加复杂。因此,除了加快抗性品种选育的进程外,还需要持续对晚疫病菌群体演变趋势进行监测,以便能准确预测晚疫病的危害和流行趋势,科学有效地指导病害的合理控制。
参考文献
[1]王腾, 孙继英, 汝甲荣, 等. 中国马铃薯晚疫病菌交配型研究进展[J].中国马铃薯, 2018, 32(1): 48 -53.
[2]蒋伟, 潘哲超, 包丽仙, 等. 马铃薯资源晚疫病抗性的全基因组关联分析[J]. 作物学报, 2021, 47(2):245 -261.
[3]BLACK W, MASTENBROEK C, MILLS W R, et al. A proposal for an international nomenclature of races of Phytophthora infestans and of genes controlling immunity in Solanum demissum derivatives [J]. Euphytica, 1953, 2(3): 173 -179.
[4]李洪浩, 彭化賢, 席亚东, 等. 四川马铃薯晚疫病菌交配型、生理小种、甲霜灵敏感性及mtDNA单倍型组成分析[J]. 中国农业科学, 2013, 46(4): 728- 736.
[5]TIAN Yue’e, YIN Junliang, SUN Jieping, et al. Population genetic analysis of Phytophthora infestans in northwestern China [J]. Plant Pathology, 2016, 65(1):17- 25.
[6]王鹤. 2009年中国4省马铃薯晚疫病菌群体特性分析及其交配型分子标记的开发[D]. 保定: 河北农业大学, 2011.
[7]韩淼, 汪晓雯, 黄琛, 等. 甘肃和内蒙古地区马铃薯晚疫病菌的致病型[J]. 植物保护, 2014, 40(2): 146- 150.
[8]韩丽丽, 杨策, 潘贤, 等. 福建省马铃薯晚疫病菌线粒体DNA单倍型分析[J]. 激光生物学报, 2014, 23(2):165 -169.
[9]GRIFFITH G W, SHAW D S. Polymorphisms in Phytophthora infestans: four mitochondrial haplotypes are detected after PCR amplification of DNA from pure cultures or from host lesions [J]. Applied and Environmental Microbiology, 1998, 64(10): 4007 -4014.
[10] 赵志坚, 曹继芬, 李灿辉, 等. 云南致病疫霉交配型、甲霜灵敏感性、mtDNA单倍型及其群体演替研究[J].中国农业科学, 2007, 40(4): 727 -734.
[11] 郑小波. 疫霉菌及其研究技术[M]. 北京: 中国农业出版社, 1997.
[12] 连延浩, 叶广继, 王舰. 青海马铃薯晚疫病菌线粒体DNA单倍型鉴定及分析[J]. 植物病理学报, 2012, 42(2): 164- 168.
[13] 黄河, 程汉清, 徐天宇, 等. 我国北部马铃薯晚疫病菌生理小种的发生和变化[J]. 植物病理学报, 1981,11(1): 45- 49.
[14] 赵青, 郑峥, 李颖, 等. 四川省马铃薯晚疫病菌群体表型和遗传变异的分析[J]. 菌物学报, 2016, 35(1): 52- 62.
[15] 杨继峰, 朱小琼, 国立耘, 等. 内蒙古西部地区马铃薯晚疫病菌的交配型分布及对3种杀菌剂的敏感性[J]. 华北农学报, 2011, 26(5): 16- 20.
[16] 张大为, 惠娜娜, 王立, 等. 甘肃省马铃薯致病疫霉交配型组成及其对甲霜灵的抗药性[J]. 西北农业学报, 2014, 23(6):184 -188.
[17] 张铉哲. 黑龙江省马铃薯晚疫病菌群体结构研究[D]. 哈尔滨: 东北农业大学, 2015.
[18] 宋俊丽, 朱杰华, 杨志辉, 等. 宁夏固原致病疫霉群体结构特征[J]. 植物保护学报, 2012, 39(5): 418- 424.
[19] 李本金, 吕新, 兰成忠, 等.福建省致病疫霉交配型、甲霜灵敏感性及生理小种组成分析[J]. 植物保护学报, 2008,35(5): 453-457.
[20] 方治国. 中国马铃薯晚疫病菌交配型与无毒基因多样性分析[D]. 福州: 福建农林大学, 2013.
[21] 马云芳, 孙洁平, 马丽杰, 等. 一个马铃薯种质资源圃致病疫霉群体的分析[J]. 菌物学报, 2013, 32(5): 802 -811.
[22] 杨丽娜, 段国华, 覃雁瑜, 等. 2012年云南省会泽县马铃薯晚疫病菌小种结构分析[J]. 热带作物学报, 2016, 37(1):158- 163.
[23] RUNNOPAURSON E, RONIS A, HANSEN M, et al. Lithuanian populations of Phytophthora infestans revealed a high phenotypic diversity [J]. Journal of Plant Diseases and Protection, 2015, 122 (2): 57 -65.
[24] GOODWIN S B. The population genetics of Phytophthora [J]. Phytophthology, 1997, 87: 462 --473.
[25] GAVINO P D, FRY W E. Diversity in and evidence for selection on the mitochondrial genome of Phytophthora infestans [J]. Mycologia, 2002, 94(5):781- 793.
[26] LI Benjin, CHEN Qinghe, L Xin, et al. Phenotypic and genotypic characterization of Phytophthora infestans isolates from China [J]. Journal of Phytopathology, 2009, 157(9):558 -567.
[27] 田薈遥, 蒋继志, 李成斌, 等. 东北三省致病疫霉线粒体DNA单倍型鉴定分析及生物学特性研究[J]. 河北农业大学学报, 2018, 41(5): 25- 31.
收稿日期:2020 -12 -03修订日期:2021 -01- 15
基金项目:
福建省省属公益类科研院所基本科研专项(2019R10244);闽宁合作项目(DWX2018035);福建省农业科学院科技创新团队(CXTD2021002-1)
* 通信作者
Email:chenqh@faas.cn
