烟草拟茎点霉快速检测方法的建立
2022-02-10邢国珍陈佳敏李淑君郑文明
邢国珍,孙 帅,李 旭,邱 睿,程 琨,李 博,陈佳敏,何 雷,李淑君,郑文明*
1.河南农业大学生命科学学院,郑州市金水区农业路63号 450002
2.河南省农业科学院烟草研究所 黄淮烟区烟草病虫害绿色防控重点实验室,河南省许昌市魏都区永昌大道与青梅路交叉口 461000
3.中国烟草总公司河南省公司,郑州市金水区商务外环15号 450018
近年来,由于烟草栽培制度、气候变化以及品种单一等问题,导致烟草病害呈现多发且加重的趋势[1]。烟草根茎类病害是制约烟草生产发展的重要因素,常见的有镰刀菌根腐病、黑胫病、根黑腐病以及由拟茎点霉属引起的拟茎点霉茎枯病等。拟茎点霉属(Phomopsis)是半知菌亚门、腔孢纲、球壳孢目中的一个真菌属,是重要的病原菌和内生真菌[2]。目前该属真菌已达900多种,主要危害被子植物和裸子植物,有时还可能侵染苔藓或蕨类植物,引起植物茎枯、溃烂、根腐和叶枯等多种症状[3-4]。近年来,已有报道拟茎点霉在多种重要经济作物上造成严重危害,姜淑霞等[5]在山东泰安、临沂等地发现一种新的病原菌,通过形态学特征鉴定和rDNA-ITS序列比对分析,将其定名为板栗拟茎点霉(P.castaneae mollissima)。纪兆林等[6]结合形态学鉴定、rDNA-ITS序列比对分析和致病性测定结果,确定了江苏、浙江桃枝枯病病原菌为桃拟茎点霉(P.amygdali)。在烟草上,自2013年首次报道烟草拟茎点霉引起的烟草茎枯病为烟草新病害以来,拟茎点霉茎枯病已成为烟草生产上日益严重的病害之一[7]。烟草真菌病害常混合发病,病害症状往往较为相似,特别是在发病早期难以通过症状来快速准确判断为何种病原菌引起的病害。根茎类病害的防治难度大,快速鉴定根茎类病害的病原菌同时明确其种类以及分布情况是开展烟草根茎类病害防控的基础。
随着基因组学技术快速发展和生物信息数据库的完善,分子检测已成为植物病害早期快速检测的主要方式[8]。Liu 等[9]综合使用ITS 和β-Tublin 序列建立了烟草黑胫病和根黑腐病双重PCR 检测技术。谢中玉等[10]利用q-PCR建立了烟草赤星病的检测体系。王井田等[11]通过田间和镜检试验研究了猕猴桃拟茎点霉侵染规律,发现该病菌在越冬过程中多以菌丝体或孢子器附着于病枝、病残体和残留果梗上,待次年春季孢子则大面积传播,以侵染幼果为主,该病症早期不明显,直到果实成熟或采收后才开始缓慢显现[12],因此建立病原菌早期侵染检测方法非常必要。王云飞等[13]通过对已报道的镰孢属reductase-like基因序列的比对分析,在SNP位点设计特异性检测引物,可检测出南方镰孢Fusarium meridionale,检测灵敏度为500 pg/μL 基因组DNA。代玉立等[14]依据GenBank中已登录的玉米大斑病菌和小斑病菌的交配型基因序列,建立的特异性多重PCR 检测方法灵敏度达到10 pg/μL 基因组DNA。而目前有关烟草根茎病害的PCR快速分子检测的报道较少,烟草拟茎点霉分子检测方法则鲜见报道。为此,根据烟草拟茎点霉病原菌rDNA-ITS区域设计特异性检测引物,并优化建立了烟草拟茎点霉的PCR 分子检测技术体系,旨在为该病害的防治和病情预警提供依据。
1 材料与方法
1.1 供试菌株
2016—2018年在河南省烟草主产区采集发病烟株,利用PDA培养法分离鉴定出11种病原菌,见表1。

表1 河南烟田病害的病原菌Tab.1 Pathogens in tobacco fields from Henan Province
1.2 基因组DNA的制备
将分离纯化的病原菌菌株接种到PDA平板培养基上,于25 ℃培养箱中恒温培养5~7 d,收集菌丝体。采用CTAB 法[15]提取病原菌基因组DNA,于-20 ℃冰箱中保存,备用。
1.3 特异性引物的设计
利用真菌核糖体基因转录间隔区(ITS)通用引物ITS1(序列为5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4(序列为5′-TCCTCCGCTTATTGATATGC-3′)对病原菌的rDNA-ITS区进行PCR扩增并测序,共得到11条序列,见图1。利用DNAMAN软件对11条序列进行比对分析,选择这11 条序列中碱基差异较大的区域,通过Primer Premier 5.0 软件设计两对特异性的上下游引物P2F/P3R和P3F/P3R,见表2。

图1 通用引物ITS1和ITS4对11种病原菌的PCR扩增Fig.1 PCR amplification of 11 pathogens with universal primers ITS1 and ITS4
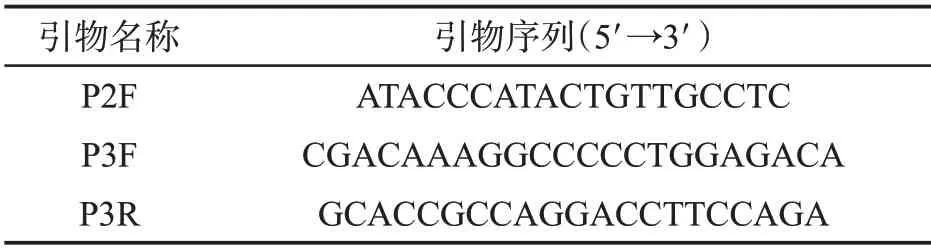
表2 拟茎点霉(Phomopsis sp.)引物序列信息Tab.2 Sequences of primers for Phomopsis sp.
1.4 引物特异性鉴定
将设计的特异性引物对11个病原菌基因组DNA和阴性对照(ddH2O)进行PCR扩增检测。PCR扩增条件:反应总体积20 μL,包括2×PCR mixture 10 μL,模板DNA 1 μL,引物各1 μL,ddH2O 补足至20 μL。PCR 反应在ABI 梯度PCR 仪器完成。PCR反应程序:94 ℃预变性5 min;94 ℃变性45 s,60 ℃退火40 s,72 ℃延伸45 s,35个循环;最后延伸72 ℃10 min,终止反应。根据扩增出的条带大小与引物设计时理论条带大小是否一致来判断引物的特异性,扩增产物经纯化后用于克隆和测序分析。
1.5 特异性引物灵敏度鉴定
用灭菌超纯水(ddH2O)将烟草拟茎点霉的基因组DNA 模板进行梯度稀释,分别为100 ng/μL、10 ng/μL、1 ng/μL、100 pg/μL、10 pg/μL、1 pg/μL、100 fg/μL和10 fg/μL,并以此系列浓度的基因组DNA为模板对所设计的特异性引物进行PCR扩增以检验引物的灵敏度。
2 结果与分析
2.1 PCR扩增条件的优化
用通用引物ITS1 和ITS4 分别对11个病原菌基因组DNA 进行温度梯度PCR 检测,在55 ℃、60 ℃和65 ℃退火温度条件下分别进行扩增。在60 ℃退火温度条件下11 种病原菌的扩增条带单一,且扩增效率高。因此,选择60 ℃为最适退火温度。
2.2 特异性引物的设计
在60 ℃退火温度条件下,经过PCR 扩增、克隆和测序,共获得11 条DNA 序列。11 条DNA 序列比对结果以及特异性引物对P2F/P3R 和P3F/P3R 的位点见图2和图3。

图2 病原菌rDNA-ITS序列比对及特异性引物P2F/P3R的位点Fig.2 Sequence alignment of rDNA-ITS regions of pathogens and locations of specific primers P2F/P3R

图3 病原菌rDNA-ITS序列比对及特异性引物P3F/P3R的位点Fig.3 Sequence alignment of rDNA-ITS regions of pathogens and locations of specific primers P3F/P3R
2.3 引物特异性的检测
利用特异性引物P2F/P3R对11种烟草常见病原菌DNA 进行PCR 扩增检测,仅有拟茎点霉的DNA能够扩增出1条420 bp的清晰条带,见图4。特异性引物P3F/P3R 对11 种烟草病原菌DNA 进行PCR 扩增检测,仅有拟茎点霉的DNA 能够扩增出1 条381 bp的清晰条带,见图5。扩增条带经测序,并将序列在NCBI 数据库中进行BLAST 比对分析,结果表明该片段与拟茎点霉ITS序列一致性达到99%。因此,确定为拟茎点霉序列。

图4 引物P2F/P3R的特异性PCR扩增Fig.4 Specific PCR amplification with primers P2F/P3R

图5 引物P3F/P3R的特异性PCR扩增Fig.5 Specific PCR amplification with primers P3F/P3R
2.4 引物的灵敏度鉴定
以10 倍梯度稀释的烟草拟茎点霉基因组DNA(100 ng/μL~10 fg /μL)为模板进行PCR 扩增,检验特异性引物的灵敏度,结果见图6和图7。当PCR体系中含有≥10 pg 模板时,特异性引物P2F/P3R 和P3F/P3R均能扩增出清晰的目的条带。因此,引物灵敏度较高。

图6 P2F/P3R引物对的灵敏度鉴定Fig.6 Sensitivity identification of primer pair P2F/P3R

图7 P3F/P3R引物对的灵敏度鉴定Fig.7 Sensitivity identification of primer pair P3F/P3R
3 结论
利用真菌rDNA-ITS 通用引物在拟茎点霉和其他10 种烟草病原菌DNA 中进行了PCR 扩增、片段回收和DNA 测序。在序列差异区设计了两对特异检测引物,并鉴定了引物的灵敏度和特异性,优化建立了PCR反应体系。在退火温度为60 ℃时,两对特异性引物P2F/P3R 和P3F/P3R 分别从烟草拟茎点霉DNA样本中扩增出420 bp和381 bp的特异性条带,而在其他10个烟草病原菌DNA 以及阴性对照(ddH2O)中均不能扩增出任何条带。两对特异性引物的检测灵敏度均达到10 pg/μL,可实现对烟草拟茎点霉的快速和准确检测。
