早期非小细胞肺癌患者血清氨基酸检测的临床意义
2022-02-10徐润灏刘怡菁张舒林
徐润灏, 邹 琛, 曹 芸, 陈 风, 刘怡菁, 张舒林, 张 洁
(1.上海交通大学医学院附属仁济医院检验科,上海 200001;2.上海交通大学附属儿童医院检验科,上海 200062;3.上海交通大学医学院免疫学与微生物学系,上海 200025)
2020年,我国肺癌新发病例约为81.5万,新增死亡病例约为71.5万,分别较5年前增长了3.6%和11.9%[1],其中85.0%为非小细胞肺癌患者(non-small cell lung cancer,NSCLC),有64.6%的患者确诊时已处于晚期(临床Ⅲ~Ⅳ期)[2]。肺癌患者的5年生存率会随着肺癌的进展而降低,Ⅰ期患者的5年生存率可达92.4%,Ⅱ期为73.7%[3],而Ⅲ期和Ⅳ期患者的生存率急剧下降,一些地区Ⅳ期肺癌患者的5年生存率仅为5.3%[4]。因此,早期诊断NSCLC对提高肺癌患者的整体生存率具有重要意义。
氨基酸代谢是肺癌患者血清差异表达代谢物富集最显著的通路之一[5],部分氨基酸有成为NSCLC诊断标志物的潜能。有研究结果显示,NSCLC患者和健康人多种血清氨基酸水平有差异[6-11]。但这些研究未参照临床分期对NSCLC患者进行区分,也未对早期和中晚期NSCLC患者的血清氨基酸水平进行比较。莫靓等[12]的研究结果显示,不同临床分期的NSCLC患者血清中包括氨基酸在内的多个小分子代谢物存在明显差异。为此,本研究采用液相色谱串联质谱(liquid chromatography tandem-mass spectrometry,LC-MS/MS)技术检测NSCLC患者5类共14种氨基酸[非极性蛋白氨基酸:包括丙氨酸(alanine,Ala)、甘氨酸(glycine,Gly)、亮氨酸(leucine,Leu)、脯氨酸(proline,Pro)、苯丙氨酸(phenylalanine,Phe)、缬氨酸(valine,Val)、蛋氨酸(methionine,Met);极性中性蛋白氨基酸,即酪氨酸(tyrosine,Tyr);酸性蛋白氨基酸,即谷氨酸(glutamic acid,Glu);碱性蛋白氨基酸:包括精氨酸(arginine,Arg)、组氨酸(histidine,His)、赖氨酸(lysine,Lys);非蛋白氨基酸:包括瓜氨酸(citrulline,Cit)、鸟氨酸(ornithine、Orn)]水平,探讨氨基酸在早期NSCLC辅助诊断中的临床价值。
1 材料和方法
1.1 研究对象
选取2019年7月—2021年1月上海交通大学医学院附属仁济医院确诊的早期NSCLC患者64例(早期NSCLC组,其中男34例、女30例,年龄27~82岁;临床分期Ⅰ期55例、Ⅱ期9例)、中晚期NSCLC患者55例(中晚期NSCLC组,其中男29例、女26例,年龄29~82岁;临床分期Ⅲ期23例、Ⅳ期32例)。入组标准:经影像学和组织病理学检查确诊为原发性NSCLC,未经放疗、化疗和手术治疗。另选取同期上海交通大学医学院附属仁济医院确诊为社区获得性肺炎等肺部良性疾病患者65例(肺良性疾病组),其中男35例、女30例,年龄25~86岁。入组标准:经临床诊断排除肺部恶性肿瘤可能,且无其他脏器重大疾病。以2020年10月—2021年1月上海交通大学医学院附属仁济医院健康体检者80名为正常对照组,其中男43名、女37名,年龄24~81岁。入组标准:经影像学检查肺部未见明显病变,无其他重大疾病,血糖、血脂、肝功能、肾功能等常规指标均无异常。所有研究对象均未服用免疫抑制剂和氨基酸类药物,各组间年龄和性别差异均无统计学意义(P>0.05)。本研究经上海交通大学医学院附属仁济医院伦理委员会审查通过(批准号:2017205),所有对象均签署知情同意书。
1.2 方法
1.2.1 样本采集和处理 采用促凝管采集所有对象空腹静脉血4 mL,30 min内2 685×g离心10 min,分离血清。在24 h内进行检测的血清样本冷藏(2~8 ℃)保存;无法及时检测的样本,吸取血清装入离心管,冷冻(-80 ℃及以下)保存。
1.2.2 仪器和试剂 采用API3200MD三重四级杆质谱仪(美国ABSciex公司)、LC-20A高效液相色谱仪(日本Shimadzu公司)和氨基酸代谢谱分析试剂盒(上海可力梅塔生物医药科技有限公司)检测Ala、Gly、Leu、Pro、Phe、Val、Met、Tyr、Glu、Arg、His、Lys、Cit、Orn,试剂盒中含氨基酸内标液、流动相添加剂A(主要成分为甲酸)、流动相添加剂B(主要成分为甲酸铵)、氨基酸转化液(主要成分为正丁醇)、样本稀释液等。按试剂盒说明书配制内标提取液、流动相A(含0.3%流动相添加剂A和0.1%流动相添加剂B)、流动相B(95%甲醇,美国MERCK公司)。
1.2.3 样本预处理 吸取20 μL待测血清样本至离心管中,加入80 μL样本稀释液,16 000×g离心5 min。取10 μL稀释后的样本,加入内标提取液100 μL,涡旋混匀5 min,16 000×g离心5 min。取上清液50 μL,加入96孔板,50 ℃氮气吹干。加入氨基酸转化液500 μL,置于微孔板恒温振荡器中,60 ℃振荡衍生反应30 min,60 ℃氮气吹干。加入复溶液100 μL,继续振荡混匀10 min,直接进样检测。
1.2.4 氨基酸检测条件 (1)色谱条件:分析柱为ACE Excel3 C18(3.0 mm×100 mm,英国ACE公司),柱温40 ℃,梯度洗脱,流速为550 μL/min。(2)质谱条件:电喷雾离子源,正离子扫描,离子源参数为雾化气压力50 psi、辅助加热器压力50 psi、气帘气压力30 psi、碰撞气压力6 psi;离子源电压5 000 V;离子源温度500 ℃;使用多反应监测模式进行扫描分析。
1.2.5 肿瘤标志物检测 采用cobas e801全自动电化学发光分析仪(瑞士罗氏公司)及配套试剂(电化学发光法)检测血清糖类抗原(carbohydrate antigen,CA)19-9、癌胚抗原(carcinoembryonic antigen,CEA)、细胞角蛋白19片段(cytokeratin 19 fragment,CYFRA 21-1)和鳞状上皮细胞癌抗原(squamous cell carcinoma antigen,SCC-Ag)水平。参考区间参照试剂说明书:CA 19-9为0~27 U/mL,CEA为0~4.7 ng/mL,CYFRA 21-1为0~3.3 ng/mL,SCC-Ag为0.5~2.7 ng/mL。
1.3 统计学方法
采用SPSS 22.0软件及GraphPad 6.0软件进行统计分析。采用K-S检验评估数据的正态性。呈正态分布的计量资料以±s表示,组间比较采用独立样本t检验;呈非正态分布的计量资料以中位数(M)[四分位数(P25~P75)]表示,组间比较采用Mann-WhitneyU检验。采用二元Logistic回归分析(逐步法)拟合出各项指标的最佳诊断组合,采用受试者工作特征(receiver operating characteristic,ROC)曲线评价各项指标单项检测和联合诊断早期NSCLC的效能。以P<0.05为差异有统计学意义。
2 结果
2.1 各组间血清14种氨基酸水平比较
与正常对照组相比,早期NSCLC组血清His、Lys水平降低(P<0.05),血清Ala、Pro、Val、Glu、Cit、Orn水平升高(P<0.05)。与肺良性疾病组比较,早期NSCLC组血清Ala、Leu、Pro、Val、Glu、His、Lys、Cit、Orn水平升高(P<0.05)。与早期NSCLC组比较,中晚期NSCLC组血清Ala、Leu、Val、Glu、Lys水平降低(P<0.05)。见表1。本研究结果与相关文献结果的比较见表2。

表1 各组间血清14种氨基酸水平的比较
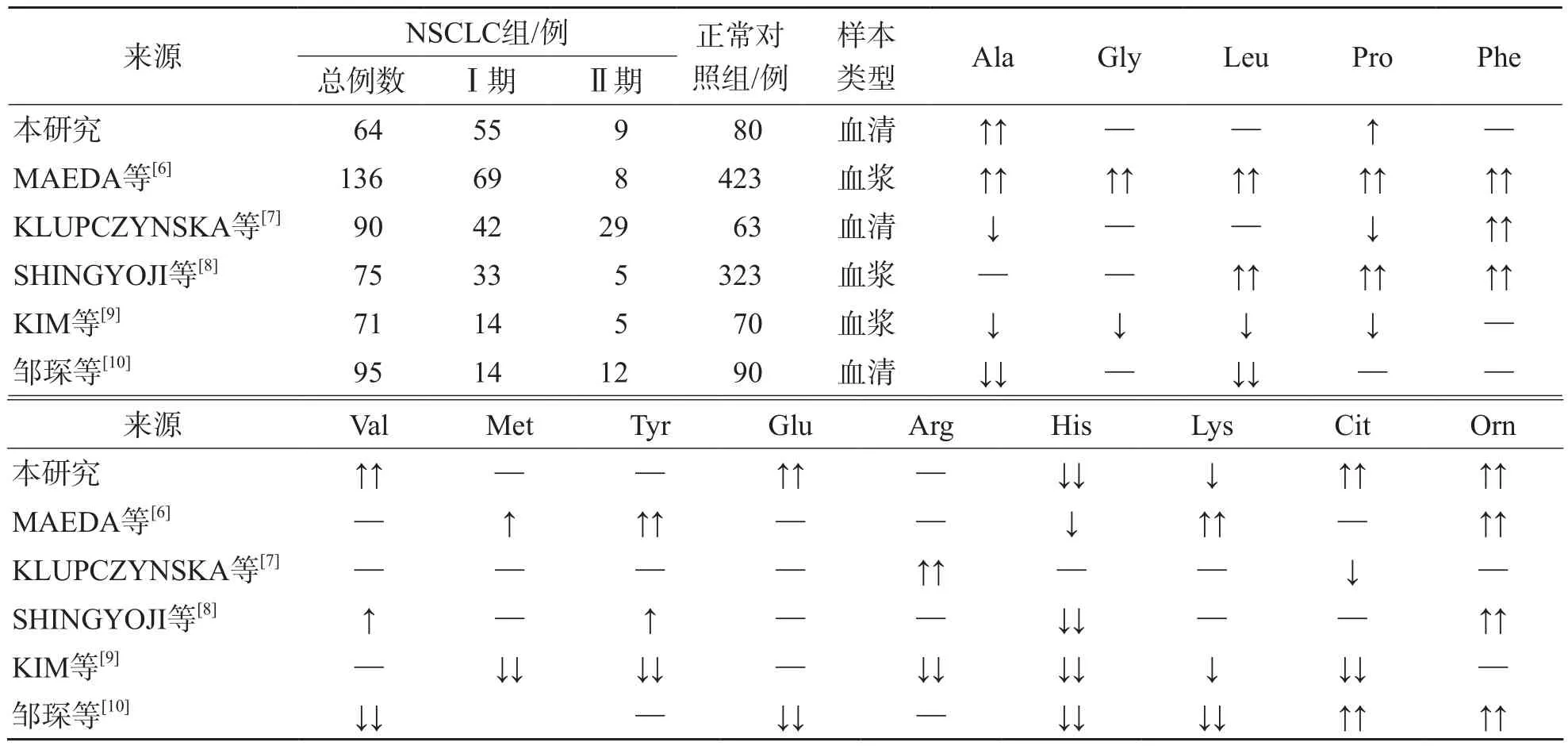
表2 本研究结果与相关文献结果比较
2.2 各组间血清CA 19-9、CEA、CYFRA 21-1、SCC-Ag水平比较
与正常对照组比较,早期NSCLC组血清CA 19-9、CEA、CYFRA 21-1水平升高(P<0.01)。与肺良性疾病组比较,早期NSCLC组血清CA 19-9、CYFRA 21-1水平升高(P<0.01)。各组间血清SCC-Ag水平差异无统计学意义(P>0.05)。见表3。
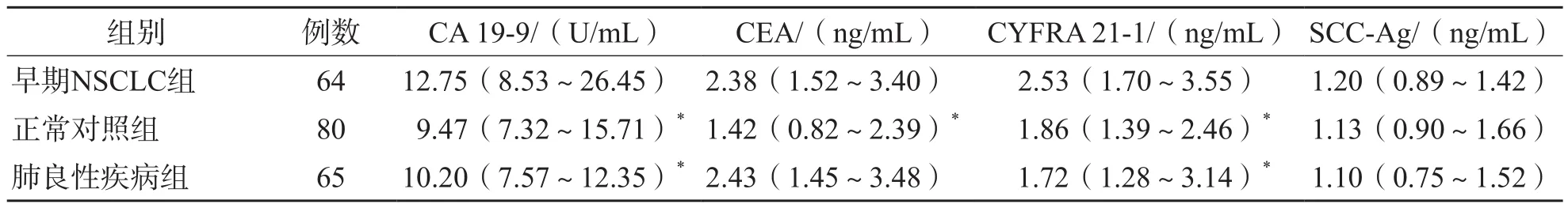
表3 各组间4种血清肿瘤标志物表达水平的比较
2.3 各项指标单项检测和联合检测诊断早期NSCLC的效能
早期NSCLC组与正常对照组之间、早期NSCLC组与肺良性疾病组之间血清Ala、Glu、Pro、Val、Cit、Orn水平均发生相同变化,因此将正常对照组和肺良性疾病组合并为非肿瘤组。ROC曲线分析结果显示,在早期NSCLC组与非肿瘤组之间有差异的6种氨基酸(Ala、Glu、Pro、Val、Cit、Orn)和3种肿瘤标志物(CA 19-9、CEA、CYFRA 21-1)中,单项诊断早期NSCLC效能最高的项目为Cit,曲线下面积(area under curve,AUC)为0.709,敏感性为81.25%,特异性为53.10%。采用二元Logistic回归分析(逐步法)从9项指标中拟合出的最佳组合为Glu+Val+Cit+CYFRA 21-1,联合检测模型为:Y=1/[1+e-Logit(P)],式中Logit(P)=0.006×Glu+0.007×Val+0.061×Cit+0.519×CYF RA 21-1-7.79。联合检测模型诊断早期NSCLC的AUC为0.808,敏感性为64.56%,特异性为88.28%。见表4、图1。

表4 各项指标单项检测和联合检测诊断早期NSCLC的效能
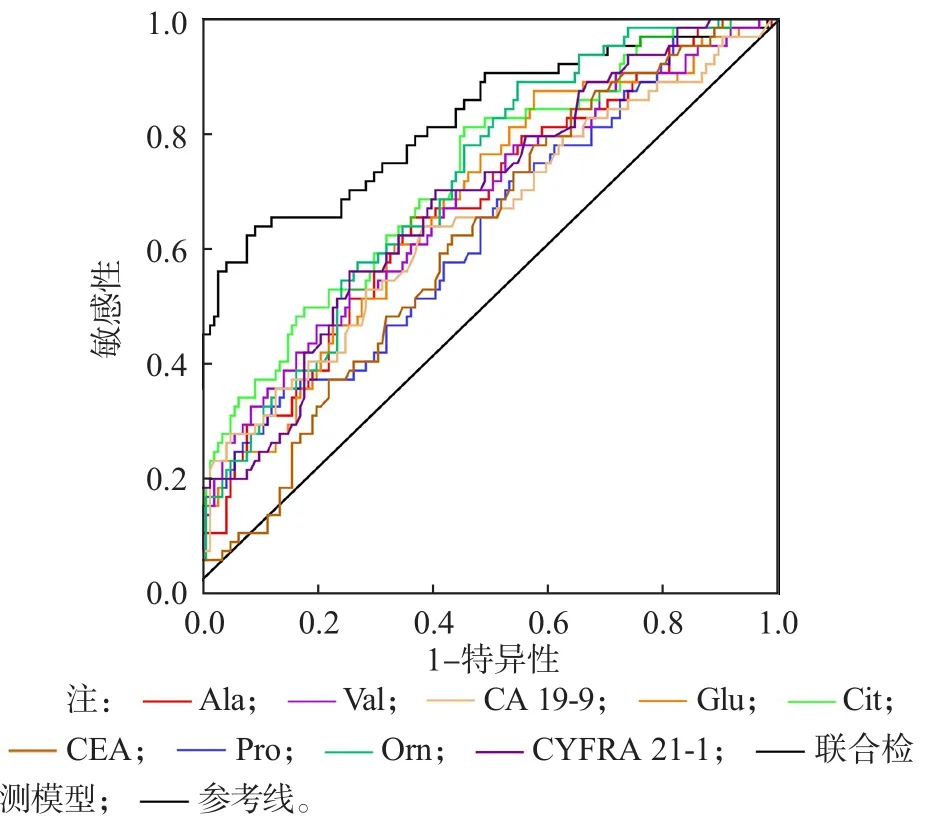
图1 各项指标单项检测和联合检测诊断早期NSCLC的ROC曲线
3 讨论
本研究结果显示,相对于正常对照者,早期NSCLC(临床Ⅰ期和Ⅱ期)患者血清中非极性蛋白氨基酸Ala、Pro、Val和酸性氨基酸Glu水平较高(P<0.05),碱性氨基酸His、Lys水平较低(P<0.05)。目前,已有学者对NSCLC患者血液蛋白氨基酸谱进行了分析[6-10],但结果相互矛盾(表2)。由于这些研究中各期NSCLC患者的比例不尽相同,且未对各期NSCLC进行分组比较,因此造成结果矛盾的原因可能是在NSCLC的不同阶段,患者血液中的氨基酸水平发生不同变化所致;也可能与血液样本的其他成分有关。KALUARACHCHI等[13]认为,受血小板的影响,血浆样本中的部分氨基酸会大量丢失或发生组分改变。
本研究结果还显示,早期NSCLC患者血清中非蛋白氨基酸Cit、Orn水平较高。Cit和Orn是尿素循环的关键氨基酸,在多种不同部位的肿瘤患者血液中明显升高[14-15],其原因尚不明确。POILLET-PEREZ等[16]认为细胞的自噬作用可以通过尿素循环维持肿瘤的生长,这可能会导致Cit和Orn水平代偿性增高。同时高水平的Cit能更快地激活中性粒细胞,介导中性粒细胞胞外杀菌网络的形成[17],从而诱导部分肿瘤细胞的增殖和转移[18]。
值得注意的是,本研究发现,中晚期NSCLC组多数氨基酸水平低于早期NSCLC组(P<0.05)。这可能是在恶性肿瘤细胞的增殖过程中,蛋白质及氨基酸被大量消耗导致的[19]。肺部肿瘤不仅会影响人体的呼吸系统和循环系统,还会引起人体能量代谢的改变,使机体氨基酸表达异常;在肺部肿瘤患者体内,氨基酸为肿瘤细胞的增殖提供能量,构建其生长所需的蛋白质,并参与肿瘤细胞在体内的免疫逃逸[19]。
本研究ROC曲线分析结果显示,在早期NSCLC组与正常对照组、肺良性疾病组发生相同改变的6种氨基酸(Ala、Glu、Pro、Val、Cit、Orn)中,诊断效能最高的是Cit(0.709),其A U C甚至高于3种经典的肿瘤标志物(CA 19-9、CEA、CYFRA 21-1)。这可能是因为早期NSCLC患者血清Cit水平较高,而肺部良性疾病患者Cit水平无明显变化;肿瘤标志物水平不仅在NSCLC中较高,在肺部良性疾病患者中同样也较高。相对于健康对照者,肺炎等肺部良性疾病患者血中CEA水平可升高2~3倍[20],CYFRA 21-1可升高50%[21],有50%以上的肺部良性疾病患者CA 19-9等也会有不同程度的升高[22]。另外,本研究采用二元Logistic回归分析对早期NSCLC组与非肿瘤组之间有差异的6种氨基酸(Ala、Glu、Pro、Val、Cit、Orn)和3种肿瘤标志物(CA 19-9、CEA、CYFRA 21-1)进行拟合,筛选出诊断早期NSCLC效能最高的指标组合(Glu+Val+Cit+CYFRA 21-1),其AUC为0.808,敏感性为64.56%,特异性为88.28%。目前,由于外周血肿瘤标志物的敏感性或特异性并不高,且忽视了除经典肿瘤标志物外的其他指标,如补体4[23]、各类载脂蛋白[24]等蛋白组学指标和miR-124a、miR-449a等转录组学指标[25]在NSCLC患者中的变化,因此早期NSCLC的准确诊断尚存在一定的困难。随着各类机器学习算法的发展,最佳指标组合的概念日趋成熟[26],通过算法将各类差异指标进行拟合,可得到由最佳指标组合建立的诊断模型,纳入的指标类型越全面、维度越广,模型的诊断效能越高。
综上所述,血清氨基酸谱的变化与NSCLC的发生、发展有一定关系。由Glu、Val、Cit和CYFRA 21-1组成的最佳指标组合对早期NSCLC有较好的辅助诊断效能。但由于本研究样本量较小,因此结论尚需大样本、多中心研究加以验证。
