三维重建在腹腔镜胰十二指肠切除术中指导血管处理的应用价值初探
2022-02-10吴昊钧梁梦萍陈利平
程 华,吴昊钧,梁梦萍,谭 颖,陈利平
(1.四川大学华西医院重症医学科,四川 成都,610041;2.四川大学华西医院胆道外科;3.华西医院上锦分院普外一科)
腹腔镜胰十二指肠切除术(laparoscopic pancreaticoduodenectomy,LPD)首次报道于1994年[1],被认为是最具挑战性的手术之一。目前临床研究证实了LPD的安全性与可行性,并且患者预后与开腹胰十二指肠切除术相近[2-5]。随着手术技术、术后护理的进步,全世界掌握LPD的肝胆胰外科医生迅速增加[6]。提高手术安全性、优化手术流程、缩短学习曲线、改善患者预后仍是LPD不断努力前进的方向。术中血管处理不当是LPD失败中转的关键因素。基于术前影像的三维重建在LPD的肿瘤可切除性评估、血管变异分析、肿瘤与胆道胰管相关性分析等方面已发挥重要作用,可提高LPD的精确性、安全性[7]。本研究分析单中心20例术前进行三维重建的LPD手术视频,旨在探讨三维重建在LPD术中血管处理方面的应用价值。
1 资料与方法
1.1 临床资料 回顾性收集2020年12月至2022年1月我中心实施LPD的20例患者的手术视频。纳入标准:(1)术前诊断胆总管下段占位、胰腺占位及壶腹部占位拟行LPD;(2)术前行三维重建。排除标准:(1)术中改变手术方式或中转开腹;(2)手术视频缺失。本研究中患者均书面知情同意,经四川大学华西医院伦理委员会同意。
1.2 研究方法 沿门静脉/肠系膜上静脉右侧缘、胰腺上缘做两条交叉直线,将手术区域划分为ABCD四块,见图1,分析术中血管的识别及处理情况。A区称为门静脉右侧区域,术中涉及的血管操作包括保护变异或替代的右肝动脉(right hepatic artery,RHA),离断胰十二指肠后上静脉及自右侧汇入门静脉的其他无名分支静脉。B区称为胰腺上缘区域,该区域的动静脉走行复杂多变。术中涉及的血管操作包括离断胃十二指肠动脉(gastroduodenal artery,GDA)、胃右动脉及少数发出点靠右侧的胰背动脉、冠状静脉、直接汇入门静脉前方的胃右静脉等;需要注意保护的血管结构包括肝动脉系统(肝总动脉、肝固有动脉、左右肝动脉、中肝动脉等)。C区称为肠系膜上静脉右侧区域,浅面需要离断以各种方式汇入肠系膜上静脉的Helen干或其他引流结肠的静脉;深面需要离断进入钩突的动静脉如胰十二指肠下动脉、胰十二指肠下静脉,尽量保护空肠的血管如空肠第一支动脉、空肠第一支静脉等。D区称为胰腺下缘区域,血管操作较少,主要包括保护各种汇入方式的肠系膜下静脉。
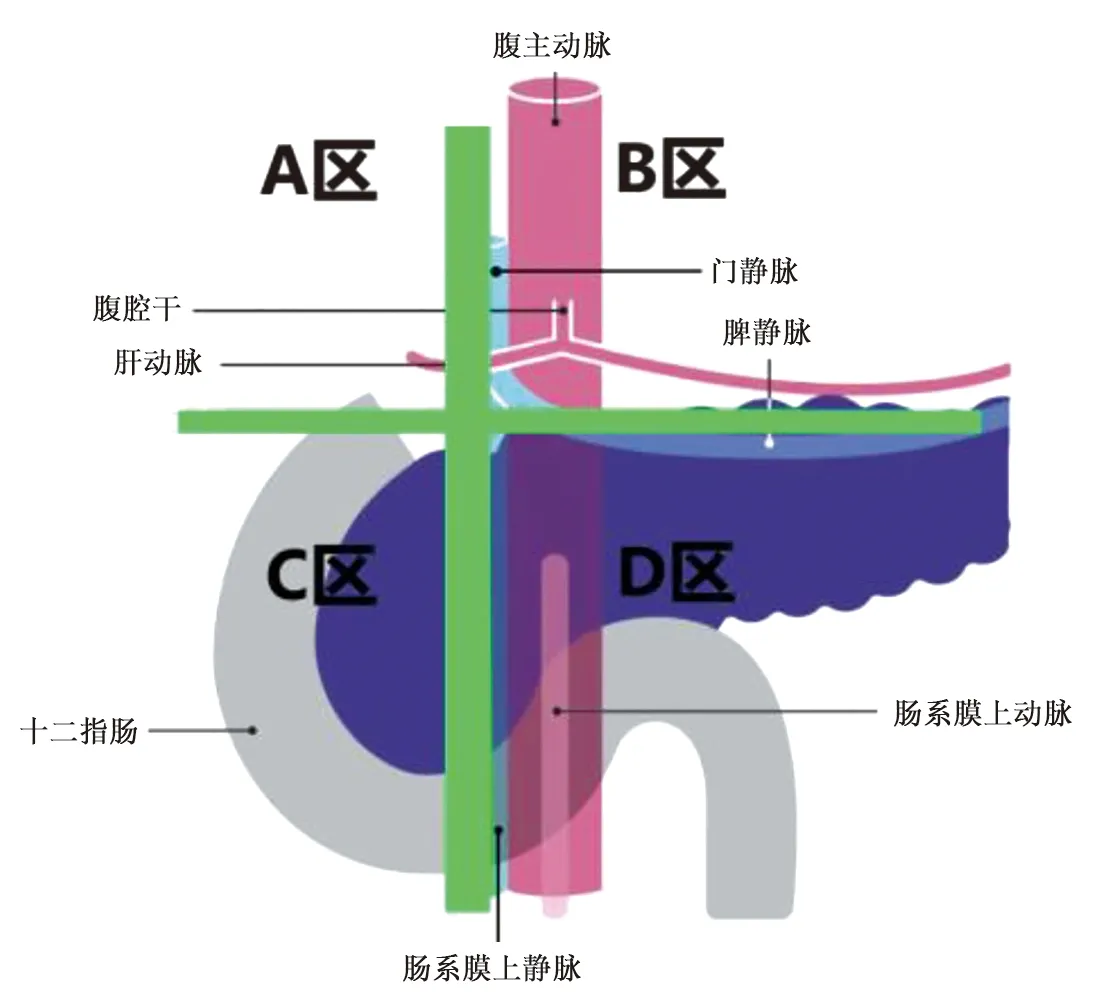
图1 LPD术中手术区域划分
1.3 观察指标 我中心的三名主治医师分别查阅手术视频并对比三维重建,记录4个区域内血管的识别与处理情况。血管的识别定义为视频中操作处理的血管数量与重建是否吻合,由三位观察医师分别做出结论,出现差异时通过协商一致解决。血管的处理定义为保护与结扎。其中保护划分为无损伤、可逆损伤、不可逆损伤3种结局;结扎划分为结扎无出血、结扎后伴远端出血、结扎失败需缝合3种结局,出现差异时通过协商一致解决。
1.4 统计学处理 应用SPSS 26.0软件进行数据分析,双侧检验P<0.05差异有统计学意义。符合正态分布的计量资料以均数±标准差表示,不符合正态分布的计量资料用中位数M(P25,P75)表示,计数资料以率表示,根据情况分别采用t检验、Mann-WhitneyU检验或Fisher精确检验进行组间比较。
2 结 果
2.1 临床资料 本研究共纳入符合标准的患者20例,其中男12例,女8例,平均(54.1±3.8)岁。BMI平均(23.2±0.3)kg/m2。18例患者为ASA Ⅱ级,2例为ASA Ⅲ级。3例患者有腹部手术史。术前中位血红蛋白[122.5(110.8-138.5)g/L]与中位白蛋白[35.6(32.4-41.8)g/L]水平正常,中位总胆红素水平[41.9(11.5-129)mol/L]明显升高。术后病检结果示胰腺导管腺癌8例,胆管癌6例,十二指肠乳头腺癌4例,其他良性疾病2例。
2.2 血管重建与术中血管处理的比较情况 8例(40%)A区域血管处理的总数量与重建吻合。2例(10%)无胰十二指肠后上静脉;2例胰十二指肠后上静脉被肿瘤侵犯术中未处理;共结扎胰十二指肠后上静脉16例,与重建吻合率为31.3%(5/16)。保护变异肝动脉3例(15%),与重建100%吻合,均伴有损伤。结扎其他汇入门静脉右侧缘的粗大静脉支与重建的吻合率66.7%(2/3)。
14例(70%)B区域血管处理的总数量与重建吻合。术中均结扎GDA,重建吻合率100%(20/20)。其中2例(10%)GDA与RHA共干,结扎未出血;1例(5%)GDA同时发出胰背动脉及胃右动脉,GDA结扎未出血,胰背动脉结扎失败,胃右动脉结扎后出血。结扎胃右动脉与重建吻合率70%(14/20),结扎胰背动脉2例(10%),均与重建吻合。肝动脉系统与重建吻合率100%(20/20),5例(25%)存在中肝动脉,3例(15%)RHA主干或分支走行于胆总管腹侧,1例(5%)肝动脉系统的保护操作中误离断(不可逆损伤)胆总管前方的RHA,其余肝动脉系统均为无损伤保护。10例(50%)冠状静脉汇入肠系膜上静脉,结扎4例,保护6例;汇入脾静脉9例(45%),结扎1例,保护8例;冠状静脉分别汇入肠系膜上静脉、脾静脉各1例(5%),予以保护。结扎胃右静脉与重建吻合率69.2%(9/13),12例汇入肠系膜上静脉,1例汇入脾静脉,其中4例结扎失败予以缝合。重建情况及血管的处理情况见表1。12例先离断胰腺、再处理B区域血管,比较先后离断胰腺在B区域血管操作的出血情况,差异无统计学意义(33.3% vs.65.5%,Z=-1.252,P=0.211)。

表1 B(胰腺上缘)区域血管处理情况
2例(10%)C区域血管处理的总数量与重建吻合。Henle干汇入处血管走行与重建吻合率100%(20/20),胃网膜右静脉、上右结肠静脉分别汇入肠系膜上静脉未形成Henle干3例(15%),结肠中静脉汇入上Henle干3例(15%)。82.4%(14/17)结扎Henle干根部。19例可见上右结肠静脉,其中4例(21.1%)无损保留。重建显示16例(80%)存在空肠第一支静脉,术中显露10例,其中2例予以缝扎止血。离断钩突时明确结扎血管共34处,与重建吻合率14.7%(5/34)。
19例(95%)D区域血管处理的总数量与重建吻合,12例(60%)此区域未行血管操作。2例保护结肠中静脉,其中重建未显示1例,发生不可逆损伤。重建显示,肠系膜下静脉汇入脾静脉9例(45%),汇入门静脉8例(40%),汇入脾门静脉汇合处3例(15%)。术中显露其中7例,均无损伤保护。3例行门静脉血管切除的病例解剖悬吊了肠系膜下静脉与脾静脉,暴露出肠系膜上动脉的走行及部分右侧缘,均未见肠系膜上动脉向右侧发出分支。三维重建出的血管在术中均真实存在,未发生术后腹腔出血等血管相关并发症。
3 讨 论
LPD手术操作区域跨度极大,切除过程中需要结扎与保护的动静脉极多。熟练、顺畅的血管处理可避免止血操作,缩短手术时间,也是渡过LPD学习曲线进入成熟期的重要标志[8]。术前三维重建虽然基于术前的CT影像制作,不能提供额外的诊断信息,但可将受制于读片者经验、空间想象能力的误差减至最低,是加强术前解剖认知的便捷工具[9]。有报道称,即使高年资医生也无法通过2D图像始终如一地制定正确的手术切除计划,三维重建提高了术者制定手术切除计划的准确性及手术的能力、信心[10]。通过科学智能的技术手段,LPD术前尽可能地掌握手术区域的血管走行并预判手术风险,在强调发展可视化、精准化、智能化的现代微创外科领域,是值得及有必要的。
本研究中20例LPD的手术视频均为渡过LPD学习曲线上升期后,优先采用动脉优先入路[11]与右侧入路[12]相结合的方式。17例常规LPD、3例门静脉重建LPD在ABC三个区域中的血管操作是相近的,门静脉重建LPD在D区行血管保护的操作明显增多。
门静脉右侧区域即A区域,可能存在变异肝动脉,其变异率高且种类复杂,目前常用Michels与Hiatt分型[13-14]。文献报道[15],由于阅片时的关注点不同,影像科医生仅能发现<30%的变异动脉,而外科医生则能对>50%的病例做出正确判断。本研究中出现替代RHA 3例(15%),借助术前三维重建,其发现率与保护率为100%,保护方式为肝门向足侧解剖时,在门静脉右侧方显示部分动脉鞘后,转为离断钩突时再自足侧向头侧解剖会师,无一例显露动脉根部。3例均伴有可逆损伤,视频可见变异肝动脉均存在发往胰腺的细小动脉,即使已通过术前三维重建明确走行,沿血管鞘右侧用超声刀解剖时仍有出血发生。因此我中心建议,解剖变异肝动脉右侧至可见脉管时,使用合成夹可能更安全。此区域其他的血管处理还包括结扎胰十二指肠后上静脉、偶尔出现的汇入门静脉右侧的其他分支。胰十二指肠后上静脉重建率仅为31.3%,但其出现率较高,位置相对恒定,结扎效果尚可。3例可见肠系膜上静脉右侧分支出现,与重建吻合。我们认为,通过重建了解门静脉右侧有无分支,会使离断头侧钩突更从容,出血更少。
胰腺上缘区域即B区域,是LPD结扎血管失败的相对高发区域。本研究中共统计血管保护66次,与重建吻合率100%,仅1次不可逆损伤,无损保护率98.5%。共结扎血管62次,结扎无出血83.9%,结扎效果按是否重建可见分层比较差异有统计学意义(P<0.05),重建出的血管结扎效果更优。GDA重建率100%,其中高危的类型(如RHA与GDA共干)可于术前通过重建显现,术中加以重视避免损伤。肝动脉在B区域的变化也很多,我中心认为,通过三维重建可明确此区域的肝动脉变异分型,三维重建提供的这些信息如RHA(或中肝动脉)分支位置、RHA走行于胆总管腹侧或背侧等,对于LPD术中个体化解剖肝十二指肠韧带[16]是有帮助的。此外,其他需要处理的血管按照重建率由高到低分别为冠状静脉、粗大的胃右静脉、胰背动脉,本研究中结扎及保护效果各异。按照先后离断胰腺分层分析,虽然两组差异无统计学意义,但此处汇入门静脉的分支由远端向近端分离时容易出血,因此我中心建议,当三维重建显示胰腺上缘的门静脉前方有静脉汇入,或冠状静脉汇入门静脉时,先离断胰腺,显露门静脉后再沿血管鞘解剖B区域的血管。
肠系膜上静脉右侧区域即C区域,浅面的血管操作主要围绕Henle干进行。Henle于1868年首次提出胃结肠静脉干的概念[17]—由胃网膜右静脉与上右结肠静脉汇合形成,于胰腺下缘注入肠系膜上静脉。随后胰十二指肠上前静脉被发现并引入其中,此数支静脉汇入位置相对固定,具体分类复杂多变,胃网膜右静脉、胰十二指肠上前静脉再加一支结肠静脉的形式最为常见,结肠中静脉与副中结肠静脉有时也会参与其中[18-20]。我中心在LPD探查阶段重视下降横结肠系膜,在上右结肠静脉汇入处与钩突下缘有明显距离、不影响手术操作时予以保留。本研究仅有21.1%的上右结肠静脉予以保留,术后未观察到相关并发症发生。有研究认为,对于Henle干及胰腺表面复杂属支的构成,三维重建能帮助外科医师在术前进行有效判断,从而减少术中因不慎牵拉导致的出血[21-22],我中心认为,解剖静脉干时,三维重建提供视野以外血管分支及血管走行的信息,以达到既可将静脉干游离出合适结扎的适当长度,又不损伤静脉分支的目的。深面处理钩突血管时,我中心采用烧灼大束组织后用合成夹结扎的方式,仅10例术中显露空肠第一支静脉,而胰十二指肠下动静脉等因为术中未进行解剖,辨识度差,导致结扎的钩突血管与三维重建吻合率仅为14.7%,但三维重建提供血管的大致数量、位置等信息仍然有指导作用。
胰腺下缘区域即D区域,在此进行的血管操作较少,60%甚至未行血管结扎/保护的操作。3例门静脉重建LPD在此区域显露保护了肠系膜上动脉与肠系膜下静脉,三维重建有助于显示肠系膜下静脉走行、判断肠系膜上动脉右侧缘是否有分支血管。肠系膜下静脉汇入多变,分为汇入脾静脉、肠系膜上静脉、脾门静脉汇合处及肠系膜上静脉左主干型[23]。
本研究将LPD操作划分为A、B、C、D四个手术区域,初步探讨三维重建指导术中血管处理的经验和效果。三维重建还提供很多有助于LPD实施的重要信息。有研究认为,三维重建技术可清晰显示胰头部血管、肿瘤及其周围正常组织的形态、范围,走行、变异情况,胰周、腹腔大血管分支的毗邻关系及肿瘤是否对血管形成推挤、压迫、侵犯等常规二维影像学检查不易观察的情况,为手术关键步骤提供导航,对关键部位快速识别与定位提供有利保障。引导重要脉管的分离、病灶的切除、保护血管分支、实现完整切除病灶、保证切缘阴性、避免重要解剖结构的副损伤,从而提高手术精准性,实现根治性切除,有效降低手术风险[24-26],也被认为是影响LPD术后胰瘘发生的重要因素[27]。LPD中三维重建的应用值得进行更广、更深入的探索。
综上所述,三维重建应用于LPD术中指导血管处理安全可行,部分手术区域的血管显示特异性好,值得推广。其中肝动脉系统、Henle干汇入处重建吻合率100%,而对离断钩突血管操作的指导作用稍差。三维重建在LPD术中的应用范围可继续扩大,应用方式可能继续拓展。
