儿童再生障碍性贫血异基因造血干细胞移植术后免疫重建的临床研究
2022-02-10游红亮汤苗苗李欢欢刘玉峰
游红亮, 汤苗苗, 李欢欢, 刘玉峰, 王 叨
(郑州大学第一附属医院儿童医院血液肿瘤科, 河南 郑州 450052)
再生障碍性贫血(aplastic anemia,AA)是儿童常见的骨髓衰竭性疾病,多认为其发病机制为自身免疫系统紊乱引起的造血功能减低,异基因造血干细胞移植(allogeneic hematopoietic stem cell transplantation,allo-HSCT)是治疗本病的重要方法。移植后免疫功能的重建是影响预后的重要因素,且与移植物抗宿主病(graft-versus-host disease,GVHD)及感染的发生有着密切的关系[1]。目前关于儿童再生障碍性贫血移植后免疫功能重建的报道较少,本研究通过回顾性分析移植后患儿外周血淋巴细胞亚群变化,探讨免疫重建规律,并分析其与急性GVHD(aGVHD)的相关性。
1 资料与方法
1.1一般资料:回顾性分析2017年12月至2019年12月在郑州大学第一附属医院儿童医院血液干细胞移植中心行allo-HSCT 34例AA患儿,其中男性20例,女性14例;中位年龄8岁(1.8~14岁),输血依赖AA 2例,重型AA 14例,极重型AA 18例,诊断标准参考文献[2]。供受者HLA配型:5/10相合15例,6/10、7/10相合各1例,9/10相合4例,10/10相合13例,同胞全相合11例,无关全相合2例。移植前排除移植禁忌症,详细告知患儿家属移植风险,并签署知情同意书。采用简单随机抽样的方法选择同期我院门诊体检的15例健康儿童为对照组,其中男9例,女6例,中位年龄7岁(1~13岁)。研究方案经医学伦理委员会批准,征得患儿家属同意并签署知情同意书。
1.2移植方式及预处理方案:15例采用骨髓联合外周血干细胞输注,19例单用外周血干细胞。预处理采用白舒非(Bu)+氟达拉滨(Flu)+环磷酰胺(CTX)+兔抗人胸腺细胞免疫球蛋白(ATG):Bu0.8mg·kg-1·d-1,-7d、-6d;Flu 40mg·m2·d-1、CTX 600mg·m2·d-1及ATG 3mg·kg-1·d-1为 -5d、-4d、-3d、-2d。供者干细胞动员采用粒细胞刺激因子5~10μg·kg-1·d-1,q12h,皮下注射,共5~6d,于动员第5天开始采集供者骨髓液或外周血干细胞。
1.3aGVHD的诊断与预防:aGVHD的诊断标准参考文献[3],应用环孢素(CsA)+短程甲氨蝶呤(MTX)+霉酚酸酯(MMF)预防aGVHD,具体为:CsA 3mg·kg-1·d-1,-3d开始静脉滴注,胃肠道恢复后改为口服5~8mg·kg-1·d-1,维持在血药浓度150ng~250ng/mL,根据病情逐渐调整剂量;短程MTX +1d 15mg/m2,+3d、+6d、+11d 10mg/m2;MMF 25~30mg·kg-1·d-1,-3d开始口服,至移植后30~60d。发生aGVHD时,应用甲泼尼龙、环磷酰胺、抗CD25单抗及间充质干细胞等。
1.4随访及淋巴细胞亚群检测:随访至2020年6月,中位随访时间549d(3d~1112d),分析移植后患儿淋巴细胞亚群变化及发生aGVHD情况,分为无aGVHD组和有aGVHD组,比较两组淋巴细胞亚群有无差异。MultiSET四色免洗制备外周血淋巴细胞亚群样本,采用流式细胞仪式(FACS Calibur流式细胞仪,美国BD公司)检测移植后第1、3、6、12个月时外周血淋巴细胞亚群比例,15例健康儿童的淋巴细胞亚群作为对照组。
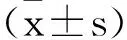
2 结 果
2.1移植后aGVHD发生及生存情况:5例未获得造血重建,29例造血重建成功。中性粒细胞计数>0.5×109L-1的植入中位时间为12.6d(7d~20d)及血小板>20×109L-1的植入中位时间为11d(4d~23d)。13例患儿发生了aGVHD,其中5例Ⅲ~Ⅳ度,8例为Ⅰ~Ⅱ度。皮肤排异I度5例、Ⅱ度1例、Ⅲ度4例,肠道排异Ⅰ度1例、Ⅱ度1例、Ⅲ度4例、Ⅳ度1例,肝脏排异Ⅰ度3例、Ⅲ度1例。至随访结束,存活24例,总生存率为70.59%。死亡10例,其中因aGVHD死亡2例,脓毒血症4例,心力衰竭、重症肺炎、脑出血及消化道出血各1例。
2.2与正常对照组相比淋巴细胞亚群变化:CD3+细胞、CD8+细胞比例在移植后移植后第1、3、6、12个月均高于健康对照组,差异有统计学意义(P<0.05),并呈逐渐下降趋势。CD4+细胞比例、CD4+/CD8+在移植后第1、3、6、12个月均低于于健康对照组,差异有统计学意义(P<0.05),并呈逐渐上升趋势。B细胞比例在移植后第1、3、6个月均低于健康对照组,差异有统计学意义(P<0.05),并呈逐渐上升趋势,在移植后第12个月与健康对照组相比无统计学差异(P>0.05)。NK细胞比例在移植后第1个月高于健康对照组,差异有统计学意义(P<0.05),其后与健康对照组相比无统计学差异(P>0.05)(见表1)。
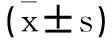
表1 allo-HSCT术后患儿与正常对照组淋巴细胞亚群对比
*P<0.05
2.3无aGVHD组与有aGVHD组相比淋巴细胞亚群变化:无aGVHD组与有aGVHD组相比,CD3+细胞、CD8+细胞比例在移植后第1、3个月较低,NK细胞比例较高,差异有统计学意义(P<0.05)。CD4+细胞比例、CD4+/CD8+、B细胞比例两组间在移植后第1、3个月无明显统计学差异(P>0.05)。在移植后6个月时两组淋巴细胞亚群中除CD4+细胞比例在无aGVHD组与有aGVHD组相比较高外(P<0.05),其他均无明显差异。在移植后12个月时两组淋巴细胞亚群相比均无统计学意义(P>0.05)(见表2)。
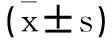
表2 无aGVHD组与有aGVHD组的淋巴细胞亚群对比
*P<0.05
3 讨 论
预防aGVHD与感染是造血干细胞移植成功的关键,而移植后免疫功能的重建与两者密切相关。HSCT后患儿免疫功能的恢复是动态变化的过程,各淋巴细胞亚群的变化又各有自己的规律,密切观察移植后免疫重建的过程有重要的临床意义。
我们研究显示CD3+细胞比例在移植后第1个月时即恢复且高于正常水平(P<0.05),之后逐渐下降,移植后12个月时仍高于正常水平,CD8+细胞比例呈现同样的规律。而CD4+细胞比例虽呈逐渐上升趋势,但恢复较慢,移植后12个月时仍未至正常水平(P<0.05),造成CD4+/CD8+长期倒置,说明早期CD3+细胞中以CD8+细胞为主。Ingham等[4]研究显示CD8+细胞在移植后3~6个月即可恢复正常水平,而CD4+细胞重建可长达1~2年,与本研究结果相似。移植后T细胞免疫重建主要有外周T淋巴细胞的扩增和供者T祖细胞在胸腺内的发育成熟。有研究表明CD8+细胞增殖可不完全依赖胸腺功能,CD4+细胞却依赖胸腺[5]。在移植前患儿均接受较强的化疗,可造成胸腺功能不同程度的损伤,影响胸腺依赖途径细胞的增殖,从而造成CD8+细胞、CD4+细胞恢复时间的不同,出现移植后CD4+/CD8+长期倒置。有研究发现角质细胞生长因子具有保护胸腺细胞和促进其修复的作用[6],前体T细胞输注也可增加胸腺细胞数量和供体的嵌合率[7],但目前临床应用处于探索阶段。
NK细胞比例恢复较快,在移植后第1个月即高于健康对照组(P<0.05),在3个月时降至正常范围,此后保持稳定,与报道相似[8]。B细胞比例在移植后长期低于健康对照组(P<0.05),至移植后12个月时才达到正常范围。有文献报道B细胞在移植后不仅数量增长缓慢,且缺乏成熟B细胞的的功能,对CD4+T细胞依赖的抗体反应长期不能恢复,从而导致移植后患儿体液免疫缺陷,需间断输注丙种球蛋白加强支持。
aGVHD是多种免疫细胞和炎症因子相互作用的结果,是移植后重要的并发症。本组患儿中13例患儿发生了aGVHD,其中5例Ⅲ~Ⅳ度,8例为Ⅰ~Ⅱ度。无aGVHD组与有aGVHD组相比,CD3+细胞、CD8+细胞比例在移植后第1、3个月时较低,NK细胞比例较高,差异有统计学意义(P<0.05)。CD4+细胞比例、CD4+/CD8+、B细胞比例在移植后第1、3个月无统计学差异(P>0.05)。多数研究显示CD8+细胞是引起aGVHD重要效应细胞,而CD4+细胞中的Treg细胞可抑制过度的免疫反应,参与预防aGVHD的发生[9]。有文献发现NK细胞计数与aGVHD的发生呈一定程度的负相关,NK细胞数量较高时,aGVHD发生率越低[10]。有研究报道供者NK细胞在受者体内激活后,可灭活受者体内的抗原递呈细胞,阻断aGVHD的起始环节,发挥抗aGVHD作用[11]。由于B细胞恢复较慢,因此在aGVHD中起到作用有限,但有研究显示B细胞功能缺陷可能与慢性GVHD有关[12]。
综上所述,再生障碍性贫血患儿接受造血干细胞移植术后CD3+细胞、CD8+细胞及NK细胞重建较快,而CD4+细胞、B细胞恢复缓慢。较高的CD8+细胞及较低NK细胞比例是导致aGVHD重要因素。定期检测移植后患儿的淋巴细胞亚群变化有助于了解免疫重建情况及预防aGVHD。