蒺藜苜蓿lncRNA167及其剪切产物miR167c的鉴定和功能分析
2022-02-10张家驹于洁李明娜康俊梅杨青川龙瑞才
张家驹,于洁,李明娜,康俊梅,杨青川,龙瑞才
(中国农业科学院北京畜牧兽医研究所,北京 100193)
长链非编码RNA(long non-coding RNAs,lncRNAs)是存在于真核生物中的一类长度大于200 nt、无蛋白编码能力或编码能力很低的RNA转录本[1]。起初,lncRNA被认为是转录的“噪音分子”,由于它们表达水平低且位置保守,所以被认为是一种不具备生物学功能的副产物[2]。随着高通量测序和生物信息学工具的发展,lncRNAs被证明广泛存在,是构成真核生物转录组的重要成分。目前lncRNA的研究多集中于哺乳动物中,研究证明其错误表达会诱导细胞癌变,并增强癌细胞生长和转移的能力[3]。lncRNA的作用机制和生物学功能复杂多样,可与DNA、RNA、蛋白质分子等相互作用,在染色质、转录和转录后水平起着重要的调节作用。
根据其基因组来源和相对于邻近蛋白编码基因的位置,lncRNA可分为基因间lncRNA(long intergenic noncoding RNAs,lincRNAs)、基因内lncRNA(long intronic noncoding RNAs,incRNAs)以及天然反义转录本(long noncoding natural antisense transcripts,lncNATs)。在哺乳动物中,基因间lncRNA也被称为大型介入性非编码RNA(large intervening noncoding RNA,lincRNA)[4]。基因间lncRNA与编码蛋白基因无任何重叠,基因内lncRNA既与编码蛋白的基因位点重叠,又与内含子位点重叠。而天然反义转录本在基因互补链上与基因的部分外显子序列互补[5]。这类lncRNA可以以顺式或反式的方式调控植物的开花时间、基因沉默、根系器官形成、幼苗光形态形成和繁殖等[6—7]。mRNA在细胞核中产生,并被输出到细胞质中翻译成蛋白质,与mRNA不同的是,大多数lncRNA主要存在于细胞核中,有些可能只存在于细胞质中,也可能同时存在于两个亚细胞室中[8]。相比于早先被大量研究的miRNA,lncRNA目前在植物中的研究还很少,只有很少一部分lncRNA被鉴定,研究前景广阔。
近两年来,大量的研究集中于非生物胁迫相关的lncRNA转录组测序,包括盐[9]、低温[10]、干旱[11]、营养缺乏[12]等。在盐胁迫的研究中,Sun等[13]通过比较转录组测序,鉴定了甜高粱(Sorghum bicolor)中响应盐胁迫的lncRNA,其中包括lncRNA 13472、lncRNA 11310、lncRNA 2846、lncRNA 26929和lncRNA 14798,它们可能是竞争性内源RNA(competing endogenous RNAs,ceRNAs),通过调控离子转运、蛋白修饰、转录调控和物质合成转运等靶基因的表达,影响植物对盐胁迫的响应。Wan等[14]通过综合分析lncRNA与mRNA,揭示lncRNA对于茶树(Camellia sinensis)耐盐性的调控作用,鉴定了172条差异表达lncRNA,其中12条可能作为miRNA靶模拟物的lncRNA。Fu等[15]和Jannesar等[16]也利用转录组测序分别对黄莲花(Pistacia vera)、浮萍(Lemna minor)两种非模式植物中盐响应lncRNA进行鉴定和功能分析。
miRNA是一种广泛存在于高等动植物中的内源性非编码RNA,成熟miRNA长度主要集中在20~24 nt的范围内,在植物中以21或24 nt为主,而在动物中以22 nt为主。miRNA在植物中研究起步稍晚于动物,miRNA 167(miR167)是一个高度保守的miRNA家族,通过下调生长素响应因子6/8(auxin response factor 6/8,ARF6/8)的表达参与植物生长素信号传导,在植物的各种发育过程中发挥关键作用[17—19]。除了ARF6/8外,miR167还可以靶向IAA-Ala Resistant3基因在发育和非生物胁迫中发挥关键作用[20]。目前,大部分miR167的研究集中于拟南芥(Arabidopsis thaliana)、水稻(Oryza sativa)和番茄(Lycopersicon esculentum)中。在拟南芥中,miR167调控ARF6/8控制胚珠和花药的育性[21—22],并且会抑制不定根的产生[23]。最新的研究发现,miR167的突变体开花时间会稍微晚于野生型植株[24]。在番茄中,过表达miR167a的植株叶片变小和节间长度缩短,花瓣、雄蕊和花柱缩短,同时也会引起雄性不育[25]。在水稻中,miR167会调控籽粒灌浆以及淀粉的积累[26—27],且过表达miR167导致水稻分蘖角度变大和植株矮小[28]。在大豆(Glycine max)中,miR167调控生长素应答因子GmARF8a和GmARF8b参与大豆根瘤形成和侧根发育[29]。蒺藜苜蓿(Medicago truncatula)中,暂时没有针对miR167功能的相关研究。
最新的研究表明,拟南芥中存在一种能够被蓝光诱导的lncRNA,其可以作为miR167的内源性目标拟态(endogenous target mimicry,eTM)参与拟南芥光形态的建成和对甘露醇的响应[30]。更早的研究中发现,毛白杨(Populustomentosa)中存在lncRNAARFRL-PtomiR167a-PtoARF8的互作关系,三者在毛白杨木质部的形成过程中发挥重要作用[31]。上述研究表明miR167与lncRNA可能存在互作关系,但均为lncRNA作为eTM抑制miRNA发挥作用,目前在植物中,还没有可以作为miRNA前体的lncRNA被报道。
紫花苜蓿(Medicago sativa)是一种重要的豆科牧草。在实际生产中,土壤盐渍化严重制约紫花苜蓿的产量。蒺藜苜蓿虽然饲用价值不高,但已成为继大豆、百脉根(Lotuscorniculatus)之后的第3种豆科模式植物,常用于研究紫花苜蓿等苜蓿属植物的相关基因分子机制。Wang等[32]和Zhao等[33]近年通过高通量测序,从蒺藜苜蓿中挖掘了一批盐胁迫、低温胁迫和磷元素缺失等非生物胁迫响应lncRNA。但目前为止,功能明确的lncRNA在蒺藜苜蓿中寥寥无几。比如,MtENOD40可以通过蛋白的重定位参与调控蒺藜苜蓿根瘤的形成[34],Mt4作为miR399的ceRNA调控其靶基因PHO2的表达,从而提高蒺藜苜蓿对磷缺乏环境的适应性[35]。上述两个lncRNA均为20世纪末被发现,随着高通量测序的快速发展,lncRNA在蒺藜苜蓿中被大量鉴定,但明确其功能和作用机制的lncRNA依然很少,该领域依然存在很大空白。为填补这一领域的空白,本研究通过转录组测序鉴定了一个盐碱胁迫响应Mt-lncRNA 167,利用生物信息学分析了其编码潜能及其与周围基因间的位置关系,并预测其可能是miRNA 167家族的一个新成员miRNA 167c前体。利用生物信息学软件分析了该lncRNA编码的Mt-miR167c的二级结构、保守性以及靶基因,并检测了Mt-lncRNA 167与Mt-miR167c以及靶基因在不同非生物胁迫处理下(NaCl、聚乙二醇、4℃)的表达水平。通过分析Mt-lncRNA 167与Mt-miR167c超表达拟南芥植株的表型及其表达量水平,初步验证了二者的关系。本研究克隆鉴定一个全新的lncRNA和一个蒺藜苜蓿miR167家族新成员,并初步揭示了二者之间的互作关系,为后续耐盐碱苜蓿的选育提供了一个新的理论支撑。
1 材料与方法
试验于2019年5月—2020年9月在中国农业科学院北京畜牧兽医研究所农业农村部牧草种质资源与育种重点实验室进行。
1.1 植物材料的培养
生态型R108蒺藜苜蓿种子保管于本实验室。砂纸打磨种子表皮破除硬实,使用10%NaClO溶液清洗10 min,然后蒸馏水洗净后放置于铺好滤纸的培养皿中,于4℃春化2~3 d,后转移至人工气候培养箱中(光照16 h/黑暗8 h、温度26℃/22℃、相对湿度60%)。待种子萌发长出两片子叶后,将幼苗移至1/2 Hoagland营养液中培养,营养液购自西美杰生物公司,水培液每周更换一次。
生态型Col-0拟南芥种子用10%NaClO溶液清洗10 min,无菌水洗净后种于1/2 MS(Phytotech,M 519)固体培养基上。4℃春化2~3 d后,移入人工气候培养箱中(光照16 h/黑暗8 h,温度22℃/20℃,相对湿度60%),待长出4片莲座叶后,将其移入土(营养土∶蛭石=1∶1)中生长。
1.2 lncRNA的鉴定
本实验室前期工作中,曾对蒺藜苜蓿R108发芽期间盐碱胁迫响应lncRNA进行高通量测序。本实验的研究对象为测序得到的差异表达lncRNA(genbank accession:MW142219),序列初步分析结果表明其可能剪切形成一种miR167,初步命名为Mt-lncRNA 167。
1.3 Mt-lncRNA 167和Mt-miR167c的克隆
提取1月龄蒺藜苜蓿叶片总RNA(植物总RNA提取试剂盒,上海普洛麦格生物科技公司),反转录为cDNA(Prime Script RT reagent Kit with gDNA Eraser,Takara)。根据测序序列,使用NCBIprimer-blast(https://www.ncbi.nlm.nih.gov/tools/primer-blast/index.cgi)设计PCR扩增引物Mt-lncRNA 167-F/R。使用Takara Ex Taq酶进行扩增,将扩增产物回收纯化后(DNA纯化回收试剂盒,TransGen Biotech)连接T载体(p EASY-T 5 Zero),转入大肠杆菌Trans-T 1,挑取单克隆送至擎科生物公司进行测序。挑选比对正确菌株于40%甘油中低温保存。
根据Ensembl plants中提供的pre-Mt-miR167c序列,分别在上游和下游保留100 bp保护序列设计引物Pre-Mt-miR167c-F/R。从1月龄蒺藜苜蓿基因组DNA中进行扩增,其余步骤与Mt-lncRNA 167克隆相同。
1.4 生物信息学分析
使用Coding Potential Calculator(CPC,http://cpc.cbi.pku.edu.cn/)预测lncRNA的编码蛋白潜力。ORF Finder在线工具预测lncRNA是否存在开放阅读框(open reading frame,ORF)。此外,根据蛋白家族和结构域数据库(Pfam和SMART)的同源性搜索,检索是否存在与其他肽段匹配的功能结构域。通过ensembl plants网站blast确认lncRNA在染色体上的位置。从ensembl plants网站获得Mt-miR167c的前体序列,利用RNAfolder(http://rna.tbi.univie.ac.at/cgi-bin/RNAWebSuite/RNAfold.cgi)在线工具对Mt-miR167c前体的二级结构进行预测。利用在线软件psRNAtarget(http://plantgrn.noble.org/psRNATarget/home)预测Mt-miR167c的靶基因。在小RNA数据库miRbase下载拟南芥、水稻、烟草(Nicotiana tabacum)、大豆等植物的miR167的成熟体序列,使用weblogo(http://weblogo.berkeley.edu/logo.cgi)分析蒺藜苜蓿miR167和数据库中其他植物miR167s成熟序列的碱基保守性。通过MEGA 7.0软件使用邻接法构建不同miR167前体的系统进化树,Bootstrap设置为1000次。利用DNAMAN(Version 9)进行多序列比对。利用Plantcare(http://bioinformatics.psb.ugent.be/webtools/plantcare/)分析Mt-lncRNA 167启动子区域(5′上游2 kb)顺式作用元件。
1.5 植物的非生物胁迫处理与表达分析
Mt-lncRNA 167、Mt-miR167c和靶基因MtARF6/8的组织特异性(根、茎、叶、花)表达分析所用材料来自2月龄蒺藜苜蓿。对于盐(100 mmol·L—1NaCl)的处理,4周龄的水培蒺藜苜蓿分别在处理0、4、8、12、24、48及72 h后收集叶片。对于干旱(5%PEG 6000)和低温(4℃)的处理,4周龄的水培蒺藜苜蓿分别在处理0、2、4、8、12、24 h后收集叶片。转基因拟南芥的阳性鉴定材料来自移入土中后2周龄叶片。每组处理均测定Mt-lncRNA 167、MtmiR167c和靶基因MtARF6/8的表达量。利用荧光定量试剂盒(SYBR Premix ExTaq,Takara;miRcute Plus miRNA qPCR Kit,TIANGEN)在7300 RealTime PCR System上进行扩增,引物序列见表1。所有试验均设置3个生物学重复,数据使用2—ΔΔCT(Livak)方法分析,利用t检验进行显著性分析。

表1 本试验所用到的引物序列Table 1 Primers used in the study
1.6 载体的构建与拟南芥遗传转化
测序比对正确的菌液扩大培养后提取质粒,使用无缝克隆的方法,设计连接目的基因与载体的接头,通过无缝克隆试剂盒(p EASY-Uni Seamless Cloning and Assembly Kit)连接至p CAMBIA 3301载体,转化p CAMBIA 3301-Mt-lncRNA 167、p CAMBIA 3301-Mt-miR167c至大肠杆菌Trans-T 1中,挑取阳性单克隆送至擎科生物公司进行测序。转化测序正确重组载体至农杆菌中(GV 3101,华越洋)。使用YEB液体培养基将农杆菌摇至OD600值为0.6~0.8,离心收集菌体,重悬浮于5%蔗糖溶液(含0.02%SilwetL-77,上海生工),之后采用花序侵染法转化拟南芥。收获T0代种子使用草铵膦(4 mg·L—1)筛选转基因阳性植株。
1.7 转基因拟南芥中Mt-lncRNA 167和Mt-miR167c的鉴定和表达量分析
在含有草铵膦的培养基中筛选幼苗,提取DNA,以Mt-lncRNA 167-F和GUS为引物进行PCR阳性鉴定,分别获得12株T0代Mt-lncRNA 167转基因拟南芥、8株T0代Mt-miR167c转基因拟南芥。以MtActinF和MtActinR为内参基因引物,鉴定不同转基因株系中Mt-lncRNA 167和Mt-miR167c的表达量。所有试验均设置3个生物学重复,数据使用2—ΔΔCT(Livak)方法分析,利用t检验进行显著性分析。
1.8 转基因拟南芥花粉的收集与体外萌发
花粉的收集和体外萌发方法参照孙春丽等[36]的方法,拟南芥花粉进入成熟期时(大概在幼苗移栽20 d后),在上午10:00左右开始取花,此时花盛开并且具有最大散粉量。采摘50朵主茎上露白或刚刚盛开的花朵,置于1.5 mL离心管中,加入BK萌发液700μL,BK萌发液配方为5 mmol·L—1硼酸,8 mmol·L—1MgSO4·7H2O,1mmol·L—1KCl,5 mmol·L—1CaCl2,10 mmol·L—1肌醇,5 mmol·L—1MES。蔗糖浓度为20%,用KOH调p H值至7.0。在振荡器上振荡1 min,将上清液转移至新离心管中,重复1次上述操作,将2次收集的上清液12000 r·min—1离心1 min沉淀花粉。
将上述收集好的花粉用BK萌发液悬浮,平铺到含0.5%琼脂糖的BK萌发培养基上,将培养皿封口以保持湿度,放置于23°C光照恒温箱中培养,8 h后使用显微镜观察花粉萌发情况。
1.9 转基因拟南芥的下胚轴长度测量与耐盐性鉴定
将拟南芥野生型(wild type,WT)与T2代超表达拟南芥种子消毒并清洗后(10%NaClO溶液消毒10 min,无菌水冲洗6~8遍),种植于1/2 MS固体培养基中,春化2 d后移入人工气候培养箱,等待其生长7 d,用镊子将其移出,拍照并用直尺测量下胚轴长度。
按 照 上 述 方 法 消毒并清 洗 拟 南 芥 种 子,将其分 别 种 植 于0 mmol·L—1NaCl、125 mmol·L—1NaCl、0 mmol·L—1Mannitol、100 mmol·L—1Mannitol的1/2 MS固体培养基中(每皿种植50粒,3组重复),春化2 d后,移入人工气候培养箱中每日统计发芽率。
1.10 数据处理
采用Excel 2016统计分析实验数据,结果以平均值±标准误表示。用IBM SPSS Statistics 26、Excel 2010、MEGA 6.0等软件作图。
2 结果与分析
2.1 Mt-lncRNA 167、Mt-miR167c的鉴定与生物信息学分析
Mt-lncRNA 167为长度1444 bp的RNA长链。使用Coding Potential Calculator(CPC,http://cpc.cbi.pku.edu.cn/)预测lncRNA的编码潜力以及采用ORF Finder在线工具预测lncRNA是否存在ORF,发现MtlncRNA 167编码能力为负值,不存在长度大于30的ORF,故Mt-lncRNA 167符合lncRNA的基本特征。通过ensembl plants网站blast确认该lncRNA在染色体上的位置,发现Mt-lncRNA 167位于4号染色体25786943—2578838位置,且与一个已注释的miR167在位置上重合(图1A),分析Mt-lncRNA 167可能是该miR167的前体,作为miR167的前体发挥作用。从ensembl plants网站获得Mt-miR167c的前体序列,利用RNAfolder对MtmiR167c前体的二级结构进行预测(图1B),最小折叠自由能(minimum free energy,MEF)为—37.5 kcal·mol—1,能形成稳定的茎环结构,与蒺藜苜蓿中本来存在的Mt-miR167a、Mt-miR167b结构相似,故按照顺序将其命名为Mt-miR167c。预测其成熟体位于茎环结构5′端,序列为:5′-UGAAGCUGCCAGCAUGAUCUU-3′。利用DNAMAN(Version 9)将Mt-miR167c与蒺藜苜蓿中miR167a/b成熟体序列和拟南芥中miR167a/b/c/d进行比对,发现他们的序列相似度为93.96%。且在蒺藜苜蓿中,三者只在最后一位有所差异(图1C)。
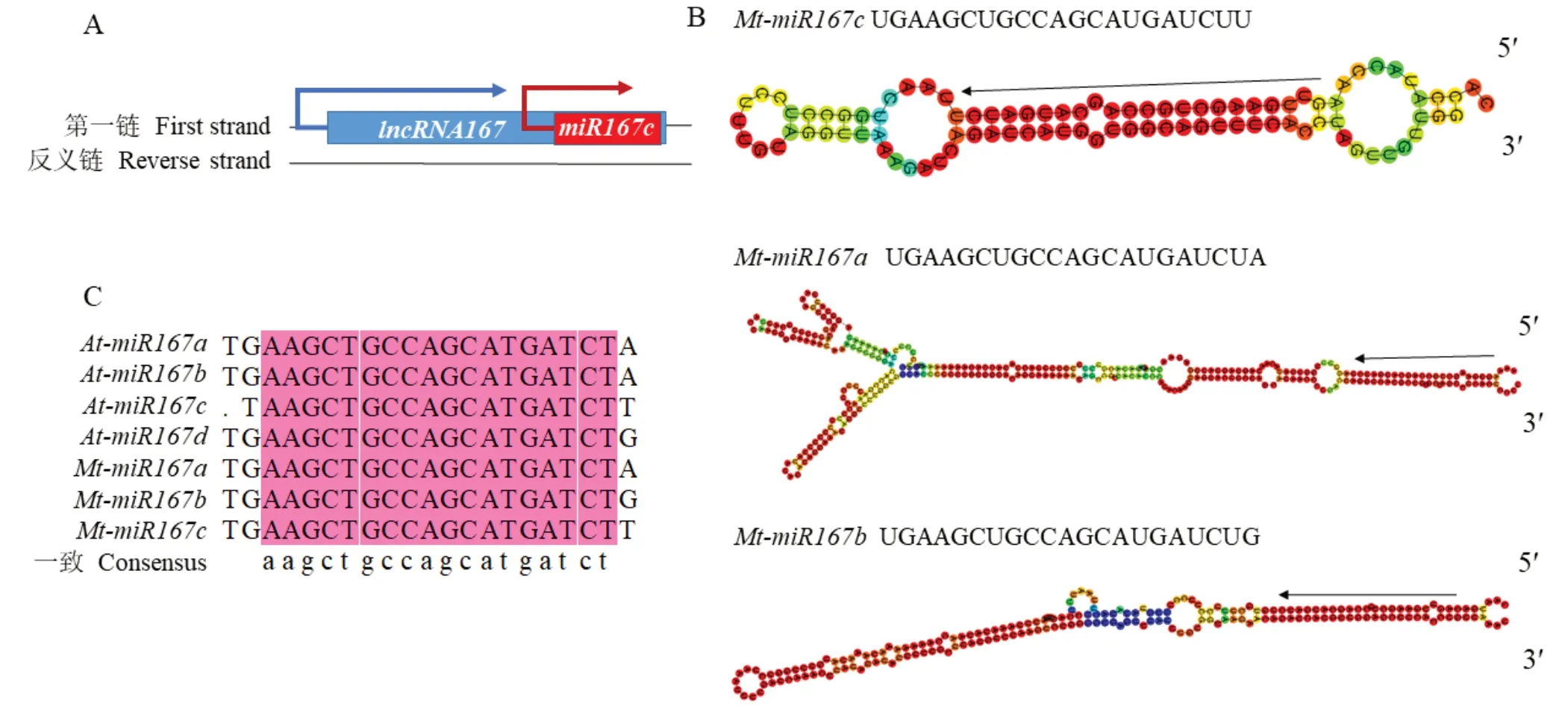
图1 Mt-lncRNA167与Mt-miR167c的鉴定Fig.1 Identification of Mt-lncRNA167 and Mt-miR167c
在小RNA数据库中下载拟南芥、水稻、烟草、大豆等植物的共73个miR167的前体序列及成熟体序列,使用weblogo(http://weblogo.berkeley.edu/logo.cgi)分析蒺藜苜蓿miR167和数据库中其他植物miR167成熟序列的碱基保守性,结果表明miR167家族在不同物种中具有很高的保守性,在3、15位上的碱基保守性最高(图2)。且蒺藜苜蓿miR167c序列与其他miR167家族大部分序列保持一致,说明miR167家族在进化上保守。

图2 miR167成熟体序列碱基保守性分析Fig.2 Analysis of base conservatism of miR167 mature sequence
选取主要模式植物及主要经济作物包括拟南芥、烟草、大豆、蒺藜苜蓿、花生(Arachis hypogaea)、番茄、马铃薯(Solanum tuberosum)、小米(Setaria italica)、陆地棉(Gossypium hirsutum)、水稻、百脉根、玉米(Zea mays)、高粱、小麦(Triticum aestivum)、二穗短柄草(Brachypodium distachyon)15个物种中共17个miR167前体构建系统发育树(图3)。由于miR167家族在不同物种中极其保守,故发育树并未表现出明显的进化规律。同属茄科的番茄和马铃薯聚为一支,豆科植物蒺藜苜蓿miR167a和b分别与陆地棉和烟草具有更近的亲缘关系。而Mt-miR167c与同属豆科的花生亲缘关系最近。进化树将17个miR167分为两个亚类,第一亚类大部分是来自豆科、茄科的双子叶植物,第二亚类大部分是来自禾本科的单子叶植物。但这并不绝对,比如第一亚类中存在一个小米的miR167,第二亚类中包含来自豆科的大豆和百脉根的miR167。
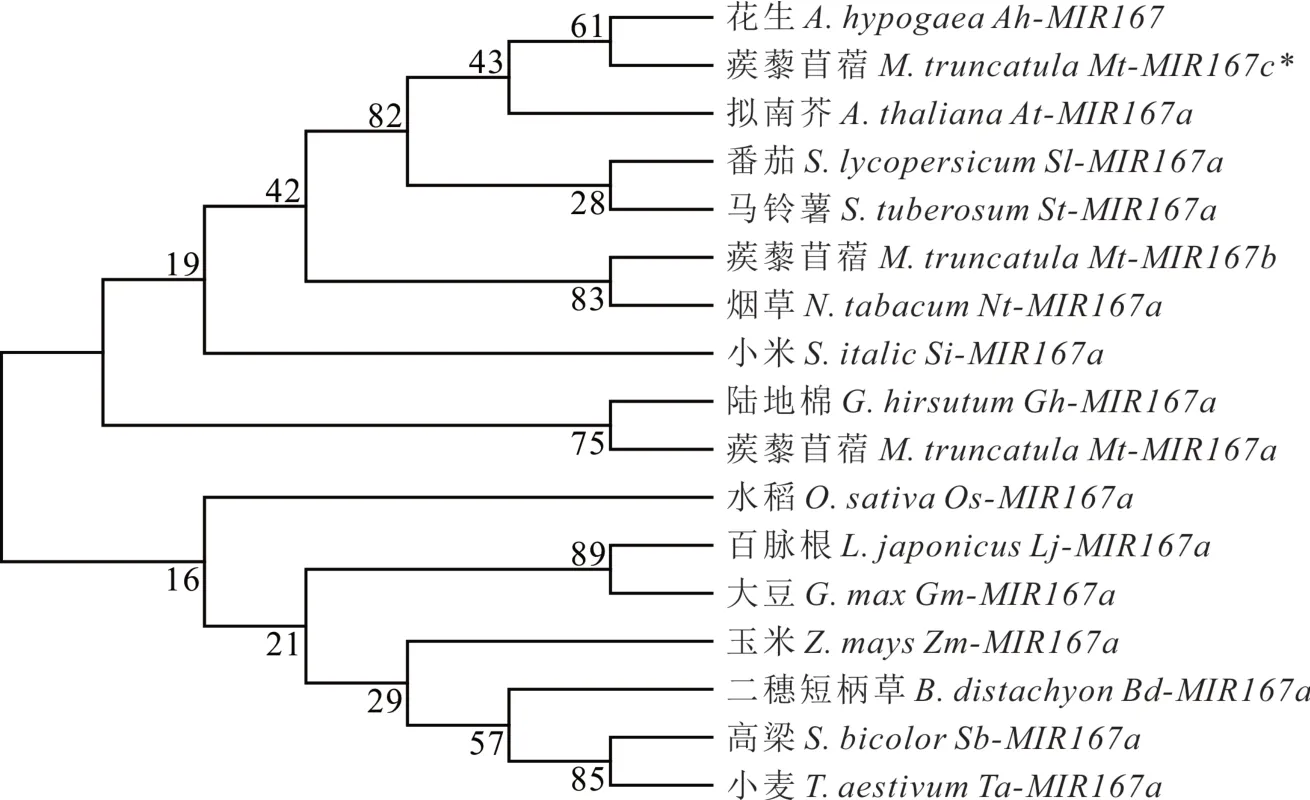
图3 pre-miR167s的亲缘关系树Fig.3 Phylogenetic tr ee of pre-miR167s
用在线软件PlantCARE(http://bioinformatics.psb.ugent.be/webtools/Plantcare/html/)对转录起始位置上游长度为2 kb启动子区域序列进行分析。发现在Mt-lncRNA 167启动子区域中,存在着响应干旱、水杨酸、低温和光的顺式作用元件,说明Mt-lncRNA 167可能在植物非生物胁迫抵抗中起到作用(表2)。利用在线软件psRNAtarget预测Mt-miR167c的靶基因,结果表明,蒺藜苜蓿中miR167c预测靶基因包括生长素响应因子、E3泛素蛋白连接酶编码基因和RNA聚合酶Ⅱ转录中介蛋白编码基因等。由于ARF6/8评分最高,且在其他物种中有所研究,故将MtARF6/8列为本研究对象[13](表3)。

表2 Mt-lnc RNA167的启动子顺式作用元件分析Table 2 Cis-acting element analysis of pr omoter of Mt-lnc RNA167
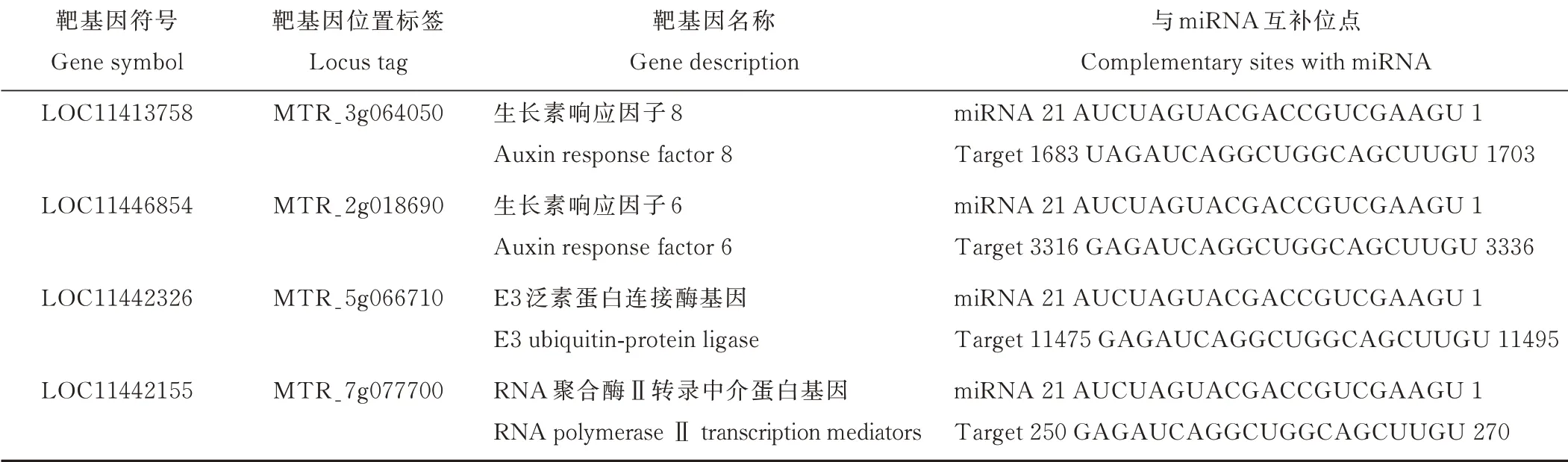
表3 psRNAtarget预测Mt-miR167c的靶基因Table 3 Prediction of the target gene of Mt-miR167c by psRNAtarget
2.2 Mt-lncRNA 167和Mt-miR167c的表达模式分析
Mt-lncRNA 167在蒺藜苜蓿的根、茎、叶、花中均有表达,在茎中的表达量最低,在叶中的表达量最高,是茎的17倍,根和花中的表达量相似,分别是茎中的7.3和7.6倍(图4)。Mt-miR167c表达模式与Mt-lncRNA 167相似,在叶中表达量最高,是根的48.3倍,其次在花中表达量较高,为根的10.6倍。靶基因MtARF6和MtARF 8与之相反,在叶片中表达量低,在花中表达量最高,分别为根的33.6和22.3倍。

图4 Mt-lncRNA167、Mt-miR167c、MtARF6/8在不同组织中的表达Fig.4 The relative expression of Mt-lncRNA167,Mt-miR167c,MtARF6/8 in different tissues of M.truncatula
针对Mt-lncRNA 167启动子序列中存在的各种顺式作用元件的功能,研究了Mt-lncRNA 167以及MtmiR167c在盐、低温、干旱等胁迫条件下的表达情况。结果显示Mt-lncRNA 167和Mt-miR167c在不同的非生物胁迫处理下均有响应,但各不相同(图5~7)。
在100 mmol·L—1NaCl处理下,Mt-lncRNA 167的表达量在处理之初(4 h)显著升高,约为对照的2.7倍。之后表达量略有下降,但一直高于对照(1.1~1.7倍)。表明Mt-lncRNA 167的表达量只受到盐胁迫的短暂诱导,并不能长期响应。与之相应的,Mt-miR167c的表达量也随着处理时间的累计呈上升趋势,并且在所有时间点显著高于对照,在8 h处理后达到最高值(为对照的2.7倍)。Mt-miR167c靶基因MtARF 6和MtARF8的表现与其相反,在处理之初MtARF6和MtARF8均受到显著抑制,二者表达量均在处理12 h时达到最低值(均约为对照的0.4倍)。但相比于MtARF6,盐处理对MtARF8的抑制效果更持久。直到处理72 h,MtARF8的表达量依然为对照的0.4倍,但MtARF6的表达量在24 h后开始上升并超过对照。总体来看,在盐处理的情况下,Mt-lncRNA 167和Mt-miR167c的表达量上升,而MtARF6/8的表达量呈下降趋势(图5)。
图5 Mt-lncRNA167、Mt-miR167c、MtARF6/8在盐胁迫(100 mmol·L-1 NaCl)处理下的表达Fig.5 The r elative expr ession of Mt-lncRNA167,Mt-miR167c,MtARF6/8 under NaCl(100 mmol·L-1)tr eatment
在4℃的低温处理下,Mt-lncRNA 167表达量在所有时间点均显著下降。Mt-miR167c的表达趋势与其相同,在所有处理时间点均显著下降,在24 h达到最低值(为对照的0.4倍)。MtARF6和MtARF8表达量也呈现显著下降趋势,特别是MtARF6,在所有时间点均显著降低。MtARF8表达量在低温处理8 h时达到最低(为对照的0.4倍)。故在低温处理下,Mt-lncRNA 167与Mt-miR167c表达趋势相同,均为显著下降。靶基因MtARF6和MtARF8也呈现显著下降趋势(图6)。
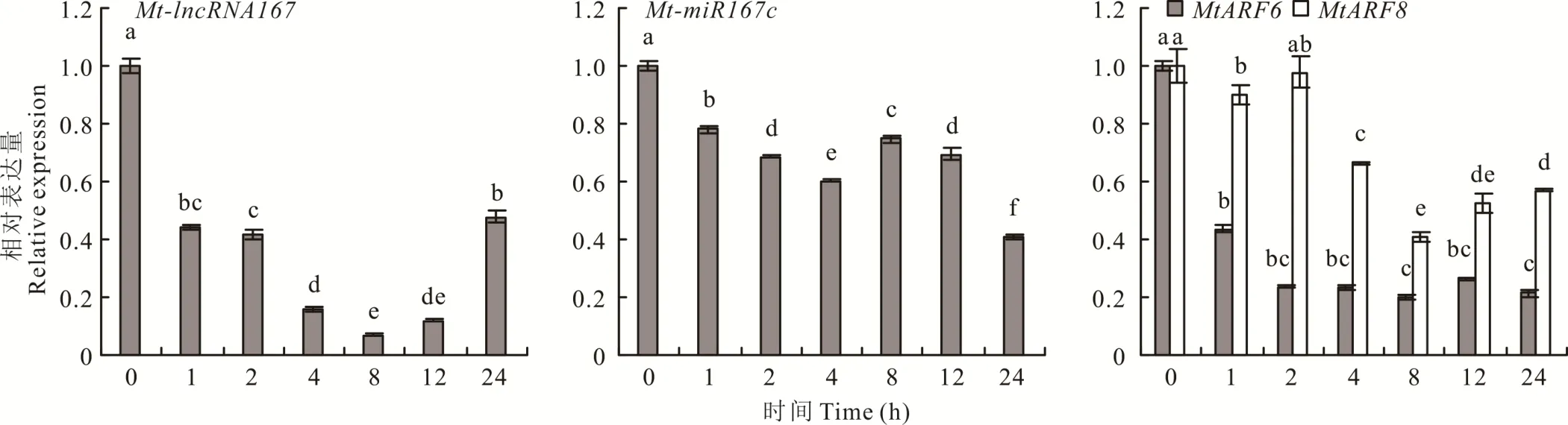
图6 Mt-lncRNA167、Mt-miR167c、MtARF6/8在低温胁迫(4℃)处理下的表达Fig.6 The r elative expr ession of Mt-lncRNA167,Mt-miR167c,MtARF6/8 under cold str ess(4℃)tr eatment
在5%PEG 6000的干旱处理下,Mt-lncRNA 167表达水平存在波动,总体保持上升的趋势,在处理8 h时表达水平最高,达到对照组的1.9倍。Mt-miR167c表达水平也在处理下上升,但升高幅度较小,在处理2 h时达到峰值(为对照的1.3倍)。MtARF 6和MtARF 8表达水平均先下降再升高,二者均在处理2 h时达到最低(分别为对照的0.1和0.5倍)。故在干旱情况下,Mt-lncRNA 167与Mt-miR167c表达趋势相同,与MtARF6/8表达趋势相反(图7)。

图7 Mt-lncRNA167、Mt-miR167c、MtARF6/8在干旱胁迫(5%PEG 6000)处理下的表达Fig.7 The relative expression of Mt-lncRNA167,Mt-miR167c,MtARF6/8 under drought(5%PEG 6000)treatment
故lncRNA 167-miR167c-ARF 6/8三者都可以响应不同的非生物胁迫。在3种非生物胁迫下,Mt-lncRNA 167与Mt-miR167c的表达趋势均呈正相关,符合二者互作关系的预测,即Mt-lncRNA 167作为Mt-miR167c的前体。在盐胁迫和干旱胁迫下,Mt-miR167c的表达量与MtARF6/8的表达量趋势相反,符合二者为Mt-miR167c靶基因的预测,即Mt-miR167c会在MtARF 6/8转录后发生作用,在特定位点切割mRNA,抑制其表达水平。但在低温胁迫下,MtARF6/8与Mt-miR167c表达水平正相关。
2.3 超表达Mt-lncRNA 167、Mt-miR167c转基因拟南芥的分析
为验证Mt-lncRNA 167、Mt-miR167c的功能以及二者之间的关系,分别构建35S∶∶Mt-lncRNA 167-GUS和35S∶∶Mt-miR167c-GUS载体,采用花序侵染法转化拟南芥(Col-0)。使用4 mg·L—1草铵膦筛选T0代种子。共筛选出11个Mt-lncRNA 167转基因株系(OE1~11)和8个Mt-miR167c转基因株系(OE1~8)。对转基因植物(T2)的Mt-lncRNA 167和Mt-miR167c转录水平验证表明,与野生型(WT)相比,转基因拟南芥中Mt-lncRNA 167与Mt-miR167c均异位表达,且不同株系中表现差异大(图8A,B)。如Mt-lncRNA 167超表达植株表达量最高的OE9为最低的OE11的49.9倍,Mt-miR167c超表达植株表达量最高的OE3为最低的OE1的23.5倍。
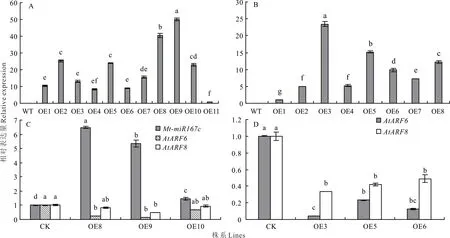
图8 超表达拟南芥中Mt-lncRNA167、Mt-miR167c的表达量分析Fig.8 Analysis of the relative expression level of Mt-lncRNA167 and Mt-miR167c in the overexpressed Arabidopsis
此外,本研究分别在超表达Mt-lncRNA 167和超表达Mt-miR167c拟南芥中选取3个株系进行靶基因ARF6/8表达量的检验(图8C,D)。结果可以看出在超表达Mt-lncRNA 167的8、9、10号株系中,Mt-miR167c的表达量也有所上升,如在株系8中,Mt-miR167c的表达量上升至对照的6.5倍。相应地,Mt-miR167c的靶基因ARF6/8在超表达拟南芥植株中表达量降低,但ARF 6的降低幅度大于ARF 8,如在株系9中,ARF6的表达量降低至对照的0.2倍,而ARF 8仅降低至对照的0.5倍。在超表达Mt-miR167c的株系3、5、6中,ARF6和ARF8表达量也呈降低趋势。相同的是,ARF6的降低幅度依然大于ARF8。如在株系3中,ARF6表达水平低于对照的0.1倍,而ARF8仅降低至对照的0.3倍。同时,本研究发现超表达Mt-lncRNA 167对ARF6/8的抑制效果弱于直接超表达Mt-miR167c。
超表达Mt-lncRNA 167和Mt-miR167c植株均表现出生育缺陷的表型,在转基因拟南芥中,果荚和花丝显著缩短,花药不能正常释放花粉,花粉粒萌发率低。WT花瓣正常开放,而超表达Mt-lncRNA 167和Mt-miR167c拟南芥花瓣闭合(图9A,C~E)。WT角果延长且饱满,而超表达Mt-lncRNA 167和Mt-miR167c拟南芥角果很短,不向外延长(图9B)。使用显微镜观察可知,超表达Mt-lncRNA 167和Mt-miR167c拟南芥与WT具有相同结构和数量的花器。但剥开花瓣与萼片可观察到,与WT相比,超表达Mt-lncRNA 167和Mt-miR167c株系的雄蕊花丝过短,导致花药无法接触柱头完成正常授粉(图9F~H)。这种特殊的结构特征可能是超表达Mt-lncRNA 167和Mt-miR167c株系表现出生育缺陷的原因。

图9 Mt-lncRNA167、Mt-miR167c超表达拟南芥的花结构Fig.9 The flower str ucture of over expr essed Mt-lnc RNA167 and Mt-miR167c Arabidopsis
另外,超表达Mt-lncRNA 167和Mt-miR167c植株的下胚轴显著长于WT(图10)。超表达Mt-lncRNA 167和Mt-miR167c植株下胚轴均显著延长,但超表达Mt-miR167c植株子叶明显偏小、展开程度低,超表达MtlncRNA 167植株的子叶却与WT相似。且超表达Mt-miR167c植株下胚轴也显著长于超表达Mt-lncRNA 167的植株。
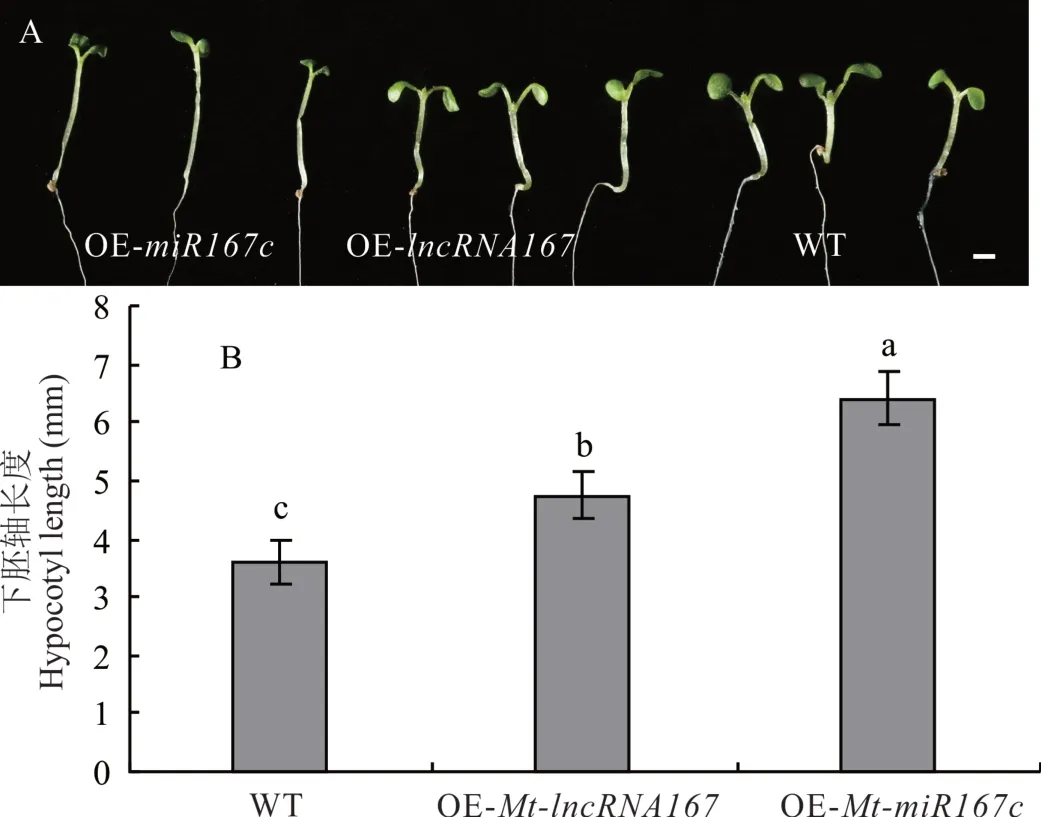
图10 WT和超表达拟南芥的幼苗和下胚轴长度Fig.10 Seeding and hypocotyl length of WT and overexpressed Arabidopsis
通过花粉离体培养试验测定植株花粉活力,结果显示,同一大小视野中Mt-lncRNA 167和Mt-miR167c超表达植株花粉数量明显较少,说明花药不正常释放花粉(图11)。以花粉管伸出长度大于花粉直径为准,随机选取5个视野,统计花粉萌发百分比,WT在萌发培养基中8 h后萌发率可达50%,超表达植株花粉活力显著弱于WT。
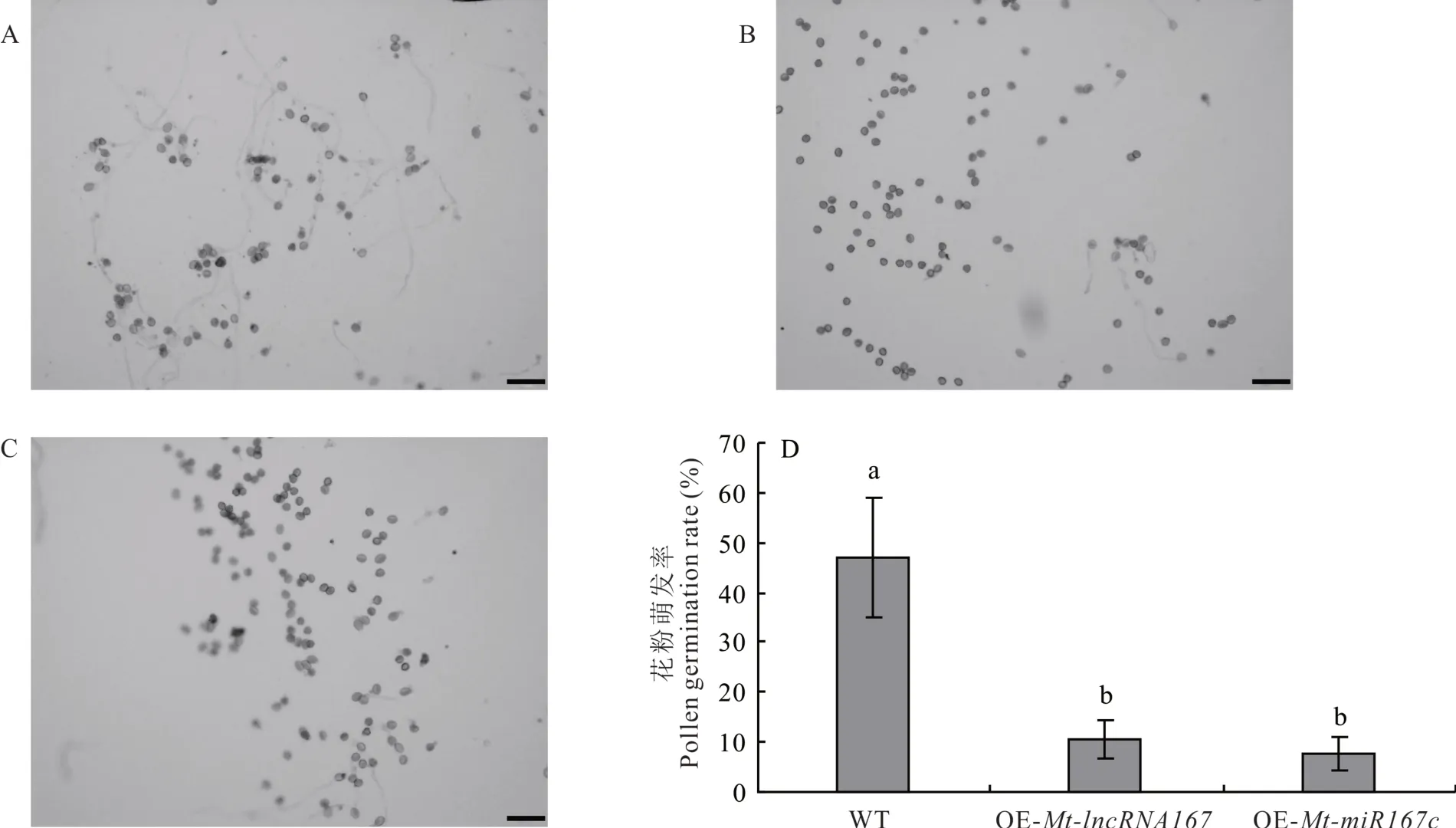
图11 拟南芥花粉的体外萌发Fig.11 In vitro germination of Arabidopsis pollen
为验证Mt-lncRNA 167与Mt-miR167c对拟南芥非生物胁迫抗性的影响,分别在盐胁迫(125 mmol·L—1NaCl)和干旱胁迫(100 mmol·L—1Mannitol)下,对野生型和T2代超表达拟南芥进行每日发芽率测定。在对照条件下,超表达Mt-lncRNA 167和Mt-miR167c的拟南芥和WT最终发芽率基本一致,均能达到100%的发芽率。在盐胁迫(125 mmol·L—1NaCl)处理下,WT和超表达植株均受到了一定程度的抑制,发芽时间晚于对照。Mt-lncRNA 167和Mt-miR167c超表达植株的最终发芽率显著大于WT,且在发芽过程中,发芽率也高于WT(图12A,B)。在干旱胁迫下,植株发芽时间没有推后,且最终发芽率在不同株系中没有明显差异(图12C,D)。但干旱胁迫对WT的抑制程度明显大于超表达植株,发芽第2天,超表达MtlncRNA 167和Mt-miR167c拟南芥发芽率可分别达到35.3%和41.3%,WT的发芽率仅为16.0%(图12D)。故在盐胁迫和干旱胁迫中,WT均比超表达植株受到更严重的抑制,说明超表达MtlncRNA 167与Mt-miR167c增强了拟南芥对盐和干旱胁迫的抗性。

图12 不同浓度盐胁迫和干旱胁迫下转基因拟南芥的发芽率Fig.12 Ger mination rate of over expressed Arabidopsis under differ ent salinity and dr ought stress
3 讨论
近年来,高通量测序等新兴技术的出现,极大地提高了对lncRNA的功能意义和作用机制的认识。lncRNA被普遍定义为长度超过200 nt的非编码RNA,其作用机制和生物学功能复杂多样,可与DNA、RNA、蛋白质分子等相互作用,在染色质、转录和转录后水平起着重要的调节作用。目前有关lncRNA与miRNA关联的研究,主要集中在两个方面。一方面是lncRNA可以作为eTM发挥作用,即lncRNA通过结合miRNA最终裂解,导致miRNA表达水平下降无法发挥作用,最终使得miRNA的靶基因无法受到抑制。随着生物信息学和测序技术的发展,这种关系在植物中被广泛报道,但真正得到证实的却有限。INDUCED BYPHOSPHATE STARVATION 1(IPS1)是植物中第一个发现的eTM,IPS1可以结合miR399,抑制miR399的活性,增加靶基因PHO2的表达,维持植物在磷酸盐饥饿条件下的正常生长[37]。另一方面,是lncRNA作为产生miRNA或siRNA(small interfering RNA)的前体而产生作用。根据lncRNA的定义来说,miRNA和siRNA的前体由于不编码蛋白质,也属于lncRNA的一种。在植物中,这种作用模式研究较少,且只有关于产生siRNA的研究。比如在桑树(Morus alba)中,Mulnc1被muli-mir3954裂解,产生si16157可以靶向并沉默桑树中CML 27的表达,该基因在介导植物抗逆性方面发挥着重要作用[38]。关于lncRNA作为miRNA前体的研究,只在动物中有报道过,比如lncRNAmiR100 mg产生miR-100和miR-125b可介导西妥昔单抗耐药性[39],lncRNAH 19的第一外显子区可编码产生miR-675-5p/3p[40]。故本研究将目光聚焦于能编码miRNA、作为miRNA前体发挥作用的lncRNA,初步揭示其互作关系和功能。
在本实验室的前期工作中,对蒺藜苜蓿R108发芽72 h的材料进行了lncRNA深度测序,得到了大量响应盐胁迫的lncRNA。早在2015年,Wang等[32]通过高通量测序鉴定了蒺藜苜蓿中参与渗透胁迫和盐胁迫的lncRNA,但其研究材料为受到渗透胁迫和盐胁迫的叶片和根组织。本实验室的转录组测序来源于萌发幼苗组织,故测得大量与之不同的lncRNA样本。其中,Mt-lncRNA 167因与miR167家族成员存在特殊的位置关系而引起注意,初步分析Mt-lncRNA 167作为此miR167的宿主前体发挥作用,可以促进该miR167的表达。
通过两种不同的在线工具分析了Mt-lncRNA 167的编码潜能,均证明Mt-lncRNA 167是一个不能编码肽段的RNA片段,故证实了其为lncRNA。miRNA的前体常形成茎环状的二级结构,成熟的miRNA序列会位于茎环结构的茎部区域[41]。为证实新miR167确实属于蒺藜苜蓿miR167家族,预测了该miR167前体的二级结构,发现其与Mt-miR167a/b同样形成茎环,且成熟体位于5′端茎部。该miR167成熟体序列与Mt-miR167a、Mt-miR167b仅在最后一位有差距。植物miR167是一个保守性很高的家族,新miR167成熟体与大部分植物体内miR167成熟体序列一致,故该miR167确为Mt-miR167家族成员,命名为Mt-miR167c。至此,本研究分别在蒺藜苜蓿中鉴定了一个全新的lncRNA和属于miR167家族的一个新成员Mt-miR167c。
根据Mt-lncRNA 167启动子区域的预测,对Mt-lncRNA 167和Mt-miR167c以及靶基因ARF6/8进行不同逆境处理下的表达模式分析。总体来看,在盐处理下,Mt-lncRNA 167和Mt-miR167c的表达量上升,且ARF6/8的表达量呈下降趋势。在低温处理下,Mt-lncRNA 167表达量与Mt-miR167c表达趋势相同,均为显著下降,但靶基因ARF6和ARF8也呈现显著下降趋势。在干旱情况下,Mt-lncRNA 167与Mt-miR167c表达趋势相同,表达量显著升高,而ARF6/8表达呈先下降再升高趋势。可以看出,在3种胁迫处理中,Mt-lncRNA 167与Mt-miR167c表达量均表现出了相同的变化趋势,这与之前的研究结果相符,即作为miRNA前体的lncRNA应与miRNA表达模式相同[39—40]。在盐胁迫与干旱胁迫中,miR167c与靶基因ARF6/8表达水平是相反的,由于miRNA的作用原理为切割或翻译抑制靶基因的表达水平[42],再结合其他植物中关于miR167靶基因的报道,可以初步判定MtARF6/8为miR167的靶基因。但二者负相关的表达趋势也并不存在于胁迫条件,比如在蒺藜苜蓿受到低温胁迫时,miR167与ARF6/8就同时下降。分析其原因,由于ARF与其他的转录因子不同,其在植物体内既可以作为激活因子也可以作为抑制因子。ARF作为激活因子会结合生长素应答基因启动子中的TGTCTC生长素应答元件(auxin response elements,AuxRE),介导以生长素为中心的转录调控[43]。ARF作为抑制因子可以通过与激活剂ARFs异二聚或竞争DNA结合位点来抑制其转录活性[44]。基于ARF转录因子家族的复杂性,且由于miRNA作用于靶基因的调控方式为转录后调控,在生物体中还存在着大量的转录前调控因子,故即便miRNA表达量下降,并未对靶基因mRNA长链进行切割,但由于低温条件下其他调控因子的存在,ARF6/8基因依然受到了抑制。本研究认为ARF6/8在低温胁迫下不仅受到miRNA的转录后调控,也可能存在一些启动子区域的转录前调控,故二者关系不符合严格的负相关。
将Mt-lncRNA 167和Mt-miR167c均在拟南芥中超表达,得到了与超表达At-miR167相同的表型[21],即角果不延长,花丝异常短,花药不能正常释放花粉,花粉粒不萌发。通过体式显微镜的观察可知,转基因植株的花器官数量虽与WT相同,花丝长度却明显短于WT,这导致花药并不能接触柱头完成授粉。且花粉体外萌发试验证明,Mt-lncRNA 167和Mt-miR167c超表达植株花粉数量和花粉活力都明显低于野生型。这表明Mt-miR167c与其家族的其他成员一样,在植物生长繁殖中发挥重要调控作用。由于该lncRNA是一个盐胁迫的差异表达lncRNA,将超表达植株和WT进行非生物胁迫抗性的分析,发现在盐胁迫和干旱胁迫中,WT均比超表达植株受到更严重的抑制,说明超表达Mt-lncRNA 167与Mt-miR167c增强了拟南芥对盐和干旱胁迫的抗性。miR167家族早先被报道过在柽柳(Tamarix chinensis)、盐穗木(Halostachyscaspica)等植物中表达模式响应盐胁迫[45—46],且在本研究中,miR167c在蒺藜苜蓿中也响应盐、干旱和低温胁迫。故作为miR167前体的Mt-lncRNA 167和MtmiR167c一样,在植物抵抗非生物胁迫过程中发挥作用。在早先的报道中,ARF8通过调节植物光照条件下生长素稳态影响拟南芥下胚轴伸长[47],在后续研究At-miR167功能时,也发现了下胚轴伸长的现象[21],再次证明miR167对ARF8的靶向作用。故在本实验中,也对拟南芥下胚轴长度给予关注,发现超表达Mt-lncRNA 167和Mt-miR167c植株下胚轴均显著延长,且超表达Mt-miR167c植株下胚轴也显著长于超表达Mt-lncRNA 167的植株。但超表达Mt-miR167c植株子叶明显偏小、展开程度低,超表达Mt-lncRNA 167植株子叶形态却与WT相同。分析其原因,由于Mt-lncRNA 167为Mt-miR167c的前体,即超表达Mt-lncRNA 167间接地超表达Mt-miR167c,植株中miR167c的表达水平低于直接超表达Mt-miR167c的植株,故表型不如超表达Mt-miR167c植株明显。
在本实验中,Mt-lncRNA 167超表达植株与Mt-miR167c超表达植株表型相同,分析二者具有相同的功能。关于二者具有相同功能的原因,本研究更倾向于Mt-lncRNA 167作为Mt-miR167c的前体,促进Mt-miR167c的表达,原因在于本研究选取的3株具有表达梯度的Mt-lncRNA 167超表达植株中,miR167c表达量均有上升。综合以上,本研究认为Mt-lncRNA 167的确具有产生Mt-miR167c的功能,Mt-lncRNA 167是作为Mt-miR167c的前体而发挥功能的。另外,研究发现在Mt-lncRNA 167和Mt-miR167c的超表达植株中,ARF6和ARF8的表达量均有明显下降,这与之前的研究相符,即miR167超表达植株与ARF6/8双突变体拥有相同的表型[19]。且在全部材料中ARF 6的表达量均低于ARF 8,表明miR167c对ARF6的抑制效果高于ARF8,故对于拟南芥生育缺陷的表型,ARF6可能起到主要作用。结合蒺藜苜蓿中三者的表达模式,综合超表达植株的表型关系,分析得到MtlncRNA 167与Mt-miR167c以及靶基因ARF6/8存在互作网络关系。
4 结论
本研究对蒺藜苜蓿盐胁迫响应的一个新预测lncRNA及其剪切产物miRNA进行了研究。通过生物信息学和转录水平表达分析确定该lncRNA为一个真实的lncRNA。在此lncRNA的相同基因座上发现一个新miRNA,通过生物信息学分析确定具有miRNA的基本特性和miR167家族的特征,将其命名为Mt-miR167c,将lncRNA命名为Mt-lncRNA 167。对Mt-lncRNA 167、Mt-miR167c、靶基因ARF6/8在3种非生物胁迫下的表达模式进行分析,发现在大部分情况下,Mt-lncRNA 167与Mt-miR167c表达模式相同,与靶基因ARF6/8表达模式相反。将Mt-lncRNA 167与Mt-miR167c在拟南芥中过表达,超表达植株表现出生育缺陷、抵抗非生物胁迫和延长下胚轴的表型。且在超表达材料中,Mt-lncRNA 167、Mt-miR167c和ARF6/8的表达模式与上述相同。综合以上,本研究认为Mt-lncRNA 167作为Mt-miR167c的前体发挥作用,而Mt-miR167c通过抑制ARF6/8的表达影响拟南芥的育性和非生物胁迫抗性。本研究鉴定了蒺藜苜蓿中一个新的lncRNA,和miR167家族的一个新成员MtmiR167c。在蒺藜苜蓿中构建了Mt-lncRNA 167-Mt-miR167c-MtARF6/8的作用网络,该网络可能在调控植物育性的过程中发挥关键作用。
