植物香豆素生物合成途径及关键酶基因研究进展
2022-02-10段珍吴凡闫启张吉宇
段珍,吴凡,闫启,张吉宇
(兰州大学草地农业生态系统国家重点实验室,兰州大学草地农业科技学院,甘肃 兰州 730020)
香豆素类化合物是一类具有芳香气味的天然产物,是通过苯丙氨酸和部分植物中的酪氨酸从莽草酸途径中衍生出来的苯丙烷内酯。已从植物、细菌和真菌次生代谢产物中鉴定出超过1300种香豆素。香豆素最初是在豆科植物零陵香豆(Dipteryx odorata)中发现的,目前在芸香科、豆科、伞形科等74科、330多个属的植物中发现了香豆素类化合物[1—2]。在自然界中发现的香豆素有多种类型,既具有抗炎、抗病毒[3]、抗菌[4]、保护心脏[5]、诱导癌细胞凋亡[6]等药理作用,在植物中还可作为主要的化感物质用作天然除草剂[7],另外,还影响多种植物的生长和发育,特别是种子萌发[8]、调节根系微生物群落结构[9]、抗氧化[10]和对逆境胁迫的响应[11]等。
尽管香豆素对人类和植物具有重要作用,但其生物合成的主要细节仍在不断探索中。本研究综述了香豆素在植物体内的发生与功能,以及生物合成途径的主要步骤,重点介绍了所涉及的酶,讨论了近年来发现香豆素合成相关酶(基因)的进展,可为香豆素的后续研究提供参考和理论支撑。
1 香豆素概述
1.1 分类
香豆素类化合物通过苯丙烷途径产生,以游离态或糖苷的形式存在于植物中,具有极性结构,可分为简单香豆素和复杂香豆素。一般结构简单的化合物如香豆素、东莨菪内酯、伞形酮内酯等广泛存在于菊科、豆科、伞形科和禾本科等多种植物中;而一些结构复杂的化合物如补骨脂素、花椒树皮素等可在伞形科、芸香科和豆科植物中见到。复杂香豆素以苯并α—吡喃酮为母核,通过在简单香豆素核心苯环上添加杂环化合物而产生,并进一步分为呋喃香豆素、吡喃香豆素、苯并香豆素、二氢呋喃香豆素和双香豆素[12]。简单香豆素是指仅仅在苯环上有取代,且7位羟基与6位或者8位没有形成呋喃环或者吡喃环的香豆素,取代基包括羟基、甲氧基、亚甲二氧基和异戊烯基等。由于香豆素吸收紫外光,因此具有特有的蓝色荧光[13],香豆素母体本身无荧光,羟基化香豆素在紫外光下大多显蓝色荧光。
1.2 分布与含量
香豆素主要存在于植物根[14—19]、茎[20]、叶[21—25]、花[26—30]、果皮[31—33]、种子[34—35]、果实[36]以及根系分泌物中[37],其含量与植物体的利用密切相关,不同植物、不同品种、不同种质、不同部位香豆素含量存在差异。例如在豆科草木樨属(Melilotus)中,细齿草木樨(Melilotus dentatus)香豆素含量较低,为0.1%(干物质含量),黄香草木樨(Melilotus suaveolens)香豆素含量较高,为0.753%(干物质含量)[38];黄花草木樨(Melilotus officinalis)种质间香豆素含量为0.3%~1.5%(干物质含量),白花草木樨(Melilotus albus)种质间香豆素含量为0.2%~1.3%(干物质含量)[39];朱宏等[40]的研究发现草木樨叶、花中香豆素平均含量为6.64 mg·g—1,茎中香豆素平均含量为6.18 mg·g—1,全草香豆素含量为6.30 mg·g—1;汤春妮[41]发现草木樨富含香豆素的最佳时间是盛花期。而在伞形科植物白花前胡(Peucedanum praeruptorum)的干燥根中总香豆素提取物中白花前胡甲素含量为602.42~721.44 mg·g—1,白花前胡乙素的含量为38.34~101.46 mg·g—1[42]。芸香科柑橘属(Citrus)柚子(Citrusmaxima)皮中检测到7-甲氧基香豆素含量较高,为11.4~123.7 mg·g—1[43]。在伞形科植物珊瑚菜(Glehnia littoralis)中,不同采收期根和叶的香豆素总量不同,根中在不同采收期的香豆素总含量为0.0466~0.0772 mg·g—1,叶中不同采收期的香豆素总含量为0.0131~0.2065 mg·g—1[44]。
1.3 功能
香豆素是最简单的植物次生代谢物之一,在植物中分布广泛,在细胞受损伤后释放,其功能大多和防御有关,例如抗微生物、紫外线屏蔽、抑制种子萌发等[45]。
1.3.1香豆素可参与植物的生长和生理过程 香豆素可以通过抑制水稻(Oryza sativa)脱落酸分解代谢和胚活性氧的积累来延迟种子萌发[8];能诱导α-淀粉酶的产生,抑制超氧化物歧化酶、过氧化氢酶和抗坏血酸过氧化物酶的活性,降低细胞活力,破坏小麦(Triticum aestivum)糊粉层氧化还原的稳态[46];可以通过调节质膜H+-ATP酶活性来提高玉米(Zea mays)根系对硝酸盐的吸收,且发现它可能在基因转录中起诱导因子的作用[47];香豆素还是黄花草木樨的主要化感物质,对许多杂草种子萌发和幼苗生长有较强的抑制作用,可作为天然除草剂[7]。
1.3.2东莨菪内酯等羟基化香豆素参与植物对胁迫的响应 Chong等[48]的研究发现东莨菪内酯具有清除活性氧自由基的作用,可能参与减轻植物细胞氧化应激反应。在拟南芥(Arabid opsis thaliana)中,东莨菪内酯和生长素刺激了细胞结构的发育[49],低温显著诱导了东莨菪内酯的积累[50]。另外植物在缺铁条件下根系会分泌东莨菪内酯、秦皮素和儿茶酚香豆素、七叶亭、瑞香素等小分子氧化还原活性分子至根际以促进铁的活化和吸收,儿茶酚香豆素可与土壤中的铁形成铁螯合物或还原Fe3+,东莨菪内酯因不含儿茶酚基不能被Fe3+所吸附[51]。另外,Chutia等[52]发现香豆素的组成变化还依赖于铁和磷。
此外,东莨菪内酯被分泌到根际会选择性地影响拟南芥根系的菌群群落组成,抑制植物病原体的生长,调节根系菌群,促进植物健康生长[9]。Beyer等[53]发现拟南芥东莨菪内酯可以抑制亚洲锈病真菌的活性以保护大豆(Glycine max)免受感染,可以作为一种天然杀菌剂。抗菌素东莨菪内酯和秦皮素在烟草(Nicotiana attenuata)根中积累,以抵御坏死性真菌的感染[54]。从苦楝(Melia azedarach)果实中分离的东莨菪内酯与香草醛等其他化合物联用,具有协同抗真菌作用[36]。说明植物可以利用香豆素等代谢产物的混合物从根际消灭致病菌。
1.3.3香豆素与牧草品质 香豆酸主要以没有香气的糖苷形式存在于液泡中,由于外界条件的改变可与葡萄糖苷酶接触,在水解的同时闭环生成香豆素,可放出芳香气味。豆科草木樨植株高大,产量高,是优质的蛋白牧草,但其香豆素含量较高,且具有特殊的香气严重影响其适口性。有一种香豆素衍生物4-羟基香豆素,其通常形成于微生物的代谢过程,在发霉的含有香豆素的植物材料中,霉菌将反式邻香豆酸转化为4-羟基香豆素,两分子4-羟基香豆素与甲醛自发结合生成双香豆素[55],双香豆素是众所周知的抗凝血剂,会引起牲畜内出血导致死亡。因此含有香豆素的植物在贮藏或调制时如遇霉烂,体内的香豆素就转变为双香豆素或出血素,从而对牲畜产生危害。Luo等[56]对饲料作物白花草木樨半同胞家系进行多年多地点试验评价,选育出了低香豆素草木樨育种材料,从而提高牧草品质。
2 香豆素的生物合成途径
在生物合成中,简单香豆素、呋喃香豆素、吡喃香豆素结构的转化过程是简单香豆素在6位或8位烷基化,取代异戊烯基与7位羟基形成呋喃环或者吡喃环的香豆素,进一步形成呋喃香豆素类和吡喃香豆素类。因此本研究主要以简单香豆素生物合成途径为重点进行综述。
植物中的L-苯丙氨酸解氨酶(phenylalanine ammonia-lyase,PAL)能够将L-苯丙氨酸转化为反式肉桂酸,反式肉桂酸在肉桂酸2-羟化酶(cinnamic acid 2-hydroxylase,C2H)和肉桂酸4-羟化酶(cinnamic acid 4-hydroxylase,C4H)的作用下发生邻羟基化和对羟基化反应,分别转化为邻香豆酸和对香豆酸,再经过进一步的反应最终形成香豆素类化合物等次生代谢产物。反式肉桂酸的对羟基化反应先于邻羟基化反应[20],如果叶绿体中缺乏C4H时,C2H可以将肉桂酸转化为邻香豆酸[57]。香豆素生物合成途径简单框架如图1[13,58—62]。
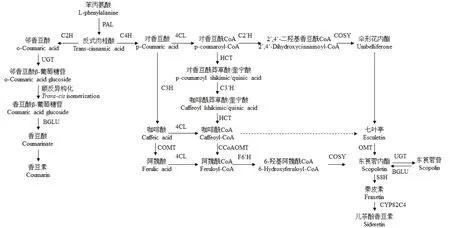
图1 简单香豆素生物合成途径Fig.1 Pathway of simple coumarin biosynthesis
2.1 反式肉桂酸形成香豆素
香豆素的合成源于反式肉桂酸[63],反式肉桂酸首先在C2H作用下发生邻羟基化生成邻香豆酸[64],再与UDP-葡萄糖在2-香豆酸O-β-葡萄糖基转移酶(UDP-glucosyltransferase,UGT)的作用下生成反式邻香豆酸β-葡萄糖苷[58],在液泡中积累并发生反/顺式异构化,在紫外线辐射下引起非酶光化学反应,转换为顺式香豆酸葡萄糖苷[65]。香豆素的非游离状态就是以香豆酸葡萄糖苷的形式存在,它在葡萄糖苷酶(β-glucosidases,BGLU)的作用下释放糖苷水解为香豆酸,最后自发内酯化形成游离香豆素[66]。
2.2 反式肉桂酸形成伞形花内酯等其他羟基化香豆素
反式肉桂酸在C4H的作用下进行对羟基化形成对香豆酸,首先与4-香豆酸CoA连接酶(4-coumarate CoA ligase,4CL)作用生成对香豆酰CoA,再与对香豆酰CoA 2’-羟化酶(p-coumaroyl CoA 2’-hydroxylase,C2’H)发生邻羟基化作用生成2’,4’-二羟基香豆酰CoA[60],进而内酯化形成伞形花内酯(7-羟基香豆素)。
对香豆酸也可以先后与香豆酸-3-羟基化酶(4-coumarate-3-hydroxylase,C3H)、咖啡酸O-甲基转移酶(caffeic acid O-methyltransferase,COMT)作用生成咖啡酸、阿魏酸,咖啡酸和阿魏酸分别与4CL作用生成咖啡酰CoA和阿魏酰CoA。对香豆酰CoA亦可先后在羟基肉桂酰基转移酶(hydroxycinnamoyl transferase,HCT)、对香豆酰酯3’-羟化酶(p-coumaroylshikimate/quinate 3-hydroxylase,C3’H)和羟基肉桂基转移酶作用下生成对香豆酰莽草酸/奎宁酸、咖啡酰莽草酸/奎宁酸、咖啡酰CoA[67],咖啡酰CoA再与咖啡酰辅酶A O-甲基转移酶(caffeoyl CoA O-methyltransferase,CCoAOMT)作用生成阿魏酰CoA[68],接着在阿魏酰-CoA 6’-羟化酶1(feruloyl-CoA 6’-hydroxylase1,F6’H1)的作用下发生邻羟基化生成6-羟基阿魏酰CoA[69],并在香豆素合酶(coumarin synthase,COSY)的作用下发生内酯化形成东莨菪内酯[61]。F6’H 1是东莨菪内酯生物合成的控制酶。东莨菪内酯经东莨菪内酯8-羟化酶(scopoletin 8-hydroxylase,S8H)生成秦皮素[70],植物细胞色素P450酶(cytochrome P450 82C4,CYP82C4)进一步把秦皮素氧化为儿茶酚香豆素[51]。
咖啡酰CoA可在体外与各种含有酚酶活性的植物提取物作用转化成七叶亭(6,7-二羟基香豆素)[63],而七叶亭的有效前体是伞形花内酯而不是咖啡酸,且伞形花内酯的6-羟基化可能是在P450单加氧酶的作用下完成的[71]。Bayoumi等[72]的研究也提出了东莨菪内酯及其糖苷的生成是通过对香豆酸到咖啡酸再到阿魏酸的步骤实现的,而七叶亭及其糖苷的合成是通过对香豆酸到2’,4’-二羟基肉桂酸再到伞形花内酯的步骤实现的。
此外,Liu等[55]发现了4-羟基香豆素新的生物合成途径,它是由联苯合酶(biphenyl synthase,BIS)催化底物水杨酸酰基CoA而合成,是一种不需要邻羟基化的生物合成途径。
3 香豆素生物合成关键酶基因
Luo等[73]对香豆素含量存在显著差异的5份白花草木樨进行转录组测序分析,通过京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)分析鉴定出213个unigenes属于苯丙氨酸合成途径,其中在种质间差异表达的unigenes有17个,初步归纳了白花草木樨香豆素合成通路,总结出已知香豆素合成途径相关酶,包括PAL、C4H、4CL、C3H、HCT、CCoAOMT、COMT和BGLU;Wu等[74]对不同香豆素含量的5份白花草木樨可能调控香豆素合成基因的microRNA(miRNA)进行了分析,共鉴定出417个已知和76个未知的miRNAs,利用GO和KEGG对预测的4196个靶基因进行功能注释,预测出2个HCT基因和3个miRNA参与香豆素生物合成途径。研究者在香豆素的合成途径中,挖掘到了PAL、C4H、HCT、C3H等多个参与香豆素生物合成的基因。本研究对香豆素生物合成通路涉及的关键酶进行总结,具体信息见表1。
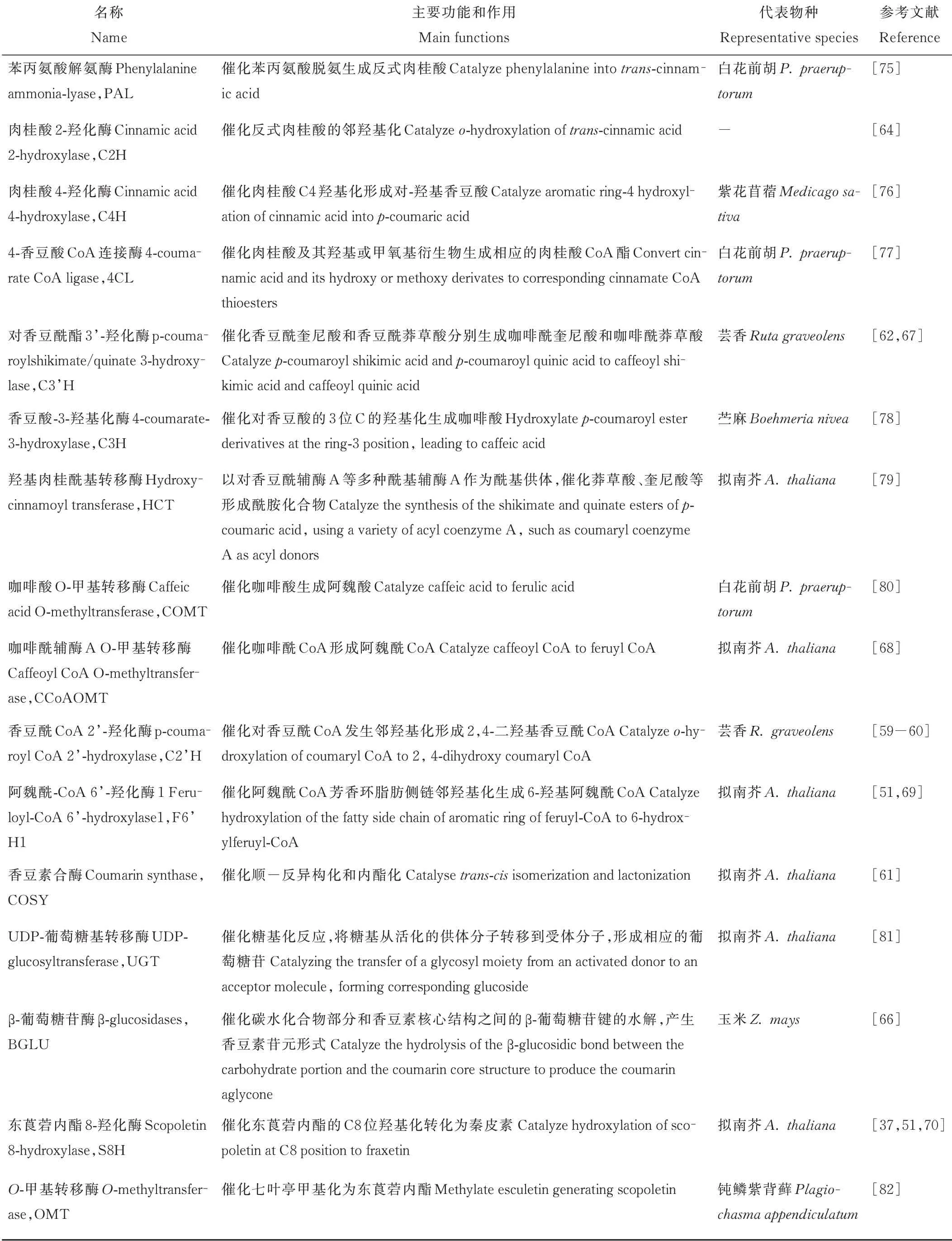
表1 香豆素生物合成途径关键酶及其作用Table 1 Key enzymes and their functions in coumarin biosynthetic pathway
香豆素合成通路中的大多基因都是以基因家族的形式存在于植物中,不同亚族参与不同的代谢过程。PAL作为限速酶来调节进入苯丙烷代谢的总通量,拟南芥AtPAL 1、AtPAL 2、AtPAL 4与木质素的生物合成密切相关,同时发现AtPAL 1和PAL2控制类黄酮的合成[83]。4CL基因分为ClassⅠ和ClassⅡ两组,其中ClassⅠ与木质素合成相关,ClassⅡ参与类黄酮生物合成[84]。Liu等[77]从白花前胡中分离出了4CL 1、4CL7和4CL10,明确了Pp4CL1是参与香豆素生物合成的酶。Vogt[68]认为,CCoAOMT不仅与木质素的合成相关,也可以催化阿魏酰CoA合成东莨菪内酯[69]。拟南芥根中东莨菪内酯和东莨菪苷的产生需要C3H的活性,在c3h突变体中,东莨菪内酯和东莨菪苷的含量下降3%[11]。另外参与香豆素合成的酶基因C2H、C2’H、F6’H和S8H均属于2-氧戊二酸依赖双加氧酶(2-oxoglutarate-dependent dioxygenases,2OGDs)超家族。Kawai等[85]将2OGDs分为DOXA、DOXB和DOXC三类,其中参与简单香豆素生物合成的邻羟基化酶属于DOXC30,芸香RgC2’H仅催化p-香豆酰CoA形成伞形花内酯[60],甘薯(Ipomoea batatas)2OGDs基因根据其底物特异性分为Ib1s和Ib2s两组,Ib1s对阿魏酰CoA具有邻羟基化活性,而Ib2s具有对p-香豆酰CoA和阿魏酰CoA的双重活性,且主要利用p-香豆酰CoA合成伞形花内酯[86];拟南芥AtF6’H 1介导阿魏酸CoA的邻羟基化生成的东莨菪内酯和东莨菪苷是拟南芥中含量最多的香豆素[50],而AtF6’H2只是具有对肉桂酸CoA硫代酯的活性,对东莨菪苷含量变化无影响[59]。S8H和其同源基因F6′H 2同时转化本氏烟草叶片,可显著增加秦皮素的积累,是由于烟草叶片中自然存在阿魏酸,F6’H2的过量表达导致阿魏酰CoA合成东莨菪内酯,为S8H催化反应提供了底物,导致秦皮素含量显著升高[70]。
Vanholme等[61]首次在拟南芥中发现COSY,证明它是伞形花内酯和东莨菪内酯生物合成的关键酶,负责顺反异构化和内酯化。COSY是BAHD-酰基转移酶家族的成员之一,属于V亚支,该亚支的蛋白作用于苯并酰CoA或羟基肉桂酰CoA[61]。一直以来认为在C2’H、F6’H 1作用下随后的顺反异构化和内酯化过程是由光催化且自发发生的,因此对这一步酶的要求一直被忽视,该项研究表明COSY在避光器官如根中的香豆素合成中具有重要功能。
BGLUs属于糖苷水解酶I家族,催化碳水化合物部分和香豆素基本核心结构之间的β-葡萄糖苷键的水解,从而产生具有生物活性的香豆素苷元形式[87]。BGLU广泛参与防御、细胞壁木质化、信号传导、激素的活化和类黄酮代谢等植物次生代谢重要的生理过程[88],拟南芥中AtBGLU 21-23控制在根中特异产生的东莨菪苷的水解,在抵抗病原体攻击和非生物胁迫中发挥作用,AtBGLU 42参与诱导机体对细菌疾病的抵抗力,并在缺铁时对荧光香豆素在根际的分泌有重要作用[37]。
UGT属于糖基转移酶I家族,催化糖基活化转移。根据环境条件,植物可以通过UGT将东莨菪内酯转化为东莨菪苷,糖基化香豆素储存在液泡中,在胁迫条件或植物受到病原菌侵染时,糖基化的香豆素与BGLU在细胞质中接触,将东莨菪苷转化为东莨菪内酯,使其发挥抗菌活性,清除H2O2对植物的伤害[13]。参与植物次生代谢的UGT具有广泛的底物特异性,拟南芥UGT 84A 1和UGT 84A 3具有羟基肉桂酸葡萄糖基转移酶活性[89];AtUGT 84A 1对咖啡酸、p-香豆酸有较高的亲和力,AtUGT 84A 3对阿魏酸的活性最显著[90];烟草UGT 73A 1和UGT73A 2介导香豆素东莨菪苷和七叶苷的合成[81]。
本研究根据已有文献对香豆素合成关键基因在拟南芥、水稻和蒺藜苜蓿(Medicago truncatula)3种模式植物中的基因家族进行统计,结果见表2,以期为非模式植物香豆素合成基因的研究提供参考。
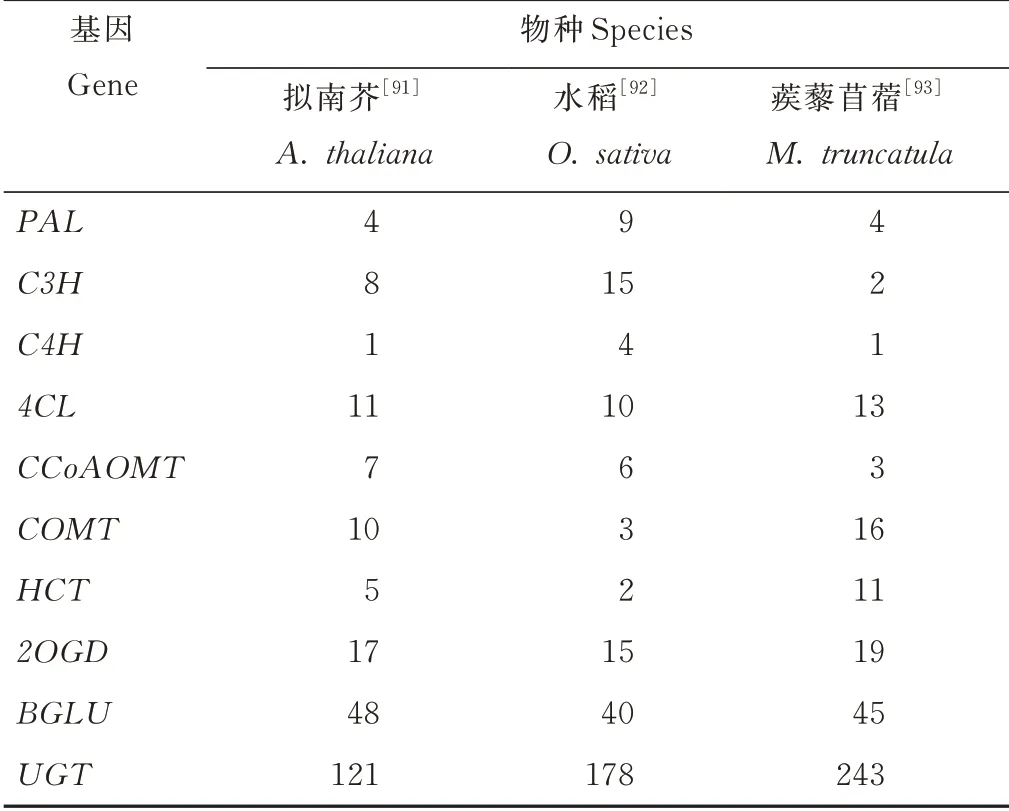
表2 3种模式植物的香豆素合成基因家族统计Table 2 Member statistics of coumar in synthesis gene families in three model plants
4 模式植物中UGT基因家族系统进化分析
在香豆素合成途径中,UDP-葡萄糖基转移酶(UGT)基因家族在香豆素代谢过程中起着重要作用,它的功能是参与植物代谢物的糖基化。糖基化过程在调节次生代谢产物的有效性方面起着重要的作用,可以增强分子的稳定性和水溶性,从而改变其在细胞内的运动,进而改变生物活性[94]。糖基化是由糖基转移酶催化的一种常见的后修饰过程[95],能增加代谢物在植物体内的稳定性[96],有利于代谢物在体内积累和贮存[97]。
UGT基因家族的C末端含有1个由44个氨基酸组成的保守序列PSPG(plant secondary product glycosyltransferase)基序,该保守序列被认为是与UDP-糖供体结合的区域[98],但是仅凭序列信息通常无法可靠地预测物种间糖基化次生代谢产物的结构变化和功能[98],相反,高同源性的UGT可以作用于不同的底物[99—100]。
UGT分布广泛,双子叶植物与单子叶植物的基因外观模式存在差异。然而,双子叶植物和单子叶植物在各物种间所占基因数量上差异不大。本研究使用ClustalX v2.0对拟南芥121个[94]、水稻178个[94]以及蒺藜苜蓿243个[101]UGT氨基酸序列进行多序列比对,使用MEGA 7软件利用邻接法(neighbor-joining method,NJ)构建系统进化树(图2),bootstrap为1000。来自3种模式植物的UGT至少可以形成17个不同的组,其中拟南芥14个组(A~N),水稻15个组,蒺藜苜蓿15个组。水稻中缺失F组,说明F组是双子叶植物特有的组,拟南芥中缺少O和P组,蒺藜苜蓿中缺少C和K组,Q组在3种模式植物中均缺失,R组只有蒺藜苜蓿存在。各组的个体数量各不相同,在D和E组中的UGT数量最多,其次是A、L和G组,这与Caputi等[94]的研究结果一致,在高等植物的进化过程中,每个物种的这5个类群比任何其他类群的扩张都要大。D组中蒺藜苜蓿比其他两种植物扩张明显。在I和G组中,拟南芥的UGT数量为1和7,水稻和蒺藜苜蓿分别为9、20和5、39,发现I和G组在水稻和蒺藜苜蓿中有明显的扩张。根据文献报道,大豆A组中GmSGT 2和GmSGT 3参与大豆皂苷I的生物合成;拟南芥D和E组功能相似,参与萜类化合物、类黄酮、苯甲酸盐和油菜素类固醇生物合成;L组可以催化苯丙烷类代谢产物羧基的葡萄糖酯的形成;G组参与萜类化合物合成;C、I、J、K、M、N组的功能尚未明确[94],因此预测D、E和L组最有可能与香豆素合成相关。
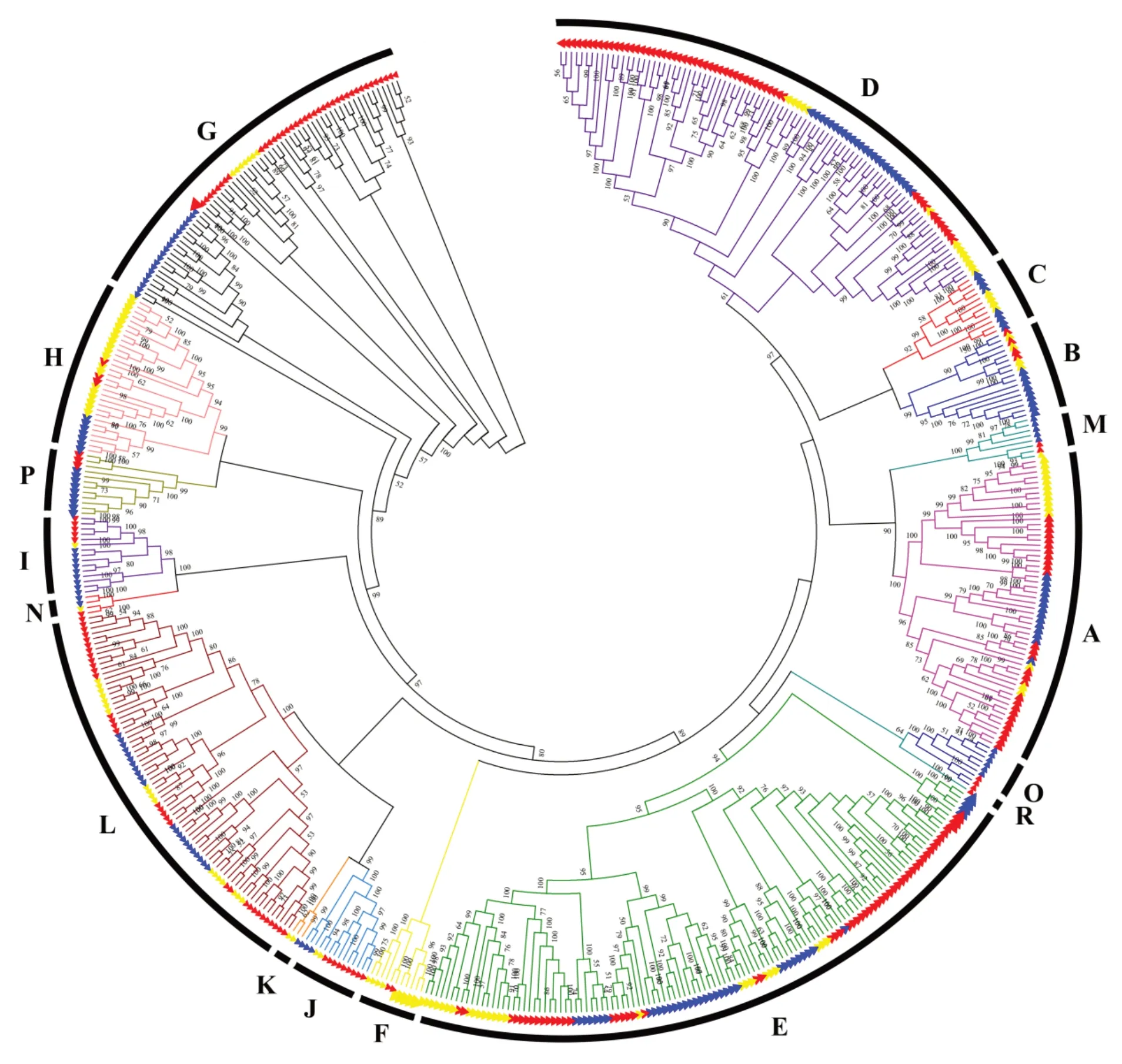
图2 UG T基因家族在模式植物中的进化分析Fig.2 Phylogenetic analysis of the UGT gene family in three model plants
5 结语与展望
本研究以香豆素作为切入点,对香豆素生物合成途径中的关键酶基因研究进展进行综述。虽然目前大量研究已对香豆素生物合成相关基因进行了定位,并对生物合成途径中诸多基因进行克隆、鉴定及部分功能经过验证,然而更多的研究是针对香豆素合成途径中单个基因的功能研究,基因表达量的上调和下调与香豆素含量之间的关系仍有待进一步探讨;且由于该代谢网络复杂,关键基因是单一地参与香豆素的生物合成,还是与上下游的关键酶基因形成调控网络参与到香豆素的生物合成,目前暂无明确定论;且结构基因和转录因子在香豆素生物合成途径的调控网络尚较模糊,多基因以及多转录因子间蛋白互作及其对香豆素合成相关结构基因的调控机制尚未挖掘清楚,具体调控的靶基因及有关转录因子的作用机制还不透彻。另外,香豆素含量高的草木樨等植物由于遗传转化体系不成熟等因素,低香豆素含量品系的选育一直没有取得明显突破。
结合当前研究存在的问题,今后对香豆素生物合成的研究应集中在以下几点:1)进一步在香豆素生物合成的下游途径进行探索;2)利用转录组学、蛋白组学、代谢组学等现代生物技术发掘更多与香豆素生物合成的关键基因,确定关键基因之间的关系,基于多组学的网络构建和完善香豆素生物合成调控网络;3)克隆出相关调控香豆素合成基因后,通过转基因技术转入模式植物中进行功能验证,并进一步构建非模式植物自身转基因体系进行功能验证;4)基因过表达或敲除以及基因编辑技术已逐步取得突破,从遗传学角度高效准确地深入研究并验证香豆素生物合成过程中不同基因的生物学功能,这对将来通过基因工程进行作物的改良育种具有重要意义。
