遗传密码子扩展技术在蛋白质及多肽类药物中的应用*
2022-02-10高晓威韦思平
高晓威 韦思平 王 钦
(西南医科大学药学院,泸州 646000)
蛋白质参与包括细胞骨架、生物催化、信号转导、转录调控、物质运输等在内的所有生物学过程,其几乎全部由20 种天然氨基酸(canonical amino acids,cAAs)组成[1]。蛋白质功能的多样性由20种cAAs的排列组合及侧链间的相互作用共同决定。在自然界中通过对蛋白质进行翻译后修饰(如甲基化、乙酰化、磷酸化、糖基化等),可向蛋白质中引入新的化学基团进一步丰富蛋白质的功能;同时,一些蛋白质只有在辅酶存在或者结合金属离子的情况下才能发挥正常的生物学功能[2],这表明20种cAAs提供的有限化学基团在某些情况下并不能够完全满足蛋白质功能的需求,而引入新的化学基团有望丰富蛋白质的物理化学性质,产生新的生物学功能。
非天然氨基酸(noncanonical amino acids,ncAAs)种类繁多,其结构与性质的多样性远超cAAs。通过插入ncAAs 来提高蛋白质或者多肽的生物化学特性已见诸许多报道[3]。鉴于ncAAs 在蛋白质研究和应用中的巨大潜力,研究人员目前已开发出多种向蛋白质或多肽中插入ncAAs 的技术。其中固相肽合成(solid‑phase peptide synthesis)可用于合成不超过50个氨基酸残基的含ncAAs多肽;通过内含肽(intein)技术将合成的短肽共价相连可获得较大分子质量的含ncAAs 蛋白质[4]。无细胞翻译系统(cell‑free translation systems)亦可用来合成含ncAAs 的蛋白质,该技术的关键在于首先要在体外制备能被核糖体识别的装载有ncAAs的氨酰tRNA[5]。研究表明,有些与cAAs 结构类似的ncAAs能够在胞内被相应的氨酰tRNA合成酶(aminoacyl tRNA synthetase,aaRS)识别并装载到特定tRNA上[6]。在某种cAA营养缺陷型菌株的培养基中加入该cAA 的结构类似物(ncAA),菌体内的翻译系统可将其错误地插入到整个蛋白质组中[7]。该方法有可能扰乱菌体内一些关键蛋白质的功能,存在细胞毒性,降低目标蛋白产量。上述方法尽管均可有效制备含ncAAs 的蛋白质或多肽,但都具有各自的局限性,比如非位点特异性、不可持续且生产成本高、只能应用于cAAs 结构类似物等。遗传密码子扩展技术(genetic code expansion)能够有效克服上述局限性,实现在生物体内向蛋白质或多肽中位点特异性插入各种ncAAs[2]。
遗传密码子扩展技术首次由美国Scripps 研究所Peter G Schultz 教授领导的研究组建立起来[8]。研究人员目前已可利用该技术将200多种含有不同功能侧链基团的ncAAs位点特异性地插入到各类蛋白质中[2]。遗传密码子扩展技术已被广泛应用于生物医药、蛋白质工程、合成生物学、结构生物学等诸多生物学领域,为一些重大生命科学问题的研究与解决提供了极大便利。本文将重点关注遗传密码子扩展技术的前沿进展及其在各类抗体、细胞因子以及抗菌肽等蛋白质及多肽类药物中的应用,同时也对其衍生的新型生物治疗手段进行简单阐述。
1 遗传密码子扩展技术
1.1 原理
遗传密码子扩展技术是指通过在生物体内引入外源正交aaRS/tRNA 对,借助特殊密码子(如UAG、UAGA 等)向目的蛋白中位点特异性插入ncAAs(图1)[8]。目前应用较为广泛的外源aaRS/tRNA 对包括来源于古生菌詹氏甲烷球菌(Methanococcus jannaschii)的酪氨酰aaRS/tRNA对(MjTyrRS/tRNA)、巴氏甲烷八叠球菌(Methanosarcina barkeri)的吡咯赖氨酰aaRS/tRNA 对(MbPylRS/tRNA),以及来源于大肠杆菌(E.coli)的酪氨酰aaRS/tRNA对(EcTyrRS/tRNA)和亮氨酰aaRS/tRNA 对(EcLeuRS/tRNA)(表1)[9]。其中MjTyrRS/tRNA 对可在原核生物中应用,EcTyrRS/tRNA 对和EcLeuRS/tRNA 对可在真核生物中应用,而MbPylRS/tRNA对在原核生物和真核生物中均可应用。以野生型外源aaRS/tRNA对为基础,通过构建突变体库并在宿主细胞中进行基于特定ncAAs 的正负筛选,获得与内源性aaRS/tRNA 对和cAAs 不存在交叉反应且能特异性识别ncAAs 的突变体是遗传密码子扩展技术的关键所在[8]。遗传密码子扩展技术首次在E.coli中获得成功,目前其应用已实现从单细胞到多细胞、从低等到高等物种的跨越[10]。研究人员已经能够利用遗传密码子扩展技术在乳酸乳球菌、结核分支杆菌、枯草芽孢杆菌、酵母菌、委内瑞拉链霉菌、哺乳动物细胞、人造血干细胞、线虫、果蝇、斑马鱼、拟南芥、小鼠等物种中定点插入ncAAs(表1)。尽管遗传密码子扩展技术应用潜力巨大,但其自身仍有多方面的局限性需要突破才能实现大规模工业应用。
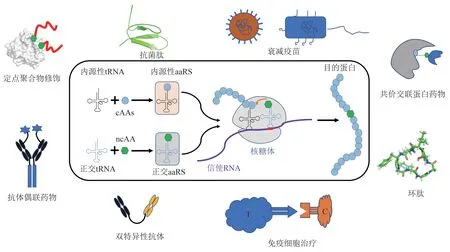
Fig.1 Principles of genetic code expansion and its applications in protein and peptide related drugs图1 遗传密码子扩展技术原理及其在蛋白质、多肽相关药物中的应用

Table 1 Orthogonal tRNA/synthetase pairs used in different hosts表1 不同物种中使用的外源正交aaRS/tRNA对
1.2 提高ncAAs整合效率
目前在遗传密码子扩展技术中使用频率最高的密码子为琥珀密码子(UAG),该密码子在蛋白质翻译过程中被释放因子1(release factor 1,RF1)所识别,介导新生多肽链的翻译终止[41]。正交aaRS/tRNA对需要在蛋白质翻译的过程中与RF1竞争性识别mRNA 上的UAG 密码子才能获得含ncAAs的全长蛋白质,因此含ncAAs蛋白质的表达量一般只有野生型的10%~20%[10]。为了解决这一问题,研究人员尝试了采用不同的方法敲除RF1基因,避免RF1 对UAG 密码子识别导致翻译提前终止。通过将E.coli中7 个必需基因(coaD、had、hemA、mreC、murF、lolA和lpxK)的终止密码子UAG 替换为UAA,Sakamoto 课题组[42]成功敲除了RF1基因。通过将框内UAG 自调节元件(in‑frame UAG autoregulation element)失活并将RF2中的T246 突变为A,Wang 课题组[43]同样也成功敲除了RF1基因。利用RF1 敲除菌株作为表达宿主,含ncAAs 蛋白质的产量,尤其是多位点插入ncAAs蛋白质的产量,得到了显著提高。但值得注意的是,这两种RF1敲除菌株的生长速率都明显下降。利用多元自动化基因组编辑技术(multiplex automated genome engineering)和基因组接合组装技术(conjugative assembly genome engineering),Isaacs 课题组[44]将E.coliMG1655 中所有已知UAG密码子全部替换成了UAA并将RF1基因进行了敲除,成功构建了菌株E.coliC321.ΔA。在菌株E.coliC321.ΔA 中,UAG 已不再作为终止密码子发挥功能而是成为了一个空白密码子。以E.coliC321.ΔA作为表达宿主,可将含ncAAs蛋白质的产量提高至与野生型相当。我们近期从转录组和蛋白质组学的角度分析了UAG 密码子重排对E.coli生理特性的影响,并通过向基因组中整合T7 RNA聚合酶系统进一步提高了E.coliC321.ΔA 菌株含ncAAs蛋白质的表达能力[45]。
由于遗传密码子扩展技术使用的正交aaRS/tRNA 对均为外源性的,其在宿主细胞中的活性往往偏低。通过增加正交aaRS/tRNA对在细胞内的基因拷贝数和调整启动子强度,提高正交aaRS/tRNA对的表达量,可在一定程度上提高含ncAAs蛋白质的产量[46]。Isaacs 课题组[47]在E.coli中利用多元自动化基因组编辑技术对正交aaRSs进行了定向进化,显著提高了酶活性和特异性,将含ncAAs蛋白质的产量提高了25 倍。他们利用进化后的aaRS/tRNA 对获得了最多含有30 个ncAAs 插入的蛋白质。Liu 课题组[48]利用噬菌体辅助的连续进化技术(phage assisted continuous evolution)分别对PylRS 和TyrRS 进行定向进化,显著提高了酶的催化效率和底物特异性。类似地,Söll 课题组[49]利用噬菌体辅助的非连续进化技术(phage assisted noncontinuous evolution)对PylRS 进行了定向改造,获得了活性和特异性显著提高的突变体。通过不同策略提高ncAAs在宿主细胞内的浓度(如过表达宿主细胞的氨基酸转运酶、将ncAAs以二肽的形式添加至培养基等),亦可增加含ncAAs 蛋白质的产量[50]。氨酰化的ncAA‑tRNA 需要延伸因子(elongation factor thermo‑unstable,Ef‑tu)辅助才能进入核糖体参与蛋白质的合成。然而ncAA‑tRNA并不是Ef‑tu的天然底物,这导致二者的识别和结合效率偏低。通过对Ef‑tu 进行工程化改造提高其对非天然底物的亲和力可有效提高含ncAAs蛋白质的产量[51]。
1.3 同一多肽链中整合不同ncAAs
遗传密码子扩展技术一般只能向蛋白质中插入单种ncAA,这主要是由两方面的原因造成的:a.缺乏相互正交的外源aaRS/tRNA对;b.缺乏介导不同ncAAs 插入的密码子。前期研究表明,MjTyrRS/tRNA对与PylRS/tRNA对相互正交,可用于向同一多肽链中插入两种不同ncAAs[18]。Chatterjee 课题组[52]和Chin 课题组[53]分别采用不同的方法获得了三重正交aaRS/tRNA对,实现了向同一多肽链中插入3种不同ncAAs。从头设计产生多重相互正交的aaRS/tRNA 对亦获得了一定突破[54]。最近,Lin 课题组[55]通过蛋白质工程将MbPylRS/tRNA对中赋予其正交性的结构元件转移至E.coliHisRS/tRNA 对中,获得了新的正交嵌合aaRS/tRNA对,为正交aaRS/tRNA对的构建提供了新的思路。要想实现向同一多肽链中插入多种ncAAs,除需要多重相互正交的aaRS/tRNA 对之外,还需要更多介导ncAAs插入的密码子。受菌株E.coliC321.ΔA的启发,目前多个研究小组正通过不同的基因组工程技术将E.coli基因组中编码特定cAAs的密码子进行同义替换,从而实现对64个三碱基密码子进行压缩和重排,产生更多的空白密码子用于ncAAs的插入[56‑57]。截止目前,在E.coli基因组中已有7个三碱基密码子实现了同义替换,并被用于介导ncAAs 的插入[58]。通过设计四碱基密码子介导ncAAs的插入亦见诸多报道,将四碱基密码子广泛应用于遗传密码子扩展技术可有效解决介导ncAAs插入密码子数量不足的问题,然而宿主细胞中的翻译系统对四碱基密码子的识别效率较低且无法避免对四碱基密码子中前三个碱基的错误识别。Chin课题组[59]通过对核糖体进行工程化改造获得了正交核糖体Ribo‑Q,显著提高了含ncAAs蛋白的产量,同时也为工程化改造获得有效解码四碱基密码子的正交核糖体提供了研究思路。通过向E.coli基因组中引入非天然碱基(X,Y)获得自然界中不存在的密码子,并将其用于遗传密码子扩展技术介导ncAAs的插入同样也获得了成功[60]。
1.4 原位合成ncAAs
现阶段遗传密码子扩展技术主要依赖于人为外源添加ncAAs 才能获得含相应ncAAs 的蛋白质。若某些ncAAs 价格昂贵则势必会增加含ncAAs 蛋白质的生产成本。通过蛋白质工程(protein engineering)或代谢通路工程(metabolic pathway engineering)改造宿主细胞原位合成ncAAs,并将其直接用于蛋白质合成可有效解决这一问题。Xiao课题组[61]通过引入来源于委内瑞拉链霉菌(Streptomyces venezuelae)的代谢通路实现了在E.coli中有效合成对氨基苯丙氨酸(p‑amino‑phenylalanine,pAF),利用遗传密码子扩展技术将其插入到单链抗体中与荧光探针偶联可用于细胞成像。该课题组还通过引入来源于野油菜黄单胞菌(Xanthomonas campestris)的苯丙氨酸4‑羟基化酶(phenylalanine 4‑hydroxylase)和辅酶再生系统成功实现了在E.coli中合成5‑ 羟基色氨酸(5‑hydroxytryptophan,5‑HTP)[62]。Liu 课题组[63]通过工程化改造E.coli中Cys合成路径并向培养基中补加各种廉价芳香硫醇,实现了合成50 种ncAAs。同样地,L‑磷酸苏氨酸(O‑phospho‑L‑threonine)、L‑二羟基苯丙氨酸(3,4‑dihydroxy‑L‑phenylalanine)和S‑烯丙基L‑半胱氨酸(S‑allyl‑L‑cysteine)等ncAAs 均实现了在E.coli中生物合成并直接用于遗传密码子扩展技术生产含ncAAs 的蛋白质[64‑66]。随着越来越多的新颖酶分子以及代谢通路被发掘,更多的ncAAs 将能够被生物合成并直接用于遗传密码子扩展技术。随着遗传密码子扩展技术在上述各个环节的瓶颈问题得以突破,该技术的应用也日趋多样化,有望为下一代蛋白质及多肽类药物的开发提供技术支持。
2 在蛋白质及多肽类药物中的应用
2.1 抗体偶联药物
抗体是体内获得性免疫应答的重要组成部分,对抗原具有优异的识别特异性和亲和力。将抗体与其他毒性小分子或者治疗性药物通过一定方式连接到一起,制备成抗体偶联药物(antibody‑drug conjugates,ADCs),可有效提高药物的靶向性,实现向肿瘤等病灶组织精确递药,降低药物毒副作用(图1)。目前有超过175种ADCs正在开展临床试验,超过10 种ADCs 已成功上市[67‑68]。尽管ADCs在包括癌症等人类重大疾病的治疗中表现出了巨大的应用潜力,但是其安全性和有效性一直受到制备技术的制约。传统ADCs主要依赖于抗体分子中的Cys 或Lys 残基与亲电子基团反应形成共价交联实现药物分子的装载。由于抗体分子中Cys和Lys残基数量较多,往往无法与配体基团形成均一的化学修饰,造成药物与抗体的偶联比率(drug‑to‑antibody ratios,DAR)和偶联位点不均一、不固定。通过还原抗体分子内部的二硫键暴露Cys残基进行化学修饰则会影响抗体分子的稳定性[69]。因此传统方法制备的ADCs是不稳定的混合物,其可能同时含有未装载药物的抗体以及过量装载药物的抗体。未装载药物的抗体会与装载药物的抗体竞争性结合目标抗原,减弱ADCs的疗效,而过量装载药物的抗体则会导致ADCs 发生沉淀、毒性增加、血清稳定性降低等[70]。传统方法制备的ADCs在体内的有效性、安全性、免疫原性、半衰期、亲和力、药物动力学等性质可能会受到不同生产批次的影响。实现抗体和药物定点偶联,制备均一的ADCs有望解决这一问题。Mallet课题组[71]通过定点突变引入反应性Cys 并减少抗体分子中非必需Cys 残基的数量(the engineered thio monoclonal antibody,THIOMAB)首次制备出了均一的ADCs。该 ADCs(THIOMAB antibody‑drug conjugates)与非均一ADCs 相比显示出了更高的剂量耐受性和血清稳定性,有效提高了药物的治疗窗浓度范围。然而抗体中引入的Cys会与其他含巯基物质或者抗体分子间形成二硫键从而影响偶联,同时许多基于Cys形成的加合物在生理条件下并不稳定,这限制了THIOMAB 技术在ADCs 中的应用。通过蛋白质标签(protein tagging)和酶催化等技术同样也实现了均一化ADCs的制备,但考虑到抗体上偶联位点的选择对ADCs的有效性和安全性具有重要影响,而这些方法对抗体上的修饰位点选择性有限,可能会影响对ADCs 的进一步优化[72]。
利用遗传密码子扩展技术位点特异性插入ncAAs制备均一化ADCs具有以下明显优势:a.遗传密码子扩展技术可实现在抗体分子中任意一个或者多个位点插入ncAAs,实现药物偶联位点的自由选择;b.借助ncAA侧链上的生物正交化学官能团(如叠氮基、炔基、酮基、卤代基等)不仅可以建立起抗体与药物分子之间稳定、高效、高特异性的定点偶联,而且还可以使偶联反应多样化,允许更多不同化学结构的药物用于ADCs 的制备(图2)[73]。Schultz 研究组[74]利用遗传密码子扩展技术向曲妥珠单抗(trastuzumab)中引入L乙酰基苯丙氨酸(4‑acetyl‑L‑phenylalanine,pAcF),使其与烷氧基胺修饰的药物auristatin F形成肟键制备成功了DAR 为2 的均一化ADCs。与非均一化ADCs 相比,该ADCs在小鼠肿瘤移植模型中具有消除Her2阳性肿瘤的能力,并且展现出了偶联效率高、安全性能好、血清清除率低等优点。随后该方法被成功用于制备治疗前列腺癌、肾癌以及癌症转移等疾病的均一化ADCs。Chin 课题组[75]利用遗传密码子扩展技术将含有环丙烯基团的Lys 衍生物CypK 插入到曲妥珠单抗中,随后通过Diels‑Alder反应实现了与药物auristatin E的定点偶联,显著提高了偶联反应的速率,提高了均一化ADCs 的产量。Sapra研究组[76]将正交EcTyrRS/tRNA 对基因整合到中国仓鼠卵巢癌细胞(Chinese hamster ovary,CHO)基因组中,构建了稳定的重组细胞系4E2,将含ncAAs 抗体产量提升至1 g/L,为均一化ADC 的大规模生产提供了极大便利。
凭借ncAAs结构与化学性质的多样性,遗传密码子扩展技术不仅可以实现ADCs 的均一化制备,而且还可以极大丰富ADCs的种类与功能。随着众多含有不同生物正交化学官能团的ncAAs被用于遗传密码子扩展技术,越来越多在生理条件下稳定的偶联反应,如叠氮‑炔环加成(azide‑alkyne cycloaddition)、点击化学(click chemistry)等被用于制备均一化ADCs[77]。通过遗传密码子扩展技术引入两种不同的ncAAs既可以实现在单个抗体分子中装载两种具有协同作用的药物提高ADCs的效力,又可以在单个抗体中实现同时装载药物分子和荧光探针用于ADCs 在组织细胞中的荧光成像。Schultz研究组[78]通过遗传密码子扩展技术分别将pAcF 和叠氮化赖氨酸类似物(azido‑lysine analog,pAzK)插入到anti‑Her2 IgG抗体的重链和轻链上,成功制备了能同时偶联毒性药物分子和荧光探针的均一化ADCs。该课题组还通过遗传密码子扩展技术将pAcF 位点特异性插入到anti‑Her2 IgG 抗体中与小干扰RNA(small interfering RNAs,siRNAs)偶联,成功制备出了能够沉默肿瘤细胞内基因表达的ADCs 药物,并且他们发现偶联位点对该ADC分子的活性影响较大[79]。Guo课题组[80]利用遗传密码子扩展技术将含叠氮基团ncAA定点引入到利妥昔单抗(rituximab)中,通过与双功能臂DIBO−DOTA 发生click 反应成功制备出了有放射性核素64Cu 标记的ADCs,其具有肿瘤成像和放射性免疫治疗的应用前景。除了用于抗击肿瘤外,目前由遗传密码子扩展技术制备的均一化ADCs还被用于其他疾病的治疗。Schultz研究组[81]通过遗传密码子扩展技术将免疫抑制剂——达沙替尼(dasatinib)定点偶联到能够与造血干细胞(hematopoietic stem cells)表面抗原CXCR4高效结合的人源化抗体HLCX上,制备的ADCs能够有效避免达沙替尼靶向性不足而产生的毒副作用,可用于治疗T细胞活化引起的免疫紊乱。利用遗传密码子扩展技术将甲状腺激素受体激动剂与靶向肝脏的抗体进行定点偶联可用于非酒精性脂肪肝炎的治疗[82]。此外,相关ADCs 还被应用于治疗其他炎症及代谢性疾病[2]。目前基于ncAAs 偶联构建的ADCs数量约占临床试验ADCs的4%,我们认为凭借遗传密码子扩展技术的优势未来将有更多基于ncAAs的ADCs被应用[67]。
2.2 双特异性抗体
双特异性抗体(bispecific antibody)是基因工程抗体的一种,具有两个不同的抗原结合位点,可发挥类似于免疫突触(immunological synapse)的功能。双特异性抗体能够同时结合靶细胞(通常为肿瘤细胞)和功能细胞(通常为T 细胞),增强对靶细胞尤其是免疫原性较低的肿瘤细胞的杀伤作用(图2)。双特异性抗体结构独特、功能多样,已被用于病毒性传染病的酶联免疫检测、体内组织细胞成像、肿瘤免疫治疗以及穿透血脑屏障治疗神经退行性疾病等领域[82]。目前大量双特异性抗体药物仍处于临床试验阶段,至少有3种双特异性抗体药物已获批上市。2009 年由欧盟批准上市的双特异性抗体——卡妥索单抗(catumaxomab)可用于治疗EpCAM 阳性肿瘤导致的恶性腹水[83]。2014 年由美国批准上市的博纳吐单抗(blinatumomab)是首个具有双特异性T 细胞接合器(bispecific T cell engager)结构的双特异性抗体,可同时结合T细胞的CD3受体和淋巴癌细胞的CD19受体,用于治疗前体B 细胞急性淋巴细胞白血病[84]。该抗体药物于2015 年在欧盟批准上市。由罗氏公司(Roche)开发的双特异性抗体——艾美赛珠单抗(emicizumab)于2017 年在美国批准上市,并于2018 年获得FDA 认证。该抗体药物是首个非凝血因子类血友病药物,可用于预防体内不含VIII因子抑制物的血友病频繁出血,为血友病的治疗提供了新的解决方案[85]。虽然与普通抗体相比,双特异性抗体表现出了优异的灵敏度、特异性以及多靶点靶向能力,但其面临着表达量低、容易聚集、血清半衰期短、副作用强等缺点[85]。

Fig.2 Applications of genetic code expansion in antibody-related drugs图2 遗传密码子扩展技术在抗体类相关药物中的应用
传统双特异性抗体的构建方法主要依赖于将两个抗原结合区的编码基因进行融合表达,然而这将限制二者的空间排列并可能对稳定性、有效性、选择性产生影响[86]。利用遗传密码子扩展技术在两个抗原结合区中引入ncAAs,通过正交反应与不同长度的聚乙二醇(polyethylene glycol,PEG)连接臂相连可对二者在空间位置和距离上进行调控。Schultz 研究组[87]利用遗传密码子扩展技术将pAcF 定点插入到anti‑CD3 和anti‑Her2 抗体的Fab区,随后与一端为氨氧基、另一端为叠氮或环辛烷基团的PEG 连接臂通过两步反应进行共价连接,成功制备了anti‑HER2/anti‑CD3 Fab双特异性抗体。只需皮摩尔级浓度的anti‑HER2/anti‑CD3 Fab 即可引导T细胞对Her2+阳性肿瘤细胞进行选择性杀伤,该抗体同样对低表达Her2+的肿瘤细胞显示出了较强的抑制作用。利用相同的策略,Schultz 研究组[88]还成功制备出了双特异性抗体anti‑CLL1/anti‑CD3,用于急性髓系白血病的治疗。Young 研究组[89]向anti‑BCMA 和anti‑CD3 抗体Fab 区中定点引入pAcF 并利用Diels‑Alder 反应实现了二者之间的高效交联,成功制备的双特异性抗体BiFab‑BCMA,能够介导T细胞识别成熟B细胞抗原,特异性杀伤恶性多发性骨髓瘤细胞,为多发性骨髓瘤的耐药性问题提供了新的治疗手段。
鉴于Watson‑Crick 碱基配对具有高度特异性,利用寡核苷酸链作为连接臂进行双特异性抗体的快速构建同样取得了成功。Smider研究组[90]利用遗传密码子扩展技术将pAcF 位点特异性地插入到anti‑Her2 或anti‑CD20 抗体片段的Fab 区并与一端经过氨氧基修饰的寡核苷酸链或者肽核苷酸链进行正交反应,随后与携带有anti‑CD3 Fab区的反义寡核苷酸链或肽核苷酸链进行互补配对形成完整连接臂,成功制备的双特异性抗体分别用于乳腺癌和淋巴癌的治疗。利用该策略可以快速制备双特异性抗体,甚至可以制备出异源多价特异性抗体用于提高抗体药物的有效性。
基于ncAAs 的正交反应可以突破通过传统基因融合方式产生双特异性抗体的限制,将具有靶向作用的小分子与抗体片段Fab连接到一起,制备成均一的小分子/Fab 双特异性抗体(small‑molecule‑antibody conjugate,SMAC)(图2)。Zn2+依赖金属蛋白酶PSMA在前列腺癌细胞表面大量表达而在正常组织中的表达水平极低,是理想的前列腺癌分子标志物。DUPA(2‑[3‑(1,3‑dicarboxy propyl)‑ureido]pentanedioic)是PSMA 的高效抑制剂,通过与PSMA 结合抑制其酶活性[91]。Schultz 研究组[92]利用遗传密码子扩展技术将pAcF 定点引入到anti‑CD3 抗体片段Fab 中并将其与DUPA 通过连接臂相连,制备成了DUPA/anti‑CD3 双特异性抗体。DUPA/anti‑CD3不仅在体外对前列腺癌细胞展现出了高效地选择性杀伤作用,而且在小鼠肿瘤移植模型中也显现出了良好的安全性和延长的血清半衰期。叶酸受体(folate receptor)在许多炎症细胞和肿瘤细胞(如卵巢癌和非小细胞肺癌等)表面过度表达,其对叶酸具有极强的亲和力。该研究组采用相同的策略成功制备了叶酸分子/anti‑CD3 Fab双特异性抗体并将其用于靶向叶酸受体高表达的癌症治疗,同样获得了较好的实验结果[93]。
2.3 基于蛋白质开关控制的细胞治疗
与传统的放化疗相比,免疫细胞疗法具有靶向性好、毒副作用小等特点。嵌合抗原受体T细胞免疫疗法(chimeric antigen receptor T‑cell immune‑therapy,CAR‑T)在癌症治疗中表现出了巨大潜力,工程化T细胞表面的scFv抗体能够靶向识别体内肿瘤组织,特异性杀伤肿瘤细胞。目前该疗法已被FDA 批准用于急性淋巴细胞白血病的治疗[94]。然而工程化T细胞在体内的不可控性可能导致严重后果,包括引起细胞因子释放综合症(cytokine release syndrome)以及长效B细胞发育不全等[95]。为了解决这一问题,Young 课题组[96]和Cao 课题组[97]设计了一种基于遗传密码子扩展技术的蛋白质“开关分子”,实现了在体内对工程化T 细胞活性的调控。该“开关分子”由异硫氰酸荧光素(fluorescein isothiocyanate,FITC)和靶向肿瘤细胞的小抗体分子组成,二者通过基于ncAAs的正交反应共价相连(图2)。工程化T细胞在体内不再直接靶向肿瘤细胞,而是特异性识别蛋白质“开关分子”中的FITC,随后由蛋白质“开关分子”介导其对肿瘤细胞的识别和杀伤。该方法能够使人们通过控制蛋白质“开关分子”在体内的浓度来精细调控工程化T 细胞的活性,避免了CAR‑T 在体内的不可控性。同时只需对“开关分子”中的小分子抗体进行简单替换,即可实现将工程化T细胞靶向不同肿瘤细胞,避免了对工程化T 细胞进行重复改造。
通过诱导剂控制治疗性蛋白质的表达可用于多种疾病的治疗。目前研究人员主要通过诱导剂控制转录水平的应答来实现对治疗性蛋白质表达的调控。这种调控方式响应速度慢,并不能够完全满足对疾病治疗的需求。Liu 课题组[98]近期开发出了一种基于遗传密码子扩展技术的治疗开关系统(ncAA triggered therapeutic switch,NATS),实现了在翻译水平上对治疗性蛋白质表达的控制,并成功将其用于小鼠糖尿病的治疗。他们将遗传密码子扩展系统以及含有UAG 终止密码子的胰岛素基因同时整合进工程化细胞中,随后将该工程化细胞移植到小鼠体内,通过饲喂含有相应ncAA的饲料实现了对工程化细胞中胰岛素表达的精准调控,有效降低了小鼠的血糖水平。
2.4 具有共价交联活性的蛋白质药物
与靶点存在共价交联机制的药物一般具有选择性高、药效持久、药代动力学性质优良等特点,因此共价交联药物的开发一直备受关注。由于小分子化合物药物易于通过化学合成或修饰添加各种反应官能团,一段时间以来共价交联药物的研发主要聚焦于一些小分子化合物。一般小分子共价交联药物会与靶点蛋白的口袋或活性中心特异性结合并与其中的Lys 或Cys 残基侧链发生交联形成共价键[99]。值得注意的是,小分子共价交联药物并不适合用于干扰蛋白质与蛋白质之间的相互作用(protein‑protein interactions,PPIs),这是因为PPIs 往往发生在面积高达数百埃的界面上,远超小分子共价交联药物的作用能力。PPIs 与诸多生命过程密切相关,包括信号转导、分化调控以及大分子合成等。PPIs 紊乱会导致多种疾病的发生[100]。以干扰PPIs为目标设计药物已被证实是治疗一些炎症疾病的有效手段。受抗原‑抗体特异性相互作用启发,研究人员认为以同为大分子的多肽或蛋白质为基础设计药物有望成为干扰PPIs,治疗相关疾病的有效手段。
与小分子共价交联药物类似,若蛋白质或多肽类药物能够与其靶点共价连接,有望提高药物的选择性并增强药效。然而20 种cAAs 仅Cys 能够在没有酶催化的情况下形成二硫键。二硫键在生理条件下易受还原势的影响,不适合用于共价交联蛋白药物的开发[101]。通过向蛋白质或多肽中引入含有正交反应官能团的ncAAs 有望解决这一问题。Pellecchia研究组[102]利用固相肽合成将Lys‑丙烯酰胺插入到靶向E3 泛素连接酶Siah 的短肽BI‑107D1中,发现具有共价交联活性的BI‑107D1 肽能够更好地抑制Siah 的活性,有望用于由Siah 诱发的癌症的治疗。采用相同的策略,BIM肽被设计成为共价交联肽靶向致癌蛋白Bcl2A1,表现出了极好的位点选择性[103]。在人类癌症中肿瘤蛋白Mdm2 和Mdm4 会与肿瘤抑制蛋白p53 发生相互作用导致其失活。Wang 课题组[104]将含芳基磺酰氟的氨基酸(aryl sulfonyl fluoride,Ar‑SO2F)插入到靶向肿瘤蛋白Mdm2 和Mdm4 的短肽SAHp53‑8 中制成了共价交联肽,成功干扰了p53 与Mdm2/4 之间的相互作用。他们还发现该共价肽对Mdm4的选择性明显高于Mdm2,而野生型SAHp53‑8 对二者的亲和力是相同的。随后又有靶向不同PPIs 的共价交联肽被设计合成出来,其优点也得到越来越多的验证。
由于固相肽合成只能用于合成相对较短的多肽,这导致该方法不能够用于大分子共价交联蛋白药物的开发,而遗传密码子扩展技术有望解决这一问题。为避免共价交联蛋白药物中ncAAs 与胞内其他蛋白质组分发生无区别的交联反应干扰细胞功能,Wang 课题组[105‑108]率先提出了邻近触发化学共价交联(proximity‑triggered chemical crosslinking)的概念并合成了一系列新型ncAAs,包括含卤代烷烃的EB3、含全氟苯的F‑PSCaa、含氟乙酰胺的FAcK 以及含芳基氨基甲酸酯的FPheK等。这些ncAAs 在生理条件下不会与胞内低浓度游离的cAAs 或蛋白质发生交联,只有含ncAAs 的共价交联蛋白药物与靶蛋白成功建立起稳定的相互作用,ncAA以适当方向接近其靶点cAA时才会激发共价交联反应的发生。该课题组最近利用遗传密码子扩展技术开发出了第一种共价交联蛋白药物用于癌症的治疗[109]。人程序性死亡蛋白‑1(PD‑1)是位于T 细胞膜表面可调控T 细胞活性的转膜受体。PD‑L1 可与PD‑1 发生相互作用抑制T 细胞增殖活化,导致肿瘤特异性T细胞衰竭和凋亡,其往往在不同肿瘤细胞表面过度表达(图3)。使用外源PD‑1竞争性阻断体内T细胞上PD‑1分子与肿瘤细胞上PD‑L1分子间的相互作用可用于癌症免疫治疗。Wang 课题组将氟磺酸‑L‑酪氨酸(4‑flourosulfate‑L‑tyrosine,FSY)通过遗传密码子扩展技术定点引入到PD‑1 中制备成了可发生共价交联的蛋白药物PD‑1(FSY)。FSY 可在PD‑1(FSY)与PD‑L1 发生相互作用时与PD‑L1 上特定的His残基发生共价交联(图3)。他们发现,不管是体内还是体外,PD‑1(FSY)都比野生型PD‑1表现出了更好的抗肿瘤活性[109]。利用蛋白水解靶向嵌合体(proteolysis‑targeting chimera methodology,PROTAC)降解肿瘤源性蛋白可用于癌症的治疗。Chen 课题组[110]通过遗传密码子扩展技术向anti‑PD‑L1纳米抗体中引入FYS,构建了能够与PD‑L1 形成共价交联蛋白药物GlueTAC。GlueTAC能够与肿瘤细胞表面的PD‑L1形成共价交联,促进PD‑L1的内吞和在溶酶体中的降解,有效缓解PD‑L1造成的肿瘤细胞免疫逃逸。共价交联蛋白药物概念的提出以及遗传密码子扩展技术的应用将蛋白药物的设计与开发提升到了新的高度。

Fig.3 The mechanisms of PD-1(FSY)in cancer treatment图3 共价蛋白药物PD-1(FSY)治疗肿瘤的原理示意图
2.5 治疗性蛋白疫苗
遗传密码子扩展技术为治疗性疫苗和预防性疫苗的开发提供了开创性解决方案,有望在疫苗领域引起一场新的技术革命。一般人体内免疫系统不会对自身蛋白质产生免疫应答的现象称之为免疫耐受,自身免疫耐受可有效防止自免疫疾病的发生[111]。然而在某些情况下打破自身免疫耐受,引导免疫系统靶向自身蛋白质有助于包括癌症、慢性炎症以及骨质疏松等多种疾病的治疗[112‑113]。通过向自身蛋白质中引入新的抗原表位或者进行大量化学修饰可在一定程度上打破自身免疫耐受激活体内免疫应答,但同时有可能对目标蛋白的折叠产生影响[114]。机体在受到病毒感染以及发生炎症时会通过氧化应激反应引发自身某些蛋白质中的Tyr残基发生翻译后修饰形成硝基酪氨酸(nitrotyrosine)和磺基酪氨酸(sulfotyrosine),目前这一过程被证实与机体打破免疫耐受,诱发自身免疫疾病相关。随后研究人员发现硝基和磺基在体内具有较强免疫原性,是打破自身免疫耐受的关键所在。因此,一些含硝基或者磺基的ncAAs,包括p‑nitro‑L‑phenylalanine(pNO2F)、3‑nitro‑L‑tyrosine(3‑NO2Y)和p‑sulfo‑L‑phenylalanine(pSO3F)被认为可用于治疗性蛋白疫苗的开发(图4)[115‑116]。
肿瘤坏死因子‑α(TNF‑α)是在机体炎症发生过程中扮演重要角色的多功能细胞因子,被认为与多种炎症疾病相关,包括克罗恩病和类风湿性关节炎等。以TNF‑α为靶点,打破其自身免疫耐受,诱导免疫系统产生中和TNF‑α抗体被认为可用于多种炎症疾病的治疗。Smider课题组[117‑118]利用遗传密码子扩展技术将小鼠mTNF‑α中第11位Lys或第86位Tyr 残基定点突变成pNO2Phe 后,mTNF‑α 产生了新的抗原决定簇,有效打破了自身免疫耐受,产生了能够同时识别突变体及野生型mTNF‑α的高效价抗体。他们发现pNO2Phe在mTNF‑α中的突变位置对能否打破自身免疫耐受至关重要。为了明确pNO2Phe86‑mTNF‑α 的作用,他们分别将接种了野生型mTNF‑α 和突变体pNO2Phe86‑mTNF‑α 的小鼠进行脂多糖(LPS)处理,发现免疫接种pNO2Phe86‑mTNF‑α 后可有效降低小鼠的死亡率。RANKL是TNF家族中的细胞因子,其与能够分解骨骼组织的噬骨细胞激活有关,是治疗骨质疏松症和类风湿性关节炎等疾病的潜在靶点[119]。Tao 课题组[120]通过遗传密码子扩展技术将RANKL 中第234位和第240位的Tyr残基突变为pNO2Phe后,有效打破了其自身免疫耐受,产生了能够同时特异性识别野生型和突变体RANKL且在体内持留时间长的高效价抗体。他们随后还明确了免疫接种pNO2Phe234‑mRANKL 后,小鼠的骨质疏松和类风湿性关节炎症状明显减轻。其他自身蛋白质如补体系统组分5α、蛋白前体转化酶subtilisin/kexin 9 等同样可以通过类似的策略打破自身免疫耐受[117]。通过遗传密码子扩展技术插入免疫原性强的ncAAs不仅可以用于打破自身免疫耐受,同时还有望提高一些外源蛋白的免疫原性,用于一些感染性疾病的预防和治疗。
2.6 预防性衰减疫苗
目前人们主要通过接种灭活或者减毒疫苗来预防一些传染病。灭活疫苗中的病原体在体内无法复制繁殖,往往需要多次免疫接种才能达到理想的预防效果;而减毒活疫苗在体内能够正常复制繁殖,只需接种一次就可以获得较强的免疫应答,但存在减毒病原体通过回复突变重新获得致病性的使用安全问题。将病原微生物中关键蛋白进行基于遗传密码子扩展技术的ncAAs 突变,可构建出严格依赖ncAAs生长的营养缺陷型突变株。这些突变株由于ncAAs的缺乏而不能在人体内正常复制繁殖,会逐渐消亡(图4)[67]。将该技术用于疫苗领域具有诸多优势:a.突变株与野生型病原体的结构完全一致,具有与野生型一样的免疫原性,能够激发宿主发生较强免疫应答;b.在病原微生物必需基因中插入多个ncAAs可有效降低发生回复突变重新获得致病性的概率,提高安全性;c.与获得减毒突变株的传统方法相比,ncAAs营养缺陷型突变株构建方法简单且适用范围较广。
目前遗传密码子扩展技术已被应用于病毒衰减疫苗的研发。ncAAs营养缺陷型突变病毒株只能够在相应ncAAs 存在的情况下,在含有正交aaRS/tRNA 对的细胞系中生长繁殖,在人体正常细胞中则不能复制繁殖(图4)。Guo课题组[121]率先将遗传密码子扩展技术用于HIV‑1 ncAA 营养缺陷型突变株的构建。他们向HIV‑1 不同基因中引入UAG突变,随后利用含有正交aaRS/tRNA对的转基因细胞系对HIV‑1病毒进行诱导表达,以期能获得具有感染活性的ncAA营养缺陷型突变株。通过一系列筛选,他们发现将HIV‑1蛋白酶第59位Tyr残基或将Gag 蛋白第36 位Trp 残基和第127 位Gln 残基突变为pAzPhe 可保留病毒的自组装能力和感染性。然而UAG 回复突变为其他有义密码子的风险限制了该ncAAs营养缺陷型突变株的进一步应用。为了解决这一问题,该课题组将四碱基密码子(UAGA)替换了UAG密码子用于介导ncAAs的插入,大幅降低了ncAAs营养缺陷型突变株发生回复突变的频率[122]。除此之外,他们还将编码正交aaRS/tRNA对的基因整合到HIV‑1基因组中,其可在感染过程中与病毒基因组一起插入到机体正常细胞中,随后可通过控制ncAAs的有无来调控HIV‑1在体内的传代次数,达到增强免疫的效果[123]。Zhou 课题组[124]利用遗传密码子扩展技术向流感病毒(influenza virus)NP蛋白中引入多个UAG突变,成功构建了低逃逸率的流感病毒ncAAs 营养缺陷型突变株。通过多种动物模型实验,他们发现获得的流感病毒ncAAs 营养缺陷型突变株与商品化的疫苗相比具有更强的免疫原性,可激发宿主免疫系统发生更强、更广泛的免疫应答。
利用遗传密码子扩展技术构建严格依赖ncAAs生长的致病菌同样获得了成功。与病毒相比,由于病原菌具有独立的大分子合成系统,其逃逸频率,即发生回复突变的频率相对更高。目前研究人员已采用多种策略有效解决了这一问题。Isaacs 课题组[125]通过向E.coli22个必需基因中同时引入多个UAG 突变,大幅降低了逃逸频率。Church 课题组[126]通过计算生物学和基于ncAAs的筛选,获得了代谢过程严格依赖ncAAs的E.coli菌株,有效避免了由基因突变或者水平基因转移造成的逃逸。Schultz课题组[127‑129]通过利用定点突变建立起严格依赖ncAAs 的关键酶活性位点、关键蛋白质间相互作用以及关键蛋白质修饰/去修饰的方式同样大幅降低了逃逸效率。目前严格依赖ncAAs 的结核分枝杆菌(Mycobacterium tuberculosis)已被成功构建,其作为活体疫苗预防肺结核的研究也正在进行当中[24]。
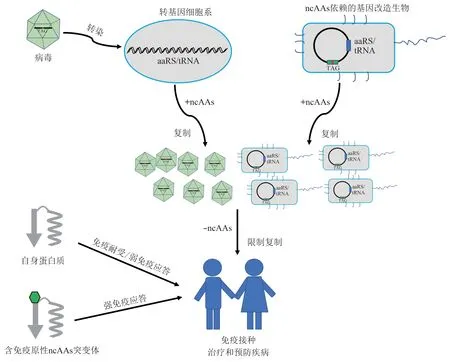
Fig.4 Applications of genetic code expansion in the vaccine development图4 遗传密码子扩展技术在疫苗中的应用
2.7 治疗性细胞因子的长效化
蛋白质类药物一般都具有分子质量高、半衰期短、免疫原性强等特点。通过对蛋白药物进行共价聚乙二醇修饰(PEGylation)可有效提高蛋白药物的稳定性以及在体内的半衰期[130]。过去一般采用对蛋白质N 端氨基、C 端羧基、Lys 的ε‑氨基或者Cys的巯基进行修饰。然而对蛋白质末端修饰可能会影响其活性,对内部的Lys 和Cys 残基进行不加选择地修饰会导致产物不均一,无法获得药效稳定的产物并可能影响蛋白药物的免疫原性[131]。通过遗传密码子扩展技术定点引入ncAAs不仅可以获得均一的PEG 修饰产物,还可以明确不同修饰位点对治疗性蛋白性质的影响从而获得药效更加优良的修饰蛋白。Kimmel 研究组[132]率先利用遗传密码子扩展技术向人生长激素(human growth hormone,hGH)不同位点引入pAcF,通过与含氨氧基修饰的PEG 分子形成肟键构建了一系列在不同位点实现均一化PEG 修饰的hGH,并对它们的性质进行了比较分析。其中Y35pAcF‑hGH 在大鼠模型中与野生型hGH 活性相当并且具有更优良的药代动力学性质,极大提高了hGH 在体内的半衰期。随后Y35pAcF‑hGH 被命名为ARX201,用于成人生长激素缺乏症(AGHD)的临床治疗并取得了理想效果,有助于大幅降低hGH 的给药频率。Zhou 研究组[133]在上述研究的基础上利用相同的策略对hGH 进行了多位点PEG 修饰,获得的最终突变体Y35/G131/K145‑NEAK 与Y35pAcF 相比具有更低的免疫原性和更优良的药代动力学性质。目前人成纤维细胞生长因子21(FGF21)、牛粒细胞集落刺激因子(GCSF)、干扰素α2b(IFN‑α2b)、生长激素受体拮抗剂(GHR antagonists)、白介素‑4(interleukin‑4,IL‑4)等均采用遗传密码子扩展技术进行了定点PEG 修饰,在保留了其生物学功能的同时大幅提高了血清半衰期[72]。PEG 虽然能够有效延长治疗性蛋白在体内的半衰期,但研究表明PEG黏附脂质体会激活体内补体系统产生中和PEG抗体,导致二次给药时PEG 修饰蛋白的血清半衰期缩短,因此有必要寻找性质更加优良并可用于蛋白质修饰的聚合物[134]。Meinel 研究组[135]通过遗传密码子扩展技术向IL‑4中定点引入含炔丙基的赖氨酸类似物(propargyl‑L‑lysine,Plk)并将其用于聚2‑恶唑啉(poly 2‑oxazoline,Pox)聚合物修饰,结果表明修饰后的IL‑4生物学功能、热稳定性和化学稳定性均未受到影响。
将生长因子、细胞因子以及其他调控因子固定到病灶周围可在保证治疗疾病的同时有效缓解这些治疗性蛋白存在的全身毒副作用。利用蛋白质分子内部的Lys 或Cys 残基固定到介质表面会导致产物不均一、空间排列混乱,影响其药代动力学性质以及免疫原性[136]。通过遗传密码子扩展技术将治疗性蛋白位点特异性地固定到载体上,可制备空间排列单一的均一化产物。Meinel研究组[137]利用遗传密码子扩展技术将Plk位点特异性插入到成纤维细胞生长因子2(FGF2)中,通过铜催化的叠氮炔环加成反应将其连接到琼脂糖颗粒上,制备的固定化Plk‑FGF‑2可高效促进其周围人骨肉瘤细胞的增殖。他们采用相同的策略将IL‑4 固定到琼脂糖颗粒上,发现固定后的IL‑4仍具有生物学功能,可有效促进巨噬细胞的分化[138]。该研究组还通过遗传密码子扩展技术将Plk 定点插入到胰岛素样生长因子I(IGF‑1)中并将其固定到琼脂糖颗粒上,他们发现固定化plk‑IGF‑I比游离IGF‑1更能有效促进C2C12细胞肌管形成[139]。Nickel 课题组[140]利用基于ncAAs 的点击化学反应将骨形态发生蛋白2(BMP2)固定到含有活化叠氮基的琼脂糖微珠上,发现BMP2‑K3Plk具有促进其周围细胞向成骨细胞系分化的潜力。上述研究表明利用遗传密码子扩展技术制备固定化蛋白因子有望用于伤口愈合、骨缺陷、类风湿性关节炎以及动脉硬化症等疾病的治疗。
2.8 抗菌肽
随着抗生素滥用导致的细菌耐药性问题日趋严重,开发下一代高效广谱抗菌药物已迫在眉睫。抗菌肽(antimicrobial peptide)是一类具有抑菌杀菌功能、带正电荷的两亲性小分子肽,通常由11~50个氨基酸残基组成,广泛存在于微生物以及动植物体内,是宿主天然免疫的重要组成部分。抗菌肽种类和数量繁多,目前已发现有3 000 多种,被认为是抗生素药物的理想替代品[141]。一般在生理条件下,抗菌肽的稳定性及可溶性较差,易受蛋白酶水解,这限制了其在生物医药行业中的应用。已有大量研究表明,通过蛋白质工程可有效改良抗菌肽的性质,提高其应用价值[142]。一些抗菌肽以前体的形式被核糖体翻译出来,随后通过翻译后加工修饰形成有活性的形态,翻译后修饰的过程往往涉及一些ncAAs的形成。受此启发,研究人员认为对抗菌肽进行基于ncAAs 的改造有望获得稳定性、特异性、半衰期、抗菌谱等性质显著提高的突变体[143]。
目前有关利用遗传密码子扩展技术对抗菌肽进行基于ncAAs 改良的研究才刚刚起步。Donk 课题组[144]通过遗传密码子扩展技术向抗菌肽lacticin 481和nukacin ISK‑1核心区与前导肽之间定点引入α‑羟基酸(alpha hydroxy acid),实现了利用酸碱处理去除前导肽,避免了特异性蛋白酶的使用。Schultz研究组[145]将含有α氯乙酰胺的ncAAs通过遗传密码子扩展技术插入乳链菌肽A(nisin A)中形成了由硫醚键组成的新型环状拓扑结构。Link研究组[146]利用遗传密码子扩展技术将4 种ncAAs引入抗菌肽MccJ25 结构中,丰富了该抗菌肽的化学多样性。Süssmuth研究组[147]同样通过遗传密码子扩展技术将5 种ncAAs 插入抗菌肽capistruin 中,利用Hoveyda‑Grubbs 催化剂修饰ncAAs 的侧链基团成功引入了新的化学结构。Young 课题组[25]利用遗传密码子扩展技术向抗菌肽thiocillin中引入了一些含有生物物理探针(荧光探针、光交联基团)的ncAAs,在提高thiocillin化学多样性的同时为探测其抗菌机理提供了便利。Donk 课题组[148]将多种ncAAs定点引入到抗菌肽lacticin 481中获得了抑菌活性显著提高的突变体。尽管多项研究表明插入ncAAs可能会导致抗菌肽的生物学活性下降,但该领域的先驱们普遍认为向抗菌肽分子内部引入ncAAs必将丰富抗菌肽的化学多样性,有望开发出针对新型病原体的杀伤能力。
2.9 病毒载体外壳蛋白修饰
腺病毒(adeno‑associated virus,AAV)隶属于细小病毒科,其基因组为线状DNA 分子。AAV无明显致病性,转导效率高,是基因治疗中常用的病毒载体。然而其在体内靶向性差,免疫原性强,血清半衰期短等特点限制了其应用[149]。相关学者通过基于遗传密码子扩展技术的多种策略在一定程度上解决了上述问题。Zhou 课题组[150]利用遗传密码子扩展技术将Nε‑2‑azideoethyloxycarbonyl‑L‑lysine(NAEK)定点插入到衣壳蛋白VP1 中,构建了一系列含有定点PEG 修饰的AAV 突变体并从中获得了血清稳定性提高了2.4 倍的修饰病毒颗粒。Chatterjee 课题组[151]利用遗传密码子扩展技术将靶向整合素的环肽RGD(cyclic‑RGD peptide)定点锚定到AAV衣壳蛋白上,显著提高了AAV对高表达αvβ3整合素受体细胞的识别和转染。Zhou课题组[152]通过遗传密码扩展技术将荧光探针连接到病毒载体上,实现了对病毒颗粒感染细胞及在胞内运输的可视化监测。最近,Chatterjee 课题组[153]利用遗传密码子扩展技术实现了对AAV 载体感染性的光调控,为未来在使用过程中对AAV 载体的时空调控打下了坚实基础。他们将AAV2衣壳蛋白VP1 中参与宿主细胞表面硫酸乙酰肝素蛋白多糖(heparan sulfate proteoglycan,HSPG)结合的关键氨基酸残基(R585,R588)进行了ncAAs 突变,新引入的赖氨酸衍生物NBK 由于正电荷屏蔽作用及空间位阻效应可干扰VP1与HSPG的结合,从而抑制AAV2 的感染性。通过紫外光照射可使NBK脱去保护基团转变为Lys,使AAV2恢复感染活性。
3 其他应用
环肽一般结构紧密,与靶点结合亲和力高并能耐受蛋白酶的降解,其在蛋白质抑制剂开发方面具有重要应用。Schultz研究组[154]将遗传密码子扩展技术用于HIV‑1蛋白酶抑制剂环肽的开发,通过多轮进化筛选,他们发现将对苯甲酰苯丙氨酸(4‑benzoyl‑L‑phenylalanine,pBzF)定点引入到环肽G12 中,可诱使G12 与HIV 蛋白酶发生共价交联,显著抑制其活性。Kawakamide 研究组[155]同样借助于遗传密码子扩展技术获得了能够抑制TNF‑α功能的环肽分子。Smider研究组[156]利用噬菌体展示技术和遗传密码子扩展技术获得了对HIV gp120蛋白亲和力显著提高的抗体分子,并且发现ncAAs 在其中扮演的角色具有不可替代性。目前CRISPR/Cas 已被广泛应用于基因编辑领域,在未来有望用于人类一些重大遗传病以及癌症的治疗,然而其潜在的脱靶效应仍待解决。Deiters 研究组[157]利用遗传密码子扩展技术向Cas9 中定点插入光保护的赖氨酸(PCK)抑制其活性,随后通过紫外光照使PCK脱去光保护基团形成Lys恢复活性,实现了在时间和空间上对Cas9 活性的调控。Liu 课题组[158]通过将 4‑(2‑azidoethoxy)‑l‑phenylalanine(AeF)定点插入到Cas12 蛋白中并与相应含有二苯并环辛炔修饰的crRNA 形成共价复合物,显著提高了Cas12‑crRNA 的基因编辑能力,并成功将其用于CAR‑T 细胞的制备。此外,遗传密码子扩展技术还被广泛应用于一些病原微生物致病机理的研究。Chen 课题组[159]利用遗传密码子扩展技术在一些肠道致病菌中(如E.coli,Shigella,Salmonella)引入一系列光交联(photo crosslinking)ncAAs,研究了这些致病菌在感染人体过程中抵御胃酸及分泌毒素的分子机制。Müller课题组[160]利用遗传密码子扩展技术以及荧光手段研究了HIV包膜糖蛋白在病毒出芽过程中的作用。Shin课题组[161]利用遗传密码子扩展技术对β‑N‑乙酰己糖氨基酶进行甘露糖‑6‑磷酸盐(M6Ps)修饰并将其靶向细胞内的溶酶体,成功用于缺乏内源性β‑N‑乙酰己糖氨基酶细胞疾病的治疗。
4 总结与展望
本文综述了遗传密码子扩展技术近几年来的研究进展及其在蛋白质及多肽等生物技术药物中的应用。虽然研究人员目前已经能够通过遗传密码子扩展技术将200多种ncAAs位点特异性插入到蛋白质中,但是这些ncAAs 在结构上大多是对Tyr 或Lys结构的延伸,将更多不同化学结构的ncAAs用于遗传密码子扩展技术有望扩展该技术的能力。由于真核生物基因组庞大且复杂,现阶段通过密码子重分配提高遗传密码子扩展技术在真核生物中的ncAA整合效率、增加含ncAAs蛋白质的产量仍无法获得突破。由于密码子和相互正交RS/tRNA对的匮乏,向除E.coli之外的物种中同时插入两个以上不同的ncAAs依然具有困难。将遗传密码子扩展技术应用于更多物种,包括一些特殊致病菌以及高等多细胞生物等仍面临巨大挑战。然而随着合成生物学、化学生物学、分子生物学以及生物化学等学科的不断发展与积累并指导遗传密码子扩展技术的改良与突破,人类最终有望能够在细胞中从头合成全部由ncAAs 组成的非天然聚合物(non‑canonical polymers)。随着计算化学以及计算生物学技术的兴起,通过计算模拟辅助遗传密码子扩展技术用于蛋白质及多肽药物的设计将大大提高成功率并有效节约生产成本。随着遗传密码子扩展技术不断成熟与发展,未来其将为诸多生物学问题提供开创性解决方案。
