中药单体干预前列腺癌的作用机制研究进展
2022-02-09王华婷俞采妮康媛源李丹
王华婷,俞采妮,康媛源,李丹
(浙江大学药学院,浙江 杭州 310058)
前列腺癌(prostate cancer,PCa)是男性最常见的恶性肿瘤之一,严重危害生命健康。近年来,随着生活水平的提高,我国男性PCa患病和死亡人数呈明显上升趋势。PCa细胞的存活和生长通常依赖于雄激素,而雄激素受体(androgen receptor,AR)信号通路对绝大多数PCa的发生和发展至关重要[1]。目前晚期PCa的主要治疗方法是手术、药物去势或使用AR拮抗剂的雄激素剥夺疗法(androgen deprivation therapy,ADT)。虽然ADT能在一定程度上延长患者的生存时间,控制肿瘤的发展进程,但在长期ADT治疗后会出现代谢异常、认知能力下降和心血管疾病等问题,严重降低了患者的生活质量[2]。中西医联合治疗PCa在我国被广泛采用,其中中药的作用主要是减轻患者ADT治疗后的不良反应,延缓雄激素依赖性前列腺癌向去势抵抗性前列腺癌(castration-resistant prostate cancer,CRPC)发展[3]。一种包含8味中药的中药复方PC-SPES曾经在PCa治疗中作为替代疗法备受关注,1996年Botanic Lab将其作为保健品引入美国市场,但由于PC-SPES的稳定性和安全性问题于2002年撤市。随后结合临床疗效、毒性和副作用对PC-SPES进行改良得到了更好的中药复方,如PC-SPES II[4]、川龙抑癌汤[5]等。前列消癥汤是一种常用的PCa中医辅助治疗药物,其主要成分为生薏苡仁、炙黄芪和黄精等。临床研究表明,在常规西医治疗的基础上联用前列消癥汤能降低患者体内前列腺特异性抗原(prostate specific antigen,PSA)水平[6],减轻患者排尿困难、血尿和尿痛等症状,改善患者的生活质量。此外,多项临床研究表明使用中药制剂鸦胆子油乳注射剂相较于对照组(仅ADT治疗)能明显降低患者的PSA水平,改善临床症状[7]。但是由于中药方的成分复杂、作用机制不明、治疗剂量大等问题,限制了中药在抗肿瘤治疗中的应用。相比之下,研究中药提取物,明确其成分的作用机制,有助于进一步规范和完善中药在抗肿瘤治疗中的应用,也有助于以天然产物为源头的药物开发。
AR在PCa的发生发展过程中发挥着重要的作用。AR是核转录因子中类固醇激素受体家族的成员,是一种配体依赖型的反式转录调节蛋白[8]。大量研究表明,在PCa病例中,AR大多呈现持续的高表达状态。AR的高表达与癌细胞的增殖和侵袭密切相关。近年来,随着中医药研究的深入,越来越多的中药单体被发现能够在拮抗AR方面发挥直接或间接的作用,即使是对于AR阴性的PCa细胞,也有中药单体表现出较好的抑制增殖、转移、侵袭作用和促进凋亡作用。本文以中药单体的作用机制与AR及其信号通路的相关性为主线,系统归纳总结了近几年研究报道的能够治疗PCa的中药单体,为相关研究提供参考(见图1)。
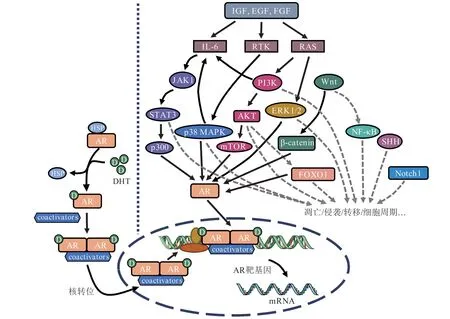
图1 中药单体在前列腺癌治疗中的作用机制分类Figure 1 Classified mechanisms of traditional Chinese medicine monomers in treating prostate cancer
1 雄激素受体依赖
目前临床常用ADT阻止AR的激活来达到治疗PCa的目的,但对于CRPC来说,ADT难以发挥作用。AR信号转导只需少量雄激素,甚至可以绕开雄激素,通过其他方式使AR激活。但在去势抵抗的过程中AR仍是各个信号通路与PCa相联系的枢纽。部分中药单体可以通过直接或间接的方式抑制AR及其转录因子活性,从而影响和控制PCa的发生和发展。
1.1 作用于雄激素受体经典信号通路
在AR信号转导通路中,AR与热休克蛋白(hot shock protein,HSP)结合时,AR以非活性状态存在。当AR与睾酮或睾酮活性代谢物5α-二氢睾酮(5α-dihydrotestosterone,5α-DHT)结合后,被激活的AR解离HSP,与辅因子蛋白结合,形成二聚体,在细胞核内与DNA雄激素响应元件(androgen response element,ARE)结合,启动转录程序[8],从而调控靶蛋白[如PSA、跨膜丝氨酸蛋白酶2(transmembrane protease serine 2,TMPRSS2)、前列腺跨膜雄激素诱导蛋白1(prostate transmembrane protein,androgen induced1,PMEPA1)等]的表达。而部分抗PCa的相关中药单体能在上述多个环节起到抑制作用。
1.1.1 降低雄激素受体的表达水平细胞中AR自身的表达量的多少是AR经典信号通路能否被激活及激活程度的重要条件,而一些中药单体能够通过各种途径降低AR的表达水平。刘彼得等[9]对AR的表达水平研究发现,雷公藤甲素(triptolide)能降低AR的mRNA和蛋白质表达水平。雷公藤甲素不易溶于水,其口服具有较高的生物利用度,大鼠和狗灌胃的生物利用度分别为63.9% ~ 72.1%和75.0%[10]。尽管雷公藤甲素被发现具有较好的抗肿瘤活性,但由于其对人体多个器官产生毒性,极大限制了在临床上的应用,目前研究方向主要是结构改造和制剂研究。Chiu等[11]的研究表明,木犀草素(luteolin)以剂量和时间依赖性方式降低AR的mRNA水平和蛋白质表达水平,显著抑制AR高表达的LNCaP人PCa细胞的增殖并诱导其凋亡,但对缺乏AR的PCa细胞PC-3和DU145较不敏感。Jang等[12]也观察到紫草素(shikonin)能降低人PCa细胞LNCaP和22RV1中AR的mRNA和蛋白质表达水平。但紫草素在体内代谢较慢,半衰期较长。体内实验表明,SD大鼠静脉给予紫草素5 mg · kg-1后消除半衰期为(630.7±124.9)min。此外,和厚朴酚(honokiol)[13]也能降低AR蛋白质表达水平。
1.1.2 促进雄激素受体降解AR是信号转导通路的关键一环,如果AR被降解,后续一系列的信号转导将无法进行。在细胞质中,AR的配体结合域与HSP90和HSP70相结合形成较稳定的异质复合体,不易被蛋白酶体降解,但当AR与HSP的相互作用被破坏时,结合减少,AR则容易被降解。He等[14]的研究显示,臭椿酮(ailanthone)可能通过破坏AR与其分子伴侣HSP90和HSP70的相互作用来诱导AR降解。但是一项亚急性毒性研究显示,臭椿酮(2.5 mg · kg-1,持续28天)会引起脂肪性肝炎、脾肿大、胃肠道黏膜损伤和生殖系统异常等问题[15]。Gibbs等[16]的研究表明萝卜硫素(sulforaphane)可增强HSP90乙酰化,从而抑制其与AR的相互作用。此外,研究发现木犀草素[11]、小檗碱(berberine)[17]、大黄素(emodin)[18]均可影响AR和HSP90的结合,导致AR的降解。此外,小檗碱还可以诱导AR及AR剪接变体蛋白的降解;而大黄素可增加AR与鼠双微体2(murine double minute 2,MDM2)的结合,诱导AR通过蛋白酶体途径以配体非依赖方式降解。
1.1.3 抑制雄激素受体核转位研究表明,许多中药单体能够抑制AR进入细胞核,进而影响AR的转录活性。朱要辉等[19]发现和厚朴酚能够抑制合成雄激素美曲勃龙(R1881)诱导的LNCaP和C4-2细胞中AR的核转位。但和厚朴酚经口给药后,只有较少的吸收,并且吸收后的和厚朴酚会被葡萄糖醛酸化,只有1%的给药剂量以游离形式存在,约90%会迅速从粪便和尿液中排出[20]。Li等[17]的研究证明,小檗碱可以抑制AR的核转位,同时降低AR转录的活性。赵一俊等[21]的研究证明,大黄素可通过抑制AR核转位来抑制雄激素依赖的AR反式激活,导致AR下游相关蛋白表达量的下降。葡萄糖醛酸化是大黄素口服生物利用度低的主要原因。大黄素经口给药后迅速经历Ⅱ相代谢形成其葡醛酸苷,因此体内几乎检测不到大黄素的母体形式[22]。此外,大黄素是大黄的主要毒性成分,其毒性问题也不容忽视。Zhu等[23]的研究显示,水飞蓟素(silymarin)作用于LNCaP细胞时,总AR表达量不变而核内AR水平下降,这表明水飞蓟素同样抑制了AR的核转位。
1.1.4 降低雄激素受体的转录活性进入细胞后,AR的转录活性是影响后续靶基因转录及表达程度的关键。韩洋洋[24]的研究提出,雷公藤甲素能显著抑制AR结合到PSA启动子以及RNA聚合酶Ⅱ(RNA polymerase II,RNA pol II)上,从而抑制AR转录活性,这可能是通过周期蛋白依赖性激酶7/着色性干皮病B组途径抑制AR S515的磷酸化实现的。Xu等[25]的研究表明,隐丹参酮(cryptotanshinone)可以通过阻止LNCaP细胞中AR的氨基末端/羧基末端(N/C)相互作用和与辅因子的络合物的形成,降低AR的转录活性。李天雨[26]的研究结果显示,异甘草素(isoliquiritigenin)可激活醛酮还原酶AKR1C2,促进细胞内雄激素的代谢,从而抑制AR转录活性,抑制PCa细胞的增殖。Chen等[27]的研究则表明,新异甘草苷(neoisoliquiritin)能抑制AR与ARE结合,降低AR的转录活性,抑制下游信号通路。Harada等[28]发现白藜芦醇(resveratrol)可抑制AR与PSA增强子区域的结合,减少AR的乙酰化,使配体诱导的AR核转位能力显著降低,影响其转录能力。虽然白藜芦醇在癌症患者中显示出一些疗效,但较差的生物利用度(口服生物利用度仅为1%)限制了白藜芦醇的临床应用。已有研究通过微粉化技术改善白藜芦醇的胃肠道吸收[29]。此外,槲皮素(quercetin)[30]、紫草素[12]和表没食子儿茶素-3-没食子酸酯(epigallocatechin-3-gallate,EGCG)[31]等也能降低AR蛋白的转录活性。
1.2 作用于雄激素受体的其他相关通路
有相关证据或现象显示,部分中药单体也可以通过作用于其他通路,间接影响AR的功能。如通过旁分泌途径来激活磷脂酰肌醇3-激酶-蛋白激酶B[phosphatidylinositol 3-kinase/protein kinase B,PI3K/PKB (AKT)]、丝裂原活化蛋白激酶 (mitogenactivated protein kinase,MAPK)、Wnt/β-联蛋白(Wnt/β-catenin)和两面神激酶/信号转导及转录激活因子(Janus kinase/signal transducers and activators of transcription,JAK/STAT)等信号通路,进而调控AR功能。
1.2.1 PI3K/AKT信号通路以PI3K/AKT为核心的信号通路能够调控多种蛋白质的合成,参与PCa细胞的增殖、凋亡、迁移和分化等多种调节。已有研究表明,长期的ADT治疗会促进PI3K/AKT通路的激活,从而增强肿瘤细胞的抗凋亡能力[32]。PI3K/AKT信号通路的一个重要靶标是叉头框转录因子O1(forkhead box O1,FOXO1),AKT可以诱导FOXO1磷酸化并使之从细胞核转移到细胞质,从而破坏了FOXO1对细胞核中AR转录活性的抑制作用。PI3K/AKT信号通路对AR的调控非常复杂,AR和AKT之间还存在负反馈机制,如AKT可以磷酸化AR,从而抑制AR反式激活[33]。此外,研究表明PI3K可以通过白介素-6(interleukin-6,IL-6)激活AR,但其通过IL-6激活AR的作用仍存在争议;另一些研究表明IL-6可通过PI3K/AKT途径抑制AR反式激活[34]。Nasser等[35]的研究证明,五味子乙素(schisandrin B)在LNCaP细胞中可通过PI3K/AKT和STAT3的磷酸化诱导细胞凋亡,同时可以抑制IL-6介导的AR激活。胡桃醌(juglone)通过抑制PI3K/AKT信号通路导致AR共刺激分子β-联蛋白表达下降,从而抑制PCa细胞AR的表达[36]。
1.2.2 MAPK信号通路PI3K/AKT途径在晚期PCa中经常被激活,当药物特异性靶向阻断这一途径后,MAPK补偿途径将被激活[37],使得PCa治疗效果变差。MAPK家族主要包括细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)、c-Jun氨基端蛋白激酶(c-Jun N-terminal kinase,JNK)和p38,其中ERK1/2信号通路具有促进细胞增殖和分化的作用,JNK和p38 MAPK信号通路主要在促进细胞凋亡和细胞周期停滞方面发挥作用。IL-6可代替雄激素诱导AR启动子的激活,促进AR的核转位,增强AR转录活性以及蛋白表达水平,而这一诱导可被p38 MAPK抑制剂等阻断,即IL-6可通过MAPK依赖性途径诱导AR活性[38]。还有实验表明HSP27在去势敏感的PCa细胞系中以p38 MAPK依赖性方式促进AR核转位[39]。薯蓣皂苷(dioscin)通过促进Src同源区2结构域磷酸酶-1(Srchomology region 2-domain-containing phosphatase-1,SHP1)的Y564位点的磷酸化,从而抑制ERK1/2和p38 MAPK信号通路来抑制LNCaP细胞生长和侵袭[40]。柚皮素(naringenin)在激活PC-3细胞和LNCaP细胞中AKT的磷酸化的同时降低了ERK1/2的磷酸化,最终实现了抑制细胞生长和诱导细胞凋亡的作用[41]。但相关研究并没有涉及中药单体通过MAPK信号通路对AR的间接作用,薯蓣皂苷和柚皮素对AR的作用还需要进一步的探索和研究。
1.2.3 JAK/STAT信号通路STAT3是STAT家族的成员,是一种关键的信号转导蛋白,可通过多种细胞因子、激素和癌蛋白介导信号转导,调节肿瘤细胞的存活、增殖、血管生成和转移。在细胞因子如IL-6的刺激下,STAT3可被磷酸化或乙酰化激活[42]。IL-6激活的STAT3以IL-6依赖性而雄激素非依赖性的方式作用于AR,这也是IL-6激活LNCaP细胞中的AR所必需的步骤[43]。Meng等[44]研究发现血根碱(sanguinarine)通过抑制JAK2和SRC激酶活性,并抑制STAT3磷酸化,从而抑制组成型表达STAT3的LN-s17细胞(用IL-6 cDNA转染的LNCaP细胞)增殖和迁移。但由于血根碱的季氮原子的存在,其胃肠道吸收较差。一项在大鼠体内进行的实验表明,10 mg · kg-1经口给药109天后,只有2%的血根碱被胃肠道吸收,剩余的未被吸收并通过粪便排出[45]。海葱次苷A(proscillaridin A)通过抑制PCa LNCaP和DU145细胞中的JAK2磷酸化作用来抑制STAT3的激活,并进一步影响PCa细胞的增殖[46],其对AR的间接作用也需要更加深入和具体的研究。
1.2.4 Wnt/β-联蛋白信号通路Wnt信号通路异常激活与PCa的发生发展有关,其在PCa进展的不同阶段通过不同的机制与AR信号相互作用。研究表明,Wnt配体(如Wnt1,Wnt3和Wnt5a等)在PCa细胞中高表达,参与肿瘤的发展及转移,当PCa细胞接受ADT治疗,逐渐适应低雄激素环境后,β-联蛋白会作为AR的协同激活剂,增强AR的转录活性[47]。Wnt信号通路和AR之间的相关性也被越来越多的研究所证明[48]。目前发现部分中药单体如姜黄素(curcumin)[49],可以抑制LNCaP细胞中的Wnt/β-catenin信号通路和AR信号通路。但是,几项研究的证据表明姜黄素的口服吸收、生物分布和全身生物利用度较低,其口服生物利用度仅约为0.47%[50]。
2 雄激素受体非依赖途径
大量研究显示,在PC-3和DU145等AR阴性的PCa细胞系中,中药单体仍可以在一定程度上通过某些信号通路抑制细胞的增殖。这说明在AR缺乏的情况下,中药单体也能通过AR非依赖的途径达到治疗PCa的目的。中药单体通过PI3K/AKT,MAPK,JAK/STAT和Wnt/β-联蛋白等信号通路,以AR非依赖的途径促进细胞的凋亡、抑制细胞周期、抑制细胞侵袭及诱导细胞自噬。藤黄酸(gambogic acid)通过作用于PI3K/AKT和核因子-κB(nuclear factor kappa B,NF-κB)信号通路抑制肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)诱导的PC-3细胞侵袭[51]。鸦胆子苦醇(brusatol)能通过增加磷酸化的p38 MAPK和JNK的表达,减少磷酸化的ERK表达,而显著抑制DU145细胞增殖,诱导DU145细胞凋亡[52]。三棱内酯B(sparstolonin B)通过PI3K/AKT通路诱导DU145和PC-3 PCa细胞凋亡,抑制裸鼠肿瘤的生长[53]。
此外,中药单体能通过Notch和Hh等信号通路以AR非依赖的途径抑制PCa细胞的增殖和发展。香芹酚(carvacrol)可通过抑制Notch信号通路,诱导PC-3细胞凋亡和细胞周期停滞[54]。中药单体如淫羊藿苷(icaritin)可能是通过抑制NOTCH-1蛋白的表达起到抑制PCa细胞株DU145与PC-3生长、迁移和侵袭的作用[55]。芹菜素(apigenin)、黄芩素(baicalein)[56]等可抑制体内外Hh通路来抑制PCa发展。
为了对一种中药单体存在的多种作用机制进行总结,或使受限于篇幅,前文中未进行详细介绍的中药单体作用机制得以呈现,特以表格形式罗列所有相关内容(见表1)。

表1 抗前列腺癌的中药单体及其作用机制总结Table 1 Traditional Chinese medicine monomers and their mechanisms in treating prostate cancer
3 结语
中药作为我国传统中医的特有药物,在预防和治疗肿瘤方面有着独特的效果。然而中药往往存在着组分复杂、有效成分难以确定、靶点不明等问题,因此,对具有确定结构的中药单体进行研究可以在一定程度上减少不确定因素的干扰,有利于明确其作用机制。同时,中药单体通常具有多靶点的特性,能有效对抗肿瘤治疗中的耐药性问题。中药单体在抗PCa方面也表现出巨大的潜力。研究显示,中药单体可以通过依赖于雄激素介导的AR信号经典通路影响靶基因的表达,也可以通过作用于其他通路间接影响AR的表达,还可以通过AR非依赖的途径达到治疗PCa的目的。
本文归纳总结了抗PCa相关中药单体的作用机制,以期为其应用于PCa治疗提供理论依据,为PCa治疗药物的开发提供新思路。然而,中药单体抗PCa的研究仍处于初步阶段,还有许多机制并不十分明确。同一单体可能对多个靶点具有作用,这种作用不一定是单向的,最终产生的结果需从宏观的角度综合考察。同时,部分中药单体存在着毒性较大、口服生物利用度低等缺点,而对中药单体的研究目前主要在细胞层面,缺乏深入的体内和临床研究。此外,中药单体的提取难度和稳定性等问题也提示其离成为临床药物还有较长的路要走。
目前,对PCa相关中药单体的研究仍需进一步深入。基于中药单体成药性较差的问题,需阐明各个单体的具体作用机制和作用网络,探索其药效骨架,并通过结构改造和优化,以及应用先进制剂等手段解决中药单体成药的相关问题。可以预见,中药单体在治疗PCa乃至其他相关疾病领域将大有可为。
