miR-21调控gp130/JAK2对心肌梗死大鼠心室重构、JNK信号通路及心肌保护的作用
2022-02-08冯月英施惠华戴蓉芳
冯月英 施惠华 戴蓉芳
心血管疾病发生与心肌梗死的发生密切相关,心肌梗死(myocardial infarction,MI)是心血管高发疾病,随着生活压力增加及生活习惯的改变,MI发病率逐渐升高并呈现年轻化趋势,致死率较高严重威胁人们的生命安全[1,2]。心肌梗死及缺血性心脏疾病均可以导致心脏功能不全,受神经内分泌及细胞内通路等因素改变会诱发心肌细胞与胶原网状支架及细胞外基质等发挥一系列形态结构改变及功能重构[3]。心室重构发生发展与多种基因表达异常相关,Gp130是白介素-6家族受用的受体信号及传导子,在全身组织内均有所表达,在心肌细胞中可被检测到,并可通过与上游相关配体结合后激活下游因子可加快心脏重构[4]。Janus酪氨酸激酶(Janus kinase,JAK)属于一类非受体型酪氨酸激酶,JAK2是其下游成员之一,在心血管发生发展中具有重要作用。相关研究认为,JAK2活性被抑制可诱导心肌组织损伤,进一步参与心肌梗死及心力衰竭等相关疾病发生发展[5]。c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)是重要的丝裂原活化蛋白激酶,可发挥细胞信号内外传导作用并可调节细胞生长、发育及死亡等多种生理反应过程。在心肌梗死中JNK表达升高可增加心肌细胞氧化应激损伤加快凋亡[6]。文献证实,在缺血心肌梗死的大鼠心肌组织中检测出多种miRNA水平异常,其中miR-21水平显著高于健康人,说明miR-21表达降低可增加后心肌损伤[7]。miR-21属于miRNAs其中之一,起初被认为具有加快癌细胞增殖扩散的作用,目前已经证实在心脏、肝脾及肠道组织中均发挥作用。研究表示,miR-21是心脏特异性小分子RNA,在成人心脏中有所表达,当发生心肌梗死时miR-21激活可减少心脏重构[8]。观察miR-21通过调控gp130/JAK2对心肌梗死大鼠心室重构、JNK信号通路及心肌保护的作用,为心肌梗死的临床治疗提供参考方法。
1 材料与方法
1.1 实验大鼠 实验中均为(Sprague Dawley)成年40只雄性大鼠,体重240~260 g,鼠龄4~5周,在广东省医学SD大鼠中心购买。动物许可证号:SYXK(粤)2019-0020,在通风且干净的环境中对大鼠进行饲养,5只大鼠1个笼子,温度23℃左右,湿度50%左右,黑夜白昼交替循环,自由进食标准颗粒饲料,饮干净饮用水。于开始实验前,适应环境饲养1周。动物实验的实施严格遵照《实验动物护理和使用指南》,在所有实验中严格遵守国际疼痛学会使用指南,尽可能减少大鼠的使用量,对大鼠的伤害以及导致的痛苦都相应减少。
1.2 主要试剂与仪器 miR-21-mimics、miR-21-NC-mimics(上海吉凯科技公司);TRIzol 试剂(美国 Sigma-Aldrich公司);GP130抗体(Abcam);兔抗人JAK2抗体(Abcam);JNK抗体(圣克鲁斯生物技术有限公司);山羊血清小鼠IgG二抗(北京百奥莱公司);苏木素-伊红试剂盒(南京生航生公司);FlexiWash全自动蛋白质免疫印迹系统(环亚生物科技);心电图(上海海哲仪器设备有限公司);反转录试剂盒试剂盒、TB GreenTM Premix ExTaqTMⅡ荧光定量试剂盒(日本Takala公司)。
1.3 心肌梗死建模方法 大鼠测量体重,清除气管分泌物,腹腔注射60 mg/kg的阿托品,5 mg/kg的安定及30 mg/kg的氯胺酮麻醉,仰卧位后固定于操作台上,暴露胸部连接小动物呼吸机,剔除左侧胸腔毛发消毒后在第四、五肋间切开皮肤,置入开胸器暴露心脏,剪开心包,于肺动脉及左侧心耳距离主动脉根部0.2 cm分别用4-0线及8-G手术针结扎左冠状动脉前降支,建立心肌梗死模型,撤离开胸器,青霉素冲洗胸腔后2-0线缝合皮肤,大鼠清醒后拔出呼吸机。sham组除不结扎左冠状动脉前降支外其余同上。
1.4 分组及干预方法 40只大鼠按照随机数字方法分为4组,sham组、MI组、NC组及实验组,均10只。建模成功后30 min,NC组及实验组分别在冠状动脉注射miR-21-NC及miR-21-mimics病毒载体,sham组及MI组用大鼠心脏冠状动脉注射PBS缓冲液。
1.5 组织提取 上述实验结束后,采用颈部脱臼处死大鼠,取大鼠心脏,剔除周围组织置入甲醛溶液中固定,组织切片石蜡包埋,HE染色,200倍显微镜观察大鼠心肌组织病理情况。
1.6 PCR检测心肌组织中miR-21、GP130、JAK2及JNK mRNA 心肌组织研磨,加入0.125%胰蛋白酶消化,1 000 r/min分离20 min,采用Trizol法提取总RNA,无核酸酶溶解。将提取的RNA进行转录为cDNA,获得反体系,条件为:42℃作用60 min,72℃作用5 min,4℃终点。每个细胞设置6个复孔,以β-actin为内参,反应条件为95℃预作用3 min,95℃作用5 s,58℃退火,40个循环,用2-ΔΔCt的方法计算相对表达量。见表1。

表1 引物序列
1.7 TTC 染色观察大鼠心肌组织梗死情况 4组大鼠心肌组织以PBS冲洗,沿着冠状方向切为5片,1%的TTC染色液染色20 min,随后放入4%多聚甲醛中固定24 h,以白色为梗死部位,Image-J软件分析梗死面积,梗死面积 =白色区域/总面积× 100%。
1.8 胶原容积分数测定 取心脏非心肌梗死区心肌组织,通过 HPIAS2000型医学图象分析系统对心肌胶原容积分数(CVF)进行测量,同时测量心肌血管周围胶原面积(PVCA)。测量计算公式如下:CVF=心肌胶原面积/所测视野面积,PVCA=小动脉管腔周围胶原面积/管腔面积,每张切片标本中随机选取4个非边缘视野进行测量,取其平均值为结果。
1.9 TUNEL法检测心肌组织心肌细胞凋亡率 石蜡包裹的心脏进行切片,逐层乙醇脱水,加入PBS冲洗,冲洗5 min,反复3次,加入2020 μg/ml的蛋白酶K溶液,在23℃下进行孵育30 min,PBS冲洗后,放入3%的H2O2,15 min后再次PBS冲洗,擦片后放入50 μl的TUNEL反应液,37℃下孵育60 min。PBS冲洗,加入50 μl转化剂POD、DAB显色,采用苏木精进行复染色3 min,0.2%氨水反蓝,逐层乙醇脱水,最后二甲苯透明树脂封片,心肌细胞非凋亡呈现蓝色,凋亡呈现棕黄色,每张切片选择5个非重叠视野,计算心肌细胞凋亡率。心肌细胞凋亡率=凋亡/总细胞×100%。
1.10 免疫印迹检测心肌组织GP130、JAK2及JNK抗体蛋白的水平 取适量蛋白样品,经十二烷基硫酸钠-聚丙烯酰胺凝胶,电泳分离后转移,转移至硝酸纤维素膜上,再次浸于5%脱脂奶粉中封闭,37℃下孵育1 h,加入GP130(1∶500)、JAK(1∶600)及JNK(1∶300)及GAPDH抗体(1∶1 000)、过氧化物酶标记二抗(1∶2 000),杂交处理4 h后,经化学发光后观察蛋白条带,利用Image J软件进行灰度分析,计算蛋白表达量。
1.11 细胞缺氧模型构建及干预方法 将心肌细胞培养基植入低氧环境中,后通入5%N2+5%CO2混合气体4 h,流速为2 L/min,与低糖培养基重复混合后,加入饱和无血清培养基,后将细胞放入37℃无氧环境下继续培养4 h备用。将建立缺氧模型的心肌细胞分别加入miR-21-NC及miR-21-mimics转染,转染方法:将数量为1×104个心肌细胞,在EP管中放入200 μl转染液体和4 μl脂质体,后加入5 μg的 miR-21-NC及miR-21-mimics转染,充分混合后,转染6 h后备用。
1.12 荧光酶素报告 从人类基因组DNA产生全长GP130、JAK2,并通过退火合成的信号寡核苷酸产生突变体GP130′UTR、JAK2′UTR。DNA片段克隆到ph-TK载体,GP130′UTR WT、JAK2′UTR WT为野生型,GP130′UTR MUT、JAK2′UTR MUT为突变型,均转染到细胞内,同时使用pGL-3.0(荧光素酶)作为内参照。使用 Lipofectamine 2000 TM检测转染效率在孢菌素酶活性的基础上正常化。按照说明书,使用双荧光素酶报告系统试剂盒测量miR-21对GP130、JAK2的表达活性的调控能力。

2 结果
2.1 4组大鼠心肌组织中miR-21mRNA表达比较 与sham组相比,MI组大鼠心肌组织中miR-21表达降低(P<0.05),MI组及NC组比较差异无统计学意义(P>0.05),与NC组相比,实验组大鼠心肌组织中miR-21表达升高(P<0.05)。见表2。
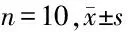
表2 4组大鼠心肌组织中miR-21水平表达比较
2.2 4组大鼠心肌组织梗死面积比较 sham组、MI组、NC组及实验组大鼠心肌梗死面积分别为(2.51±0.33)%、(31.25±4.15)%、(30.66±3.85)%及(14.36±2.06)%,差异有统计学意义(P<0.05),与sham组比较,MI组大鼠心肌梗死面积增加(P<0.05),MI组与NC组心肌梗死面积比较,差异无统计学意义(P>0.05),与NC组比较,实验组大鼠心肌梗死面积降低(P<0.05)。
2.3 4组大鼠非梗死区域的PVCA和CVF比较 与sham组比较,MI组非梗死区域的PVCA和CVF增加,差异有统计学意义(P<0.05),MI组与NC组非梗死区域的PVCA和CVF无差异(P>0.05),与NC组比较,实验组大鼠非梗死区域的PVCA和CVF降低,差异有统计学意义(P<0.05)。见表3。
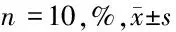
表3 4组大鼠非梗死区域的PVCA和CVF比较
2.4 大鼠心肌组织病理形态比较 Sham组大鼠心肌细胞排列整齐,结构完整,无炎症浸润;MI组及NC组大鼠心肌细胞紊乱及数目减少,排列紊乱出现大量肌肉丝溶解及炎症浸润,与NC组比较,实验组大鼠心肌细胞紊乱有效改善,炎症浸润逐渐降低。见图1。

图1 4组大鼠心肌组织病理形态比较(HE染色×200)
2.5 4组大鼠心肌细胞凋亡率比较 sham组、MI组、NC组及实验组大鼠心肌细胞凋亡率分别为(1.33±0.20)%、(30.10±2.33)%、(29.66±1.70)%及(16.20±1.85)%,组间差异有统计学意义(P<0.05)。进一步两两比较,与sham组比较,MI组、NC组和实验组大鼠心肌细胞凋亡率均增加,差异有统计学意义(P<0.05),MI组与NC组心肌细胞凋亡率差异无统计学意义(P>0.05),与实验组比较,MI组和NC组大鼠心肌细胞凋亡率均较高,差异有统计学意义(P<0.05)。见图2。
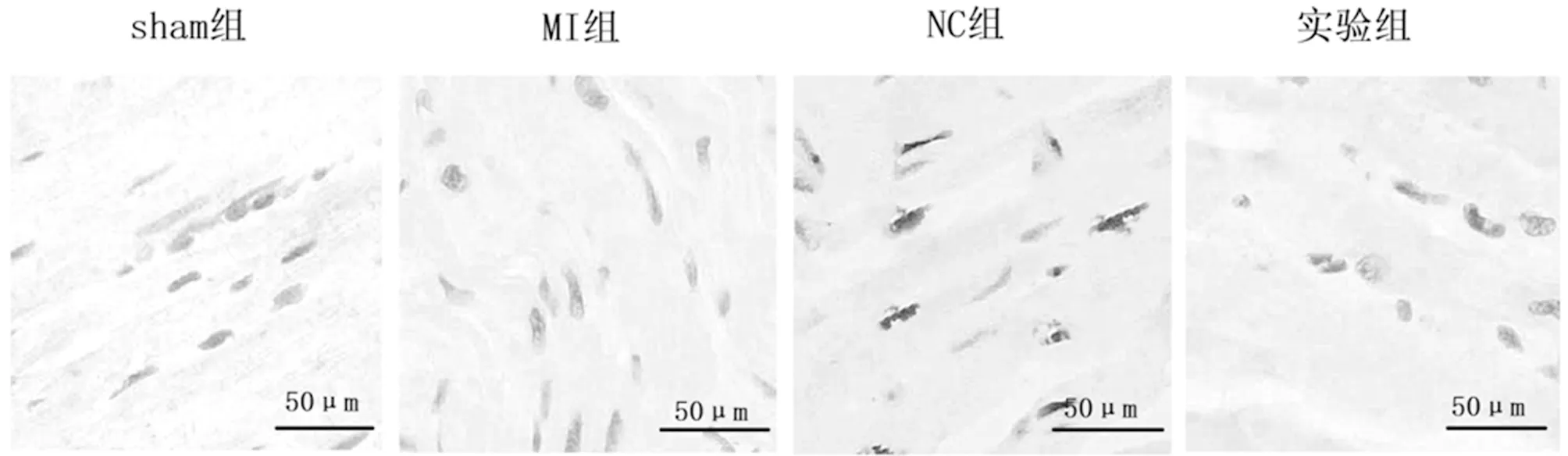
图2 4组大鼠心肌细胞凋亡率比较(TTC 染色×200)
2.6 4组大鼠心肌组织中GP130、JAK2及JNK蛋白比较 与sham组比较,MI组大鼠心肌组织GP130及JNK蛋白升高,JAK2蛋白降低,差异有统计学意义(P<0.05),MI组与NC组心肌组织GP130蛋白、JNK蛋白、JAK2蛋白差异无统计学意义(P>0.05),与NC组比较,实验组大鼠心肌组织GP130及JNK蛋白降低,JAK2蛋白升高,差异有统计学意义(P<0.05)。见表4,图3。
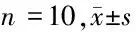
表4 4组大鼠心肌组织中GP130、JAK2及JNK蛋白比较
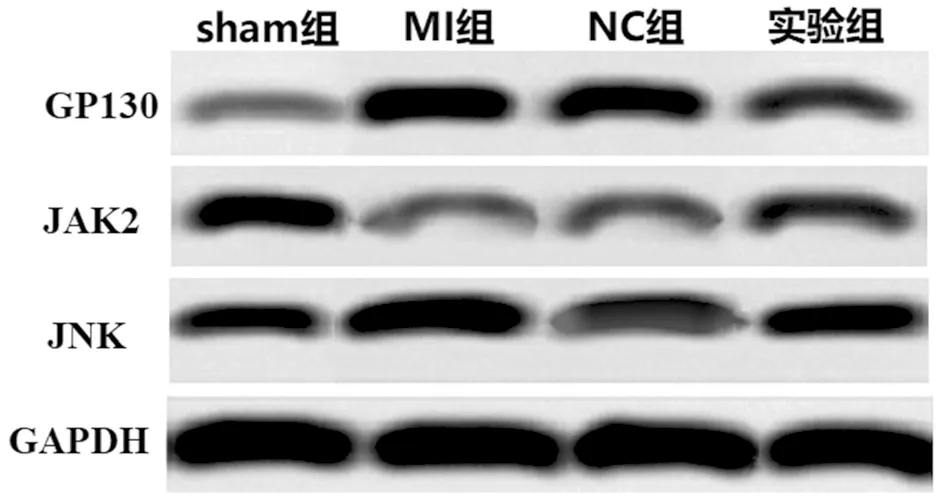
图3 4组大鼠心肌组织中GP130、JAK2及JNK蛋白比较
2.7 RT-PCR检测4组大鼠心肌组织GP130、JAK2及JNK mRNA比较 与sham组比较,MI组大鼠心肌组织GP130及JNK mRNA升高,JAK2 mRNA降低,差异有统计学意义(P<0.05),MI组与NC组心肌组织GP130 mRNA、JNK mRNA,JAK2 mRNA无差异(P>0.05),与NC组比较,实验组GP130 mRNA及JNK mRNA降低,JAK2 mRNA升高(P<0.05)。见表5。
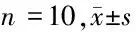
表5 4组大鼠心肌组织GP130、JAK2及JNK mRNA比较
2.8 荧光素酶结果 为了明确miR-21相关基因,使用生物信息学发现miR-21与GP130、JAK2存在相互结合的序列,两者之间存在调控关系。为了验证miR-21与GP130、JAK2的3′UTR结合,将两者均转染到心肌缺氧细胞中,通过上调miR-21观察对GP130、JAK2的荧光活性变化,证实:增加miR-21能够抑制GP130活性,激活JAK2表达,miR-21能与GP130、JAK2的3′UTR特异性结合。见表6。
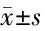
表6 荧光素酶报告
3 讨论
机体受先天及后天因素影响可导致心肌组织损伤,在此过程基因组发生一定程度的改变,基因改变会导致心肌细胞及心肌间质改变导致心室重构。心室重构是心肌梗死患者最常见的并发症,目前笔者发现其发生机制还不明确,且无有效防御方法。
心肌梗死发生过程中伴有神经内分泌系统的过度激活和心肌自分泌、旁分泌活动增多,主要表现内源性血管活性物质的升高,若长期激活可表现为一系列的促生长作用,如心脏体积增大、质量增加、单位面积内心肌细 胞数量减少等,多个因素叠加导致心室重构,加速了病情的恶化[9]。心肌梗死心室重构发生过程中存在多个指标异常表达,PVCA和CVF是检测心室重构的主要指标,心肌梗死过程中会出现胶原占比失调,PVCA和CVF占比升高可增加心肌胶原占比,增加心肌纤维化程度,严重影响心脏舒张及收缩功能[10]。邹军等[11]研究表示,在心肌梗死大鼠非梗死区域存在PVCA和CVF表达升高,治疗后,其表达降低的同时一定程度上可减少心肌细胞凋亡,推测血管肽酶抑制剂omapatrilat可显著改善心室重构与减少心肌细胞凋亡相关。miR-21是具有高度保守性且具有抗凋亡的RNA,与心脏疾病存在一定的关系,主要存在于心肌、内皮细胞中。在缺氧心肌细胞存在miR-21表达降低,并在已经出现心肌梗死大鼠中心肌组织中miR-21表达降低,影响心脏功能及心肌结构的改变[12]。相关研究证实,miR-21可对心肌梗死大鼠心室重构产生影响,可能在于miR-21参与了心肌梗死后心室重塑过程,在心肌梗死后的心室重构中miR-21含量的增加对心室重塑过程中的心肌组织具有一定的保护作用,并可以促进心肌细胞的增殖,抑制心肌细胞的肥大而发挥作用[13]。本文研究表示,MI组大鼠非梗死区域中PVCA和CVF表达升高,实验组中上述指标降低,说明miR-21的激活可以通过降低PVCA和CVF占比而减少心室重构。这与廉银珠等[14]的研究结论相似。
TCC染色是检测心肌梗死大鼠梗死体积的主要方法,心肌梗死大鼠心肌组织会出现砖红色危险梗死区域及灰白色梗死区域,会随着并心肌梗死疾病增加而白色梗死区域增大。心肌梗死缺血再灌注后中性粒细胞及血管内皮细胞表达增加后会释放大量的氧自由基等细胞毒性因子具有损伤血管内皮细胞及抑制血管扩张,加快细胞结构及功能损伤增加血管通透性而增加心肌组织水肿,导致心肌细胞凋亡。心肌细胞凋亡产生与钙离子及线粒体发生异常相关。心肌梗死大鼠心肌组织存在氧化损伤而产生大量超氧负离子而增加细胞色素合成及释放,能够激活caspase等信号通路而增加P53过表达启动细胞凋亡程序。在2006年受限发现相关miRNA与心血管疾病发生发展存在关联。随着研究的深入,目前已有大量文献证实,miR-21可通过靶向某些基因而对心肌梗死及心肌细胞凋亡方面发挥调控作用[15]。对miR-21的深入研究表明,在血管平滑肌细胞中通过抑制miR-21表达加快血管内皮细胞凋亡,机制在于可抑制Bc12和PTEN的表达来调空细胞活性。在体外培养的心肌细胞中,加入miR-21激动剂可发挥心肌细胞保护作用,并通过抑制其靶基因PDCD4,从而使心肌细胞的死亡数目降低[16]。本文研究表明,通过miR-21上调可改善心肌梗死大鼠梗死面积,抑制心肌细胞凋亡而发挥心肌组织保护作用,研究机制可能在于是通过靶向调节GP130、JAK2而发挥作用。
JNK属于应激激活蛋白激酶,心肌梗死时心脏可受到缺血再灌注损伤,JNK可进一步激活提高ROS活性而加快心肌肥厚及心肌细胞凋亡。杨丽等[17]研究表示,在心肌梗死大鼠心肌组织中JNK可以以一种TrxR依赖性方式被激活而增加心室重构,并当采用JNK激酶抑制剂可通过增加Ito电流而发挥心肌保护作用。本文研究表明,miR-21上调可通过抑制其GP130水平,上调JAK2活性而进一步抑制JNK激活而改善心室重构,减少心肌缺血损伤,减少心肌细胞凋亡。杨义等[18]研究表示,在心肌梗死状态下心脏会分泌出心肌营养素-1,可导致GP130受体活化而促进心肌肥厚和心肌纤维化的发生。随着对GP130研究深入,认为心室重构是一种炎性反应,在此过程中白细胞介素-6及受体GP130可发挥信号通路作用,且高水平GP130加快心脏炎性反应及心室重构,抑制其表达可发挥改善作用。
JAK2在调节细胞生物学活性方法具有重要作用的同时与心肌损伤关系十分密切。毛友兵等[19]研究表示,在心肌缺血损伤模型大鼠中JAK2表达降低,当采用丹参酮处理后心肌组织中JAK2表达激活,说明丹参酮可通过激活JAK2表达而改善心肌组织炎症损伤。本文为了验证miR-21与GP130、JAK2的3′UTR结合,我们将两者均转染到心肌缺氧细胞中,通过上调miR-21观察对GP130、JAK2的荧光活性变化,证实增加miR-21能够抑制GP130活性,激活JAK2表达,miR-21能与GP130、JAK2的3′UTR特异性结合,证明miR-21可对发挥调节作用而发挥心室重构保护作用。徐涛等[20]研究表示,荧光素酶报告基因分析证实 miR-21靶向调控Jagged-1的表达,实验组心肌组织Jagged-1 的表达明显下调,说明miR-21可靶向调控 Jagged-1 的表达以抗心肌纤维化。
综上所述,上调miR-21可减少心肌梗死大鼠心室重构,降低心肌梗死面积及心肌细胞凋亡率,并可抑制JNK信号发挥心肌保护作用,这与抑制gp130及激活JAK2表达相关。
