白三叶TrDFR基因克隆及表达分析
2022-02-08张婷婷许本波熊军波陆姣云张鹤山
张婷婷,刘 洋,许本波,田 宏,熊军波,陆姣云,张鹤山
(1. 动物胚胎及分子育种湖北重点实验室/湖北省农业科学院畜牧兽医研究所,武汉 430064;2. 长江大学生命科学学院,湖北 荆州 434000)
【研究意义】白三叶(Trifoliumrepens)含有大量优质蛋白,可以调节地温、防止病虫害、抑制杂草、改良土壤、提高土壤肥力,因而作为牧草被广泛应用于湿润温带气候[1-3]。白三叶除了在牧草上有广泛应用外,因其花色、叶形而具有很高的观赏价值,也作为草坪草或城市绿化植物被广泛利用[4-6]。目前已有多个具有观赏价值性状的白三叶种质,如Dark Dancer、Salsa Dancer、Dark Dancer、Good Luck和Purpurescens,在美国被登记注册为观赏品种[7]。值得注意的是,Dark Dancer和Dark Dancer均具有粉红色花瓣,并且已经作为商品种子在市场销售[8]。花的变化经常引起消费者的注意并且使得植物具有更高的观赏价值[9]。因此,白三叶的花色特征,如红色性状,具有很高的商业价值。花色素苷是黄酮类物质的次生代谢产物,在植物器官中均有分布,决定大部分花色形成的色素群[10],不但影响植物多彩的颜色[11],在植物传粉、抵御逆境胁迫、防止紫外线损伤、抗氧化、抗衰老等方面也有重要作用[12]。花色是白三叶的重要表型性状,常常作为育种工作者的参考指标,但目前对白三叶花色调控研究较少,发掘调控花色的关键基因对白三叶相关性状分子遗传改良具有重要意义。【前人研究进展】二氢黄酮醇4-还原酶(Dihydroflavonol 4-reductase,DFR)是调控花色苷和原花色素的关键酶,可以催化一种或三种二氢黄酮醇(二氢杨梅素、二氢山萘酚和二氢槲皮素)形成相应的无色花青素,进而通过花青素合成酶将无色的花色素苷氧化脱水变成有色的花青素[13]。在龙胆(Gentianalutea)[14]、香玉簪(Hostaventricosa)[15]、日本蛇根草(Ophiorrhizajaponica)[16]、观赏芥蓝(Brassicaoleraceavar. acephala)[17]、金花茶(Camellianitidissima)[18]等植物中,DFR基因已被发现和花的颜色相关。白三叶花瓣通常为白色,但也有粉色或红色花瓣的突变体[19-20]。【本研究切入点】本研究在田间资源圃中发现一株开红花的白三叶突变体,并通过转录组测序发现其DFR同源基因在野生型(白花)和突变体间具有显著差异,白三叶的红色花瓣可能与DFR基因的调控有关。【拟解决的关键问题】本研究以白三叶突变体为材料克隆TrDFR序列,并对其进行生物信息学和表达模式分析,以期为白三叶TrDFR基因功能的进一步研究提供理论依据,为红花白三叶突变体的育种提供支撑。
1 材料与方法
1.1 材料处理
选取野生型和红花突变体白三叶的根、茎、叶、花瓣、花梗和叶柄,在开花期取样并快速置于液氮中,样品于-80 ℃保存待用。提取RNA并反转录得到cDNA。RNA存放-80 ℃冰箱,cDNA存放-20 ℃冰箱,用于荧光定量分析。
1.2 试验方法
1.2.1 白三叶RNA及cDNA的获取 利用RNA提取试剂盒(OMEGA公司)中配套的常规使用方法提取野生型和突变体白三叶的根、茎、叶、花梗和叶柄的RNA;野生型和突变体白三叶的花瓣利用试剂盒中的提取样品方法。RNA提取完成后,测定浓度并利用琼脂糖凝胶电泳(1%)检测其完整性。合格的RNA样品存放于-80 ℃冰箱。用DNase I RNase-free反转录试剂盒(赛默飞公司)及其配套使用方法进行反转录得到野生型和突变体白三叶根、茎、叶、花瓣、花梗和叶柄的cDNA。cDNA样品存放于-20 ℃冰箱。
1.2.2 白三叶DFR基因克隆 利用3个重复的转录组测序结果(原始数据已上传GEO数据库,No:GSE101059)中TrDFR基因的mRNA序列设计克隆引物(TrDFR-F:5′-ATGGGTTCTTTGTCCGAAAC-3′和TrDFR-R:5′-CTTCCCATCCAAGGGTAAA-3′),以开红花的白三叶突变体的花瓣cDNA为模板,进行PCR扩增。PCR扩增程序参照2×FastTaqpremix PCR mix(TOLOBIO公司)的使用说明(94 ℃ 5 min;94 ℃ 30 s,55.7 ℃ 30 s,72 ℃ 30 s,35个循环;72 ℃ 10 min)进行。扩增产物进行电泳检测(1%);参照OMEGA公司普通琼脂糖凝胶DNA纯化回收试剂盒说明书对目的片段进行回收;采用pMD18-T载体连接回收产物;连接成功后转化至DH5α大肠杆菌感受态细胞并培养10~12 h。然后用含100 mg/mL氨苄的LB固体培养基进行检测筛选,挑选单克隆菌斑进行菌液培养,然后经菌液PCR检测选取5个阳性菌落送往奥科鼎盛生物公司(武汉)进行测序。
1.2.3 白三叶DFR基因生物信息学分析 在软件DNAMAN 6.0上对TrDFR基因的开放阅读框进行查找并翻译成氨基酸序列,利用ProtParam(https://web.expasy.org/protparam/)在线工具中对白三叶DFR蛋白质的理化性质进行预测,利用TMHMM 2.0(https://services.healthtech.dtu.dk/service.php?TMHMM-2.0)软件对TrDFR蛋白质的跨膜结构进行预测,利用SignalP 5.0(https://services.healthtech.dtu.dk/service.php?SignalP-5.0)软件对白三叶DFR蛋白质的信号肽进行预测,利用Wolfpsort(https://wolfpsort.hgc.jp/)软件对白三叶DFR蛋白质的亚细胞定位进行预测,利用NetPhos 3.1(https://services.healthtech.dtu.dk/service.php?NetPhos-3.1)软件对白三叶DFR蛋白质的磷酸化位点进行预测,利用SOPMA (https://npsa-prabi.ibcp.fr/cgi-bin/secpred_sopma.pl)软件对DFR蛋白质的二级结构进行预测,利用SWISS-MODEL (https://swissmodel.expasy.org/)软件对DFR蛋白质的三级结构进行预测,利用PlantCare(https://bioinformatics.psb.ugent.be/webtools/plantcare/html/)软件对白三叶DFR蛋白质的启动子顺式作用元件进行预测。在NCBI(https://www.ncbi.nlm.nih.gov/)上进行同源序列的查找,MEGA X软件上进行氨基酸同源序列的比对并构建白三叶DFR氨基酸的系统发育树。
1.2.4 白三叶TrDFR基因的表达模式 在Primer 5上依据引物设计原则设计TrDFR荧光定量引物(TrDFR-F:5′-TTTTGCCGAAGAGTAAAGATG-3′,TrDFR-R:5′-CAAGAGGTGGAATGATTGTGAT-3′)。内参β-actin的引物为β-actin-F(AATGAATTGCGTGTTGCTCCTGAGG)和β-actin-R(ACCAGTTGTACGACCACTTGCATAG)。以野生型‘鄂牧2号’白三叶为对照,以野生型和突变体材料的根、茎、叶、花瓣、花梗和叶柄的cDNA为模板,进行实时荧光定量。荧光定量的程序参照iTaq Universal SYBR Green Supermix荧光定量Mix(Bio-rad公司)使用说明(95 ℃ 300 s;95 ℃ 15 s,58 ℃ 15 s,72 ℃ 20 s,40个循环;95 ℃ 10 s,65 ℃ 60 s,97 ℃ 1 s;37 ℃ 30 s)进行。用96孔上样板,目的基因与内参基因对应,操作时避免强光照射。设3次重复。采用2-ΔΔCt方法计算相对表达量。
2 结果与分析
2.1 白三叶总RNA提取
如图1所示,野生型和突变体白三叶根、茎、叶、花瓣、花梗和叶柄的总RNA条带清晰;紫外分光光度检测OD260/OD280值均大于2.0,说明所提取的RNA纯度较高,可用于反转录获得野生型和突变体白三叶根、茎、叶、花瓣、花梗和叶柄的cDNA。
2.2 白三叶突变体DFR基因克隆
克隆得到1条略大于1000 bp的片段(图2),对挑选的阳性克隆进行测序得到碱基序列,测序结果与目的序列相似度为99.70%,说明TrDFR基因已被成功克隆。
利用NCBI数据库的BLAST将白三叶FDR基因cDNA核苷酸序列与其他物种进行比对发现,白三叶与红三叶(Trifoliumpratense,XM_04593587.1)、蒺藜苜蓿(Medicagotruncatula,XM_013610680.3)、鹰嘴豆(Cicerarietinum,XM_004499122.3)等物种高度同源,其中与红三叶的覆盖度为97.0%,一致性达到95.0%以上,说明所克隆的白三叶DFR基因序列具有高度完整性。
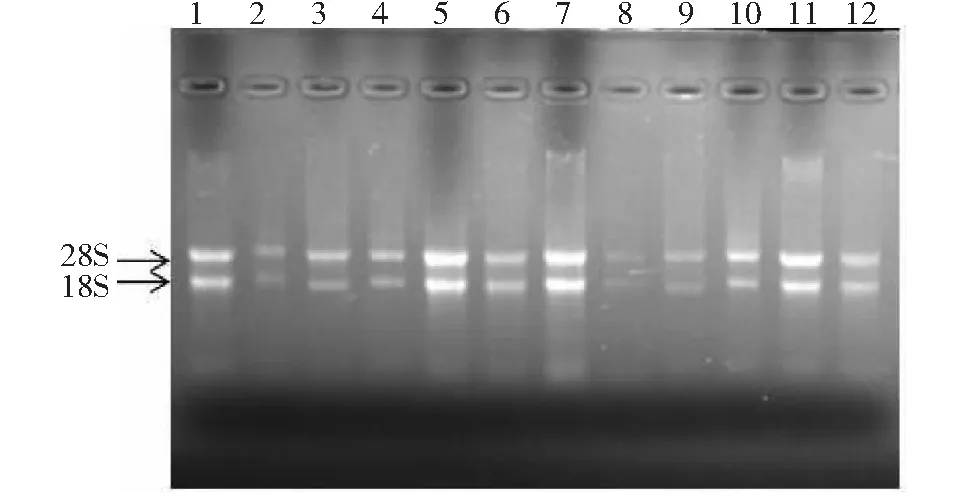
1~6:野生型白三叶的根、茎、叶、花瓣、叶柄和花梗的RNA;7~12:突变体白三叶的根、茎、叶、花瓣、叶柄和花梗的RNA1-6:RNA of the roots, stems, leaves, petal, petioles and pedicles of the wild-type white clover;7-12:RNA of the roots, stems, leaves, petal, petioles and pedicles of the mutant white clover图1 野生型和突变体不同部位的RNA提取电泳图Fig.1 RNA extraction from different sites of the wild-type and mutants
2.3 核苷酸序列生物信息学分析
2.3.1 白三叶DFR蛋白的理化性质及结构TrDFR基因长1131 bp,开放阅读框有969 bp,合成322个氨基酸,以ATG为启动子, TAA为终止子。由这些氨基酸为一级结构组成的蛋白质的分子量为36.59 kD,有5152个原子,分子式为C1643H2585N429O475S20,为亲水的带负电荷蛋白,理论等电点为6.52。Lys 氨基酸含量最多,有30个,质量占总数的9.3%,其次是Leu,有27个,质量百分比为8.4%,Trp 含量最少,只有4个,质量百分比为1.2%(表1)。白三叶DFR蛋白可能在细胞质中发挥功能,且不分泌到细胞外作用,结构不稳定,行使功能的过程中有可能发生结构改变。
白三叶DFR蛋白质的二级结构中,最多的是无规则卷曲,有136处,占42.1%;其次是α-螺旋,有116处,占35.9%;延伸链有49处,占15.2%;β-折叠有22个氨基酸,占6.81%(图3)。以2c29.1.A为模板,利用同源建模法构建白三叶DFR蛋白质的三级结构(图4),三级结构中无规则卷曲和α-螺旋含量最多,与二级结构预测结果一致。
2.3.2TrDFR基因启动子顺式作用元件分析TrDFR基因序列中共找出38个顺式作用元件,其中
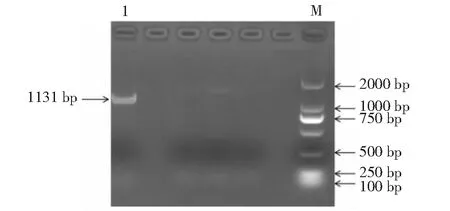
M. DL 2000 Marker;1.目的片段M. DL 2000 Marker;1. Target product图2 TrDFR克隆产物Fig.2 Clone product of TrDFR
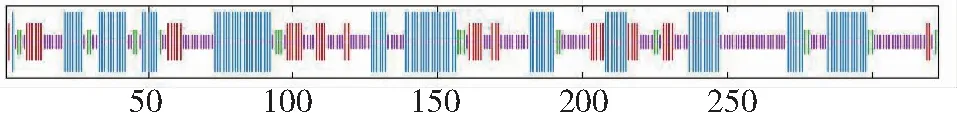
紫色表示无规则卷曲;蓝色表示α-螺旋;红色表示延伸链;绿色表示β-折叠Purple indicates random coil; Blue indicates alpha helix; Red indicates the extended strand; Green represents beta turn图3 DFR蛋白质二级结构预测Fig.3 Secondary structure prediction of DFR protein
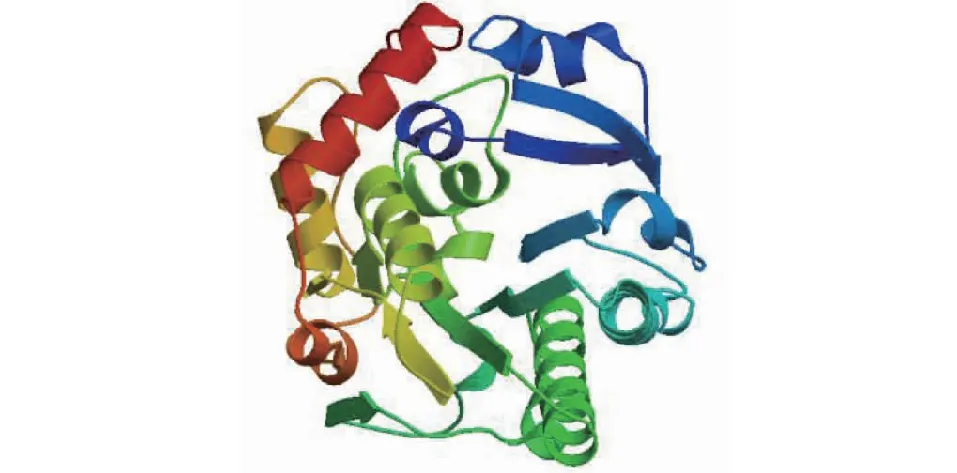
蓝色表示α-螺旋;黄色表示无规则卷曲;红色表示延伸链;绿色表示β-折叠Blue indicates alpha helix; Yellow indicates random coil; Red indicates the extended strand; Green represents beta turn图4 DFR蛋白质三级结构预测Fig.4 Tertiary structure prediction of DFR protein
11处顺式作用元件在白三叶和其他物种中均没有相关研究,有27处顺式作用元件在其他物种中有发现或相关的功能分析。分析结果(图5)表明,TrDFR基因启动子序列包含多种与光响应和抗逆性相关的顺式作用元件,如典型的真核生物启动子基本元件TATA-box和CAAT-box;光响应元件AE-box、Box 4、G-box、GARE-motif、LAMP-element;醇溶蛋白代谢调节元件O2-site;缺氧特异性诱导的增强子作用元件GC-moyif;胁迫响应元件MYB、W box、MYB-like sequence;茉莉酸甲酯响应元件CGTCA-motif和TGACG-motif;低温响应元件MYC;脱落酸响应元件ABRE;植物防御响应元件as-1。
2.3.3 TrDFR氨基酸同源性及进化分析 在NCBI上对白三叶DFR氨基酸的同源序列进行搜索,发现白三叶DFR氨基酸序列与红三叶(XP_045791829.1)相似度最高,为93.64%,与蒺藜苜蓿(XP_013466134.1)的相似度为88.35%,与野大豆(Glycinesoja,XP_028199701.1)、鹰嘴豆(XP_004499179.2)、百脉根(Lotusjaponicus,AFK35141.1)、丝茎黄耆(Lotusfilicaulis,ATI97621.1)、密花豆(Spatholobussuberectus,TKY57696.1)、大豆(Glycinemax,NP_001238612.2)、黑种豇豆(Vignaradiatavar. Radiata,XP_014503836.1)和赤小豆(Vignaumbellata,XP_047160387.1)的相似度分别为86.36%、85.90%、85.90%、85.58%、83.33%、83.13%、81.42%和80.12%,多序列比对后,采用邻接法构建白三叶与近源物种氨基酸序列的系统发育进化树(图6),结果表明,11个物种的系统发育树聚合为2大支,其中白三叶、红三叶、蒺藜苜蓿和鹰嘴豆在一个大支;剩下七个物种所在的一个大支又分为2个小支。白三叶和红三叶的遗传距离最近,因此他们之间的相似度更高,其次是蒺藜苜蓿,和NCBI中的序列相似度基本一致,说明结果准确可靠。进化树逐级分支,具有较多层级,说明DFR蛋白的进化具有保守性和物种特异性。
2.4 TrDFR基因表达分析
如图7所示,TrDFR基因在不同基因型白三叶中表达水平差异明显,在野生型的叶柄和花梗中大量表达,而根、茎、叶和花瓣中表达量很低;在突变体花瓣、茎、花梗和叶柄中有大量表达,根和叶中几乎不表达。方差分析表明,TrDFR在红花突变体茎和花瓣中表达量显著高于野生型(P<0.01),但在花梗中的表达量显著低于野生型(P<0.01)。前期研究表明,红花白三叶花瓣和茎中的矢车菊素含量比野生型花瓣中高[20],而矢车菊素是形成红色的主要色素。所以TrDFR基因可能参与白三叶花瓣花色素苷的生物合成,但相关的机制仍需进一步研究。
3 讨 论
DFR基因在不同物种中的开放阅读框长度、氨基酸个数、蛋白质的相对分子质量都相差不大,说明DFR基因在进化上具有保守性,比如在明日叶(Angelicakeiskei)中,AkDFR序列含有1131 bp的开放阅读框,编码合成376个氨基酸,蛋白大小为42.42 kD[21];刺葡萄(Vitisdavidii)中VdDFR开放阅读框长1014 bp,编码合成337个氨基酸,分子量为37.59 kD[22];本研究结果表明,白三叶TrDFR基因开放阅读框长969 bp,编码合成322个氨基酸,分子量为36.59 kD。DFR基因在明日叶[21]、荞麦(FagopyrumesculentumMoench)[23]和白三叶中均是稳定的非分泌蛋白,说明DFR蛋白在发挥功能时其构象不会发生改变,而且不分泌到细胞外发挥作用。DFR蛋白的进化关系和物种种类有关,说明DFR蛋白的进化具有物种特异性和保守性。

图5 顺式作用元件分布位点Fig.5 Cis-acting element distribution site

图6 TrDFR系统进化树Fig.6 Phylogenetic tree of TrDFR
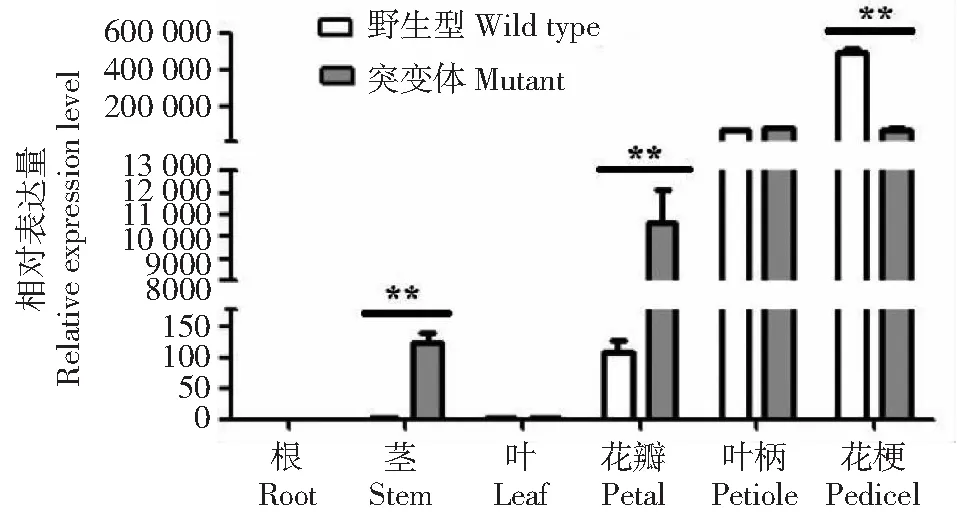
**表示1%水平差异显著** indicates significant different at 0.01 level图7 TrDFR基因在野生型和突变体白三叶不同部位的表达Fig.7 Expression of TrDFR gene in different parts of wild-type and mutant white clover
调控DFR基因的MYB转录因子与花青素的合成有关。在淫羊藿(Epimediumsagittatum)[24]、梨(PyrusComms)[25]、李(Prunussalicina)[26]和葡萄(Vitisvinifera)[27]等物种中,MYB通过激活DFR基因的启动子来诱导植物中花青素积累。白三叶中也检测到了MYB启动子顺式作用元件,故而预测TrMYB对TrDFR基因有调控作用。
DFR基因在不同物种中的表达水平有组织特异性。在红花(Carthamustinctorius)的花瓣中表达量最高,其次是叶和苞片,在根和茎中检测不到该基因的表达[28];在葡萄风信子(Muscariarmeniacum)花瓣组织中表达较高,根、茎和叶中微量表达[29]。本研究结果表明,TrDFR基因在开白花的野生型白三叶叶柄、花梗中大量表达,而在根、茎、叶和花瓣中低表达甚至不表达;但在开红花的突变体白三叶中的茎和花瓣中高表达,显示出显著的组织表达特异性。同时,TrDFR在不同基因型白三叶同一组织部位的表达也有差异,本研究中红花白三叶突变体的花瓣和茎中,其表达水平显著高于野生型白三叶(P<0.01);这一现象在其他物种中也有发现,如紫叶羽衣甘蓝叶片中BoDFR基因的表达量最高,而白叶羽衣甘蓝心叶中仅微量表达[28],这可能与不同基因型材料的花色素含量有关,白三叶红花突变体花瓣比野生型白色花瓣具有更高的矢车菊素含量[18],而紫叶羽衣甘蓝叶片中花青素含量最高[30]。因此,TrDFR基因可能参与白三叶花瓣色素的合成,这与在葡萄风信子[31]、康乃馨(Dianthuscaryophyllus)[32]和牵牛花(Toreniahybrida)[33]中的研究结果一致。
4 结 论
白色叶TrDFR蛋白分子量为36.59 kD,属于不稳定的亲水非分泌蛋白;其氨基酸序列和红三叶的进化关系最近。TrDFR基因在白三叶花、叶柄和花梗中大量表达,且红花突变体茎和花中的表达量显著高于野生型(P<0.01)。TrDFR基因可能与白三叶花瓣中花色素苷的合成有重要关系。
