贝莱斯芽孢杆菌对柑橘病原菌皮落青霉的生防初探
2022-02-08张廷富杨昌鑫文国琴
宋 波,张廷富,杨昌鑫,文国琴
(西华师范大学生命科学学院,四川 南充 637000)
【研究意义】柑橘是全世界种植面积最广的水果,也是我国重要的农业经济产业[1-2]。柑橘味道鲜美、营养丰富,含有丰富的黄酮类化合物,在医药、食品、保健等领域具有较好的利用前景[3-5]。柑橘在生产、储运和加工过程中往往会受到多种因素影响,导致柑橘发病腐烂。我国柑橘的病害有100种左右,其中采后病害有20多种。因此,加强对柑橘采后病害的防治研究,对降低柑橘病害和促进农业经济产业具有重要意义。【前人研究进展】根据发病特征可将柑橘病害分为侵染性病害和生理性病害[6]。侵染性病害由病原微生物侵染引起。青霉菌是最主要的柑橘真菌病原,真菌引起的柑橘采后侵染病害中,由指状青霉(Penicillumdigitatum)和意大利青霉(P.italicum)等引起的绿霉病、青霉病最严重,酸腐、蒂腐病、炭疽病、黑腐病、黑斑病、褐腐病等病害次之[7]。柑橘生理病害主要有褐斑病、枯水病、水肿病、油斑病等[8]。这些病害严重危害了柑橘采后保鲜,对柑橘产业造成巨大损失。目前,普遍认为引起柑橘采后病变腐烂的青霉菌主要是意大利青霉(P.italicum)和指状青霉(P.digitatum),但也有研究显示扩展青霉(P.expansum)、波兰青霉(P.polonicum)、产黄青霉(P.chrysogenus)等也是引起柑橘采后病害的病原青霉[9]。有效的防控方法非常重要,物理防控和化学防控是目前使用的最广泛的病害防控手段。物理防控对柑橘病害有较好的防控效果,但也有成本高、耗能大的缺陷。化学防控是利用化学药物抑制病原菌生长而达到病害防控的目的,比如咪鲜胺、抑霉唑、双弧盐、笨菌灵等。研究表明,咪酰胺和抑霉唑对柑橘青霉病、绿霉病、蒂腐病等采后病害具有较好的防控效果[10-11],但是大量使用化学药物会导致病原菌出现耐药性,从而影响防治效果。近年来,生物防控越来越多被利用于动植物病害防治,比如利用拮抗微生物、抗菌素类物质或者茶多酚、橘皮提取物、植酸等天然生物保鲜剂对病害进行防控。相较于物理和化学防控,生物防控具有绿色环保、经济等优势。芽孢杆菌属由于具有较好的抑制植物病原菌的能力被广泛用作农业领域的生物控制剂[12]。其中贝莱斯芽孢杆菌(Bacillusvelezensis)是一种新兴的拮抗微生物,可产生多种次级代谢产物,如脂肽类抗生素、聚酮类化合物和抗菌蛋白等,具有广谱的抑菌作用,被广泛应用于动植物病害的生物防控[13]。如B.velezensis被制成杀菌剂,不仅有效防治真菌性病害还可以用于刺激植物生长,从莴苣变种皱叶根分离出的B.velezensis制成悬浮剂直接应用于莴苣幼苗,可以控制根腐病。从番茄组织中分离出来的菌株B.velezensisC2作为番茄黄萎病的生物制剂和生物防治剂具有较大的商业化潜力,可有效防治番茄黄萎病。C2的GC-MS分析显示其具有抗真菌活性的挥发性代谢物[14]。因此,B.velezensis在植物病害生物防治上作为新的微生物资源具较大研究前景。【本研究切入点】从采后霉烂的柚子表皮样品上分离得到1株青霉,通过形态学鉴定和分子鉴定相结合的方法将其鉴定为皮落青霉(P.crustosum),并利用贝莱斯芽孢杆菌发酵液对其进行抑菌试验,检测其对皮落青霉的抑制效果。【拟解决的关键问题】当前国内的微生物制剂较少,且多数制剂的活性较低,本研究为柑橘采后真菌病害的绿色防控提供理论与技术依据。
1 材料与方法
1.1 供试菌源
采后明显病变霉烂的沃柑采集于四川省德阳市中江县,在实验室进行分离纯化致病后,将其编号为DYC1-1。生防菌株贝莱斯芽孢杆菌SB023由六盘水师范学院张晓勇老师提供。
1.2 试验方法
1.2.1 病原菌株的分离纯化与鉴定 病原菌的分离。病原菌分离纯化的方法参照方达中[15]的植病研究方法,从病变霉烂的柚子表面上挑取孢子,在PDA培养基上连续“Z”形划线,28 ℃恒温培养;菌落长出后,从单个分散的菌落上挑取孢子,再在PDA培养基上连续划线进行纯化,重复操作3次,直到分离纯化出菌落形态特征一致的菌株。
形态鉴定。利用接种环将纯化后的病原菌接种到PDA平板中央,28 ℃恒温培养,观察并记录菌落的形态特征及动态变化。待菌落长出后,利用显微镜观察菌丝和孢子的形态。在载玻片中央滴一滴棉蓝染色液,用接种针在菌落边缘挑取少量带孢子的菌丝,将其分散在染液中,盖上盖玻片,用滤纸吸去多余染液,将载玻片放于显微镜下观察。根据病原菌菌丝和孢子的特征并参考孔华忠[16]的方法,对病原菌进行初步的形态学鉴定。
分子鉴定。参照Bios pin真菌基因组DNA提取试剂盒提取病原菌株DYC1-1的基因组DNA,并以此DNA为模板,以通用引物ITS1和ITS4为引物,扩增核糖体转录间隔区ITS和细胞色素氧化酶1(CO1)基因片段,扩增产物测序后通过数据库比对和系统发育树的构建进行分子鉴定。PCR检测病原菌株反应条件:94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,30个循环;72 ℃延伸10 min,16 ℃保存。PCR扩增完成后,取5 μL 扩增产物点样用1%琼脂凝胶电泳检测,通过凝胶成像系统进行观察并拍照,然后将PCR扩增产物送昆泰锐(武汉)生物技术有限公司进行测序。
BLAST序列比对和系统发育进化树构建。将测序序列在NCBI数据库中进行比对和同源性分析,同源性95%~99%鉴定为同一属,99%以上可鉴定为同种,从而确定菌株种类[14]。分别选取与病原菌ITS和CO1序列同源性较高的菌株序列,将序列导入MEGA-X软件进行clustalw多序列比对并对序列两端剪齐,利用邻接法(Neighbor-Joining)重复1000次构建系统发育进化树。
1.2.2 病原菌致病性实验 将纯培养的病原菌菌株接种至PDA培养基上,28 ℃恒温培养。待菌落长出后,用接种环刮取分生孢子放入装有无菌水的EP管中充分洗脱,重复多次操作,然后用塞有棉花的注射器过滤,制备孢子悬液。取健康、无损伤的柚子和沃柑用无菌水清洗,表皮经75%酒精擦洗后,用移液枪枪头轻刺果实表皮并旋转,以刺破表皮为宜,然后在刺破伤口接种20 μL孢子悬液,以接种等体积无菌水作为对照。将接种后的柑橘果实装入保鲜袋内并封口,置于28 ℃恒温培养箱中贮藏,观察并记录发病症状的动态变化[15],并利用十字交叉法测量病变部位的病斑大小。
1.2.3 贝莱斯芽孢杆菌发酵液的抑菌试验 贝莱斯芽孢杆菌SB023经PDB发酵5 d后,离心收集上清液并用0.22 μm滤器过滤制备发酵液,按照发酵液终浓度分别为0、1%、2%、3%、10%的比例添加到PDA培养基中倒浓度梯度平板。取DYC1-1孢子悬液(1×107个/mL)50 μL均匀涂布在较薄的PDA培养基平板表面,28 ℃恒温培养12 h后获得种子平板;用打孔器从PDA平板上打取菌饼,用无菌牙签挑取菌饼接种在不同浓度发酵液的PDA培养基平板中央,以0的平板为对照组,各浓度设置3个重复。28 ℃恒温培养7 d后使用十字交叉法测量各个平板上菌落的直径并计算抑菌率。
抑菌率(%)=(对照组菌落直径-实验组菌落直径)/(对照组菌落直径-接种菌饼直径)[17]。
1.3 数据处理
利用Excel 2016、SPSS 24等软件进行数据处理分析。
2 结果与分析
2.1 病原菌鉴定
2.1.1 形态学特征 病原菌DYC1-1在PDA上28 ℃生长7 d的菌落直径约为35 mm。菌落上有放射状轮纹,质地绒状兼有粉末状,分生孢子生长较快,能形成明显的青绿色霉层;菌落的边缘初始为白色,培养一段时间后变为褐色,培养基背面为淡黄色(图1-A,1-B)。通过镜检观察,菌株菌丝粗壮,有隔膜和分枝,分生孢子梗先端有1~2个分枝,分生孢子呈现球形或近球形,分生孢子链较稀疏,近圆柱状(图 1-C,1-D)。参照真菌鉴定手册和中国真菌志的青霉属及其相关有性型属文献资料描述[18-19],将 DYC1-1初步鉴定为半知菌亚门青霉属皮落青霉或扩展青霉。

A.菌落正面; B.菌落背面; C.菌丝(40×); D.孢子梗(40×)A.Positive side of colony; B.Colony back; C.Mycelium (40 ×); D.Spore peduncle (40 ×)图1 病原菌株DYC1-1在PDA培养基上的菌落形态Fig.1 Colony morphology of DYC1-1 strains on PDA medium
2.1.2 分子生物学 DYC1-1菌株分生孢子接种在PDB中培养3 d后收集菌丝体,改良CTAB法提取基因组DNA并进行PCR扩增。从图2-A可知,PCR扩增条带明显,基因组DNA提取成功。以基因组DNA为模板,通用引物 ITS1和ITS4 PCR扩增引物(ITS1:5′-TCCGTAGGAACCTGCGG,ITS4:5′-TCCTCCGCTATTGATATGC,PenF1:5′-GACAAGAAGGTGAT TTTTATCTTC,AspR1:5′-TCCTCCGCTATTGATATGC)扩增出约550 bp的ITS片段(图2-B);以及青霉/曲霉鉴定引物PenF1和AspR1从DYC1-1基因组中扩增出约550 bp的CO1片段(图2-C)。
将DYC1-1菌株ITS和CO1基因扩增产物测序分别获得522和523 bp的DNA序列,BLAST比对显示,DYC1-1的rDNA-ITS和CO1序列与GenBank数据库中皮落青霉(Penicilliumcrustosem)的序列一致性均为100%。利用MEGA 6将其与一致性最高的同源序列进行clustalw比对,基于ITS和CO1序列使用N-J法构建系统发育树(图3),DYC1-1与已鉴定的P.crustosum(MZ447552.1、EF180217.1)聚在同一进化枝,可信度为95%,将DYC1-1菌株鉴定为皮落青霉(P.crustosum)。

A.基因组DNA, M: 1 kb Ladder, 2: DYC1-1; B. ITS扩增产物, M.1 kb Ladder, 2.DYC1-1; C. CO1扩增产物, M.DS5000, 1.DYC1-1A. Genomic DNA, M: 1 kb Ladder, 2: DYC1-1;B. ITS amplification product, M.1 kb Ladder, 2.DYC1-1;C. CO1 amplification product, M.DS5000, 1.DYC1-1 图2 DYC1-1基因组及PCR扩增产物电泳检测Fig.2 The electrophoresis detection of DYC1-1 strains genomic DNA and PCR amplification product

图3 菌株DYC1-1基于rDNA-ITS序列的系统进化发育树Fig.3 Phylogenetic tree constructed by strain DYC1-1 based on rDNA-ITS
2.2 致病性实验
将DYC1-1孢子悬液分别接种到柚子和沃柑表皮上,柚子和沃柑均发生病变,但是病原菌对沃柑的毒力强于柚子。接种2 dpi时,2种果实的接种处均出现了褐色斑渍,之后沃柑上的褐色斑渍迅速扩大,并长出蓝绿色霉层(图4-A),10 dpi病斑直径为40.5 mm;接种无菌水的对照组均未发生明显腐烂和扩散,接种DYC1-1与用无菌水间的病斑直径差异极显著(P<0.01,图4-B)。而DYC1-1接种在柚子表皮上的病变缓慢,10 dpi时病斑未形成明显霉层,只在柚子皮层中有褐色侵染斑痕,但没有大面积的腐烂(图4-C,4-D)。所以,DYC1-1对不同种类柑橘的致病性有一定差异。同时,从DYC1-1回接发病的果实上可以分离出与接种菌株形态相同的菌株,根据科赫假设验证说明所分离纯化的DYC1-1是引起柑橘采后霉腐的病原菌。
2.3 贝莱斯芽孢杆菌发酵液对病原菌的影响
贝莱斯芽孢杆菌发酵液对菌株DYC1-1的生长具有一定抑制作用,发酵液浓度为1%、2%和3%的抑菌率分别为8.41%、8.73%和13.7%,发酵液浓度为10%的抑制率可达到37.8%,抑制率随发酵液浓度的升高而升高(图5-A,5-B);而回归分析估计贝莱斯芽孢杆菌SB023发酵液的半有效最大浓度EC50为8.2%。显微镜观察显示,与正常对照组菌丝相比,SB023发酵液添加组的DYC1-1菌丝有明显的膨大形变和扭曲(图5-C),说明贝莱斯芽孢杆菌发酵液中存在诱导真菌菌丝畸变的活性物质。
3 讨 论
引起柑橘采后病害的病原青霉种类较多,主要有Penicilliumitalicum、P.digitatum、P.expansum、P.polonicum、P.chrysogenus等病原菌。准确的病原菌分类鉴定是研究各类病害的基础,然而青霉菌属的病原真菌在菌落形态特征上相似度较高,仅凭肉眼难以区分。此外,根据菌落形态,以分生孢子和孢子梗的特点进行鉴定的传统形态鉴定法,存在难以准确到种、不可靠以及耗时长等问题。基于ITS基因的分子鉴定法被广泛运用于病原菌的鉴定,该方法具有鉴定快速、准确度高的优点。然而,有些青霉仅通过ITS序列无法将其鉴定到种,Seifert等[20]对青霉属真菌的研究表明,CO1基因的种内平均变异率小于 ITS基因的变异率,仅为0.06%,种间平均变异率为5.6%,CO1基因对青霉属真菌的分辨率优于ITS。本研究分离的DYC1-1通过ITS序列比对和系统发育树构建不能鉴定到具体的种,而通过形态鉴定与CO1分子鉴定相结合的方法将1株柑橘采后病原菌成功鉴定为皮落青霉(P.crustosum),这为柑橘采后病原菌的准确鉴定及其多样性研究提供一定参考。

A.DYC1-1在沃柑上的致病症状; B.DYC1-1接种沃柑与无菌水对照间的病斑直径比较; C. DYC1-1在柚子上的致病症状;D. 柚子表皮内侧的发病症状。A、C、D上面是无菌水做对照,下面是接种DYC1-1 A. Pathogenic symptoms of DYC1-1 on citrus;B.Comparison of spot diameter between DYC1-1 inoculated fertile citrus and sterile water control; C.Pathogenic symptoms of DYC1-1 on grapefruit. D. Symptoms of the medial epidermis of grapefruit.A, C, D showed sterile water as control on the top, and DYC1-1 inoculation on the bottom图4 病原菌DYC1-1的致病性实验Fig.4 Pathogenicity experiment of DYC1-1
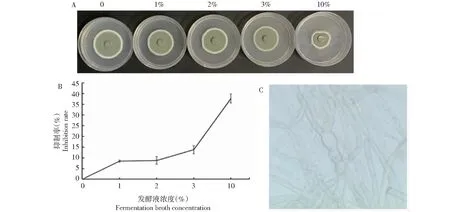
A.不同浓度的发酵液对菌株生长的影响; B. 不同浓度发酵液对DYC1-1的抑制率; C. 发酵液膨诱导DYC1-1菌丝的膨大与畸形化(40×)A. The effect of different concentrations of fermentation broth on the growth of strain; B. The inhibition rate of different concentrations of fermentation broth on DYC1-1; C. Expansion and deformity of DYC1-1 hyphae induced by fermentation broth expansion (40 ×)图5 贝莱斯芽孢杆菌发酵液对病原菌的影响Fig.5 Effects of fermentation broth of B.velezensis on pathogenic bacteria
本研究从腐烂柚子上分离的DYC1-1能够引起沃柑腐烂,而对柚子的致病性较弱,在不同种类的果实间致病性存在较大差异。在相同实验条件下, DYC1-1对沃柑的毒力远高于柚子,这可能是因为不同果实在结构和生理上存在差异。柚子常温下可贮藏 2~4个月,有 “天然水果罐头”之称。在结构方面,柚子果皮厚,外果皮油胞大,含有的芳香油具有抗真菌入侵能力,中果皮有较厚的海绵层(白皮层),内果皮的囊瓣壁厚且硬,保护着汁胞[21]。实验中的柚子不易被侵染,而分离病原菌的柚子样品却腐烂严重,可能是因为实验中的柚子属于不易感病型品种,它对病原菌具有更强的抗性,而分离菌株的样品中江柚可能属于易感病品种。此外,柑橘的病变腐烂往往是由多种致病菌共同作用引起,除果实的种类和品种外,影响柑橘果实霉烂的因素还包括果实的成熟度、果实的伤害、果实的储存条件等[22]。因此,后期还需进一步研究更多的柑橘种类并进行同种类柑橘的横向比较。
枯草芽孢杆菌(Bacillussubtilits)是较早应用于生物防治的拮抗微生物。Jiang等[23]研究表明,枯草芽孢杆菌可以通过产生iturin A等物质干扰真菌的运输、能量代谢和渗透压,从而抑制病原真菌生长。贝莱斯芽孢杆菌是一种新型的拮抗微生物,其抑菌机制是通过产生多种抗菌物质而具有广谱抑菌作用。Chowdhury等[24]研究表明,贝莱斯芽孢杆菌产生的杆菌毒素等抗菌物质会使真菌的菌丝体、细胞质膜的形态发生改变,从而抑制真菌生长。此外,贝莱斯芽孢杆菌产生的伊枯草菌素等抗菌物质会使细胞膜发生穿孔,导致内容物流失[25]。目前皮落青霉是柑橘采后青霉病害的病原之一,但是关于皮落青霉对不同种类柑橘果实的致病性研究鲜有报道,关于贝莱斯芽孢杆菌在柑橘采后病害防控方面的研究和应用较少。本研究显示,贝莱斯芽孢杆菌发酵液能引起DYC1-1菌丝发生膨大形变,说明贝莱斯芽孢杆菌能产生改变青霉细胞质膜形态的抑菌活性物质,10%的发酵液抑制率可达到37.8%,贝莱斯芽孢杆菌发酵液对皮落青霉具有一定的防效,利用贝莱斯芽孢杆菌等拮抗微生物来防治柑橘采后病害,在柑橘产业的绿色化发展上具有巨大的潜力。
4 结 论
通过病原菌形态特征观察、扩增ITS和CO1基因片段进行分子鉴定,将从发病腐烂的柚子表皮上分离到的青霉DYC1-1鉴定为皮落青霉(Penicillium.crustosum)。通过回接验证皮落青霉DYC1-1能够不同程度地引起不同柑橘果实病变腐烂,是柑橘采后青霉病害的病原,但是对不同种类柑橘的致病能力存在差异,对沃柑的侵染能力较强,而对柚子虽有侵染性,但不造成大面积腐烂。贝莱芽孢杆菌发酵液对皮落青霉的生长具有一定的抑制效果,其半有效最大浓度约为8.7%,贝莱芽孢杆菌在柑橘病害绿色防控上有巨大的应用潜力。
