花生芽白藜芦醇大孔树脂纯化工艺及抑菌功效
2022-02-07宁灿灿李军伟任红涛余秋颖
王 娜,宁灿灿,赵 峥,李军伟,王 凡,任红涛,詹 轲,余秋颖,4
花生芽白藜芦醇大孔树脂纯化工艺及抑菌功效
王 娜1,2,3,4,宁灿灿1,3,赵 峥1,3,李军伟1,3,王 凡1,3,任红涛1,3,詹 轲1,3,余秋颖1,3,4※
(1. 河南农业大学食品科学技术学院,郑州 450002;2. 河南农业大学动物医学院,郑州 450002;3. 郑州市营养与健康食品重点实验室,郑州 450002;4. 河南农业大学动物免疫学国际联合研究中心,郑州 450002)
为分离纯化花生芽中具有潜在抑菌活性的白藜芦醇化合物及研究其抑菌功效,提高花生的综合利用价值。该研究通过静态吸附-解吸试验,从16种不同型号大孔树脂中确定白藜芦醇较佳纯化树脂,并对其动态吸附-解吸条件优化,采用倍比稀释法、抑菌生长曲线及细胞膜通透性变化评价纯化物对鼠伤寒沙门氏菌的抑制作用。结果表明:LSA-40大孔树脂为花生芽白藜芦醇较佳纯化树脂,其吸附条件为:上样浓度120.00g/mL,速率1.00 mL/min,pH值4.2,上样量8.00 mL/g;解吸条件为:80%乙醇溶液,pH值6.6,流速1.00 mL/min,白藜芦醇纯度可达84.0%;利用紫外光谱、傅里叶红外光谱、超高效液相色谱串联质谱对纯化后样品进行鉴定分析,发现纯化物中主要成分为白藜芦醇及其衍生物;纯化物对鼠伤寒沙门氏菌抑制作用结果表明其最小抑菌浓度为250g/mL,在此浓度下可显著增加细胞膜通透性(<0.01),破坏细胞壁完整性,造成胞内蛋白质严重泄露,最终导致鼠伤寒沙门氏菌死亡。该研究可为花生资源综合深度利用及天然抑菌剂的开发提供一定理论参考。
吸附;抑菌;花生芽;白藜芦醇;LSA-40大孔树脂;质谱鉴定
0 引 言
花生芽是花生萌发后产生的一种食疗兼备的食品,也叫长寿芽,其具有生产工艺简便、口感独特及营养丰富等特点,因此深受大众青睐[1]。经研究发现,花生在发芽过程中蛋白质降解为肽和氨基酸,其生物利用率显著增加,脂肪含量迅速降低,维生素、钾、镁等矿物质含量全面提高,营养因子得到改善,特别是具有重要生物活性功能的多酚类物质白藜芦醇含量会大幅提升[2]。白藜芦醇化学名为3,4',5-芪三酚,是一种“植物抗毒素”,近年来,国内外很多学者对白藜芦醇的生物学功能进行了研究,结果表明其具有抗炎、抗过敏、抗氧化、调节糖脂代谢、抑制脂肪沉积、预防心血管疾病以及延缓衰老等多种作用[3-8]。
据不完全统计,全世界每年约有9 380万人感染沙门氏菌,其中15.5万人死亡,在中国,70%~80%的食源性细菌暴发都是由沙门氏菌引起的[9]。引起感染症的沙门氏菌血清型主要有鼠伤寒沙门氏菌(,.)、肠炎沙门氏菌、猪霍乱沙门氏菌等10多个血清型,其中鼠伤寒是最常见的血清型之一[10-11]。白藜芦醇作为一种几乎无毒副作用且具有广泛来源的天然植物活性物质,具有许多抑菌类药物不具备的优点。近年来,国内外已有大量研究发现白藜芦醇具有广谱抑菌活性,如Marino等[12]通过试验发现白藜芦醇对金黄色葡萄球菌感染引发的角膜炎具有抑制作用;李峰等[13]研究表明白藜芦醇对核桃细菌性黑斑病菌具有一定的抑制作用;Duan等[14]研究发现白藜芦醇通过下调sae RS减少金黄色葡萄球菌-溶血素的产生,从而达到一定的抑制作用。目前人们关于花生芽白藜芦醇对鼠伤寒沙门氏菌的研究报道较少。因此本试验通过花生芽白藜芦醇纯化工艺研究,并在对纯化物进行傅里叶红外(Fourier-Transform Infrared,FTIR)、超高效液相色谱串联质谱(Ultra-Performance Liquid Chromatography-Mass Spectrometry,UPLC-QTOF- MS/MS)鉴定分析的基础上,通过观察分析白藜芦醇作用于鼠伤寒沙门氏菌标准株后,其对菌株的抑制作用,以期为白藜芦醇在养殖业、食品行业和医药行业中[15]的合理开发提供理论依据。
1 材料与方法
1.1 材料与试剂
新鲜花生芽,实验室培养;白藜芦醇标准品纯度≥ 98%、LB培养基、琼脂粉,北京索莱宝科技有限公司;AB-8、S-8、LX-68、H103、HPD500、LS-303、X-5、ADS-8、HPD450A、LSA-7、LSA-10、LSA-12、LSA-21、LSA-30、LSA-33、LSA-40大孔树脂,郑州和成新材料科技有限公司;二甲基亚砜(Dimethyl Sulfoxide,DMSO)、BCA蛋白浓度测定试剂盒,兰杰柯科技有限公司;硫酸卡那霉素,合肥中龙神力动物药业有限公司;鼠伤寒沙门氏菌(ATCC14028),美国菌种保藏中心;所有分离用有机溶剂均为国产分析纯。
1.2 仪器与设备
SCIIIIDM型微波光波超声波萃取仪,宁波新芝生物科技股份有限公司;TU-1901型双光束紫外可见分光光度计,北京普析通用仪器有限责任公司;ME99-2A型自动液相色谱分离层析仪,上海沪西分析仪器厂有限公司;LGJ-10D型冷冻干燥机,北京四环科学仪器厂有限公司;Tensor II型傅立叶变换红外光谱仪,美国BRUKER公司;1290型超高效液相色谱仪、6550型质谱仪、色谱柱waters BEH C18(2.1 mm×100 mm,1.7m),美国Agilent公司。
1.3 大孔吸附树脂的预处理
参照巫永华等[16]的方法将树脂进行活化处理,备用。
1.4 白藜芦醇的标准曲线及曲线方程
参照马密霞等[17]的方法。以吸光度对浓度绘制标准曲线,得回归方程为=0.1443-0.008,其中R=0.999 6,从而计算白藜芦醇含量。
1.5 试验方法
1.5.1 花生芽白藜芦醇的提取
采取本实验室的方法[18]进行白藜芦醇粗提液的制备。
1.5.2 乙酸乙酯萃取
将上述方法所得粗提液离心,弃沉淀,使用微孔滤膜(孔径=0.45m)过滤除杂,其次采取陈琼玲等[19]的方法进行初步纯化。
1.5.3 大孔树脂静态吸附-解吸动力学曲线
参照杨希娟等[20]方法,并稍作修改。准确称取预处理后树脂2.0 g置于100 mL三角瓶中,加入白藜芦醇质量浓度为141.43g/mL的花生芽提取液20 mL,于温度25 ℃、120 r/min的水浴摇床中振荡吸附,每隔30 min取样一次,以吸附时间为1轴,吸附量为1轴,测定样液中白藜芦醇含量,绘制吸附动力学曲线图。将锥形瓶中吸附饱和的树脂用蒸馏水冲洗至液体澄清、无浑浊状态,其次加入20 mL 70%乙醇溶液,于25℃、120 r/min的水浴摇床中,每隔一定时间取样一次,以解吸时间为2轴,解吸量为2轴,测定样液中白藜芦醇含量,绘制解吸动力学曲线图。
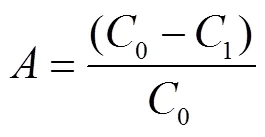
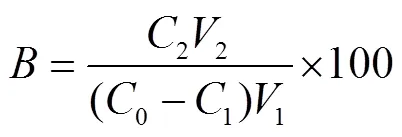
式中为大孔树脂的吸附率,%;为大孔树脂解吸率,%;0为吸附前样品溶液白藜芦醇的质量浓度,g/mL;1为吸附后样品溶液白藜芦醇的质量浓度,g/mL;1为样液体积,mL;2为解吸液中白藜芦醇质量浓度,g/mL;2为解吸液体积,mL。
1.5.4 大孔树脂动态吸附-解吸条件的优化
参考刘树兴等[21]的方法进行优化。将处理好的树脂湿法装柱,考察料液浓度、上柱速率、粗提液pH值、上样量对大孔树脂吸附效果的影响;吸附完成后考察解吸剂浓度、解吸剂pH值、解吸流速、解吸剂体积对大孔树脂解吸效果的影响。
1.5.5 产品纯度定性定量分析及组分鉴定
1)紫外光谱扫描
准确称取一定量的白藜芦醇纯化物冻干粉和标准品,用甲醇溶液将其配制成8.0g/mL的样液及标液。以甲醇作为空白对照,在190~700 nm范围内进行紫外光谱扫描[22]。
2)傅里叶红外光谱扫描检测
利用傅里叶红外光谱仪进行分析。在衰减全反射模式(Attenuated Total Refraction,ATR)下,称取一定量的白藜芦醇冻干粉和标准品,对其特征吸收峰进行表征。波数范围为400~4 000 cm-1。
3)超高效液相色谱串联质谱(UPLC-QTOF-MS/MS)检测
色谱条件:色谱柱为waters BEH C18(2.1 mm×100 mm,1.7m);流动相A:5 mmol乙酸铵水溶液;流动相B:甲醇溶液。梯度洗脱程序为:0~25 min:55%~40%A、45%~60%B;25~30 min:40%~55%A、60%~45%B;30~40 min:55%A、45%B。进样量5L,流速为 0.3 mL/min;质谱扫描范围:一级50~1 000 m/z,鞘流气温度350℃,鞘流气流量12 L/min,ESI-模式,电压3 200 V。
1.6 花生芽白藜芦醇抑菌功效研究
1.6.1 最小抑菌浓度(Minimum Inhibitory Concentration,MIC)测定
参考杜贝贝[23]、郭文瑶[24]的方法测定.的MIC,同时以硫酸卡那霉素药物培养基为阳性对照,以含2%DMSO培养基为阴性对照,通过酶标仪测定600 nm菌液的吸光度,以无菌生长孔所对应的白藜芦醇纯化物浓度为最小抑菌浓度[25]。
1.6.2 生长曲线的测定
参考朱亚珠等[26]的方法并稍作修改,绘制白藜芦醇对.的生长曲线。
1.6.3 细菌通透性测定
参考Wang等[27]的试验方法,收集菌体上清液,将上清液用0.22m滤膜过滤,按照BCA蛋白浓度测定试剂盒的方法测定不同处理条件下菌体细胞外的蛋白质含量。
1.7 数据分析
所有试验均重复3次,使用Excel 2019对数据进行初步处理,采用SPSS 16.0软件进行单因素差异性分析,使用Origin 8.5、GrapHPad Prism8软件进行作图。
2 结果与分析
2.1 大孔树脂对白藜芦醇静态吸附-解吸的影响
不同大孔树脂因其极性和比表面积不同,故会表现出不同的吸附和解吸性能。16种大孔树脂吸附和解吸性能如表1所示,LSA-40树脂吸附率与解吸率均高于其他型号树脂,且LSA-40树脂为弱极性,由于多酚类化合物的分子中含有多个酚羟基结构,其分子的极性不高,所以弱极性的树脂吸附效果较好。因此,选用LSA-40树脂作为分离纯化白藜芦醇的较佳树脂。
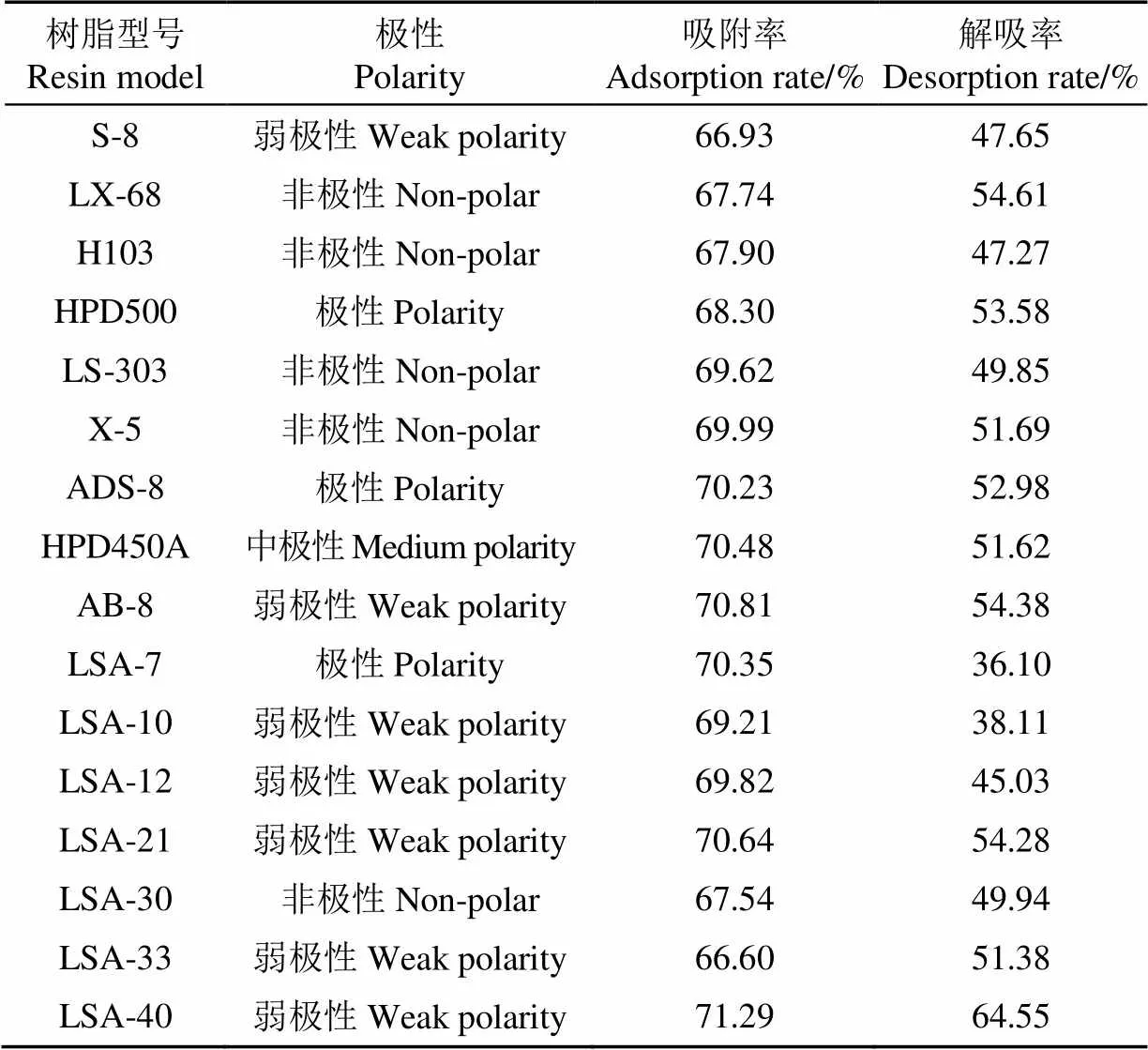
表1 不同型号树脂对白藜芦醇吸附解吸性能
2.2 LSA-40大孔树脂的静态吸附-解吸动力学曲线
由图1a可知,在吸附前110 min内,树脂对白藜芦醇的吸附量随时间的延长呈线性增加趋势,在110 min时,吸附速率逐渐平稳,表明此时树脂已接近吸附平衡,故选用110 min为较佳吸附平衡时间。由图1b可知,90 min时,LSA-40树脂对花生芽白藜芦醇的解吸率达到饱和,其后随着解吸时间的延长解吸率趋于平衡。由此确定较佳解吸时间为90 min。
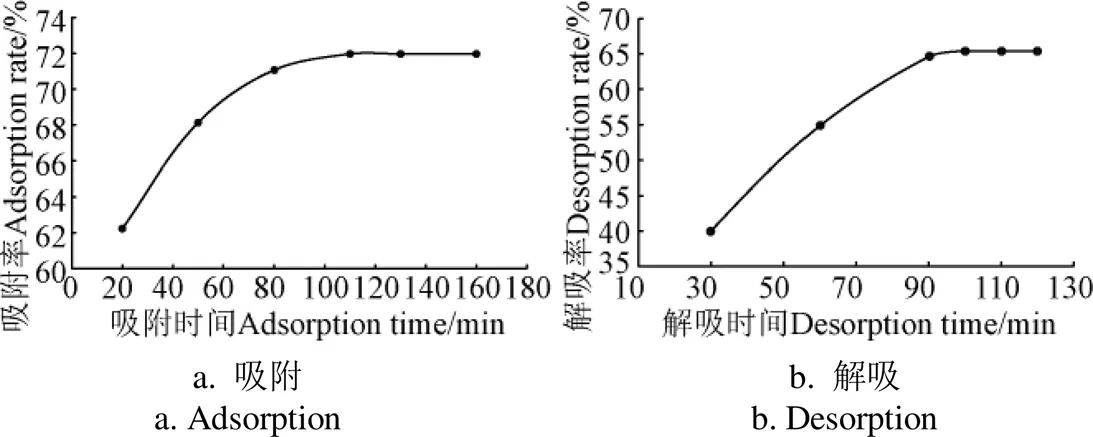
图1 LSA-40大孔树脂的静态吸附和解吸动力学曲线
2.3 LSA-40树脂对白藜芦醇动态吸附-解吸影响因素研究
2.3.1 上样料液浓度、速率、pH值和液质比对吸附效果的影响
由图2a可知,在白藜芦醇总量相同的情况下,吸附率与上柱浓度呈抛物线关系,浓度在120g/mL时吸附率达最高,因此,选择上柱浓度120g/mL为最佳。由图 2b可知,上样速率越小,则树脂对白藜芦醇的吸附容量就越大,但所耗时会增加。当速率超过1.0 mL/min后,吸附率下降较快,综合考虑吸附率及效率可选择流速1.0 mL/min。刘树兴等[21]对虎杖中白藜芦醇的纯化研究也得出了相同结果。由图2c发现,随着pH值的增加,白藜芦醇吸附率呈先增加后降低的趋势,在pH=4.2时,吸附率达到峰值,因此确定上柱液的pH值为4.2。根据图 2d可以看出,当上样量与树脂质量比例为8时吸附效果最好,上样量的比例再增大,则超过树脂饱和吸附量,吸附率反而下降,故选择上样量为树脂质量的8倍为较佳。
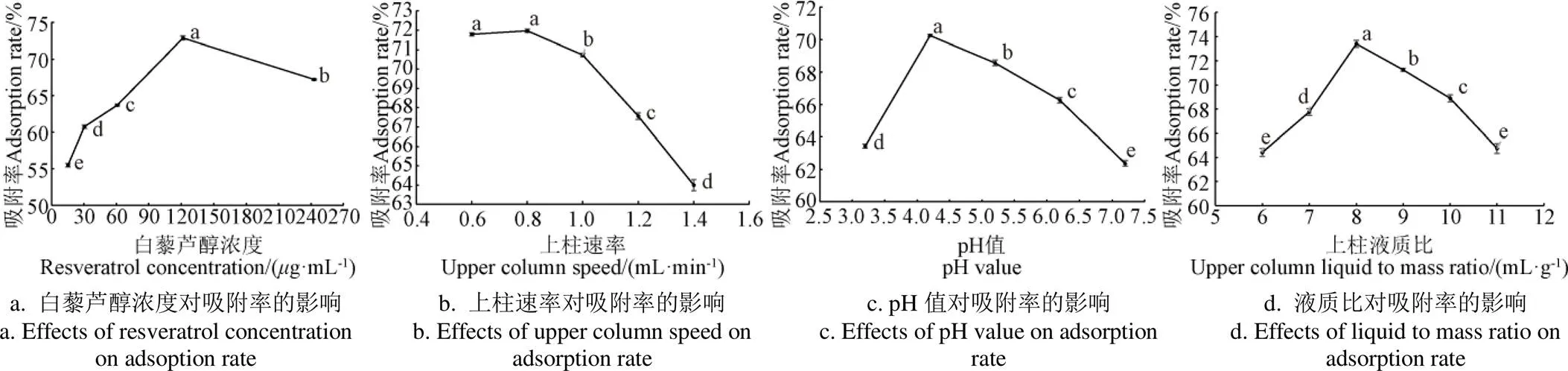
注:同一指标不同字母代表差异显著(P<0.05),下同。
2.3.2 乙醇浓度、pH值和流速对解吸效果的影响
由图3a可知,随着乙醇浓度增大,解吸率逐渐增高,因考虑到随着乙醇浓度增加,洗脱液中其他脂溶性杂质溶出增加,并且当浓度上升到80%时,再增大乙醇浓度,解吸率无显著差异(>0.05),故选用80%的乙醇作为解吸剂。由图3b可知,解吸液在pH值为7.6时解吸效果最好,因白藜芦醇在碱性溶液中不稳定,且在自然状态下pH值为6.6,与pH值7.6时解吸率无显著差异(>0.05),故选用pH值为6.6解吸液进行洗脱更有利于其稳定性。由图3c可知,解吸率随流速增大而减小,且流速越大,溶剂与树脂的作用时间越短,使有效成分不能充分解吸。但随着流速的增大,生产效率会提高。综合考虑选择流速1.0 mL/min较为合适。
2.3.3 花生芽白藜芦醇解吸曲线研究
根据已知确定的吸附条件以选取10 g树脂为例,上样充分吸附后,以解吸条件进行解吸操作,流出液每8 mL单独收集于刻度试管中,并测定每份解吸液的白藜芦醇浓度,以解吸液体积为横坐标,白藜芦醇浓度为纵坐标,绘制解吸曲线。由图4可以看到,解吸初始,白藜芦醇洗脱较少,但很快,在10~80 mL的洗脱液中,解吸了大部分的有效成分,随着乙醇的继续洗脱,剩余少量的白藜芦醇也逐渐被解吸下来,考虑到提高纯化效率,故选用解吸液体积80 mL,其与树脂质量比为8 mL/g作为较佳洗脱量。

a. 乙醇浓度对解吸率的影响a. Effects of ethanol concentration on desorption rateb. pH值对解吸率的影响b. Effects of pH on desorption ratec. 流速对解吸率的影响c. Effects of flow rate on desorption rate
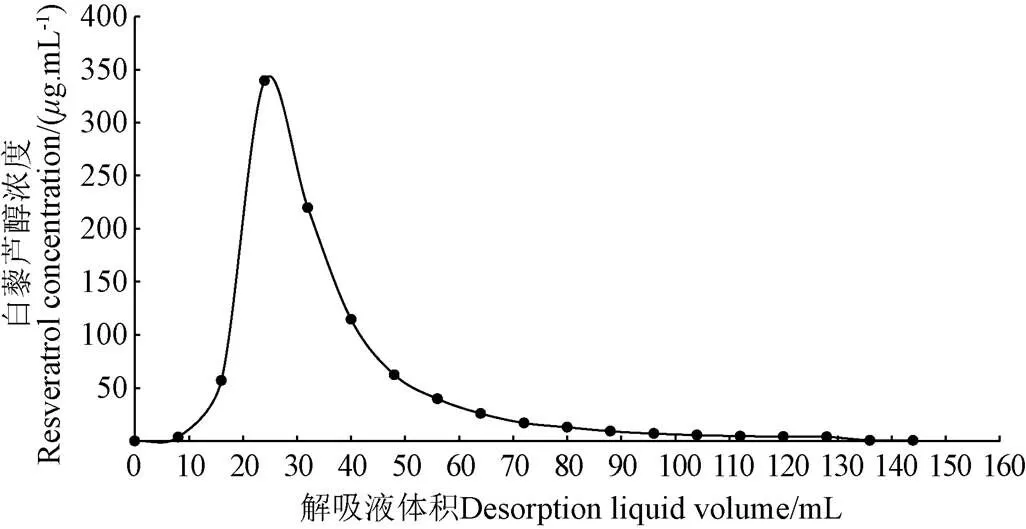
图4 白藜芦醇解吸曲线
2.4 纯化后白藜芦醇的分析及鉴定
2.4.1 紫外全波长扫描分析
由图5可知,将分离纯化所得出的白藜芦醇用甲醇溶解,对比白藜芦醇标品与纯化后样品紫外全波长扫描图,发现样品与标准品吸收峰基本一致,说明该提取物属于白藜芦醇类物质。参考纪秀凤等文献的方法[28],通过计算,样品白藜芦醇纯度可达84.0%。
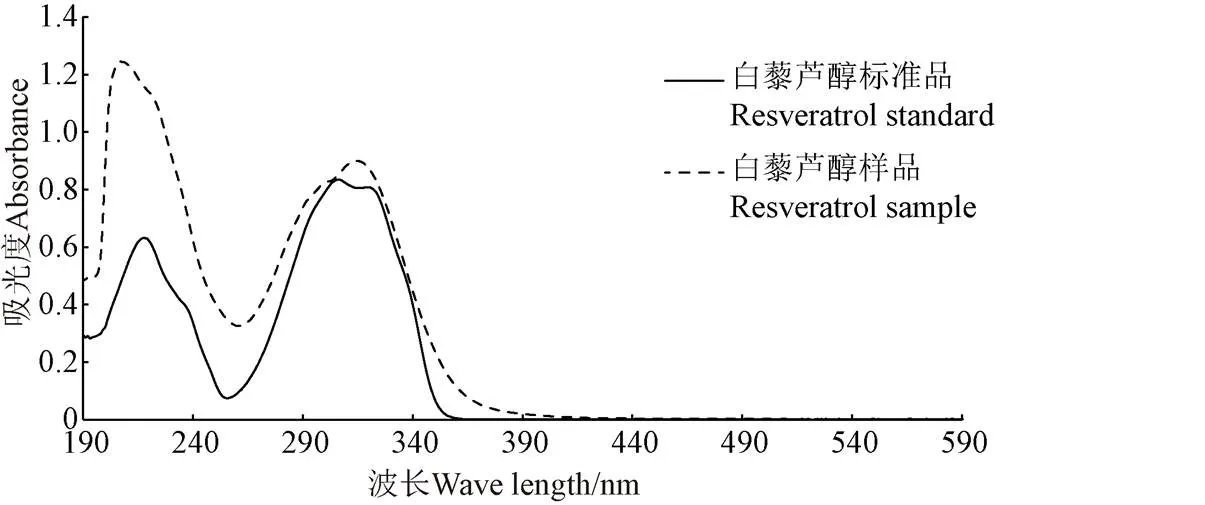
图5 花生芽白藜芦醇纯化物紫外可见光谱扫描图
2.4.2 FTIR扫描分析
花生芽白藜芦醇纯化物的傅里叶红外光谱结果如图 6所示,可知该纯化产物与标准品特征吸收峰之间无明显差异,主要吸收峰有:3 336、1 607、1 513、1 461、1 144、1 061、964、831、670、515 cm-1。3 336 cm-1处吸收峰是由于分子结构中羟基的伸缩振动形成的;在1 607、1 513、1 461 cm-1处有吸收峰主要是由于苯环内的C=C和C-C间耦合而成的伸缩振动作用导致;在1 061、964、831 cm-1处有强吸收峰是因两酚环间的反式-C=C-的伸缩振动引起;在670 cm-1处有特征吸收峰是由于两酚环间顺式-C=C-的伸缩振动所导致。以上说明花生芽白藜芦醇结构中有酚羟基、苯环、-C=C-等特征基团,此结果与孙磊磊[29]和李小妹等[30]文献研究报道相一致。
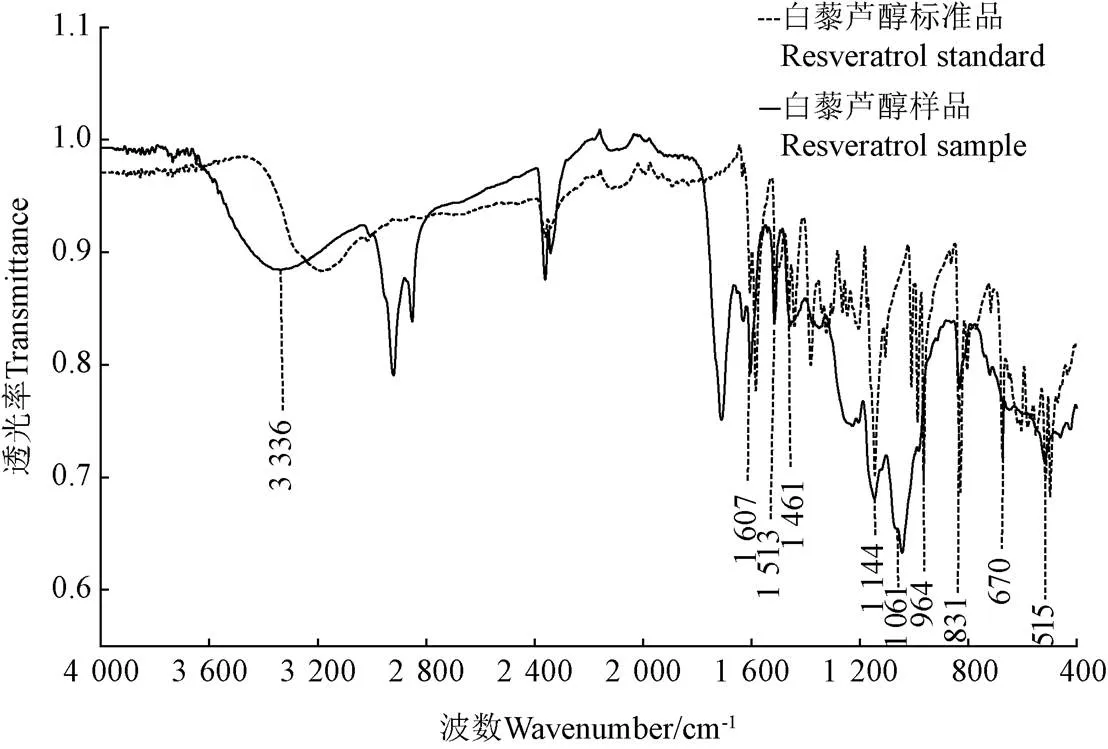
图6 花生芽白藜芦醇纯化物红外光谱图分析
2.4.3 UPLC-QTOF-MS/MS鉴定分析
通过超高效液相色谱串联质谱(UPLC-QTOF- MS/MS),结合准分子离子[M-H]-(m/z)和相对应的碎片离子信息,对花生芽白藜芦醇纯化物组成进行分析。图7为负离子模式下得到的总离子流图,对谱峰的多级碎片进行解析,共鉴别了8个化学成分,主要包含白藜芦醇和原花青素两种物质。白藜芦醇是一种非黄酮类多酚化合物,顺式白藜芦醇对光不稳定,故自然界中大多以反式白藜芦醇存在,其衍生物主要包括氧化白藜芦醇和白藜芦醇苷,根据其聚合程度分为白藜芦醇二聚体、四聚体等[31];原花青素是由黄烷-3-醇结构单元组成的多酚类物质,单体主要包括儿茶素(Catechin,Cat)、表儿茶素(Epicatechin,EC)、表儿茶素没食子酸酯(Epicatechin Gallate,ECG)及表没食子儿茶素没食子酸(Epigallocatechin Gallate,EGCG)等[32-33],根据单体间化学键结合位置不同可以将其分为A型原花青素和B型原花青素,而花生中以A型原花青素为主,且A型更稳定性、生物利用度更高。
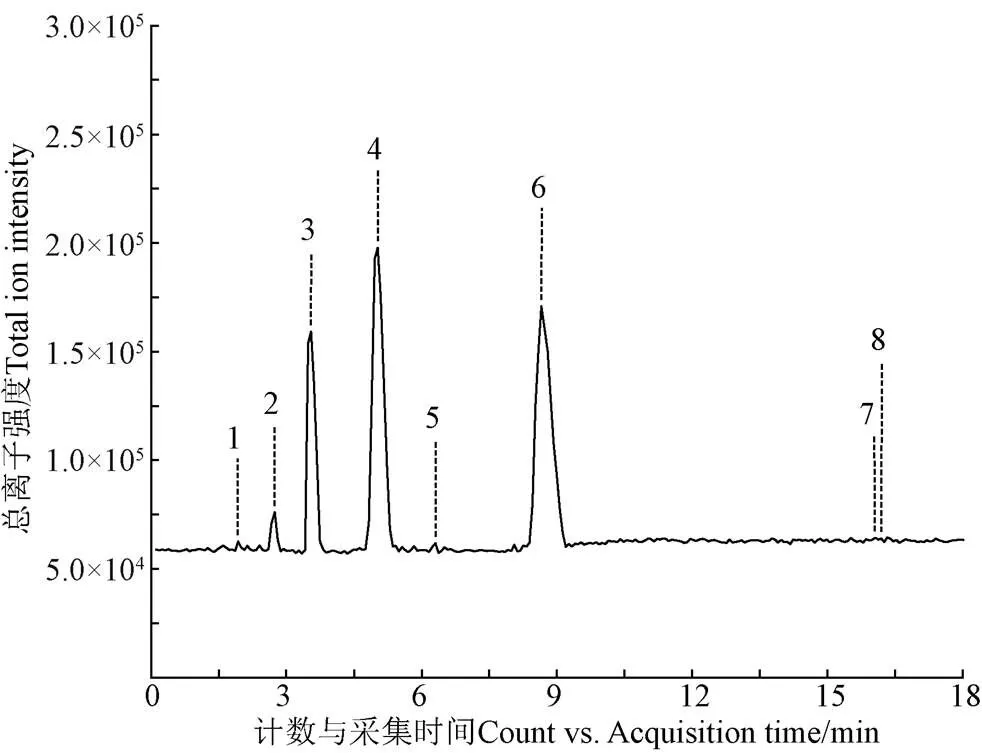
注:1-8号含义见表2。
纯化物主要成分组成,汇总结果具体见表2。
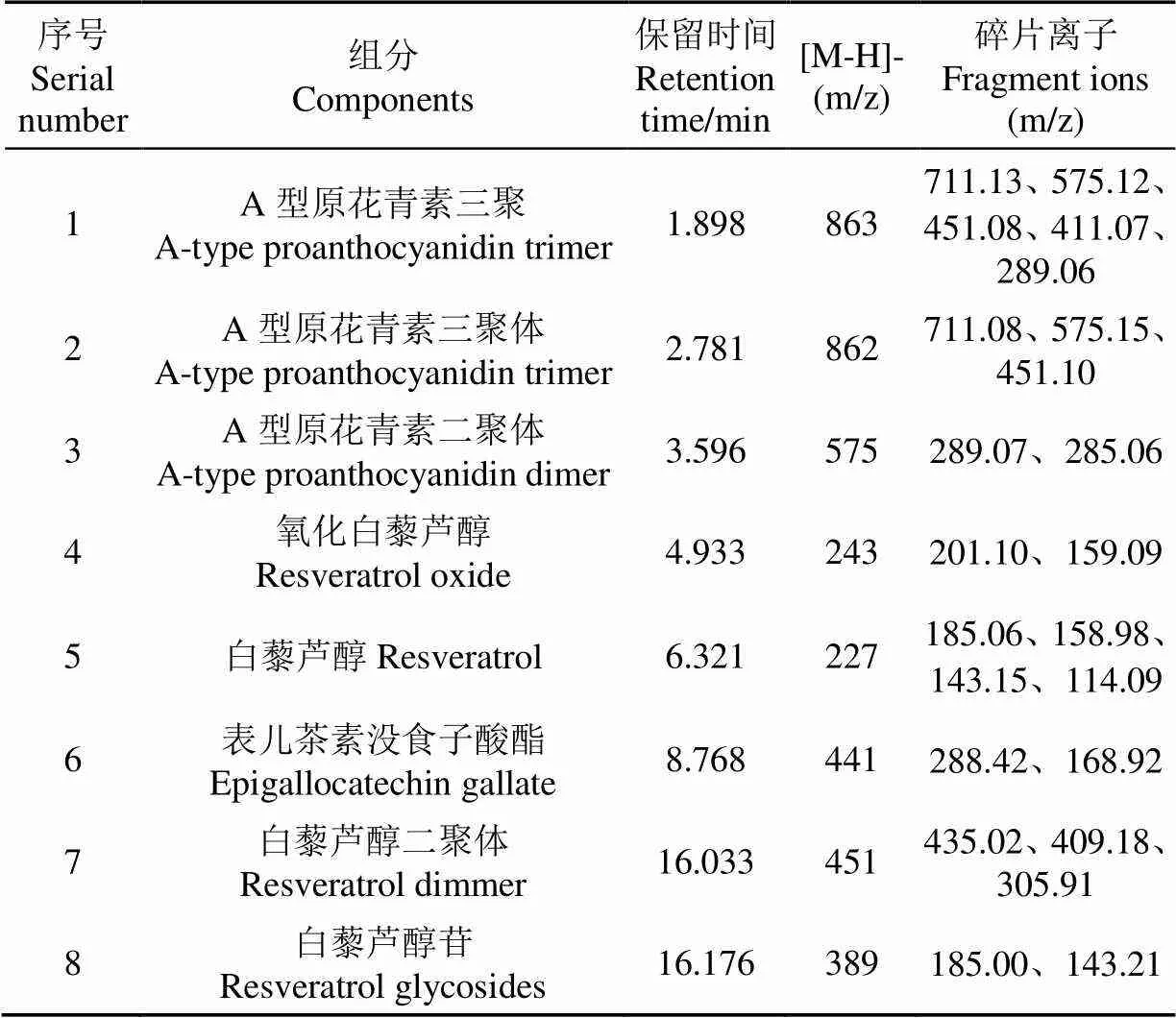
表2 已知化合物的鉴定分析结果
化合物1和2的分子离子[M-H]-m/z为863,其结构为A型原花青素三聚体。Monagas等[34]发现其碎片离子包括m/z 711、m/z 575、m/z 451、m/z 411和m/z 289。其中m/z 711是在T-unit位置发生逆狄尔斯-阿尔德(Retro- Diels-Alder,RDA )和杂环裂解(Heterocyclic Ring Fission,HRF)断裂产生的离子,m/z 575是分子离子黄烷醇间连接键的断裂量子力学(Quantum Mechanics,QM)发生在T-unit连接键位置时形成的,m/z 451和m/z 411是M-unit上发生HRF裂解产生,m/z 289是分子离子黄烷醇间连接键的断裂(QM)发生在M-unit连接键位置时形成的。通过表2碎片离子信息与上述参考文献描述相符,确定其为A型原花青素三聚体。
化合物3的分子离子[M-H]-m/z为575,其结构为A型原花青素二聚体。纪秀凤[35]研究发现其碎片离子包括m/z 289、m/z 285。m/z 289和m/z 285是由于QM碎裂失去B-unit和T-unit中性碎片所形成的。通过表2碎片离子信息与上述参考文献一致,确定其为A型原花青素二聚体。
化合物4的分子离子[M-H]-m/z为243,其结构为氧化白藜芦醇。对于氧化白藜芦醇通过丢失碎片C2H2O、2C2H2O形成产物离子m/z 201、m/z 159。通过表2碎片离子信息与杨阳[36]文献结果一致,因此确定为氧化白藜芦醇。
化合物5的分子离子[M-H]-m/z为227,其结构为白藜芦醇。在负离子模式下扫描,并通过碰撞诱导解离(Collision-Induced Dissociation,CID)产生一系列特征碎片离子m/z 185、m/z 159、m/z 143。通过表2碎片离子信息与吴泳锡等[37]文献描述相符,确定其为白藜芦醇。
化合物6的分子离子[M-H]-m/z为441,其结构为表儿茶素没食子酸酯。在负离子模式下对母离子进行碰撞诱导解离,获得二次特征碎片离子m/z 288、m/z 169。通过表2碎片离子信息与冯峰等[38]参考文献描述相符,确定其为表儿茶素没食子酸酯。
化合物7的分子离子[M-H]-m/z为451,其结构为白藜芦醇二聚体。通过丢失碎片H2O、C2H2O、C7H6O形成产物离子m/z 435、m/z 409、m/z 305。准分子离子峰[M-H]-失去碎片C2H2O形成产物离子m/z 409是其间苯二酚失去C2H2O所致。通过表2碎片离子信息与宇嘉[31]参考文献描述相符,确定其为白藜芦醇二聚体。
化合物8的分子离子[M-H]-m/z为389,其结构为白藜芦醇苷。通过表2得到的主要碎片离子m/z 185、m/z 143,与白黎芦醇苷母离子裂解丢失一个取代葡萄糖基(-C6H10O5)生成的苷元,白藜芦醇负离子的m/z 185相符,并与董静等[39]文献方法对白藜芦醇苷的分析结果一致,因此确定m/z为389的化合物为白藜芦醇苷。
2.5 花生芽白藜芦醇对鼠伤寒沙门氏菌抑菌功效评价
2.5.1 花生芽白藜芦醇对鼠伤寒沙门氏菌最小抑菌浓度的研究
由图8可知,白藜芦醇纯化物浓度在250g/mL(含白藜芦醇为210g/mL)时能够显著抑制.的生长(<0.01),因此白藜芦醇纯化物对.的最小抑菌浓度(MIC)为250g/mL,与红豆皮多酚提取物MIC[40](2 500g/mL)相比具有显著优势;随着白藜芦醇纯化物浓度增加,抑制活性越强,在500g/mL时,基本能够完全抑制.生长;在低于MIC浓度时,白藜芦醇纯化物均不能有效抑制.的生长。
2.5.2 花生芽白藜芦醇纯化物对鼠伤寒沙门氏菌生长曲线影响的研究
细菌在适宜条件下的生长曲线大致呈“S”型,一般会经历延滞期、对数期、稳定期。由图9可知,白藜芦醇纯化物浓度为62.5、125、250g/mL 3个试验组的生长曲线表现出不同程度的抑制效果。62.5g/mL组约在5 h后呈指数形式增长,约16 h后到达稳定期;125g/mL组约在7 h后呈指数形式增长,约18 h后到达稳定期,说明在62.5、125g/mL浓度处理条件下白藜芦醇破坏了.生长周期,导致其延滞期延长及对数生长期生长速度降低,且白藜芦醇浓度越高,抑制作用越明显250g/mL组约在18 h后才表现出微小的生长趋势,且整体生长速度缓慢,延滞期相比阴性对照组明显延长,说明浓度为250g/mL的白藜芦醇溶液几乎完全破坏了细菌的正常细胞分裂及生长周期,.的正常生长受到严重破坏。综上,62.5和125g/mL处理组抑制作用表现为延长迟缓期并降低其生长速度,当白藜芦醇纯化物浓度为250g/mL时,显著抑制.的生长。
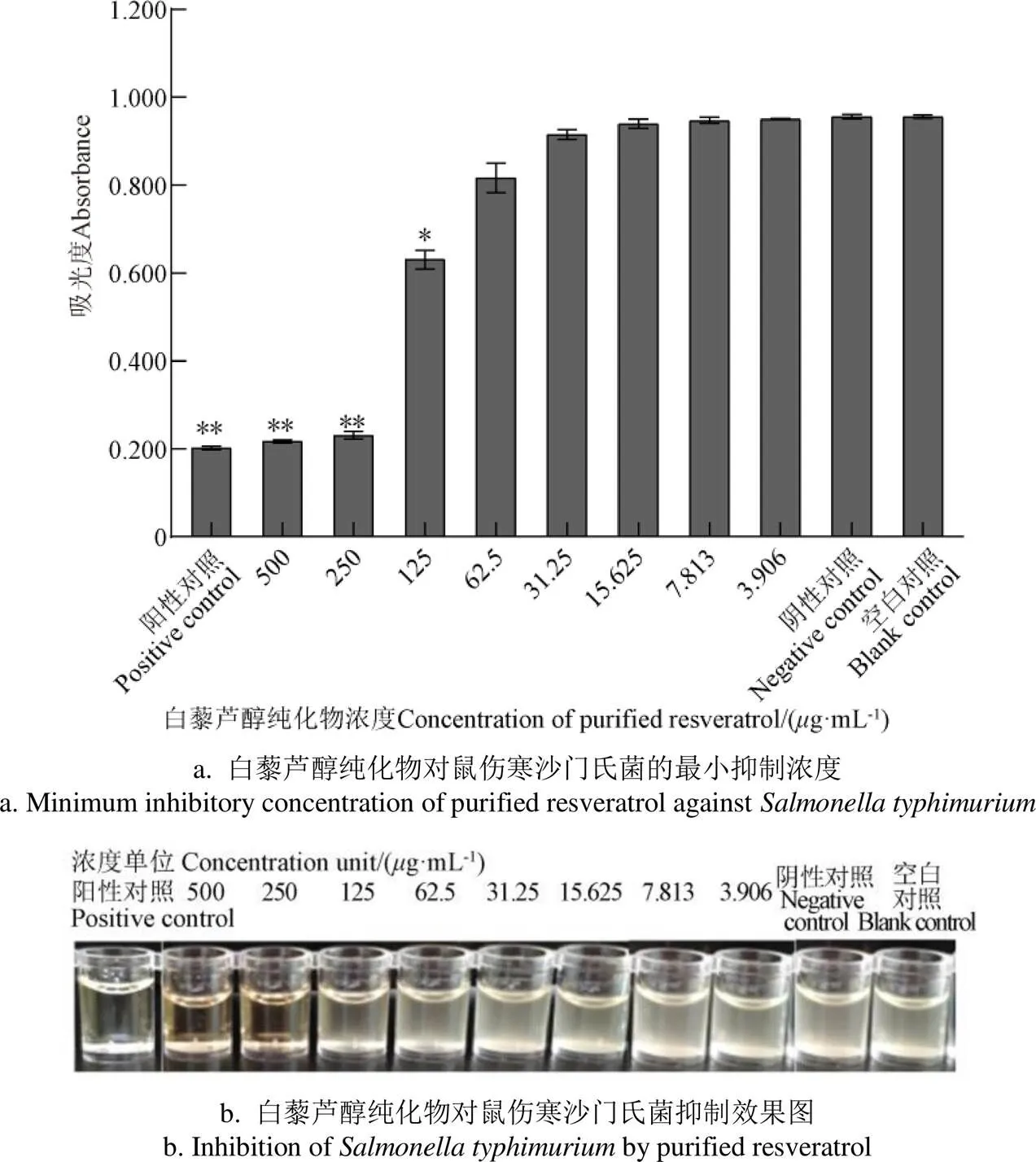
注:“*”表示组间存在显著性差异(P<0.05),“**”表示组间存在极显著差异(P<0.01),图10同。
2.5.3 花生芽白藜芦醇对鼠伤寒沙门氏菌蛋白质泄露的研究
蛋白质对于细胞的生长发育、生长代谢、各种生理功能的发挥具有重要作用。当细胞膜受到损伤时,其通透性会增加,从而使胞内大量内容物外泄,严重影响细胞的正常生长。因此,可以通过测定培养基中的蛋白质含量来判断细胞是否遭到破坏。如图10所示,白藜芦醇纯化物浓度62.5g/mL组与空白对照组没有显著性差异(>0.05),说明该浓度下菌体蛋白质泄露不明显。当浓度增至125、250g/mL时,细胞遭到严重破坏,其内容物溢出,导致培养液中的蛋白质含量增加,与空白对照组相比有极显著差异(<0.01),即白藜芦醇浓度越大蛋白质泄露程度越深,细胞膜和细胞壁破损越严重。由此表明,花生芽白藜芦醇对.有明显抑制作用。
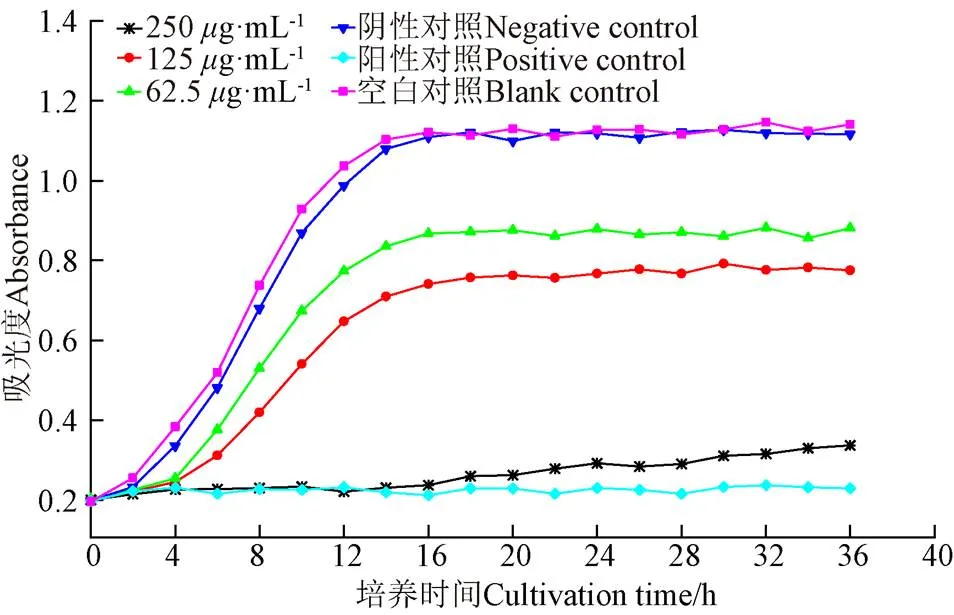
图9 鼠伤寒沙门氏菌在不同浓度白藜芦醇纯化物处理下的生长曲线
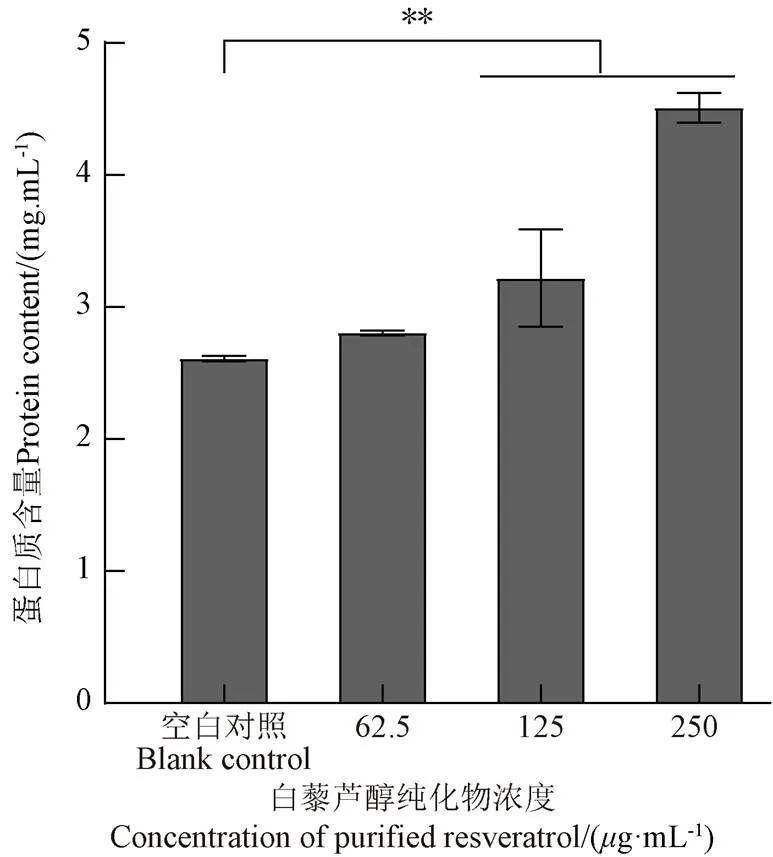
图10 花生芽白藜芦醇对鼠伤寒沙门氏菌蛋白质泄露的影响
3 结 论
本文通过静态吸附-解吸试验比较了AB-8、 S-8、LX-68、H103、X-5、LSA-40等16种大孔树脂对花生芽白藜芦醇提取物的分离纯化效果,从中筛选出LSA-40为较佳吸附树脂类型,该树脂对花生芽白藜芦醇具有较好的吸附和解吸性能,且价格便宜,易操作。通过动态吸附-解吸条件优化,得到适宜吸附条件为上样浓度120.00g/mL,上样速率1.00 mL/min,pH值为4.2,上样量8.00 mL/g;解吸条件为80%乙醇溶液,pH值6.6,流速1.00 mL/min。经紫外光谱分析,LSA-40大孔树脂在较优工艺条件下分离纯化的花生芽白藜芦醇其纯度可达84.0%;利用傅里叶红外光谱、超高效液相色谱串联质谱鉴定分析表明纯化物中主要含有白藜芦醇低聚体及部分原花青素低聚体。通过测定白藜芦醇纯化物对.的最小抑菌浓度得出最小抑菌浓度(Minimum Inhibitory Concentration,MIC)为250g/mL,此外,通过绘制生长曲线及细胞内容物蛋白质含量变化得出白藜芦醇纯化物处理后的.,其延滞期延长、对数期生长速度降低,细胞壁完整性遭到破坏,细胞膜通透性增加,最终导致菌体无法正常生长,表明经LSA-40树脂纯化后的花生白藜芦醇具有较高的活性。该研究可为花生资源深度利用和白藜芦醇生物活性的构效分析及其在功能性食品、药品、化妆品和无抗养殖等领域的利用提供一定的科学依据。
[1] 王娜,李娜,余秋颖,等. 花生芽菜发芽过程中营养物质变化规律研究[J]. 花生学报,2021,50(3):61-67,79.
Wang Na, Li Na, Yu Qiuying, et al. Study on the change of nutrients during the germination process of peanut sprouts[J]. Acta Peanuts, 2021, 50(3): 61-67, 79. (in Chinese with English abstract)
[2] 张茜,郑雅莹,李妍,等. 高压静电场预处理对花生芽活性物质及抗氧化能力的影响[J]. 食品科学,2019,40(17):190-195.
Zhang Qian, Zheng Yaying, Li Yan, et al. Effect of high-voltage electrostatic field pretreatment on active substances and antioxidant capacity of peanut sprouts[J]. Food Science, 2019, 40(17): 190-195. (in Chinese with English abstract)
[3] 于梅,秦敬波,刘竹青,等. 花生芽中白藜芦醇粗提物对香肠中4种腐败菌的抑菌活性[J]. 中国食品学报,2018,18(12):203-209.
Yu Mei, Qin Jingbo, Liu Zhuqing, et al. Bacteriostatic activity of resveratrol crude extract in peanut buds against four spoilage bacteria in sausage[J]. Chinese Journal of Food Science, 2018, 18(12): 203-209. (in Chinese with English abstract)
[4] 刘连红,陈飞,管永祥,等. 枫香拟茎点霉B3生物转化花生废弃物合成白藜芦醇[J]. 食品科学,2020,41(6):170-178.
Liu Lianhong, Chen Fei, Guan Yongxiang, et al. Synthesis of Resveratrol from Peanut Wastes by Biotransformation of Phomopsis liquidambari B3[J]. Food Science, 2020, 41(6): 170-178. (in Chinese with English abstract)
[5] 吴文英,李文娟,李露,等. 白藜芦醇对多柔比星引起的心脏毒性保护作用研究进展[J]. 食品科学,2021,42(5):271-277.
Wu Wenying, Li Wenjuan, Li Lu, et al. Research progress on the cardiotoxic protective effect of resveratrol on doxorubicin[J]. Food Science, 2021, 42(5): 271-277. (in Chinese with English abstract)
[6] Singh A K, Vinayak M. Anti–nociceptive effect of resveratrol during inflammatory hyperalgesia via differential regulation of pro–inflammatory mediators[J]. Phytotherapy Research, 2016, 30(7): 1164–1171.
[7] Biasutto L, Mattarei A, Azzolini M, et al. Resveratrol derivatives as a pharmacological tool[J]. Annals of the New York Academy of Sciences,2017,1403(1): 27–37.
[8] Singh A P, Singh R, Verma S S, et al. Health benefits of resveratrol: Evidence from clinical studies[J]. Medicinal Research Reviews, 2019, 39(5): 1851–1891.
[9] 吴上. 食品加工理化因子对鼠伤寒沙门氏菌耐药性的影响及相关机制研究[D]. 无锡:江南大学,2021.
Wu Shang. Effect of Physical and Chemical Factors of Food Processing on Resistance ofand Related Mechanisms[D]. Wuxi: Jiangnan University, 2021. (in Chinese with English abstract)
[10] Mezal E H, Stefanova R, Khan A A. Isolation and molecular characterization of Salmonella enterica serovar Javiana from food, environmental and clinical samples[J]. International Journal of Food Microbiology, 2013, 164(1): 113-118.
[11] Zhao S, Mcdermott P F, Friedman S, et al. Characterization of antimicrobial-resistant Salmonella isolated from imported foods[J]. Journal of Food Protection, 2006, 69(3): 500-507.
[12] Marino A, Santoro G, Spataro F, et al. Resveratrol role in Staphylococcus aureus-induced corneal inflammation[J]. Pathogens and Disease, 2013, 68(2): 61-64.
[13] 李峰,陈雯雯,邓江丽,等. 白藜芦醇对核桃细菌性黑斑病菌的抑制作用[J]. 生物技术通报,2021,37(6):58-65.
Li Feng, Chen Wenwen, Deng Jiangli, et al. Inhibition of resveratrol on walnut bacterial black spot fungus[J]. Bulletin of Biotechnology, 2021, 37(6): 58-65. (in Chinese with English abstract)
[14] Duan J J, Li M L, Hao Z H, et al. Subinhibitory concentrations of resveratrol reduce alpha-hemolysin production in Staphylococcus aureus isolates by downregulating saeRS[J]. Emerging Microbes & Infections, 2018, 7(1): 136.
[15] 李琳,余安玲,吴轶,等. 改性果胶与白藜芦醇的相互作用机制及抗氧化能力[J]. 华南理工大学学报(自然科学版),2021,49(9):1-10.
Li Lin, Yu Anling, Wu Yi, et al. Interaction mechanism and antioxidant capacity of modified pectin and resveratrol[J]. Journal of South China University of Technology (Natural Science Edition), 2021, 49(9): 1-10. (in Chinese with English abstract)
[16] 巫永华,张建萍,赵节昌,等. 大孔树脂纯化黄精多酚及其抗氧化性与组成分析[J]. 农业工程学报,2020,36(1):318-326.
Wu Yonghua, Zhang Jianping, Zhao Jiechang, et al. Antioxidantion and composition analysis of purified polygonatum sibiricum polyphenols using macroporous resin[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2020, 36(1): 318-326. (in Chinese with English abstract)
[17] 马密霞,秦宁,闵清,等. 微波超声波联用萃取白藜芦醇及其苷的HPLC测定[J]. 化工学报,2019,70(S1):124-129.
Ma Mixia, Qin Ning, Min Qing, et al. HPLC determination of resveratrol and its glycosides by microwave ultrasonic extraction[J]. CIESC Journal, 2019, 70(S1): 124-129. (in Chinese with English abstract)
[18] 王娜,宁灿灿,张双双,等. 不同产地及品种花生红衣白藜芦醇的差异化分析[J].花生学报, 2022, 51(1):86-92.
Wang Na, Ning Cancan, Zhang Shuangshuang, et al. Differentiation analysis of resveratrol in red coat of peanuts from different origins and varieties[J]. Journal of Peanut Science, 2022, 51(1):86-92. (in Chinese with English abstract)
[19] 陈琼玲,刘红芝,刘丽,等. 大孔树脂-硅胶柱层析法纯化花生根中白藜芦醇[J]. 中国食品学报,2014,14(6):127-132.
Chen Qiongling, Liu Hongzhi, Liu Li, et al. Resveratrol purified in peanut root by macroporous resin-silicone column chromatography[J]. Chinese Journal of Food Science, 2014, 14(6): 127-132. (in Chinese with English abstract)
[20] 杨希娟,党斌,张杰,等. 黑青稞麸皮结合态酚类物质大孔树脂分离纯化工艺优化[J]. 农业工程学报,2018,34(21):295-303.
Yang Xijuan, Dang Bin, Zhang Jie, et al. Process optimization on separation and purification of bound polyphenol in black highland barley bran by macroporous resin[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2018, 34(21): 295-303. (in Chinese with English abstract)
[21] 刘树兴,程丽英,高连周,等. 大孔吸附树脂法分离纯化白藜芦醇的研究[J]. 食品科学,2005, 26(9):247-251.
Liu Shuxing, Cheng Liying, Gao Lianzhou, et al. Separation and purification of resveratrol by macroporous adsorption resin method[J]. Food Science, 2005, 26(9): 247-251. (in Chinese with English abstract)
[22] Fu C, Yang X, Lai S, et al. Structure, antioxidant and α-amylase inhibitory activities of longan pericarp proanthocyanidins[J]. Journal of Functional Foods, 2015, 14(3): 23-32.
[23] 杜贝贝. 红蓼活性化合物槲皮素结构优化初探及对马铃薯环腐病菌的抑菌作用研究[D]. 太原:山西大学,2021.
Du Beibei. A Preliminary Study on the Structural Optimization of Quercetin, An Active Compound of Red Indigo, and Its Bacteriostatic Effect on Potato Cyclic Rot Bacteria[D]. Taiyuan: Shanxi University, 2021. (in Chinese with English abstract)
[24] 郭文瑶. 绿原酸对食源性致病菌的抑菌作用及机理研究[D]. 西安:陕西科技大学,2021.
Guo Wenyao. Study on the Bacteriostatic Effect and Mechanism of Chlorogenic Acid on Foodborne Pathogenic Bacteria[D]. Xi'an: Shaanxi University of Science and Technology, 2021. (in Chinese with English abstract)
[25] Valentina V E, Simona N, Fabrizio B, et al. In vitro antimicrobial activity of essential oils against salmonella enterica serotypes enteritidis and typhimurium strains isolated from poultry[J]. Molecules, 2019, 24(5): 900.
[26] 朱亚珠,夏率博,陈琳,等. 一株贝莱斯芽孢杆菌的生长特性及抑菌活性研究[J]. 食品科学技术学报,2022,40(1):85-92.
Zhu Yazhu, Xia Lvbo, Chen Lin, et al. Growth characteristics and bacteriostatic activity of a strain of Bacillus Velez[J]. Journal of Food Science and Technology, 2022, 40(1): 85-92. (in Chinese with English abstract)
[27] Wang L, Zhao X Q, Xia X J, et al. Inhibitory effects of antimicrobial peptide JH-3 on salmonella enterica serovar typhimurium strain CVCC541 infection-induced inflammatory cytokine release and apoptosis in RAW264.7 cells[J]. Molecules, 2019, 24(3): 596.
[28] 纪秀凤,芦宇,刘海春,等. 大孔树脂-聚酰胺分离纯化红树莓籽低聚原花青素及其体外模拟胃、肠消化[J]. 中国食品学报,2020,20(6):173-180.
Ji Xiufeng, Lu Yu, Liu Haichun, et al. Macroporous resin-polyamide separation and purification of red raspberry seed oligomeric proanthocyanidins and their in vitro simulated stomach and intestinal digestion[J]. Chinese Food Science, 2020, 20(6): 173-180. (in Chinese with English abstract)
[29] 孙磊磊. 新疆赤霞珠葡萄叶白藜芦醇的提取纯化及其应用研究[D]. 乌鲁木齐:新疆大学,2015.
Sun Leilei. Extraction and Purification of Resveratrol in Xinjiang Cabernet Sauvignon Grape Leaf and Its Application[D]. Urumqi: Xinjiang University, 2015. (in Chinese with English abstract)
[30] 李小妹,李娜,黄开胜,等. 白藜芦醇低聚体类似物的光谱特征、生源与生物活性[J]. 药学学报,2002(1):69-74.
Li Xiaomei, Li Na, Huang Kaisheng, et al. Spectral characteristics, biogenesis and biological activity of resveratrol oligomer analogues[J]. Acta Pharmaceutica Sinica, 2002(1): 69-74. (in Chinese with English abstract)
[31] 宇嘉. 白藜芦醇及其二聚体淬灭单线态氧机制的研究[D]. 西安:陕西师范大学,2019.
Yu Jia. Study on the Mechanism of Resveratrol and Its Dimer Quenching Singlet Oxygen[D]. Xi'an: Shaanxi Normal University, 2019. (in Chinese with English abstract)
[32] 苏晨露,艾连中,吴艳,等. 罗望子种皮原花青素系统的非酶褐变动力学和食品配方因素影响[J]. 食品科学,2022,43(5):26-38.
Su Chenlu, Ai Lianzhong, Wu Yan, et al. Effects of non-enzymatic browning kinetics and food formulation factors on tamarind seed coat proanthocyanidin system[J]. Food Science, 2022, 43(5): 26-38. (in Chinese with English abstract)
[33] Silva J M D, Darmon N, Mitjavila S, et al. Oxygen free radical scavenger capacity in aqueous models of different procyanidins from grape seeds[J]. Journal of Agricultural and Food Chemistry, 2002, 39(9): 1549-1552.
[34] Monagas M, Garrido I, Lebrón-Aguilar R, et al. Almond (Prunus dulcis (Mill. ) D. A. Webb) skins as a potential source of bioactive polyphenols[J]. Journal of Agricultural and Food Chemistry, 2007, 55(21): 8498-8507.
[35] 纪秀凤. 红树莓籽中低聚原花青素纯化鉴定及其微胶囊化研究[D]. 锦州:渤海大学,2019.
Ji Xiufeng. Purification and Identification of Oligomeric Proanthocyanidins in Red Raspberry Seeds and Its Microencapsulation[D]. Jinzhou: Bohai University, 2019. (in Chinese with English abstract)
[36] 杨阳. 白藜芦醇抗膀胱癌活性、代谢特征及其构效关系的体外研究[D]. 大连:大连医科大学,2019.
Yang Yang. In Vitro Study on the Activity, Metabolic Characteristics and Structure-activity Relationship of Resveratrol Anti-bladder Cancer[D]. Dalian: Dalian Medical University, 2019. (in Chinese with English abstract)
[37] 吴泳锡,张美玉,王一竹,等. 基于GC-MS和LC-MS的人参冰酒成分分析[J]. 质谱学报,2022,43(2):189-200.
Wu Yongxi, Zhang Meiyu, Wang Yizhu, et al. Composition analysis of ginseng ice wine based on GC-MS and LC-MS[J]. Journal of Mass Spectrometry, 2022, 43(2): 189-200. (in Chinese with English abstract)
[38] 冯峰,程甲,粟有志,等. 高效液相色谱-串联质谱法检测红葡萄酒中功效成分[J]. 色谱,2017,35(2):178-184.
Feng Feng, Cheng Jia, Su Youzhi, et al. Determination of functional ingredients in red wine by high performance liquid chromatography-tandem mass spectrometry[J]. Chromatography, 2017, 35(2): 178-184. (in Chinese with English abstract)
[39] 董静,王弘,万乐人,等. 高效液相色谱/电喷雾-离子阱-飞行时间质谱分析鉴定中药虎杖中的主要化学成分[J]. 色谱,2009,27(4):425-430.
Dong Jing, Wang Hong, Wan Leren, et al. Identification of major chemical components in Chinese medicine polygonum by high performance liquid chromatography/electrospray-ion trap-time-of-flight mass spectrometry[J]. Chromatography, 2009, 27(4): 425-430. (in Chinese with English abstract)
[40] 贾睿,蔡丹,葛思彤,等. 红豆皮多酚提取物对两种致病菌的抑菌活性及作用机理[J]. 食品科学,2021,42(23):64-71.
Jia Rui, Cai Dan, Ge Sitong, et al. Bacteriostatic activity and mechanism of action of red bean peel polyphenol extract on two pathogenic bacteria[J]. Food Science, 2021, 42(23): 64-71. (in Chinese with English abstract)
Purification process by macroporous resin and antibacterial efficacy of resveratrol from peanut buds
Wang Na1,2,3,4, Ning Cancan1,3, Zhao Zheng1,3, Li Junwei1,3, Wang Fan1,3, Ren Hongtao1,3, Zhan Ke1,3, Yu Qiuying1,3,4※
(1.,,450002,;2.,,450002,; 3.,450002,;4.,,450002,)
Peanut sprout (longevity sprout) is one kind of favored food and therapy, due to its crisp taste and unique flavor. The energy, protein, and crude fat content of peanut buds after germination is significantly higher than that of various vegetables. There is a great increase in the content of vitamins, potassium, magnesium minerals, and various amino acids and trace elements required by the human body, especially the content of resveratrol, a polyphenol with important bioactive functions. Among them, resveratrol (chemically known as 3, 4', 5-astragalotriphenol) has the broad-spectrum antibacterial activity as the "plant antitoxin" in recent years. But, there are only a few reports on the effects of peanut bud resveratrol on. This study was focused on the isolation and purification technique of resveratrol from peanut buds, together with its antibacterial properties. The resins were screened with excellent adsorption and desorption properties for the peanut bud resveratrol compounds, in order to construct the isolation and purification process. The antibacterial efficacy was evaluated to improve the comprehensive utilization of peanut resources. A comparison was made to determine the effects of 16 types of macroporous resins on the separation and purification of arachidonic resveratrol compounds using static adsorption-desorption tests. The LSA-40 was selected as the best adsorption resin for the saturation and plateau in 110 and 90min of static adsorption, respectively. The dynamic adsorption-desorption conditions were optimized as follows. The loading concentration was 120.00g/mL, the flow rate was 1.00 mL/min, the pH value was 4.2, and theoptimum ratio of loading volume to resin was 8.00mL/g. The desorption conditions were the 80% ethanol solution, a pH value of 6.6, and a flow rate of 1.00 mL/min. Ultraviolet (UV) spectral analysis showed that the absorption peaks of the purified arachidonic resveratrol and the control were basically the same under the optimized process conditions, where the purity was calculated to be 84.0%. Fourier infrared spectroscopy and ultra-performance liquid chromatography-tandem mass spectrometry were used to identify the components of the purified samples. It was found that the main components of the purified products were resveratrol and the derivatives. The inhibition effect of the purified product onwas evaluated by multiplicative dilution, inhibition growth curve, and cell membrane permeability. The minimum inhibitory concentration of resveratrol-purified product onwas 250g/mL. In addition,treated with resveratrol purification presented a prolonged lag period and a decreased growth rate in the logarithmic phase at the MIC concentration. The cell membrane permeability significantly increased (< 0.01), according to the growth curve and the protein content of cell contents. The integrity of the cell wall was damaged causing the serious leakage of intracellular proteins, eventually leading to the death of. This finding can provide some theoretical reference for the comprehensive utilization of peanut resources in natural antibacterial agents.
adsorption;bacteriostasis; peanut sprouts; resveratrol;LSA-40 macroporous resin; mass spectrometry identification
10.11975/j.issn.1002-6819.2022.18.032
TS209
A
1002-6819(2022)-18-0293-09
王娜,宁灿灿,赵峥,等. 花生芽白藜芦醇大孔树脂纯化工艺及抑菌功效[J]. 农业工程学报,2022,38(18):293-301.doi:10.11975/j.issn.1002-6819.2022.18.032 http://www.tcsae.org
Wang Na, Ning Cancan, Zhao Zheng, et al. Purification process by macroporous resin and antibacterial efficacy of resveratrol from peanut buds [J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2022, 38(18): 293-301. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2022.18.032 http://www.tcsae.org
2022-06-25
2022-09-13
“十三五”国家重点研发计划专项(2019YFC1605700);郑州市营养与健康食品重点实验室项目(KF20190426);河南省花生产业技术体系项目(2022)
王娜,博士,副教授,研究方向为食品安全与免疫学。Email:na-wang@163.com
余秋颖,博士,讲师,研究方向为食品安全与免疫学。Email:yuqiuyingzf@163.com
