Brock模型与肺结节影像分级报告系统对亚实性肺结节良恶性鉴别能力的比较
2022-02-04曹伟云刘海芬伍世葵刘浩雷
曹伟云,刘海芬,谭 俊,伍世葵,刘浩雷
0 引 言
肺癌是我国发病率和死亡率均为首位的恶性肿瘤[1]。低剂量计算机断层扫描技术(LDCT)公认为肺癌早发现早诊断最有效的手段,能有效降低肺癌的病死率[2]。LDCT筛查出的肺结节根据密度的不同分为实性结节和亚实性结节(SPN),SPN是指CT显示边界清楚或不清楚的肺内密度增高影,但病变密度不足以掩盖其中走行的血管和支气管影;根据实性成分的有无SPN进一步分为纯磨玻璃结节(pGGN)和混合性磨玻璃结节(mGGN)。由于SPN的恶性率高于实性结节[3],因此,SPN的良恶性鉴别尤为重要。肺结节影像分级报告系统(LU-RADS)是由美国放射学会制定的用于规范CT报告书写,指导肺结节管理和随访的标准[4]。LU-RADS能有效降低肺结节的假阳性率,是临床实践中使用最为广泛的肺结节评估工具之一[5]。除了肺结节LU-RADS分类管理外,还发展出不同的肺结节恶性概率预测模型,如梅奥模型、美国退伍军人医院(VA)模型、美国Brock大学模型(Brock 模型),其中Brock模型的诊断效能较为突出[6-7]。然而,目前尚不清楚Brock模型与LU-RADS对SPN的良恶性鉴别能力,为此,本研究总结分析了我院手术切除的SPN患者的临床资料,比较两者的良恶性鉴别能力,以之提供临床借鉴。
1 资料与方法
1.1 研究对象回顾性分析2018年1月至2021年12月期间在我院行手术切除且病理证实的133例SPN患者临床资料,纳入标准为:①符合SPN定义即直径≤3 cm的局灶性、类圆形、密度增高的含有或不含有实性成分的磨玻璃肺部阴影,不伴肺不张、肺门淋巴结肿大和胸腔积液[8];②有明确的病理结果;③所有患者均签署知情同意书。排除标准:①>3 cm的肺部肿块;②资料不完整者。本研究获医院伦理委员会批准(批准号为:KY-2022071802)。
1.2 研究方法所有患者术前均常规行胸部三维CT检查,由2位放射科高年资医师分析患者影像学资料,记录结节部位、结节最大直径和结节类型,对结节是否具有毛刺征、分叶征、胸膜牵拉征、血管集束征和空泡征进行判断,确定SPN的LU-RADS分类,如遇分歧则经讨论后决定。记录患者的年龄、性别、既往史、吸烟史、家族史、临床症状和术后病理结果等情况。Brock模型通过网站www.brocku.ca/cancerpredictionresearch下载,输入相应参数计算恶性概率。
2 结 果
2.1 临床、影像学特征及病理结果133例SPN患者,年龄(52.45±12.80)岁,最小21岁,最大74岁。吸烟者16例(12.03%),既往有肿瘤病史或家族肿瘤病史者14例(10.53%)。胸部CT表现为毛刺征有48例(36.09%)、分叶征55例(41.35%)、胸膜牵拉征32例(24.06%)、血管集束征59例(44.36%)、空泡征32例(24.06%);结节类型表现为pGGN39例(29.32%),mGGN94例(70.68%);结节最大直径中位数为12.0 mm(8.98~16.20 mm);位于上叶结节的有90例(67.67%);LU-RADS2类的有42例(31.58%),3类31例(23.31%),4A和4B类各30例(22.56%)。病理结果显示良性结节41例(30.83%),恶性结节92例(69.17%);其中良性结节有:炎性病变2例(1.5%)、非典型腺瘤样增生2例(1.5%)、原位癌37例(27.82%)。恶性结节有:微浸润性腺癌29例(21.80%)、浸润性腺癌63例(47.37%)。
恶性SPN组患者的年龄、最大直径明显大于良性SPN组患者,恶性SPN组中的毛刺征、分叶征和胸膜牵拉征明显多于良性SPN组,且恶性SPN组多以mGGN为主,恶性SPN组的LU-RADS 4A和4B类明显多于良性SPN组,Brock模型的恶性概率明显大于良性SPN组(P<0.05),见表1。亚组分析显示恶性mGGN患者在年龄、结节最大直径、毛刺征、分叶征、胸膜牵拉征、Brock模型的恶性概率、LU-RADS 4A和4B类方面与良性mGGN患者有显著的差异(P<0.05),而恶性pGGN和良性pGGN患者在上述临床和影像学特征方面差异无统计学意义(P>0.05)。见表2。

表1 亚实性肺结节患者的临床及CT影像学特征
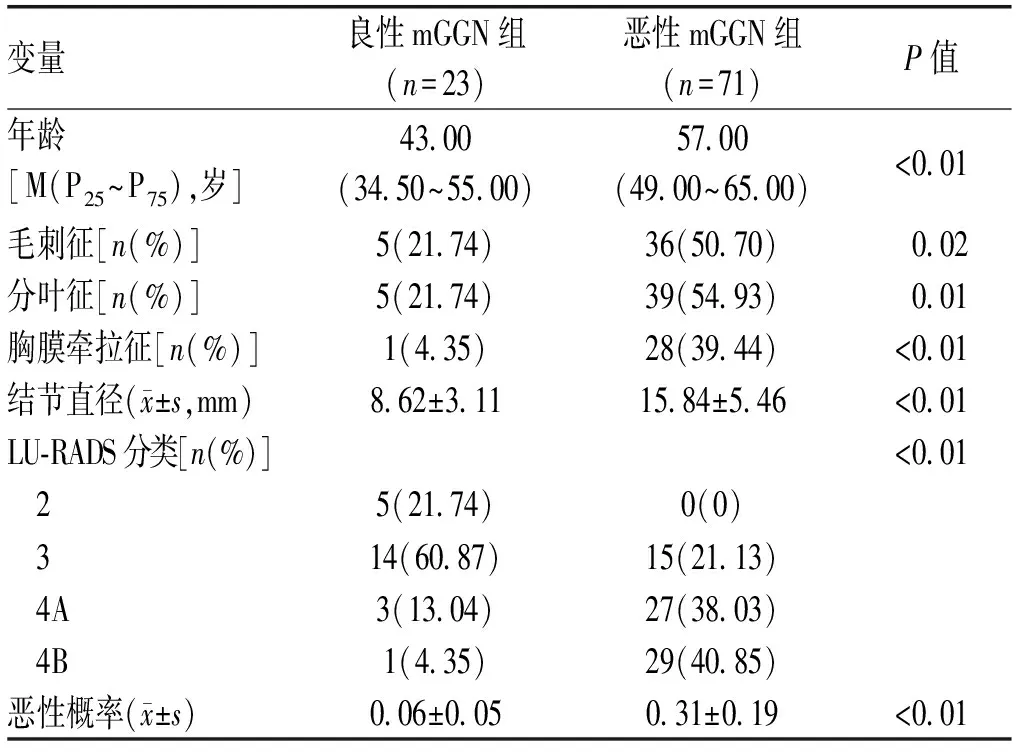
表2 混合性磨玻璃肺结节患者的临床及CT影像学特征
2.2 Brock模型与LU-RADS的相关性分析结果显示Brock模型与LU-RADS具有较好的相关性(r=0.75,P<0.01),其中LU-RADS 2类的恶性概率为(0.07±0.06),LU-RADS 3类为(0.11±0.11),LU-RADS 4A类为(0.22±0.14),LU-RADS 4B类为(0.48±0.12),见图1。

图1 不同LU-RADS亚实性肺结节的恶性概率比较
2.3 Brock模型与LU-RADS的良恶性鉴别能力比较两者鉴别SPN良恶性的能力均较高且两者差异无统计学意义(BrockvsLU-RADS,AUC±1.96 SE: 0.83±0.03vs0.78±0.04,P=0.16)。进一步亚组分析显示Brock模型与LU-RADS对pGGN的良恶性鉴别能力均较差(BrockvsLU-RADS,AUC±1.96 SE: 0.59±0.09vs0.55±0.03,P=0.66),然而Brock模型对mGGN的良恶性鉴别能力明显高于LU-RADS(BrockvsLU-RADS,AUC±1.96 SE: 0.92±0.03vs0.85±0.04,P=0.03),见图2。Brock模型对诊断恶性mGGN的敏感度、特异度、阳性似然比均高于LU-RADS,而阴性似然比则低于LU-RADS,显示Brock模型较好的诊断价值,见表3。

a:Brock模型与LU-RADS对亚实性肺结节的良恶性鉴别能力较高且差异无统计学意义;b:Brock模型与LU-RADS对纯磨玻璃结节的良恶性鉴别能力均较差;c:Brock模型对混合性磨玻璃结节的良恶性鉴别能力明显高于LU-RADS

表3 Brock模型与LU-RADS对混合性磨玻璃结节良恶性鉴别能力的比较
3 讨 论
肺结节的良恶性鉴别常常困扰着临床医师,特别是SPN在临床-影像-病理方面与实性肺结节存在明显差异,文献报道SPN的恶性概率大于实性肺结节,且SPN往往表现为“惰性”生长过程[3],故SPN的随访时间长,国内外的肺结节指南大部分推荐SPN的随访时间为5年[8-9],但有研究发现稳定5年以上的SPN仍然有恶变的可能,建议随访时间延长至10年[10]。然而,长时间的随访则会使患者陷入“复查-无变化-再次复查”的随访循环中,增加了经济成本和辐射暴露,患者心理容易焦虑不安。因此,有必要对SPN的良恶性鉴别进行单独研究。
Brock模型和LU-RADS分类是鉴别肺结节良恶性常用的简便和无创的评估方法。Brock模型是利用泛加拿大肺癌早期检测研究(Pan-Can)中的1871位受试者资料建立,并使用英国哥伦比亚癌症机构(BCCA)中1090位受试者的资料进行外部验证[6],建模参数包括年龄、性别、肿瘤家族史、肺气肿、结节直径、结节类型、上叶结节、毛刺征和结节数量。Brock模型预测效能优异,外部验证的AUC达0.905[11],即便对于直径小于10 mm的肺结节也有很好的预测能力[12]。英国胸科协会指南建议对于持续稳定存在超过3个月的亚实性结节使用Brock模型进行风险评估后再进行后续临床决策[13]。Brock模型还是首个纳入结节类型的预测模型,其结节类型包括实性结节、pGGN和mGGN并分别赋予不同分值。本研究显示恶性SPN患者的年龄、结节直径、毛刺征和mGGN结节类型明显高于良性SPN组(P<0.05),而上述均为Brock模型的参数组成,所以能解释恶性SPN的恶性概率(由Brock模型计算而来)明显高于良性SPN的恶性概率(P<0.01)。LU-RADS是影像科医师书写报告的参考标准,可作为临床医师进行肺结节分类管理和随访的评估工具[14]。LU-RADS分为4类,其中2类为良性结节可能性大,恶性概率小于1%;3类为未定性结节,恶性概率为1%~2%;4类为可疑恶性结节,4类进一步分为4A、4B和4X三个亚类,恶性概率分别为5%~15%和大于15%,其中4X的恶性概率和处理原则同4B,故本研究将4B和4X合并分析。由于LU-RADS分类的依据主要是肺结节的大小和构成,本研究结果显示恶性SPN组的结节直径和mGGN明显大于(或多于)良性SPN组,所以可以观察到恶性SPN组的LU-RADS 4A和4B类明显多于良性SPN组(56vs4,P<0.05)。本研究还通过相关性分析发现Brock模型与LU-RADS具有较好的相关性(r=0.75,P<0.01),这与两者均纳入了肺结节的大小和构成(即结节类型)有关。
最后,本研究分析了Brock模型和LU-RADS对SPN良恶性鉴别能力的比较,两者诊断效能均较高且无明显差异,但进一步亚组分析显示Brock模型和LU-RADS对mGGN的良恶性鉴别能力较高,对pGGN的鉴别能力较差,而且Brock模型对mGGN良恶性鉴别能力明显高于LU-RADS(P=0.03),表现为Brock模型对恶性mGGN诊断的敏感度、特异度、阳性似然比和阴性似然比等指标均优于LU-RADS,相似的结果见于Hammer等[15]的研究,这可能与LU-RADS只重点关注了肺结节的大小和构成,对肺结节患者的性别、年龄、吸烟史、肺气肿等风险因素未纳入评价有关[16]。值得注意的是Brock模型和LU-RADS对pGGN的良恶性鉴别能力均较差,通过比较良恶性pGGN患者的临床和影像学特征,发现良恶性pGGN患者在临床和影像学特征方面均无统计学差异,因此Brock模型和LU-RADS可能不适合对pGGN的良恶性进行鉴别,如何有效地鉴别pGGN的良恶性需要进一步研究。
综上,本研究通过比较Brock模型和LU-RADS对SPN的良恶性鉴别能力,表明Brock模型和LU-RADS对mGGN有较好的良恶性鉴别能力,而且Brock模型对mGGN的良恶性鉴别能力优于LU-RADS;但两者对pGGN的良恶性的鉴别较差,未来可考虑联合肿瘤相关的生物标志物如外周循环肿瘤细胞[17]、外泌体miRNAs[18]等以提高pGGN的良恶性鉴别能力。本研究也存在一些缺陷,比如只入组了行手术治疗且有病理结果的SPN患者,必然存在选择偏倚;还有本研究的样本量较小,需要大样本量前瞻性研究予以验证。
