表达外源蛋白的CHO-DG44细胞株的蛋白质组学研究
2022-02-04谢秋玲谭楚敏王亚玉陈子鑫熊盛
谢秋玲 谭楚敏 王亚玉 陈子鑫 熊盛
(1.暨南大学生命科学技术学院,广东 广州 510632;2.基因工程药物国家工程研究中心,广东 广州 510632)
中国仓鼠卵巢细胞(Chinese Hamster Ovary,CHO)是用于哺乳动物细胞表达的最主要的细胞系,也是目前大多数抗体药物生产的理想宿主[1-2]。据统计,市场上约70%的重组蛋白药物由CHO细胞表达。CHO细胞包含多种谱系,包括CHO-DXB11、CHO-K1、CHO-DG44和CHO-S等[3-4]。其中,CHODG44是双等位基因二氢叶酸还原酶(DHFR)敲除的一种CHO细胞类型,是用于治疗性抗体生产的稳定细胞系。
作为宿主细胞,CHO细胞是影响重组蛋白表达量高低的关键因素之一,然而CHO细胞在遗传和蛋白质组学方面的研究数据都较少。2011年,Xu等[5]对CHO-K1细胞进行了全基因组测序,采用从头基因测序和基于同源性分析的方法,发现检测到的24383个预测基因中有许多在人类、小鼠、大鼠中具有同源性,且99%参与糖基化的人类基因的同源物都存在于CHO-K1中。此外,Becker等[6]使用焦磷酸测序技术从不同培养条件下培养的多个CHO细胞系中鉴定了29000多个转录本,结果显示,超过70%的CHO转录组数据与小鼠相似,也与大鼠转录组密切相关。迄今为止进行的CHO蛋白质组学研究通常集中在CHO细胞内蛋白质组相对于重组蛋白表达水平的变化[7]。Zhu等[8]使用iTRAQ联合UPLC-MS/MS技术对宿主和转染的CHO细胞的上清液进行定量分析。但也有研究比较了重组中国仓鼠卵巢细胞(rCHO)之间的蛋白变化,如Pascoe等[9]通过比较在相同的补料分批培养条件下具有不同乳酸表达谱的两种rCHO细胞来分析蛋白质的变化。蛋白质组学应用于rCHO工程将有助于理解和改进重组蛋白生产过程,以帮助加强治疗性蛋白质的生产和开发。
笔者所在实验室有两株来源不同的DHFR缺陷性CHO-DG44细胞,CHO-DG44(A)和CHO-DG44(B)细胞株,我们发现这两株细胞在生长方面有很大差异,同时我们在这两株细胞中稳定表达了融合蛋白TNFR-Fc,发现两株细胞在重组表达蛋白方面也有很大差异。重组人Ⅱ型肿瘤坏死因子受体-Fc融合蛋白(TNFR-Fc)是通过重组DNA技术将TNF-α受体的胞外区和人免疫球蛋白Fc片段融合表达而得到的二聚体重组蛋白,是一类抗体结构的蛋白,适合在动物细胞中表达。美国辉瑞公司研发并已获得FDA批准上市的Etanercept(EnbrelTM)即为在CHO细胞中表达的TNFR-Fc融合蛋白药物[10],可以作为很好的模式蛋白对宿主细胞的性能进行研究。
本研究中,分别比较了两株细胞在生长、代谢产物生成以及TNFR-Fc蛋白表达等方面的情况,并采用同位素标记相对和绝对定量(iTRAQ)技术结合2D LC-MS/MS[11-12]对CHO-DG44(A)/TNFR-Fc和CHO-DG44(B)/TNFR-Fc细胞的蛋白进行筛选和分析,鉴定两株细胞不同时期蛋白的差异,探索影响生长、代谢和外源蛋白表达的因素,以期为CHO细胞的基因工程改造提供理论基础。
1 材料与方法
1.1 材料
两株来源不同的CHO-DG44细胞,CHO-DG44(A)和CHO-DG44(B)细胞株为笔者所在实验室保存;ProCHO5无血清培养基购自LONZA公司;乳酸、葡萄糖和血氨测定盒购自南京建成生物工程研究所;M-PER Mammalian Protein Extraction reagent购自Thermo公司;iTRAQ试剂盒购自Applied Biosystem公司。
1.2 方法
1.2.1 两株单克隆细胞株生长及代谢情况的检测
采用血球计数板测定细胞密度,台盼兰染色法测定细胞活力。利用葡萄糖测定试剂盒、乳酸测定试剂盒、血氨检测试剂盒分别检测培养液中的葡萄糖、乳酸、氨的含量。
1.2.2 重组蛋白株的构建与筛选
重组构建pIREsneo3-TNFR-Fc载体,并通过双限制性内切酶验证以及基因测序确认pIREsneo3-TNFR-Fc载体构建成功。而后分别转染至CHODG44(A)和CHO-DG44(B)细胞中,通过单克隆细胞筛选,分别选取不同宿主细胞中外源蛋白表达量最高的一株进行后续研究,依次命名为CHO-DG44(A)/TNFR-Fc、CHO-DG44(B)/TNFR-Fc细胞。
1.2.3 两株单克隆细胞株蛋白表达的比较
采用夹心ELISA的方法测定两株单克隆细胞培养上清液中TNFR-Fc融合蛋白的含量。用稀释的羊抗人IgG-Fc(1∶1 000)包被96孔酶标板。分别加入稀释后的待测样品及TNFR-Fc标准品,37℃孵育1 h。加入稀释的碱性磷酸酶标记的羊抗人IgG(1∶1000)。加入显色液,加入终止液,用酶标仪在405 nm的波长下测量OD值。通过TNFR-Fc标准品做出标准曲线,从而计算样品中TNFR-Fc融合蛋白的含量。单细胞蛋白表达量(Pe)按下式计算:
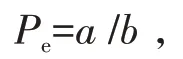
式中,a为每毫升外源蛋白表达量,b为每毫升细胞数。
1.2.4 蛋白样品制备
单克隆细胞CHO-DG44(A)/TNFR-Fc、CHODG44(B)/TNFR-Fc在TubeSpin管中培养,在稳定期(CHO-DG44(B)/TNFR-Fc细胞培养96 h,CHODG44(A)/TNFR-Fc培养120 h)时,收取细胞培养液,1 000 r/min离心5 min,弃上清液收集细胞,用PBS清洗重悬,重复离心3次。加入M-PER Mammalian Protein Extraction reagent裂解液,冰上裂解细胞30 min。混合液10 000 r/min离心10 min,取细胞裂解液的上清液。
1.2.5 iTRAQ标记定量
每份样品各取150 μg,用胰蛋白酶对2种蛋白质样品分别进行消化处理,得到不同的肽段,用iTRAQ试剂中的115、117分别标记CHO-DG44(A)/TNFR-Fc细胞蛋白、CHO-DG44(B)/TNFR-Fc细胞蛋白。将所有标记的样品混合,使用强阳离子交换液相色谱(SCX)将肽段分为多个组分,采用纳升流速HPLC液相系统Easy nLC进行再次分离,每份样品经毛细高效液相色谱分离后用QstarXL串联四极杆飞行时间质谱仪进行质谱分析。
1.2.6 差异蛋白筛选
报告置信度在95%以上的蛋白质,同时通过对115、117试剂报告离子的峰面积积分来进行相对定量分析,将每个蛋白在比较样品对(115∶117)中的比值作为差异倍数(Fold Change,FC),以FC≥1.2为条件筛选上调蛋白,以FC<1.2筛选下调蛋白,并对差异蛋白进行蛋白类型分析。
1.2.7 生物信息学分析
将筛选出的差异表达蛋白质,使用生物信息学功能注释和富集工具R包Clusterprofile(v3.14.3)以及小鼠基因数据库(org.Mm.eg.db,版本:2.1)对得到的差异蛋白进行功能富集,其中包括基因本体论(GO)和京都基因和基因组百科全书(KEGG)的功能富集。将从蛋白质的生物过程(Biological process,BP)、细胞组成(Cell Composition,CC)和分子功能(Molecular Function,MF)进行基因本体分析。所有富集统计显著性通过P值调整法benjaminihochberg计算。用R软件包ggplot2将富集结果可视化。
2 结果
2.1 两株单克隆细胞生长和重组TNFR-Fc表达的比较
在相同的培养条件下,两株细胞的活力及活细胞密度随时间的变化情况如图1(a)所示。CHODG44(B)/TNFR-Fc细胞虽然在第5天细胞活力仍在80%左右,但活细胞密度在第3天达到最高,最高密度为2.3×106个/mL,之后细胞结团,细胞密度下降。而CHO-DG44(A)/TNFR-Fc细胞株细胞密度则在第5天达到最高,为6.8×106个/mL,是CHODG44(B)/TNFR-Fc的3倍,整个培养过程结团现象不明显。
采用酶联免疫吸附试验测定的方法检测CHODG44(A)/TNFR-Fc和CHO-DG44(B)/TNFR-Fc两株细胞培养上清液中TNFR-Fc的蛋白表达量,结果如图1(b)所示,图中“****”表示与CHO-DG44(B)/TNFR-Fc细胞株相比差异极为显著(P<0.000 1)。从图中可以发现,CHO-DG44(A)/TNFR-Fc细胞株外源蛋白表达量远高于CHO-DG44(B)/TNFR-Fc。CHO-DG44(A)/TNFR-Fc细胞蛋白表达量最高可达264 μg/mL左右,而CHO-DG44(B)/TNFR-Fc细胞外源蛋白表达量较低,最高仅为10μg/mL左右。外源蛋白的表达产量随着培养时间的变化而发生改变,在培养第4天时,CHO-DG44(A)/TNFR-Fc细胞株的单细胞蛋白含量为9.12pg,而CHO-DG44(B)/TNFR-Fc细胞株的单细胞蛋白含量为0.98pg。
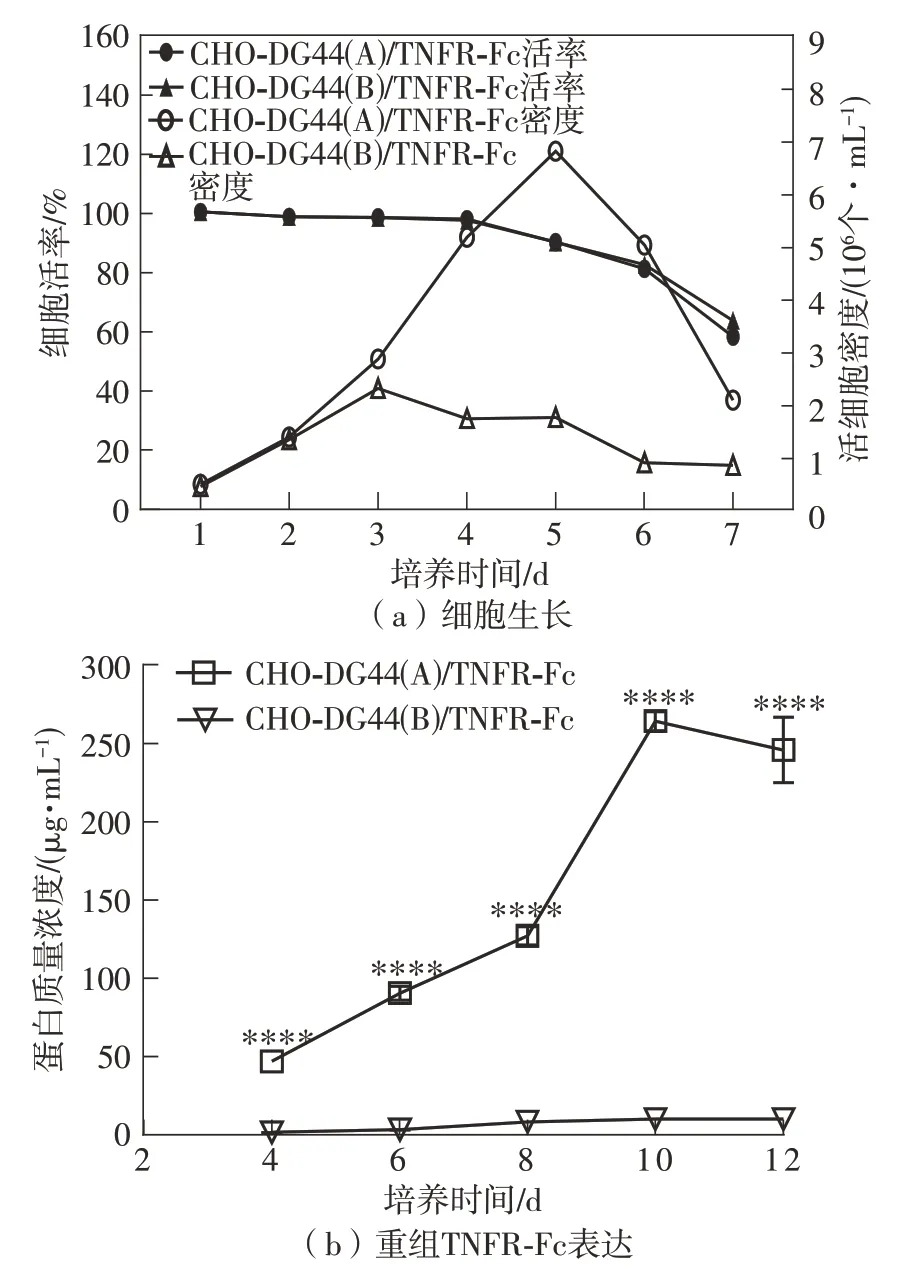
图1 两株CHO细胞生长和重组TNFR-Fc表达量的比较Fig.1 Comparison of the growth of two CHO cell lines and the expression of recombinant TNFR-Fc
2.2 两株单克隆细胞代谢的比较
通过检测CHO-DG44(A)/TNFR-FCc和CHODG44(B)/TNFR-Fc两株细胞在葡萄糖代谢和主要代谢产物乳酸和氨生成方面的情况,发现CHO-DG44(A)/TNFR-Fc细胞株葡萄糖消耗量一直高于CHO-DG44(B)/TNFR-Fc细胞株(图2(a)),CHO-DG44(A)/TNFR-Fc细胞株在发酵结束时葡萄糖的质量浓度为1.6 g/L,而CHO-DG44(B)/TNFR-Fc细胞株在发酵结束时葡萄糖的质量浓度为4 g/L,这可能是由于CHO-DG44(A)/TNFR-Fc细胞密度较高所引起的。但代谢副产物乳酸和氨 则 是CHO-DG44(B)/TNFR-Fc细 胞 高 于CHODG44(A)/TNFR-Fc细胞。在整个发酵过程中,CHO-DG44(A)/TNFR-Fc细胞株所产生的乳酸则明显少于CHO-DG44(B)/TNFR-Fc细胞,尤其是发酵中期差异更为显著(图2(b))。在氨的累积方面,两株细胞差异更为显著,在生长后期CHODG44(A)/TNFR-Fc、CHO-DG44(B)/TNFR-Fc所产生的氨的浓度分别约为4 mmol/L、2.7 mmol/L(图2(c))。其中,*表示P<0.05,***表示P<0.001,****表示P<0.000 1。
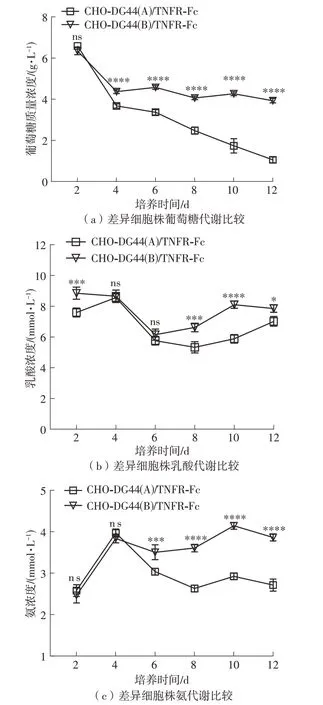
图2 两株CHO细胞代谢的比较Fig.2 Comparison of metabolism of two CHO cells
2.3 差异表达蛋白的蛋白类型分析
以CHO-DG44(B)/TNFR-Fc细胞为对照组,通过蛋白质组学比较分析,在CHO-DG44(A)/TNFR-Fc细胞的稳定期共筛选出192个差异蛋白,其中上调蛋白104个,下调蛋白88个。通过比较它们的蛋白类型发现,酶类所占的比例最多,达到38.02%,包括与代谢相关的果糖二磷酸醛缩酶A(Aldoa)、磷酸丙糖异构酶(TPI)、L-乳酸脱氢酶(Ldha)、苹果酸脱氢酶(Mdh1)、乌头酸水合酶(Aco2)等;3.65%的蛋白参与转录调节,如转录调节因子(Tcerg1)、核酸酶-敏感元件结合蛋白1(Ybx1);与翻译调节相关的蛋白占1.56%,如核糖体蛋白(Rps27)。0.52%蛋白为生长因子,如神经营养因子(Nenf)。此外,还包含G蛋白偶联受体、激酶、肽酶及运输相关蛋白等(见图3)。

图3 差异表达蛋白的蛋白类型分析Fig.3 Protein type analysis of differentially expressed proteins
2.4 差异基因GO富集分析
以CHO-DG44(B)/TNFR-Fc为对照组,运用基因本体论(GO)对CHO-DG44(A)/TNFR-Fc细胞的差异蛋白进行生物过程、细胞组成和分子功能分析,以探讨差异蛋白参与行使的功能,结果如图4。图中,纵坐标为具体的GO条目,横坐标代表富集程度;图形越大,富集到该通路的基因越多,颜色越红,差异越显著。两株细胞的差异蛋白中,参与的生物学过程主要包括碳水化合物代谢过程、谷胱甘肽代谢、细胞内蛋白质转运、蛋白质折叠、蛋白质稳定化、对氧化应激的反应等过程;在碳水化合物代谢过程、细胞内蛋白质转运、蛋白质折叠等方面的差异可能是两株细胞在乳酸累积和蛋白表达方面差异的原因。细胞组成方面,主要作用于胞质溶胶、细胞质、线粒体、细胞质核周区核、大分子复合物等等。在分子功能分类中,主要行使催化活性、相同的蛋白质结合、异构酶活性、S100蛋白结合、ATP酶活性、蛋白质结构域特异性结合等。

图4 GO功能注释及富集分析Fig.4 GO function annotation and enrichment analysis
2.5 差异基因KEGG富集分析
对筛选到的差异蛋白进行KEGG分析,探讨这些蛋白参与的生物学代谢通路及其潜在的作用,结果如图5所示。图中,纵坐标为具体的KEGG条目,横坐标代表富集程度;图形越大,富集到该通路的基因越多,颜色越红,差异越显著。从图中可以看出,差异表达蛋白涉及的信号通路主要集中在氨基酸的生物合成、代谢途径、碳代谢、糖酵解/糖异生、柠檬酸循环和丙酮酸代谢等。其中,氨基酸合成涉及到细胞生长和蛋白质的合成,而其他几条途径则涉及到能量代谢。
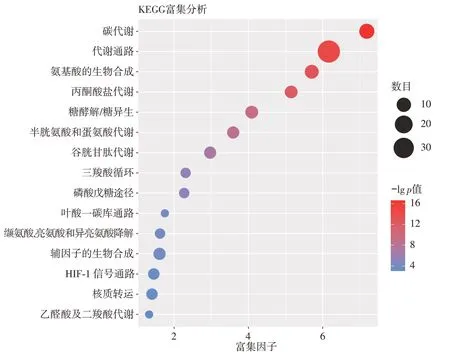
图5 KEGG富集分析Fig.5 KEGG enrichment analysis
3 讨论
CHO细胞由于其独特的特性,已成为重组蛋白治疗剂工业生产中最常用的宿主细胞[13],但不同的CHO细胞株性能相差很大。2011年,包括中国在内的多国科学家共同合作收集世界各地的CHO-K1的细胞株进行全基因测序,发现经过长时间的传代培养,细胞有大量的基因重排,从而细胞株之间也有差异[5]。笔者所在课题组保存有两株不同来源的CHO-DG44细胞,在实验过程中发现,两株细胞不仅生长、代谢存在差异,而且重组表达外源蛋白也有显著差异。
在相同培养条件下,CHO-DG44(B)/TNFR-Fc细胞株最高细胞密度只有CHO-DG44(A)/TNFR-Fc细胞株最高细胞密度的30%左右,而且活力下降迅速,细胞培养周期短,并伴有严重的细胞结团现象。这表明两株细胞除了在自身生长活力方面存在差异外,可能在细胞凋亡方面也有所不同[14-15]。CHO-DG44(A)/TNFR-Fc对葡萄糖的利用率显著高于CHO-DG44(B)/TNFR-Fc细胞,而CHO-DG44(A)/TNFR-Fc产生代谢副产物乳酸和氨的量却远远低于CHO-DG44(B)/TNFR-Fc。目前代谢副产物,尤其是乳酸的累积会对细胞的生长产生抑制作用已是共识[16],其在细胞生长过程中的不断积累能够导致渗透压的增高及培养基酸化[17],这也从某种角度解释了CHO-DG44(B)/TNFR-Fc的细胞密度为什么低于CHO-DG44(A)/TNFR-Fc的细胞密度。
细胞在生长、代谢等方面的差异也反映出两株细胞在磷酸戊糖途径、糖酵解和三羧酸循环等能量代谢方面可能存在显著差异[18],对两株CHO-DG44细胞蛋白的蛋白质组学分析也印证了这一点。研究发现两株CHO-DG44细胞中参与碳代谢、糖酵解/糖异生、三羧酸循环、丙酮酸代谢等代谢通路的蛋白质差异显著,这些代谢过程在氨基酸的生物合成及乳酸代谢中起重要的调节作用。本研究中,参与糖代谢途径的果糖二磷酸醛缩酶A(Aldoa)、丙糖磷酸异构酶(Tpi1)、丙酮酸激酶(PKM)等多个蛋白在CHO-DG44(A)/TNFR-Fc中表达上调。这些都是碳代谢途径、氨基酸的生物合成通路中重要的酶,其中PKM是EMP途径中一个重要的变构酶,可催化磷酸烯醇丙酮酸不可逆地转化成丙酮酸。这些蛋白的表达上调,可能通过影响糖酵解/糖异生、TCA循环等代谢途径,从而影响相关的生物合成、糖的代谢以及能量的产生[19]。蛋白质的形成及功能与氨基酸的缩合和肽的自组装有关,组成蛋白质的大部分氨基酸是以糖酵解途径与柠檬酸循环的中间产物为碳链骨架生物合成的[20],因而代谢的差异也会影响到蛋白质的合成。
在CHO细胞大规模培养中发现,乳酸的累积量与外源蛋白质表达量成负相关的关系。当葡萄糖过量时,代谢途径会从丙酮酸经乳酸脱氢酶(LDH)还原产生乳酸[21-22],但当葡萄糖消耗后,乳酸会作为碳源被细胞所消耗。乳酸脱氢酶(LDH)在CHODG44(A)/TNFR-Fc细胞具有高表达,该酶可以催化丙酮酸和乳酸的转变,而且这一过程是可逆的。通过检测两株细胞在培养的12 d中重组外源蛋白TNFR-Fc的表达情况,发现乳酸的累积量与外源蛋白质表达量呈负相关的关系,CHO-DG44(A)/TNFRFc细胞的蛋白表达量均高于CHO-DG44(B)/TNFRFc细胞株。虽然产生这一现象的具体机制尚不清楚,也从一定程度说明了细胞的代谢与蛋白质的合成有一定的关系。
外源蛋白的表达产量随着培养时间的变化而发生改变,两株细胞在外源蛋白表达量上的差异,可能是由于蛋白合成、蛋白折叠及蛋白分泌等相关功能的不同而引起的。在CHO-DG44(A)/TNFR-Fc细胞中,我们发现某些与蛋白质折叠和稳定相关的蛋白,如热休克蛋白90a(Hsp90aa1)、肽基脯氨酰顺反异构酶-3的异构体1(Ppil3)表达上调,这将有助于蛋白质从无规则卷曲折叠成特定的功能性三维结构。但与此同时,微管蛋白特异性伴侣A(Tbca)、蛋白质二硫键异构酶A4(Pdia4)、GrpE蛋白同源物1(Grpel1)存在不同程度的下调,这会不会影响大量合成的重组蛋白的正确组装,从而影响到重组蛋白质的活性是需要进一步研究的课题。
4 结论
在两株CHO-DG44细胞中存在192种差异表达基因,这些差异表达基因主要富集在包括蛋白质折叠、谷胱甘肽代谢过程、碳水化合物代谢过程、细胞内蛋白质转运等生物过程,主要涉及氨基酸的生物合成、碳代谢、糖酵解/糖异生、三羧酸循环等信号通路。不同CHO细胞株在氨基酸的生物合成、碳代谢、糖酵解/糖异生等方面的蛋白差异,可能是引起两株细胞生长代谢以及外源蛋白TNFR-Fc表达方面的差异的原因。
