Let⁃7b靶向抑制树突状细胞Bach1通过激活HO⁃1调控肠黏膜的损伤修复
2022-02-03田元元覃晓日田阁符雪婷孙晓宁
田元元 覃晓日 田阁 符雪婷 孙晓宁
1海南省人民医院(海南医学院附属海南医院)消化内科(海口 570311);3海南医学院第二附属医院(海口 570216);2北京市先农坛体育运动技术学校科研科(北京 100050);4海南医学院(海口 571199)
炎症性肠病(inflammatory bowel diseases,IBD)是一种由潜在的免疫失调诱导的特发性、慢性、复发性炎症状态,包括两种主要的临床形式:溃疡性结肠炎(ulcerative colitis,UC)和克罗恩病(Crohn′s disease,CD)[1-2]。IBD已成为一种全球性疾病,其发病率不断增加,目前影响着北美、欧洲、南美、中东和亚洲越来越多的人群[1-3]。尽管已建立了标准的治疗方法,例如抗肿瘤坏死因子抗体治疗[3-4],但目前尚未完全明确导致IBD的潜在因素和机制。仍需要进一步的科学实验研究来探索IBD发展机制,从而为IBD的新疗法和药物靶点提供新的视角。
血红素加氧酶 1(heme oxygenase⁃1,HO⁃1)是一种抗氧化反应元件依赖性基因,具有抗氧化和抗炎功能[5-6]。HO⁃1的转录被则被另一种关键转录因子TB和CNC同源性1(TB and CNC homology 1,Bach1)通过结合前者增强子中多个Maf识别元件所抑制[7]。而且,HO⁃1的表达则需要 Bach1失活或被抑制[8]。但Bach1是如何失活的仍不清楚。以前的研究报道,在IBD条件下,HO⁃1水平上调[5]。已知树突状细胞(dendritic cells,DCs)是最重要的抗原提呈细胞。其在固有免疫和获得性免疫应答的调节中都起到重要作用,能够介导IBD炎症反应或者参与免疫耐受,而且Bach1/HO⁃1通路能够密切调控 DCs[9]。然而,在 DCs中的 Bach1和HO⁃1如何参与调控IBD并不清楚。
微小RNA(microRNA,miRNA)是一类高度保守的小单链RNA,其长度通常在21~25个核苷酸之间。众所周知,miRNA通过使用种子序列靶向mRNA的 3′非翻译区(3′⁃UTR)来抑制基因表达,最终导致靶向mRNA的降解或靶向蛋白质的抑制[10-11]。因此,miRNAs在转录或转录后水平调节基因表达中起关键作用[12]。不仅如此,miRNA还广泛参与多种生理和病理过程[13]。miRNA的失调导致包括IBD在内的多种疾病的发展和进展[14]。Let⁃7 miRNA家族是最早在秀丽隐杆线虫中发现的两个miRNA之一,是第一个已知的人类miR⁃NA,由 Let⁃7a、b、c、d、e、f、g、i和 miR⁃98 miRNA 组成。Let⁃7家族已被发现可在人类肠道发育和肠癌、肠炎中发挥重要作用[15]。而且最新研究显示Let⁃7b在CD中参与调控了巨噬细胞的免疫功能并抑制了炎症[16]。由于Let⁃7、HO⁃1、Bach1在IBD发病机制中均扮演关键角色,因此,本研究旨在观察DSS诱导的IBD小鼠模型中HO⁃1和Bach1的表达,随后利用生物信息学筛选了抗炎miRNA Let⁃7b作为DCs细胞中调控Bach1的关键上游基因。探讨Let⁃7b是否介导DCs中Bach1的失活来促进HO⁃1表达,是否对结肠黏膜上皮细胞的损伤修复发挥作用。
1 材料与方法
1.1 材料小鼠DCs细胞DC2.4购于长沙丰晖生物。小鼠结肠黏膜上皮细胞MCEC购于上海青旗生物技术有限公司。C57BL/6小鼠购自海南药物研究所有限责任公司。胎牛血清(FBS)购于美国Gibco公司。DMEM培养基购于美国Invitrogen公司。Trizol试剂购于美国Sigma公司。TaqMan miRNA探针购于美国Applied Biosystems公司。SYBR Green染料购于美国Ambion公司。ChamQ SYBR qPCR Master Mix购于中国Vazyme公司。盐酸表小檗碱(Epiber⁃berine Chloride,EC)和锌原卟啉(zinc protoporphy⁃rin,ZnPP)购于美国sigma公司。PMSF和RIPA裂解缓冲液购于上海Beyotime公司。购于BCA蛋白质测定试剂盒购于美国Thermo Scientific公司。pMIR⁃report荧光素酶载体购自美国Ambion公司。EdU原位细胞增殖试剂盒购于美国RiboBio公司。Let⁃7b拟似物、Let⁃7b拟似物阴性对照、Let⁃7b 抑制剂、Let⁃7b抑制剂阴性对照购于上海吉玛公司。苏木素⁃伊红(HE)染色试剂盒购于上海碧云天生物技术有限公司。萤光素酶测定试剂盒购于美国Promega Madison公司。
1.2 方法
1.2.1 葡聚糖硫酸钠诱导的结肠炎小鼠模型和病理分析所有用于实验的12只6周龄C57BL/6小鼠均在无特定病原体条件下饲养,小鼠进行自由摄入啮齿类动物食物并自由取水,本研究中动物实验均经我院伦理委员会审批通过。为建立结肠炎小鼠模型,用随机数字表法将12只C57BL/6小鼠随机分为正常组和模型组2组,每组6只。模型组的干预方法是在小鼠的饮用水中加入了3%葡聚糖硫酸钠(dextran sulfate sodium,DSS),小鼠自由饮水和摄食,持续饮水7 d。给予正常组小鼠正常饮水(饮水中不加入任何药物),持续7 d。在整个造模期间每天监测模型组和正常组小鼠的体重。疾病活动度(disease activity index,DAI)评分按照DAI=体质量下降分数+大便性状分数+便血情况分数)/3进行计算。
实验结束后处死小鼠。收集这2组肠道组织,即选取模型组中清洁后的病变明显的新鲜肠组织约1.0 cm,正常组则按照模型组取样位置取同节段的新鲜肠组织1.0 cm。2组中剪0.5 cm组织用于 Let⁃7b的表达分析和Bach1及 HO⁃1蛋白表达的分析。其余肠组织置于4%甲醛溶液中固定,然后进行石蜡包埋及切片,最后根据HE染色试剂盒提供的说明进行结肠组织HE染色分析其病理情况。组织病理学评分=上皮损伤+损伤程度。
1.2.2 小鼠DCs细胞的培养、瞬时转染以及蛋白抑制剂处理37℃温度下,在含5% CO2的湿润空气环境中将DC2.4细胞培养于补充有10%FBS的DMEM培养基,并同时添加青霉素(100 U/mL)和链霉素。细胞培养1~2 d更换新鲜培养基,3 d传代1次,DC2.4细胞生长至对数生长期用于Bach1强效抑制药盐酸表小檗碱(epiberberine chloride,EC)、HO⁃1特异性抑制剂锌原卟啉(zinc protopor⁃phyrin,ZnPP)的干预,以及 Let⁃7b 拟似物或 Let⁃7b抑制剂的瞬时转染。
将DC2.4细胞共分为Ⅰ组、Ⅱ组、Ⅲ组、Ⅳ组、Ⅴ组、Ⅵ组、Ⅶ组,共7组:(Ⅰ)空白对照组(细胞不进行任何药物干预);(Ⅱ)Let⁃7b拟似物阴性对照组(用Lipofectamine 2000试剂,将2 nmol/L的Let⁃7b拟似物阴性对照序列转染细胞24 h);(Ⅲ)Let⁃7b拟似物转染组(用Lipofectamine 2000试剂,将2 nmol/L的Let⁃7b拟似物转染细胞24 h);(Ⅳ)Let⁃7b抑制剂阴性对照组(用Lipofectamine 2000试剂,将2 nmol/L的Let⁃7b抑制剂阴性对照序列转染细胞24 h);(Ⅴ)Let⁃7b抑制剂转染组(用 Lipofect⁃amine 2000试剂,将 2 nmol/L 的 Let⁃7b抑制剂转染细胞24 h);(Ⅵ)Let⁃7b抑制剂联合EC干预组(将2 nmol/L的 Let⁃7b抑制剂序列和 20 μg的 EC联合处理DCs 24 h);(Ⅶ)Let⁃7b抑制剂、EC、ZnPP三种药物共处理干预组(将2 nmol/L的Let⁃7b抑制剂序列、20 μmol/L 的 EC、6 μmol/L 的 ZnPP 联合处理DCs 24 h)。细胞干预结束,收集各组DCs和培养物上清液用于实验研究。
1.2.3 RNA分离和定量RT⁃PCR(qRT⁃PCR)用Trizol试剂分离1.2.1中留取的肠组织中的总RNA以及1.2.2中各组DC2.4细胞及细胞培养物上清液中的总RNA。使用SYBR Green以及特异性引物定量各组肠组织和各组DC2.4细胞中的Let⁃7b,并定量DC2.4细胞培养物上清液中的Bach1和HO⁃1 mRNA。使用ChamQ SYBR qPCR Master Mix进行逆转录PCR和定量RT⁃PCR(qRT⁃PCR)。在qRT⁃PCR反应后,循环阈值(CT)数据被标准化,miRNA的内参基因为U6和,mRNA的内参基因为GAPDH。计算公式包括:△△CT=(CT miRNA-CT U6)观察组-(CT miRNA-CT U6)对照组;△△CT=(CT mRNA-CT GAPDH)观察组-(CT mRNA-CT GAPDH)对照组,引物序列见表1。

表1 引物序列Tab.1 Primer sequences
1.2.4 蛋白提取和蛋白免疫印迹(Western blot,WB)使用补充有苯甲基磺酰氟(phenylmethane⁃sulfonyl fluoride,PMSF)的RIPA裂解缓冲液提取1.2.1中留取的肠组织中的总蛋白以及1.2.2中各组DC2.4细胞培养物上清液中的总蛋白,所有组的蛋白浓度使用BCA蛋白质测定试剂盒进行定量。通过十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodi⁃um dodecyl sulfate polyacrylamide gel electrophoresis,SDS⁃PAGE)分离蛋白,通过湿转法将电泳胶上的蛋白转印至聚偏氟乙烯膜上,膜在含5%脱脂奶粉和0.1%吐温⁃20的PBS中封闭,然后与一抗在4℃孵育过夜。一抗稀释倍数和抗体信息如下:Bach1(ab49657,1∶1 000,abcam),HO⁃1(#43966S,1∶1 000,Cell Signaling Technology),磷酸甘油醛脱氢酶(glyceraldehyde⁃phosphate dehydrogenase,GA⁃PDH)(sc⁃25778,1∶1 000,Santa Cruz Biotechnology)。然后将膜与IgG二抗(稀释1∶10 000)孵育1 h。用柯达1DV3.6计算机成像系统进行各条带的相对灰度值测定,内参蛋白为GAPDH。
1.2.5 萤光素酶基因报告实验pMIR⁃report荧光素酶载体购自Ambion。将含有Let⁃7b结合位点的Bach1 3⁃′UTR并克隆到pMIR⁃report荧光素酶载体中以构建野生型(WT)萤光素酶质粒。转染萤光素酶报告质粒的DC2.4细胞分别与Let⁃7b拟似物或Let⁃7b抑制剂共转染。然后使用萤光素酶测定试剂盒测定荧光强度。
1.2.6 Edu法检测小鼠结肠黏膜上皮细胞的增殖利用48孔培养板观察MCEC细胞的增殖。48孔板中首先分别加入1.2.2中Ⅰ组、Ⅱ组、Ⅲ组、Ⅳ组、Ⅴ组、Ⅵ组、Ⅶ组的DC2.4细胞的培养物上清液各150 μL,随后接种100 μL含2 × 105/mL对数生长期的MCEC细胞,培养基为含10% FBS的DMEM。以观察不同处理的DCs的培养液对MCEC细胞增殖的影响。培养体系置于温度为37℃含5% CO2的湿润培养箱中,培养24 h。随后去掉原培养基,将各组处理好的MCEC细胞按照试剂盒说明加入到EdU原位细胞增殖试剂中孵育2 h,按照方案说明,用荧光显微镜捕捉细胞的核,并测定Edu阳性细胞的比例。
1.2.7 小鼠结肠黏膜上皮细胞的伤口愈合试验利用48孔培养板观察MCEC细胞的增殖。48孔板中首先分别加入1.2.2中Ⅰ组、Ⅱ组、Ⅲ组、Ⅳ组、Ⅴ组、Ⅵ组、Ⅶ组的DC2.4细胞的培养物上清液各150 μL,随后接种100 μL含2 × 105/mL对数生长期的MCEC细胞,培养基为含10% FBS的DMEM。培养体系置于温度为37℃含5% CO2的湿润培养箱中,在培养6 h时在每个孔的中轴线上划痕,并在划痕后0 h和24 h拍摄后计算划痕的宽度和伤口愈合率。
1.3 统计学分析本研究数据使用()表示。用SPSS软件统计本研究中各组数据的分布和差异显著性。初步分析的结果为正态分布。正常组和模型组2组中基因表达差异的分析使用t检验。Ⅰ~Ⅶ组的细胞实验数据之间的差异使用单因素方差分析,存在差异后的两两比较采用LSD⁃t检验。P<0.05为差异有统计学意义。实验至少重复3个批次,均得到一致的结果。所有实验包括每个处理组至少3个重复的样本。
2 结果
2.1 Bach1和HO⁃1在IBD结肠炎炎症组织中的表达通过给予小鼠3%DSS 7 d构建了结肠炎小鼠模型,使用WB法检测模型组和正常组中Bach1和HO⁃1的表达情况。结果,与正常组的肠组织相比,模型组中的Bach1显著下调,而HO⁃1的表达明显增加,差异均有统计学意义(P<0.05),见图1A⁃C。

图1 DSS诱导的结肠炎小鼠炎症组织中Bach1和HO⁃1的表达Fig.1 Expression of Bach1 and HO⁃1 in the inflammatory tissue of DSS⁃induced colitis mice
以DAI评分、HE染色、组织病理学评分综合判断小鼠IBD结肠炎模型是否建立成功。首先大体观测发现正常组小鼠的状态活跃且健康,体质量未见减轻。而模型组所有小鼠欠活跃,体质量持续减轻,而且给予3%DSS 3 d小鼠均出现肉眼便血和大便不成形现象,DSS 7 d模型组所有小鼠均出现无粪质排便,而仅有鲜血。另外,正常组DAI评分7 d内不高于1分。而模型组2~7 d DAI的评分依次达到(1.52±0.15)、(2.11±0.32)、(2.48 ± 0.22)、(2.72 ± 0.44)、(3.16 ± 0.30)、(3.73±0.17)。正常组和模型组的结肠组织的HE染色图片在光镜下对比明显,正常组未见炎症浸润的细胞,且组织结构完好,上皮形态致密。模型组则出现黏膜水肿、免疫细胞浸润、隐窝扭曲且隐窝显著减少,组织结构破坏严重。而且模型组的组织病理学评分达到(8.48±0.57),正常组为(0.76±0.06)。表明DSS成功诱导IBD结肠炎小鼠模型,造模成功率100%,DSS诱导7 d内小鼠病死率为0%。见图1D-E。
2.2 DCs中过表达Let⁃7b抑制Bach1并促进HO⁃1分泌DCs中过表达或沉默Let⁃7b后对细胞培养物上清液中Bach1表达的影响。结果显示Let⁃7b过表达明显抑制DCs培养物上清液中Bach1蛋白表达水平,而Let⁃7b沉默促进Bach1表达,差异有统计学意义(P<0.05)。Let⁃7b过表达明显促进了细胞培养物上清液中HO⁃1的表达而沉默则抑制了细胞培养物上清液中HO⁃1的表达,差异有统计学意义(P<0.05),见图2A⁃C。还检测了结肠炎小鼠肠组织中Let⁃7b的表达水平,与正常组(1.00±0.06)比,模型组(4.26 ± 0.39)Let⁃7b的表达增加,差异有统计学意义(P<0.05)。应用Pearson相关分析来研究Bach1和HO⁃1与Let⁃7b之间的关系。如图所示,结肠炎小鼠中Let⁃7b的表达与Bach1呈负相关,而 Let⁃7b与 HO⁃1呈正相关,差异均有统计学意义(P<0.05),见图2D-E。
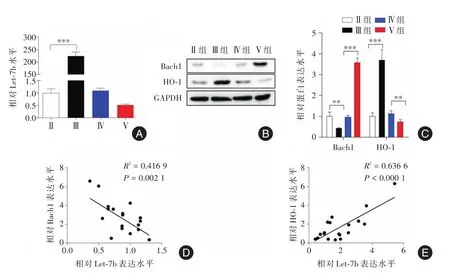
图2 Let⁃7b对DCs培养物上清液中Bach1和HO⁃1表达的影响Fig.2 Effect of Let⁃7b on Bach1 and HO⁃1 expression in DCs culture supernatant
2.3 Let⁃7b通过直接与Bach1的3′⁃UTR结合通过生物信息学方法分析出Let⁃7b潜在的靶基因基因为Bach1。因此,在这部分进一步研究了Bach1是否被Let⁃7b靶向负调控。生物信息学分析揭示了Let⁃7b和 Bach1的 3′⁃UTR 处的潜在结合位点。为证明 Let⁃7b 在 Bach1 3′⁃UTR 处的直接结合,在DC2.4细胞过表达(Let⁃7的模拟物)和抑制Let⁃7的条件下进行了荧光素酶报告基因测定。发现荧光素酶活性是受Let⁃7过表达的负调控,受Let⁃7抑制的正调控。结果表明,Let⁃7b过表达时荧光素酶活性显著降低,而Let⁃7b沉默组的荧光强度明显增强,见图3。
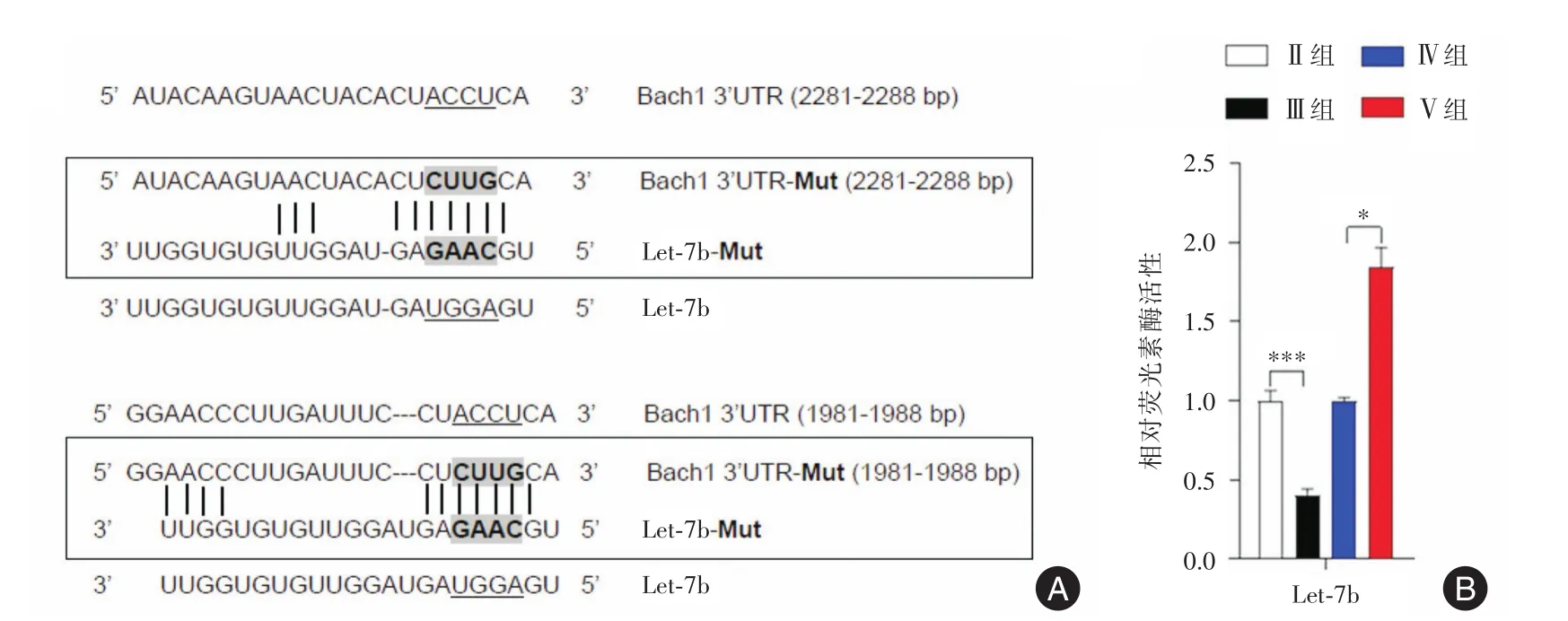
图3 Let⁃7b与Bach1的3′⁃UTR直接结合Fig.3 Direct binding of Let⁃7b to the 3′⁃UTR of Bach1
2.4 Let⁃7b通过抑制Bach1并促进HO⁃1分泌增加结肠黏膜上皮细胞的增殖和伤口愈合见图4和表2,DCs中过表达Let⁃7b显著抑制培养物上清液中Bach1的mRNA水平,并提高了培养物上清液HO⁃1 mRNA水平和结肠黏膜上皮细胞的Edu阳性率(P< 0.05),当沉默Let⁃7b时培养物上清液中Bach1的mRNA水平增加(P<0.05),而结肠黏膜上皮细胞的Edu阳性率明显降低(P<0.05)。另外,根据实验结果,沉默Let⁃7b可促进靶基因Bach1的表达,而在此基础上抑制Bach1则可大幅度恢复结肠黏膜上皮细胞的Edu阳性率(P<0.05),而继续加入HO⁃1抑制剂则Edu阳性率又降低(P<0.05),而研究结果还显示,HO⁃1抑制剂明显抑制了HO⁃1 mRNA(P<0.05),而Bach1的mRNA水平不受HO⁃1抑制剂的影响(P>0.05)。

图4 Let⁃7b体外抑制Bach1调控HO⁃1的分泌促进结肠黏膜上皮细胞的增殖Fig.4 Let⁃7b inhibits Bach1 and regulates HO⁃1 secretion to promote proliferation of colonic mucosal epithelial cells in vitro
表2 Let⁃7b抑制Bach1的分泌从而促进HO⁃1分泌增加MCEC细胞的Edu阳性率Tab.2 Let⁃7b inhibited Bach1 secretion and promoted HO⁃1 secretion to increase Edu positive rate of MCEC cells±s
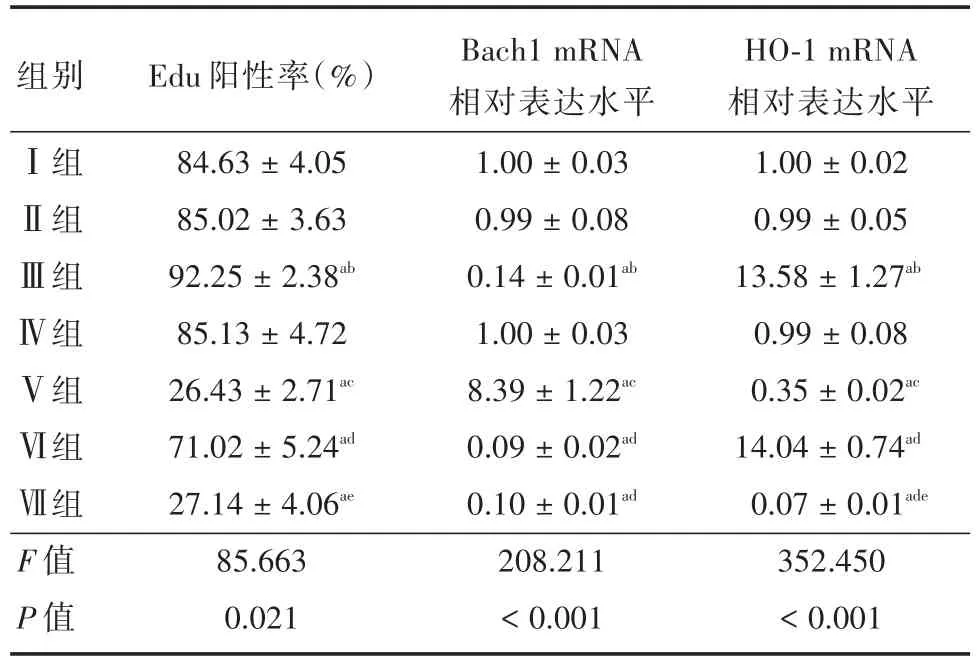
表2 Let⁃7b抑制Bach1的分泌从而促进HO⁃1分泌增加MCEC细胞的Edu阳性率Tab.2 Let⁃7b inhibited Bach1 secretion and promoted HO⁃1 secretion to increase Edu positive rate of MCEC cells±s
注:与Ⅰ组比,aP <0.05;与Ⅱ组比,bP <0.05;与Ⅳ组比,cP <0.05;与Ⅴ组比,dP <0.05;与Ⅵ组比,eP <0.05
组别Ⅰ组Ⅱ组Ⅲ组Ⅳ组Ⅴ组Ⅵ组Ⅶ组F值P值Edu阳性率(%)84.63±4.05 85.02±3.63 92.25±2.38ab 85.13±4.72 26.43±2.71ac 71.02±5.24ad 27.14±4.06ae 85.663 0.021 Bach1 mRNA相对表达水平1.00±0.03 0.99±0.08 0.14±0.01ab 1.00±0.03 8.39±1.22ac 0.09±0.02ad 0.10±0.01ad 208.211<0.001 HO⁃1 mRNA相对表达水平1.00±0.02 0.99±0.05 13.58±1.27ab 0.99±0.08 0.35±0.02ac 14.04±0.74ad 0.07±0.01ade 352.450<0.001
进一步研究DCs中 Let⁃7b调控Bach1 和 HO⁃1在培养物上清液中的表达从而对结肠黏膜上皮细胞伤口愈合率的影响。结果如图5显示,Let⁃7b过表达提高结肠黏膜上皮细胞伤口愈合率,而当沉默Let⁃7b时结肠黏膜上皮细胞的伤口愈合率明显降低,差异均有统计学意义(P<0.05)。另外,根据实验结果,与单独沉默 Let⁃7b组比,沉默Let⁃7b联合Bach1抑制剂则可明显恢复伤口愈合,差异有统计学意义(P<0.05),而继续加入HO⁃1抑制剂伤口愈合率则被抑制(P<0.05),表明,Bach1是Let⁃7b调控结肠黏膜上皮细胞增殖和伤口愈合的直接调控靶点,HO⁃1是 Let⁃7b/Bach1轴调控结肠黏膜上皮细胞增殖和伤口愈合的下游靶点。

图5 Let⁃7b抑制Bach1从而调控HO⁃1的分泌促进结肠黏膜上皮细胞的伤口愈合Fig.5 Let⁃7b inhibits Bach1 and regulates HO⁃1 secretion to promote wound healing in colonic mucosal epithelial cells
3 讨论
本研究中,观察了DSS诱导的IBD小鼠模型中HO⁃1和Bach1的表达。利用生物信息学筛选出一种靶向Bach1的关键抗炎miRNA Let⁃7b。为研究Let⁃7b簇对HO⁃1的潜在调节作用,综合使用荧光素酶报告基因检测、基因表达检测、沉默和过表达目标miRNA等策略结合蛋白免疫印迹实验和细胞增殖和伤口愈合实验。最终证实Let⁃7b恰好通过与Bach1的3′⁃UTR的结合来抑制Bach1的表达。在体外进一步证实Let⁃7b/Bach1/HO⁃1这一条潜在调控轴。最后使用DCs培养物上清液和结肠黏膜上皮细胞共培养,经过Edu细胞增殖实验和细胞伤口愈合实验得出,Let⁃7b在结肠黏膜上皮细胞增殖和损伤修复中的保护作用。总之,本研究揭示Let⁃7b/Bach1/HO⁃1轴的差异表达在保护肠黏膜炎症不受损伤中起到重要作用,并为IBD治疗提供了潜在的治疗靶点。
IBD是一种与强烈氧化应激损伤相关的自身免疫性疾病[17]。由肠上皮屏障驱动的肠黏膜免疫失衡可能是IBD的病因之一。IBD的主要免疫调控角色是DCs、中性粒细胞、淋巴细胞、单核细胞和巨噬细胞。其中DCs是免疫系统中最有效的抗原呈现细胞,然而DCs在IBD条件下是如何发挥作用,以及受何种机制调控并不十分明确。已知DCs在IBD黏膜中会表现出显示促炎特性,从而推动IBD疾病进展[18]。另外,HO⁃1已被证实可以抑制DCs的成熟和促炎功能,Bach1可以抑制该功能[19-21],暗示DCs在IBD中很可能也通过Bach1/HO⁃1轴发挥促炎和免疫调控功能。本研究中证实了IBD中Bach1的蛋白表达明显升高,而HO⁃1的表达水平降低,而且在DCs中发现了一个新的机制即Let⁃7b可以靶向Bach1,导致DCs培养物上清液中Bach1的表达被抑制,反而促进了DCs培养物上清液中HO⁃1的表达。已知在IBD模型中,通过激活DCs促进炎症因子表达,而姜黄素可以通过抑制DCs活性来改善实验性肠炎的炎症[22]。作为响应氧化应激的细胞保护程序的主要调节剂,通过激活HO⁃1等细胞保护酶对结肠炎具有显著的保护作用[23]。研究表明,HO⁃1在结肠炎的活动性炎症结肠中显著升高,并保护肠黏膜屏障免受炎症损伤和氧化应激,而且降低小鼠HO⁃1的水平可以增加对结肠炎相关结直肠癌的易感性[8,24]。然而,在炎症过程中调节的机制仍然难以捉摸。正如本研究前言部分提到的,HO⁃1激活需要Bach1的失活[8]。因此目前需要阐明Bach1失活的原因。
miRNA是一类重要的转录后水平的基因表达调控因子,主要通过翻译调控和mRNA的失稳发挥作用。在哺乳动物中,miRNAs被预测调节超过60%的蛋白编码基因。Bach1是HO⁃1基因表达的重要抑制因子,而且 Bach1 的 3′⁃UTR(3313 nt)较长,这为推测miRNA结合提供了更大的机会。本研究中利用双荧光素酶基因报告实验证明了Let⁃7b与Bach1的3′⁃UTR的多个碱基结合,并在转录后水平直接抑制Bach1 mRNA和蛋白分泌到细胞外,随后缓解Bach1介导的HO⁃1抑制。另一方面,在Let⁃7b诱导Bach1表达减少的前提下,可以直接刺激HO⁃1的启动子启动HO⁃1转录[8]。通过这两种功能途径,Let⁃7b/Bach1/HO⁃1 调节轴则极大增强了IBD炎症过程中HO⁃1的表达水平。Let⁃7b过表达后的DCs培养物上清液可提高结肠黏膜上皮细胞的增殖活性和细胞伤口愈合,这归功于Let⁃7b过表达抑制Bach1的分泌从而导致HO⁃1分泌增加或者大幅度激活。因为与Let⁃7b抑制剂单独处理组比,Let⁃7b抑制剂联合Bach1抑制剂共处理DCs后的培养物上清液能增强MCEC的增殖活性和伤口愈合能力,但 Let⁃7b、Bach1、HO⁃1三者抑制剂共处理DCs后的细胞培养物上清液则抑制了结肠黏膜上皮细胞的增殖活性并减弱了细胞伤口愈合能力。另外,还观察到DCs细胞培养物上清液中Bach1水平不受HO⁃1抑制剂影响,但是Bach1抑制剂可以明显促进DCs细胞培养物上清液中HO⁃1的水平。这进一步证实,HO⁃1是Let⁃7b/Bach1轴调控结肠黏膜上皮细胞增殖和伤口愈合的关键下游靶点,Let⁃7b则是Bach1表达减少的直接上游调控靶点。
然而,这项研究仍存在一些局限性。例如,考虑到实验操作的可行性,只通过体外实验开展DCs细胞培养物上清液对MCEC细胞增殖和伤口愈合实验来验证预测的结果,而没有涉及动物体内的机制探讨。在IBD的过程中,炎症破坏了黏膜屏障,肠腔内的DCs等递送抗原激活免疫细胞,进一步加剧了黏膜屏障的破坏。众所周知,IBD的特点是肠黏膜上皮细胞的愈合能力受损,例如增殖和迁移功能受损[25]。本研究中DCs通过分泌关键基因从而影响了结肠黏膜上皮细胞的增殖和迁移功能,因为观察到DCs中过表达Let⁃7b可通过抑制Bach1的分泌而促进HO⁃1在细胞培养物上清液中的表达,从而促进了结肠黏膜上皮细胞的增殖和迁移,这表明Let⁃7b参与了IBD进展中的肠黏膜损伤修复,涉及到DCs细胞和结肠黏膜上皮细胞形成的细胞环境系统。因此在本课题的后续实验中,将深入探讨IBD体内外环境中Let⁃7b/Bach1/HO⁃1轴在DCs⁃肠黏膜上皮系统中的关键调控作用和机制。
总之,在本研究中确定了DCs细胞中Let⁃7b靶向抑制Bach1并激活HO⁃1的分泌从而保护肠黏膜上皮细胞的增殖活性和伤口愈合活性。本研究扩展了Bach1/HO⁃1轴调节IBD过程的理解,并强调了Let⁃7b在IBD中的促再生和损伤修复作用。本研究将为IBD治疗提供新的治疗靶点。
