染料木素结构修饰及活性研究进展
2022-02-03邹靖培钱晶晶刘珊鸣董常娥张笑清史大华
邹靖培,钱晶晶,刘珊鸣,董常娥,李 瑞,张笑清,史大华
(江苏海洋大学 药学院,江苏 连云港 222005)
染料木素(Genistein,1,结构式见图1)属于异黄酮类化合物的一种,化学名称为4′,5,7-三羟基异黄酮(4′,5,7-trihydroxy-isoflavon),广泛存在于槐角、山豆根及葛根等天然豆科植物中,主要来源于染料木(金雀花)的根茎,因此又称为染料木黄酮、金雀异黄酮[1].据相关文献报道,染料木素具有雌激素样效应[2]、抗骨质疏松[3]、抗肿瘤[4]、抗心律失常[5]、抗菌[6]、抗氧化[7]、抗炎[8]、神经保护[9]、金属螯合[10]等多种生物学活性.但染料木素的脂溶性较差,很难通过血脑屏障;此外,染料木素的酚羟基间易形成分子间氢键以致其具有极高的晶格能和极差的水溶性[11].这些都导致了染料木素的生物利用率不高,药效学性质欠佳,制成的药物很难满足临床需求[12-13].基于染料木素的这些优缺点,染料木素成为了多靶点药物设计和合成中常使用的先导化合物之一[14].众多研究表明,染料木素经结构修饰后,其修饰物的生物学活性均得到不同程度的改善,如抗炎活性增强、抑菌活性提高、抗肿瘤活性增强等[15-17],因此,合成新型的染料木素衍生物,已成为寻找抗癌、抗阿尔茨海默症、抗糖尿病等多靶点潜在有效性药物的重要突破口.
染料木素是一类具有多个活性位点的多酚类化合物.到目前为止,染料木素的结构修饰大多是通过修饰染料木素C-7、C-4′、C-5位的酚羟基以及C-8、C-3′位的氢原子来进行[18](如表1所示).本文主要针对这几种修饰方法以及修饰后衍生物的活性进行综述,并指出目前染料木素结构修饰的一些局限性,以期为新型染料木素衍生物的合成提供借鉴和参考.
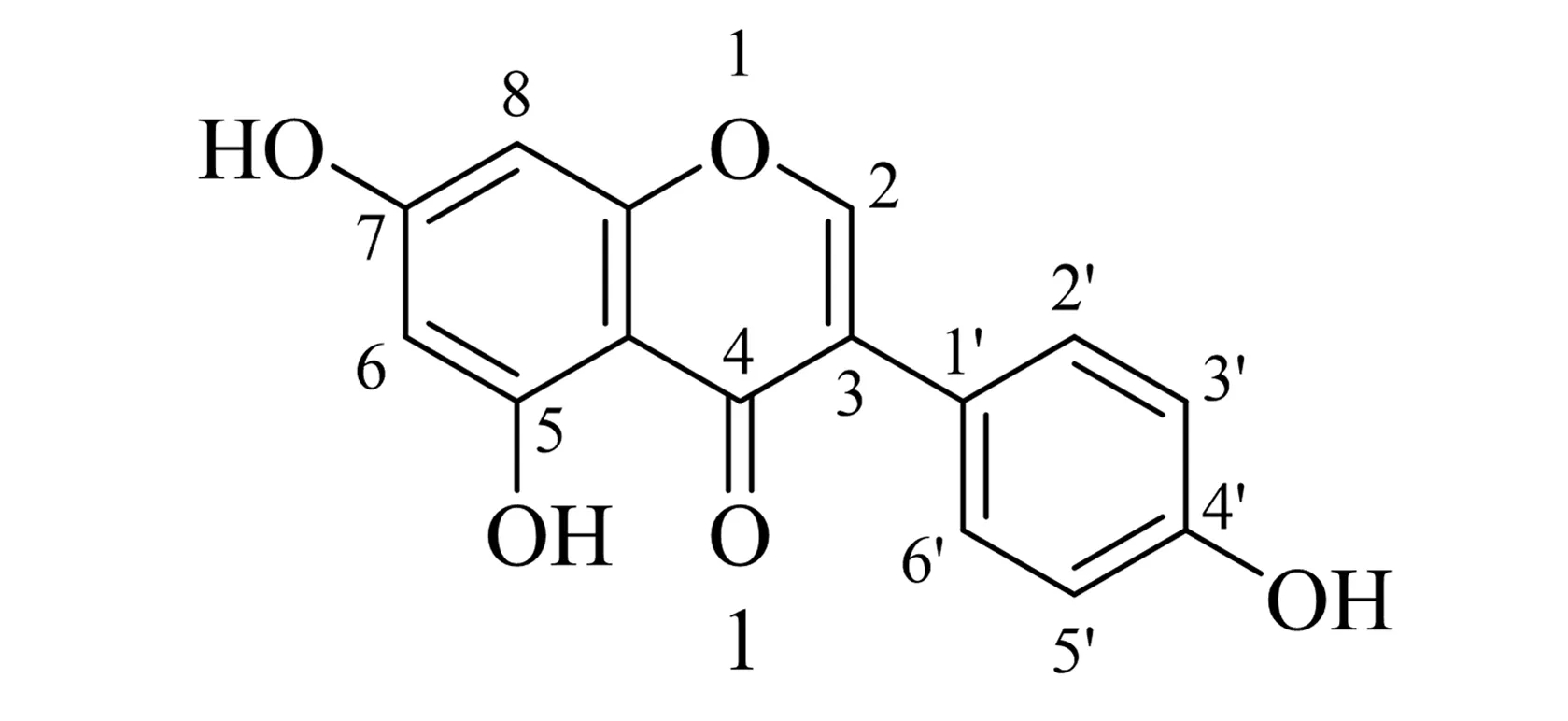
图1 染料木素1的化学结构式

表1 染料木素的修饰位点
1 酚羟基的修饰
染料木素含有三个酚羟基,而酚羟基的修饰具有一定的选择性,其中C-7位酚羟基酸性最强最易形成氧负离子,C-4′位酚羟基亲和活性最强最易发生亲和反应,而C-5位酚羟基因其空间位阻较大,易和邻位羰基形成分子内氢键,因此反应活性最低[19].染料木素酚羟基的选择性修饰通常和反应加入的碱量、原料量、温度及时间有关[20].染料木素多个酚羟基的存在,是其脂溶性和水溶性差以及生物利用度不高的主要原因,因此对染料木素酚羟基的修饰是改善其脂溶性和水溶性、阻断其首过效应,从而提高生物利用度的一种重要手段.
1.1 C-7位酚羟基修饰
染料木素酚羟基酸性强弱顺序为C-7>C-4′>C-5,其中C-7位酚羟基因其临近羰基的吸电子效应,酸性最强极易发生脱质子化[19],因此染料木素C-7位酚羟基的修饰是目前染料木素结构修饰中最常用的方法之一.
2015年,Zhang等[21]以染料木素为原料,通过威廉姆逊(Willamson)醚合成法将其C-7位酚羟基和2-氯乙酸乙酯反应生成7-O-乙氧乙酰基-4′,5-二羟基异黄酮8,化合物8在碱性条件下水解得到7-O-羧甲基-4′,5-二羟基异黄酮9,最后通过酸胺缩合反应合成了8个染料木素多胺缀合物10a~h(合成如图2).胆碱酯酶活性测试结果表明,化合物10a~h具有显著的乙酰胆碱酯酶(AChE)抑制活性.其中化合物10b对AChE的抑制作用最强,半数抑制浓度(IC50)为2.75 μmol/L,优于卡巴拉汀(IC50=5.60 μmol/L).此外,化合物10b还显示出良好的金属螯合能力,因此,化合物10b可以作为治疗阿尔茨海默症的多靶点潜在药物.
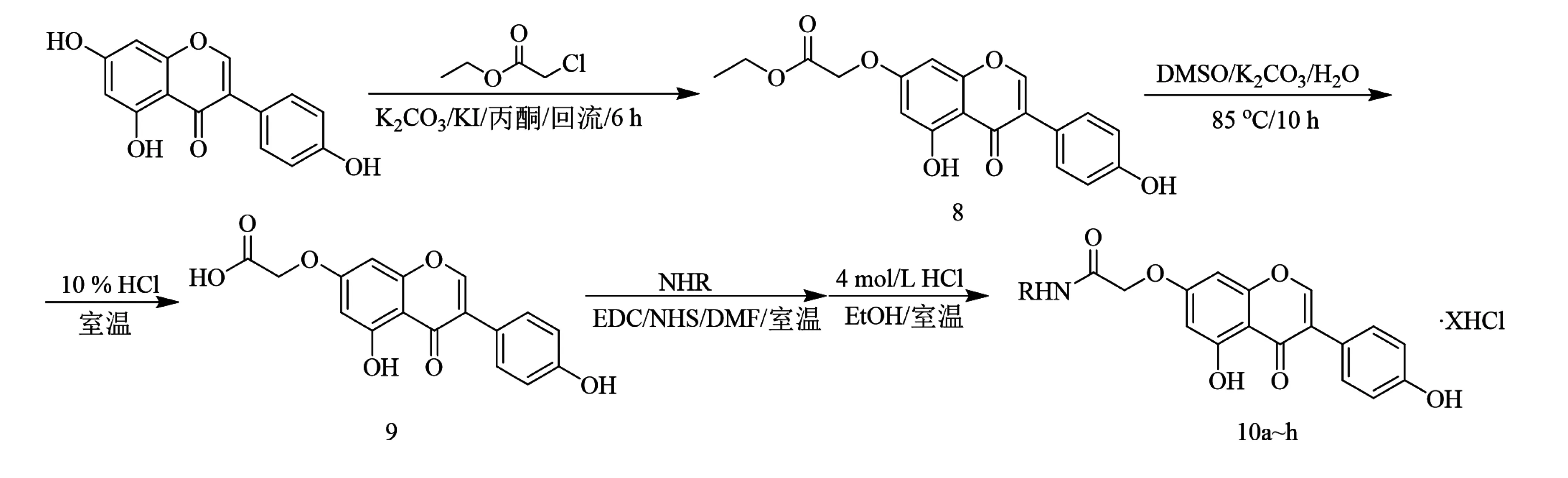
图2 化合物10a~h合成路线[21]
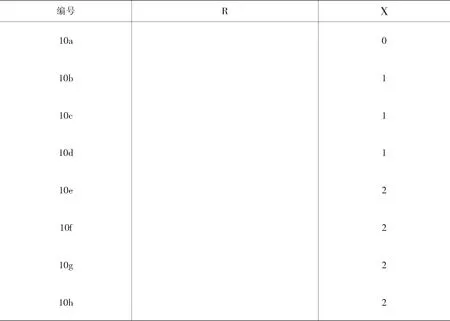
表2 化合物10a~h的取代基R和X[21]
2017年,Cao等[22]以染料木素为先导化合物,利用Willamson醚合成法对其C-7位酚羟基进行修饰,合成了关键中间体7-O-叔丁氧乙酰基-4′,5-二羟基异黄酮11,化合物11经冰醋酸水解成7-O-羧甲基-4′,5-二羟基异黄酮9,再经碳酸氢钠处理得到一种水溶性的染料木素衍生物7-O-羧酸钠甲基-4′,5-二羟基异黄酮12(合成如图3).通过高效液相色谱(HPLC)测定化合物12的水溶性表明,在染料木素C-7位酚羟基处引入羧酸基团其水溶性有了极大改善,较母核染料木素提高了1 000多倍,这使得化合物12将作为异黄酮类化合物生物学活性和临床化学研究的候选化合物.
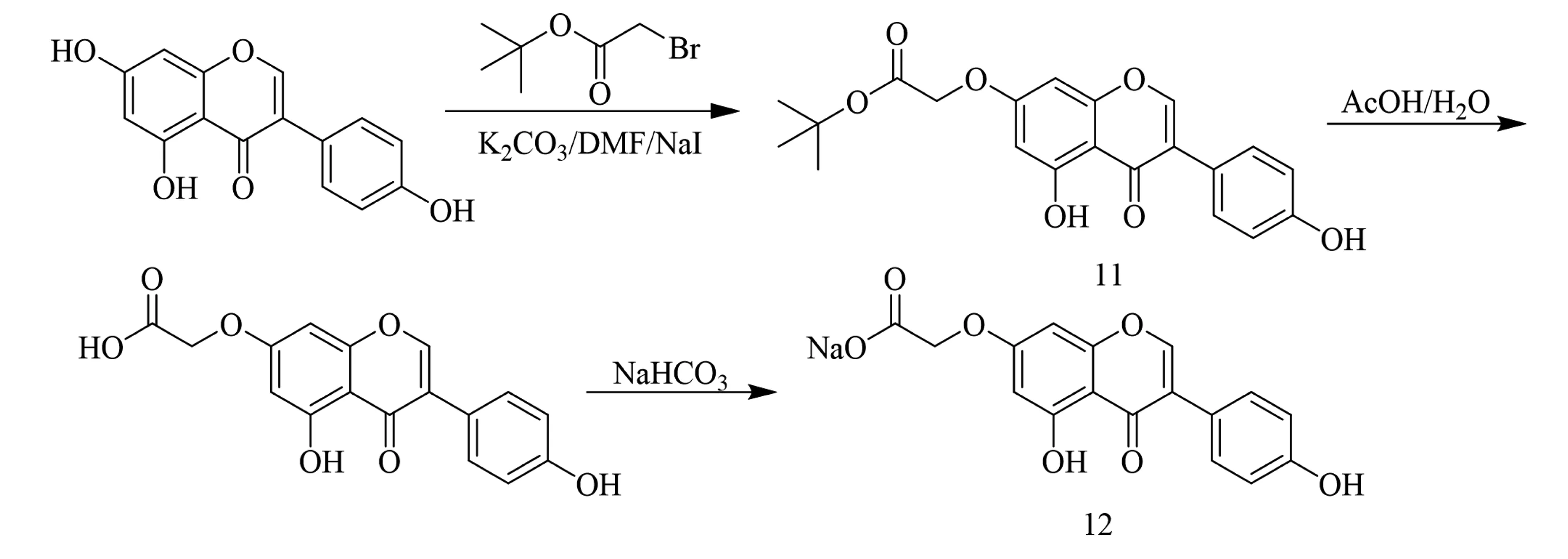
图3 化合物12合成路线[22]
2020年,Yan等[23]用不同碳间隔的二溴烷烃对染料木素的C-7位酚羟基进行烷基化修饰,合成了中间体7-O-溴烷基-4′,5-二羟基异黄酮13a~c,化合物13a~c和二乙醇胺通过取代反应得到7-O-(N,N-二乙醇)烷基-4′,5-二羟基异黄酮14a~c,最后经氯化亚砜处理得到3种新型染料木素氮芥衍生物15a~c(合成如图4).通过体外MTT法[24]测定了其对7种人癌细胞(人宫颈癌细胞HeLa、人肺癌细胞A549、人肝癌细胞HepG-2、人乳腺癌细胞MCF-7、人神经母细胞瘤细胞SH-SY5Y、人前列腺癌细胞PC-3、人前列腺癌细胞DU145)的抗增殖活性,IC50结果表明,化合物15a-c对7种人癌细胞的抑制活性较母核染料木素均有不同程度的提高,其中化合物15b对A549、MCF-7、SH-SY5Y、PC-3和DU145细胞的抑制活性均优于多发性骨髓瘤药物美法仑.
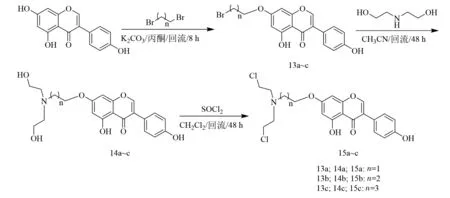
图4 化合物15a~c合成路线[23]
1.2 C-4′位酚羟基修饰
染料木素酚羟基亲和活性强弱顺序为C-4′>C-7>C-5,其C-4′位酚羟基的亲核活性最强,但其酸性弱于C-7位酚羟基,因此对其直接修饰需要具备一定的条件[19].目前对于染料木素酚羟基修饰的方法主要有两种:一种是通过在染料木素C-7位酚羟基处引入保护基团,再对其C-4′位酚羟基进行修饰.保护酚羟基的方法通常是使其成醚或成酯,成醚主要有硅基醚、甲基醚、苄基醚等,成酯有对甲苯磺酸酯、醋酸酯等[25].另一种则是不保护染料木素C-7位酚羟基,而是通过控制反应加入的碱量和投料比来实现其C-4′位酚羟基的单修饰[26].研究表明,如果不保护C-7位酚羟基而直接对C-4′位酚羟基修饰,条件控制往往比较困难、且产率不高.相比较而言,引入酚羟基保护基再修饰的方法简单且产率高.
2009年,刘美华等[27]先将α-D-吡喃木糖16的羟基用乙酸酐保护得到1,2,3,4-四--O-乙酰基-α-D-吡喃木糖17,再溴化得到2,3,4-三-O-乙酰基-1-溴-1-脱氧-α-D-吡喃木糖18,在没有对染料木素C-7位酚羟基进行保护的情况下,通过控制反应加入的碱量,实现了乙酰溴代木糖对染料木素C-4′位酚羟基的糖基化修饰,得到4′-O-(2,3,4-O-三乙酰基-β-D-吡喃木糖-1-基)-5,7-二羟基异黄酮19,最终再还原得到4′-O-(β-D-吡喃木糖-1-基)-5,7-二羟基异黄酮20(合成如图5).此外,课题组还利用HPLC监测目标产物所占比例,确定了最佳反应条件,即2 mmol染料木素加入2.5%氢氧化钠水溶液24 mL和乙酰溴代木糖2.4 mmol,产率为40.81 %(如表3所示).由此可以看出,在不添加保护基的情况下,染料木素C-4′位酚羟基的反应程度与所加入的碱量息息相关,但反应的总产率并不高.
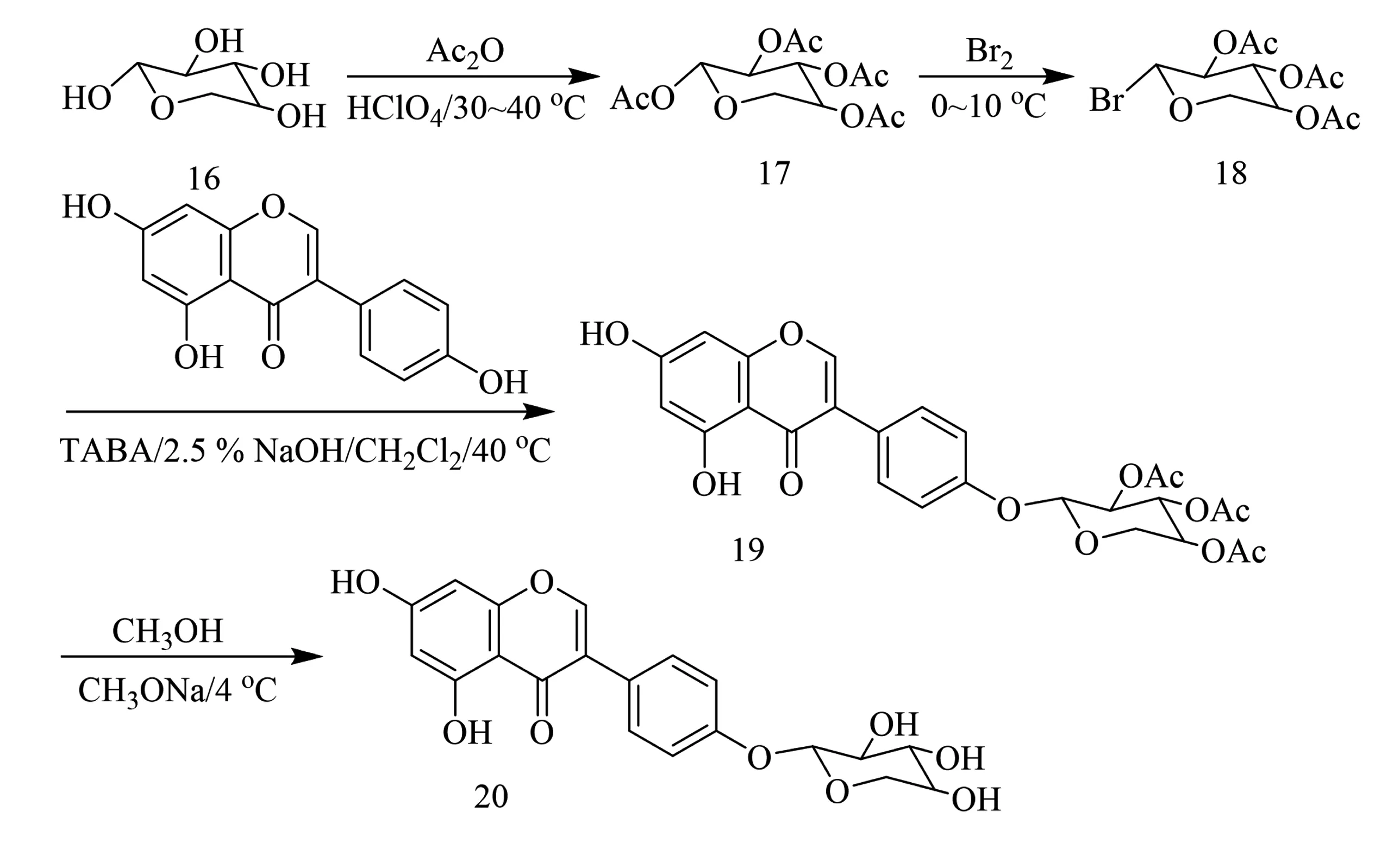
图5 化合物20合成路线[27]

表3 碱量对产率的影响[27]
基于不保护染料木素C-7位酚羟基直接对C-4′位羟基修饰,所得的产物产率不高,且反应条件要求性高的情况,越来越多的药物化学工作者更倾向于先对染料木素C-7位酚羟基进行保护后再对C-4′位羟基进行修饰.2019年,Yang等[28]将染料木素C-7位酚羟基用氯甲基甲基醚保护得到7-O-甲氧基甲基-4′,5-二羟基异黄酮21,进而让染料木素的C-4′位羟基与七甲川菁染料衍生物(IR-783)共价偶联生成偶联物22.化合物22经盐酸去除保护基后得到一种新型染料木素衍生物23(合成如图6),其总收率高达86%.生物学活性测定表明,与染料木素(IC50=24.8±0.5 μmol/L)或染料IR-783(IC50=25.7±0.7 μmol/L)相比,化合物23(IC50=10.4±1.0 μmol/L)对人乳腺癌MCF-7细胞的杀伤活性有所提高,对MCF-7细胞的选择性摄取也高于正常乳腺MCF-10A细胞,这些都表明染料木素与染料IR-783偶联后,其抗癌谱明显改善.
1.3 C-7和C-4′位二羟基修饰
为了对染料木素研究进一步深入,许多药物化学研究者还合成了一系列C-7和C-4′位二羟基修饰的染料木素衍生物.研究表明,这类衍生物大多具有很强的生物学活性.
2019年,Zeng等[29]利用Willamson醚合成法合成了4′,7-O-二-乙氧乙酰基-5-羟基异黄酮24,化合物24在碱性条件下水解生成4′,7-O-二-羧甲基-5-羟基异黄酮25,最后经酸胺缩合反应得到一种C-7和C-4′位二取代的染料木素氨基酸酯衍生物26(合成如图7).以5-氟尿嘧啶(5-Fu)为阳性对照,对化合物26的3种癌细胞系(人胃癌细胞MGC-803、人宫颈癌细胞HeLa、人结肠癌细胞HCT-116)和一种正常细胞(HUVEC)进行抗增殖活性评价,结果表明,化合物26对MGC-803细胞具有显著的抗增殖活性,IC50值为8.52 μmol/L,且对HeLa和HCT-116癌细胞的抑制作用强于阳性对照药物5-Fu.
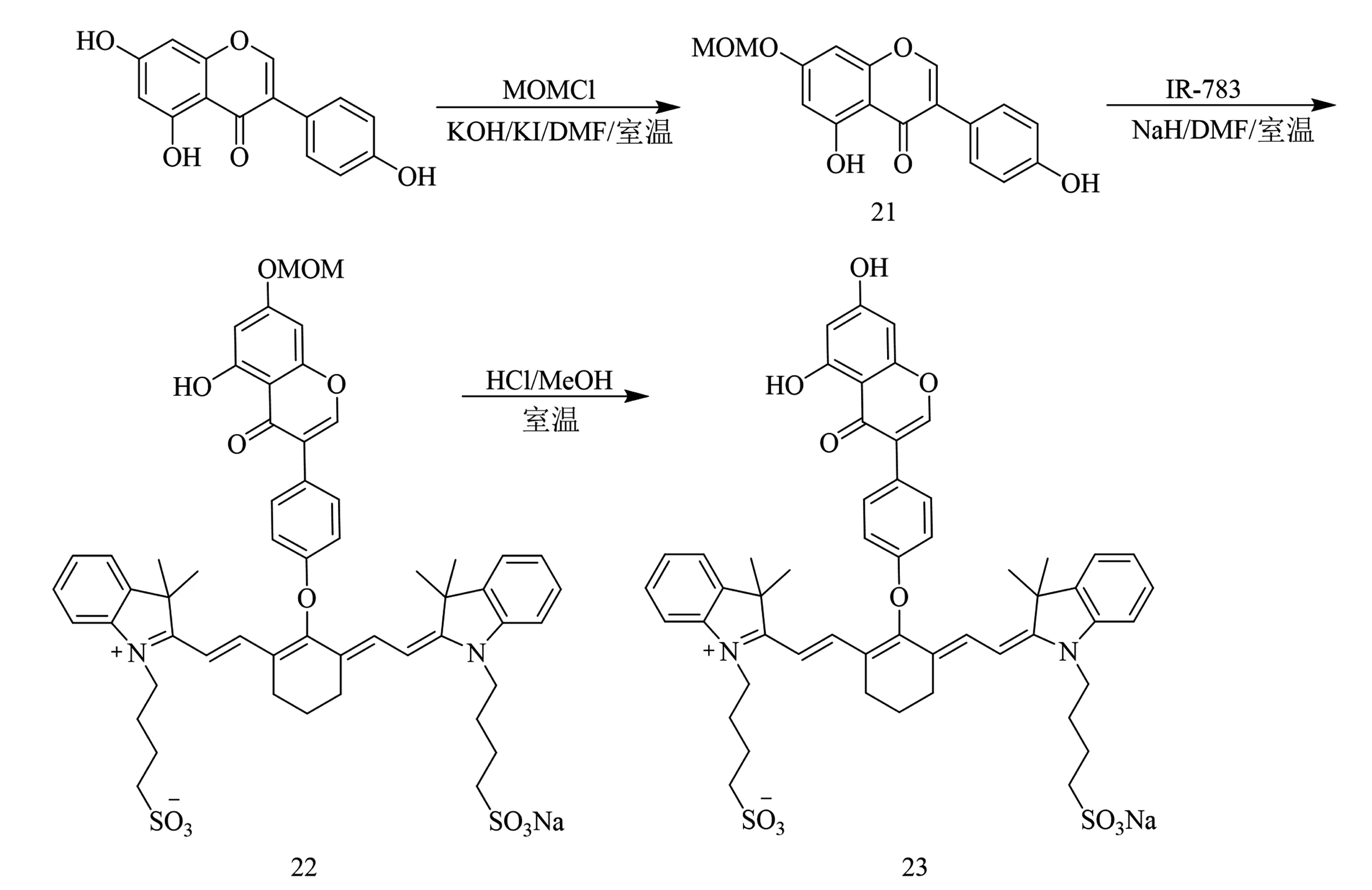
图6 化合物23合成路线[28]
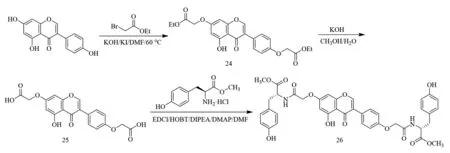
图7 化合物26的合成路线[29]
2021年,Sang等[30]用二溴戊烷对染料木素C-7和C-4′位酚羟基进行烷基化修饰得到4′,7-O-二-溴戊烷基-5-羟基异黄酮27,化合物27再与1,2,3,4-四氢异喹啉发生取代反应得到一种C-7和C-4′位酚羟基双取代的染料木素-O-烷基胺类衍生物4′,7-O-二-(1,2,3,4-四氢异喹啉-2-戊基)-5-羟基异黄酮28(合成如图8).活性测试结果表明,化合物28具有可逆性和高选择性的hAChE抑制活性,IC50值为0.53 μmol/L.此外,化合物28还具有良好的抗氧化活性(ORAC=1.1 当量)、神经保护作用、金属螯合性能以及抑制Aβ聚集的作用.尤其化合物28在体外具有良好的血脑屏障通透性,且在剂量高达1 000 mg/kg时没有表现出任何急性毒性,因此化合物28可以作为潜在的多功能抗阿尔茨海默症药物.
1.4 C-7、C-4′和C-5位三羟基修饰
染料木素的C-5位酚羟基因其空间位阻的因素,反应难度较大,因此目前对其进行修饰的很少[31],但在碱性足够强的条件下,对染料木素C-7和C-4′位酚羟基修饰的同时,C-5位酚羟基也会发生反应,从而生成三羟基修饰的染料木素衍生物.
2008年,Fu等[32]利用染料木素酚羟基的选择性差异,先将染料木素的C-7位酚羟基与二氟一氯甲烷反应生成7-二氟甲氧基-4′,5-二羟基异黄酮29,再对其C-4′和C-5位酚羟基进行甲基化修饰合成了一种三羟基修饰的染料木素衍生物7-二氟甲氧基-4′,5-二甲氧基异黄酮30(合成如图9).体外研究结果表明,化合物30对过氧化氢诱导的人脐静脉内皮细胞(HUVE-12)的细胞凋亡具有很强的抑制作用,并可以减少乳酸脱氢酶(LDH)的释放,可以有效防护氧化应激引起的血管内皮损伤.

图8 化合物28合成路线[30]
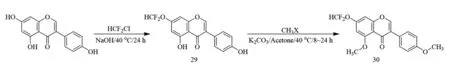
图9 化合物30合成路线[32]
2 苯环上氢原子的修饰
除了对染料木素的酚羟基进行修饰以外,针对其酚羟基邻对位碳上氢原子的修饰也是染料木素结构修饰的方法之一.染料木素酚羟基氧原子与苯环形成的p-π共轭,使其邻对位碳上的氢原子电子云密度增大,从而活性增强极易对其进行修饰.目前染料木素苯环上氢原子修饰主要集中在其C-8和C-3′位的氢原子上.
2.1 C-8位氢原子修饰
目前,染料木素C-8位氢原子的修饰方法主要是与胺类化合物在甲醛中通过曼尼希(Mannich)反应[33]合成Mannich碱衍生物.
2017年,Zhou等[34]用1-苄基哌嗪对染料木素的C-8位的氢原子进行修饰,通过Mannich反应合成了一种新型染料木素Mannich碱衍生物4′,5,7-三羟基-8-(4-苄基哌嗪-1-甲基)异黄酮31(合成如图10).通过化合物31对豚鼠皮肤黑色素抑制作用机制的研究表明,化合物31的作用与治疗皮肤色素沉着的药物熊果醇相似,当其浓度为2%时效果优于熊果醇,因此化合物31可用于治疗UVB诱导的豚鼠色素沉着,这为治疗皮肤色素沉着提供了一个新的方向.
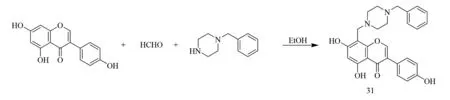
图10 化合物31合成路线[34]
2018年,Xin等[35]以染料木素为原料,与3-甲基哌啶通过Mannich反应合成了一种C-8位的氢原子修饰的染料木素Mannich衍生物4′,5,7-三羟基-8-(3-甲基哌啶-1-甲基)异黄酮32(合成如图11).其抑制组胺H3受体(H3R)的活性测试结果表明,化合物32具有良好的H3R抑制活性,可以为新型H3R拮抗剂的开发提供参考.
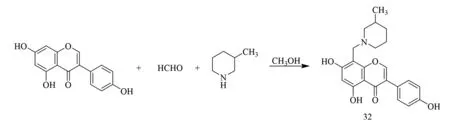
图11 化合物32合成路线[35]
2.2 C-3′位氢原子修饰
染料木素C-3′位氢原子的修饰相对较少,现阶段对其修饰的方法往往都仅限于磺化、羟基化、硝化等的简单取代反应.有研究表明,在染料木素C-3′位引入磺酸基团可以增加其水溶性[36],而羟基和硝基的引入则给了染料木素C-3′位氢原子进一步修饰的可能.
2017年,Chiang等[37]首先利用巨大芽孢杆菌酪氨酸酶生物转化方法,对染料木素的C-3′位的氢原子进行羟基化修饰得到3′,4′,5,7-四羟基异黄酮33,再利用另一种来自前胡链霉菌O-甲基转移酶对其C-3′位羟基进行甲基化修饰,合成了4′,5,7-三羟基-3′-甲氧基异黄酮34(合成如图12).活性研究结果表明,化合物34对培养的小鼠B16黑色素瘤细胞显示出有效的抗增殖活性,可能比其前体染料木素在黑色素瘤的治疗中具有更大的潜力.

图12 化合物34合成路线[37]
2020年,Al-Maharik等[38]利用硝化反应对染料木素的C-3′位的氢原子进行修饰,合成了4′,5,7-三羟基-3′-硝基异黄酮35(合成如图13),并确定了最佳的反应条件,即加入的硝酸铵和三氟乙酸酐的比例为1∶3.5,反应溶剂为乙腈.此外,通过其对牛脑毛细血管内皮细胞(BBCE)体外增殖活性测试结果表明,硝基的引入会导致抗增殖活性的降低,但硝基可以还原成氨基,这为染料木素的C-3′位氢原子的进一步修饰创造了条件.
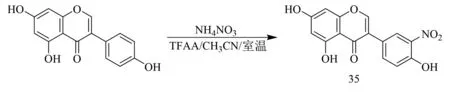
图13 化合物35合成路线[38]
3 结论
染料木素因其活性基团较多且具有多种生物学活性,是药物合成领域运用广泛的先导化合物,但较多的活性基团也是其进行合成和纯化的一大难点.现阶段人们对于染料木素的研究大多主要通过对其进行结构修饰以得到活性更好的衍生物,但对于染料木素水溶性和脂溶性的改善效果并不大,两者往往不能同时兼顾.在今后的研究中,在考虑其构效关系设计新化合物的同时,如何改善染料木素的水溶性和脂溶性,以得到水溶性脂溶性好且活性强的新型染料木素衍生物是今后研究的重要方向.
